高通量测序分析黄酒糟制香糟自然发酵过程中微生物群落多样性
2023-08-05周国燕郭全友
贾 曼,杨 絮,周国燕,郭全友,*,朱 琳,郑 尧
(1.上海理工大学健康科学与工程学院,上海 200093;2.中国水产科学研究院东海水产研究所,上海 200090)
黄酒糟是黄酒生产过程中的副产物,是黄酒成熟醪压榨后留下的固形物[1]。以黄酒糟等为主要原料,经压碎、过筛并与香辛料均匀混合后入坛密封,发酵后制成香糟。香糟卤是以香糟为主要原料,通过添加天然植物香辛料、食盐、黄酒等调味成分[2],经配制、过滤、灭菌、灌装等工艺开发而成的液态调味品[3]。目前,优质香糟卤的生产常以封坛固态发酵3 a形成的香糟为原料,发酵周期长,大大影响了生产效率。此外,香糟卤固态发酵1、2、3 a产品风味存在一定差异,而发酵食品风味的形成与发酵过程中的微生物及其代谢产物密切相关[4],且黄酒糟发酵是在相对不受控制和自发的方式下进行,导致香糟卤制品风味不稳定。因此,了解发酵过程中的微生物群落多样性将有助于确保最终产品的质量,对开发发酵剂,改进发酵工艺,缩短发酵周期至关重要。
高通量测序技术代替了传统纯培养、聚合酶链式反应-时间温度梯度凝胶电泳和聚合酶链式反应-变性梯度凝胶电泳等方法[5],可一次性对样品中的几十万到几百万条DNA分子进行序列测定,快速确定其中微生物的种类和丰度[6],并广泛应用于传统发酵食品的微生物群落的宏基因组研究中[7],如意大利腊肠[8]、泡菜[9]和豆豉[10]等。基于高通量测序对微生物多样性与物种组成研究发现,酒糟中的细菌主要有乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、醋酸杆菌属(Acetobacter)、微球菌属(Micrococcus)等;真菌主要有酵母属(Saccharomyces)、根霉属(Rhizopus)、曲霉属(Aspergillus)等。Wang Xueshan等[11]采用16S rRNA扩增子测序技术分析了白酒糟中的原核生物群落,共鉴定出204 个属,主要以乳杆菌属和明串珠菌属(Leuconostoc)等为主;Song Zhewei等[12]基于高通量测序技术分析酱香型白酒固态发酵过程中核心微生物群落结构与功能,发现毕赤酵母属(Pichia)和曲霉属等为优势真菌群落。但是,目前关于自然发酵过程中黄酒糟微生物的研究鲜有报道,对黄酒糟发酵中微生物群落结构的复杂性、多样性以及动态变化情况等仍缺乏全面的认识。
本研究以发酵1、2、3 a黄酒糟为研究对象,采用Illumina MiSeq高通量测序技术分析不同发酵阶段黄酒糟样品微生物组成,客观地评价微生物种类、数量及优势菌群的变化规律,旨在为筛选功能发酵菌株和发酵条件优化等提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品准备
黄酒糟取自东江酒业有限公司。其工艺主要为:黄酒糟→添加香辛料等→搅拌均匀→入坛盐封→加盖泥封→室外自然发酵。同时对发酵1、2、3 a黄酒糟取3 份平行,分别标记为DJ1-1~DJ1-3、DJ2-1~DJ2-3、DJ3-1~DJ3-3。样品4 ℃贮藏,供后续分析。
1.1.2 试剂
DNA提取试剂盒 广州美基生物科技有限公司;Q5®High-Fidelity DNA Polymerase 美国NEB公司;DNA Marker 日本TaKaRa公司;琼脂糖凝胶电泳 缓冲液 美国Invitrogen公司;DNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
2720聚合酶链式反应仪 美国ABI公司;DYY-6C电泳仪 北京六一仪器厂;BG-gdsAUTO(130)凝胶成像系统 北京百晶生物技术有限公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品总DNA提取
取4 ℃中保存的黄酒糟充分破碎搅拌,取200 mg黄酒糟样品于离心管中,使用美基DNA提取试剂盒(D6356-03)按照说明书提取总基因组DNA样品,并在进一步分析前贮存在-20 ℃。分别用紫外分光光度计和琼脂糖凝胶电泳测定提取的DNA数量和质量。
1.3.2 PCR扩增及测序
对细菌两个连续的可变区V3~V4[13]进行PCR扩增,使用正向引物338F(ACTCCTACGGGAGGCAGCA)和反向引物806R(GGACTACHVGGGTWTCTAAT)[14]进行。将PCR所需的成分配制完后,在PCR仪上于98 ℃预变性5 min,使模板DNA充分变性,然后进入扩增循环。在每一个循环中,先于98 ℃保持30 s使模板变性,然后将温度降到52 ℃,保持30 s,使引物与模板充分退火;在72 ℃保持45 s,使引物在模板上延伸,合成DNA,完成1 个循环。重复循环25 次,使扩增的DNA片段大量累积。最后,在72 ℃保持5 min,使产物延伸完整,4 ℃保存。
对真菌内转录间隔区ITS1进行PCR扩增,使用正向引物ITS5F(GGAAGTAAAAGTCGTAACAAGG)和反向引物ITS2R(GCTGCGTTCTTCATCGATGC)[15]进行。将PCR所需的成分配制完后,在PCR仪上于98 ℃预变性5 min,使模板DNA充分变性,然后进入扩增循环。在每一个循环中,先于98 ℃保持30 s使模板变性,然后将温度降到52 ℃,保持30 s,使引物与模板充分退火;在72 ℃保持1 min,使引物在模板上延伸,合成DNA,完成一个循环。重复循环28 次,使扩增的DNA片段大量累积。最后,在72 ℃保持5 min,使产物延伸完整,4 ℃保存。
扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用Axygen凝胶回收试剂盒回收目的片段。委托上海派森诺生物科技有限公司Illumina MiSeq平台进行双端 测序。
1.4 数据分析
采用Illumina平台对群落DNA片段进行双端(Pairedend)测序,使用分析软件QIIME2(2019.4)并调用qiime cutadapt trim-paired切除序列的引物片段,弃去未匹配引物的序列;然后通过qiime dada2 denoise-paired调用DADA2进行质控、去噪、拼接、去嵌合体[16],相当于以100%相似度聚类。完成对所有文库的去噪后,合并扩增序列变体(amplicon sequence variant,ASV)的特征序列和ASV表格,并去除singletons ASVs;序列长度分布统计使用R语言脚本,对全部样本中所包含的高质量序列的长度分布进行统计。利用OriginPro 2022和Excel 2019软件工具绘制各分类水平下的微生物多样性群落结构图,对各样本在不同分类水平上的群落结构进行分析。
2 结果与分析
2.1 α多样性分析
α多样性反映了单个样品内部物种的多样性,根据100%相似性水平下的ASV信息,采用α多样性指标的覆盖率、ASV数量、Chao1指数、Shannon指数与Simpson指数对样品微生物物种的丰富度和多样性进行评估。
表1显示,3 个发酵阶段样品的覆盖率均在99.95%以上,表明测序数据能够覆盖样品中细菌及真菌的种类,真实反映样品中物种丰度及多样性;如图1所示,稀释曲线平缓,说明测序深度较好,测序数据量合理[17]。结果显示,无论细菌还是真菌,发酵初期ASV数量和Chao1指数均最低,即物种丰度最低。发酵初期组内样品细菌Chao1指数差异大,变化范围为613.91~1017.90,均值为882,发酵中期和后期Chao1指数均值为1213和1201,物种丰度呈现向上升后稳定的趋势,发酵中后期Chao1指数的浮动趋势不大,表明样品中的微生物在逐渐适应生长环境,物种丰度趋于平稳。发酵过程中,细菌Shannon指数分别为6.39、6.14和6.55,Simpson指数变化范围为0.93~0.95;真菌的Shannon指数分别为6.71、6.88和6.62,Simpson指数变化范围为0.97~0.99,多样性指数无明显变化,表明黄酒糟固态自然发酵过程微生物群落结构较稳定,群落复杂度不变。

图1 高通量测序中细菌(A)和真菌(B)的稀释性曲线Fig.1 Rarefaction curves of bacteria (A) and fungi (B) in high-through sequencing
2.2 微生物物种组成分析
2.2.1 基于门水平的发酵黄酒糟菌群结构分析
根据得到的每个ASV在门分类水平的物种分类信息,分析样本ASV在门分类水平上的群落结果。由图2可知,3 组发酵黄酒糟样品中细菌及真菌微生物群落组成相似,但相对丰度存在差异。在门水平下,发酵黄酒糟样品一共鉴定出31 个细菌物种,图2A显示丰度水平前10的物种。发酵黄酒糟中细菌优势菌门分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。罗爱国等[18]基于门水平对清香型堡子酒酒糟样品中的细菌菌群进行分析,同样发现这4 个菌门为细菌优势门,与本研究结果一致。变形菌门是黄酒糟发酵整个过程中的绝对优势菌门,发酵第1年其平均相对丰度为71.26%,整个发酵过程,其相对丰度变化不大,发酵第2年相对丰度上升至75.27%,于发酵第3年下降至73.22%。这可能是由于变形菌门的一部分细菌为好氧型,不能适应黄酒糟发酵过程中缺氧、产酸、产醇的环境,因而在发酵第3年丰度降低。厚壁菌门在发酵第1年时占较高比例(16.09%),随发酵进行其相对丰度逐渐降低并趋于稳定。拟杆菌门在黄酒糟发酵过程中呈现小幅度先上升后下降的趋势,在黄酒糟发酵第2年相对丰度达到最高(6.82%)。放线菌门在黄酒糟发酵过程中呈现逐渐上升的趋势,在发酵第3年相对丰度达到最高(5.78%)。

图2 发酵黄酒糟中细菌(A)和真菌(B)门水平的群落分类学 组成和相对丰度分布Fig.2 Phylum-level composition and abundance distribution of bacterial (A) and fungal (B) communities in fermented huangjiu vinasse
在门水平下,发酵黄酒糟样品共鉴定出10 个真菌物种。如图2B所示,发酵黄酒糟中主要真菌优势菌门分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和蛙粪霉门(Basidiobolomycota)。子囊菌门是黄酒糟发酵整个过程中的绝对优势菌门,发酵过程中,其相对丰度分别为63.46%、58.07%、51.68%,呈现逐年下降的趋势。陈雪等[19]利用高通量测序技术分析凤香型白酒发酵过程中微生物群落结构及演替规律,发现整个发酵过程中子囊菌门占绝对优势,与本研究结果一致。担子菌门在发酵过程中呈现先上升后下降的趋势,在发酵第2年其相对丰度达到最高(16.23%)。被孢霉门在发酵第1、2年相对丰度较接近,呈现轻微下降趋势,在发酵第3年相对丰度下降至3.10%。蛙粪霉门在黄酒糟发酵第1、2年相对丰度接近,分别为1.47%、1.56%,在发酵第3年其相对丰度下降至0.35%。有研究表明,子囊菌门、担子菌门等是多种发酵食品中的主要真菌种群[20]。
2.2.2 基于属水平的发酵黄酒糟菌群结构与热图分析
根据得到的每个ASV在属分类水平的物种分类信息,分析样本ASV在属分类水平上的群落结果。在属水平下,发酵黄酒糟样品共鉴定出944 个细菌物种,315 个真菌物种。3 组发酵黄酒糟样品中细菌及真菌微生物群落组成相似,但相对丰度存在差异。由图3A可知,黄酒糟发酵过程中排前10的细菌属分别为水小杆菌属(Aquabacterium)、短波单胞菌属(Brevundimonas)、柄杆菌属(Caulobacter)、不动杆菌属(Acinetobacter)、嗜糖假单胞菌属(Pelomonas)、不黏杆菌属(Asticcacaulis)、Muribaculaceae、Inhella、毛螺菌科NK4A136组(Lachnospriaceae_NK4A136_group)、芽孢杆菌属(Bacillus)。发酵初期,以水小杆菌属为优势细菌属,在发酵过程中由22.48%升高到24.94%,发酵结束时恢复到21.29%,仍为优势属;且由图3B可知,水小杆菌属于DJ2-3与DJ3-2相对丰度最高,分别为26.52%与25.93%,水小杆菌发酵可产生聚β-羟基丁酸酯,积聚在细菌体内,作为碳源和能源的储备物质[21]。短波单胞菌属随着发酵时间延长相对丰度呈现逐年下降的趋势;由图3B可知,与其他发酵阶段相比,慢生根瘤菌属(Bradyrhizobium)和芽孢杆菌属在发酵末期相对丰度较高,如DJ3-1与DJ3-3样品中慢生根瘤菌属相对丰度为1.15%与0.95%;芽孢杆菌相对丰度为2.33%与2.35%。芽孢杆菌能影响白酒的风味物质如酯、醇的形成[22-23];同时,乳杆菌属在发酵中期相对丰度最高,在DJ2-2与DJ2-3样品中相对丰度分别为1.60%与1.89%,在发酵第3年其相对丰度降低至0.64%,乳杆菌属与乳酸乙酯的形成具有密切关系[24],其对于有机酸具有一定的耐受能力[25],能减弱酵母菌的好氧代谢速度,延长前发酵期,有利于发酵有益菌的生长,对香味物质增加有利[26-27]。
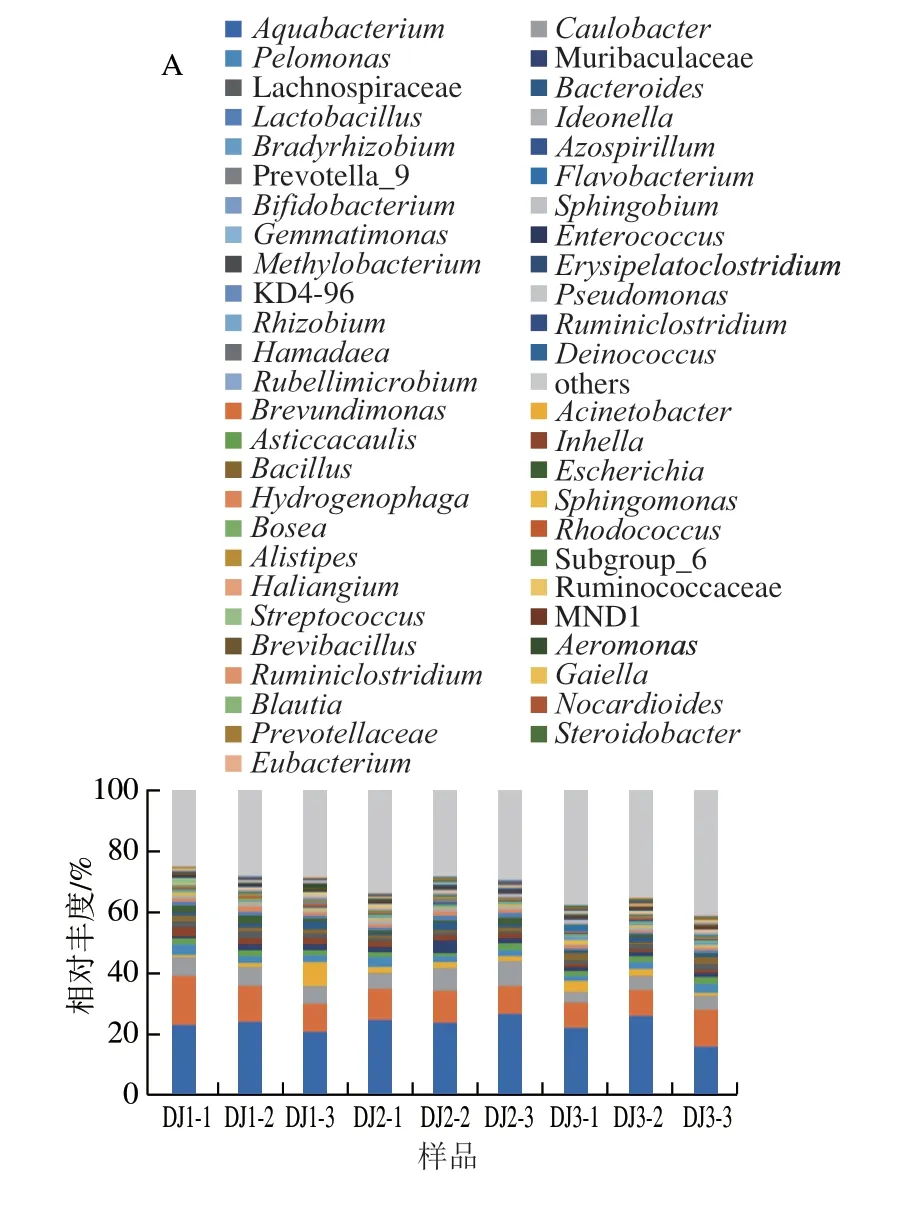
图3 发酵黄酒糟中细菌属水平的群落分类学组成(A)和热图(B)Fig.3 Genus-level composition (A) and heatmap (B) of bacterial communities in fermented huangjiu vinasse
由图4A可知,黄酒糟发酵过程中排前10的真菌属分别为毕赤酵母属(Pichia)、Tausonia、被孢霉属(Mortierella)、曲霉属(Aspergillus)、裂壳菌属(Schizothecium)、尖孢镰刀菌属(Fusarium)、亚隔孢壳属(Didymella)、外瓶霉属(Exophiala)、Phialemoniopsis、Tetracladium。刘念等[28]在对浓香型白酒糟醅微生物研究中发现,酵母属、曲霉属等是浓香型白酒糟醅中的主要优势菌。研究表明酵母类真菌在产香、产酒等方面具有较强作用[29],能够产生多种风味酯并贡献乙醇和其他有机酸[30-31]。结果显示,毕赤酵母在整个发酵过程中占绝对优势,结合图4B可知,其在发酵末期相对丰度最高,在DJ3-2与DJ3-3样品中相对丰度分别为18.43%与17.41%。毕赤酵母以甲醇作为唯一碳源[32],发酵过程中,原料的植物细胞壁及细胞间质的果胶被水解成甲醇,随着发酵过程的积累,发酵后期毕赤酵母丰度达到最高;毕赤酵母具有高产乙酸乙酯的特性,同时是乙酸异丁酯和乙酸异戊酯的第2大生产者[33],能促进发酵过程中挥发性化合物的产生,增强产品的香气特征。另外,发酵中期DJ2-2样品中Tausonia、亚隔孢壳属、曲霉属与球腔菌属(Mycosphaerella)相对丰度较其他发酵阶段高,分别为9.94%、4.21%、9.38%与2.77%。曲霉属能够产生淀粉酶、蛋白酶等,是黄酒糟发酵中淀粉等大分子物质分解的主要动力之一[34-35]。被孢霉属与裂壳菌属在发酵过程中相对丰度呈现逐年下降的趋势,在发酵第3年相对丰度均达到最低值,分别为3.10%、1.55%;发酵末期DJ3-1样品中,外瓶霉属、Knufia和双足囊菌属(Dipodascus)相对丰度较高,分别为8.81%、4.17%与2.78%。以上结果表明,黄酒糟同一批次不同样品间存在差异,表明了固态自然发酵过程的不均一性。
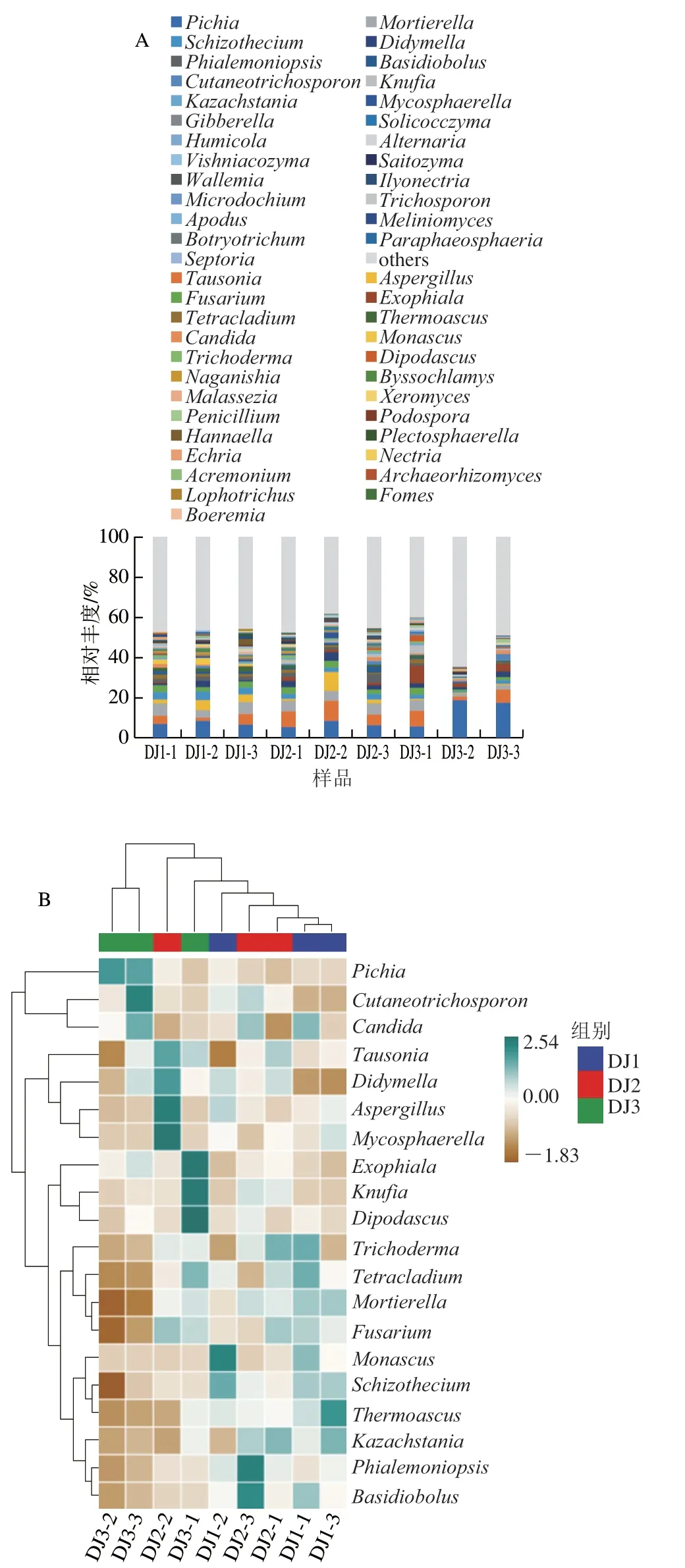
图4 发酵黄酒糟中真菌属水平的群落分类学组成(A)和热图(B)Fig.4 Genus-level composition (A) and heatmap (B) of fungal communities in fermented huangjiu vinasse
同时,由属水平的菌群结构可以看出,无论是细菌还是真菌,菌群结构都十分复杂。发酵过程中产生的风味物质与微生物的生长和代谢密切相关[36]。这些微生物催化原料不断进行一系列复杂的反应,可以分解原料中的淀粉、蛋白质,形成糖和氨基酸,从而引发美拉德反应,生成黄酒糟独特的风味前体物质;能够将蛋白质分解为小分子肽,并形成重要的香气成分,例如醛、醇、酯、酮等,进而形成糟卤清爽醇厚的风格特征[37-39]。
2.3 β多样性分析
通过β多样性分析黄酒糟制香糟发酵过程中微生物群落组成的差异性,基于Bray-Curtis距离算法对所有样品进行非度量多维尺度(non-metric multidimensional scaling,NMDS)分析,不同样品间的差异程度,通过点与点的距离表现在图中,两点之间的距离越远,表明两个样品中微生物群落的差异越大[40],结果如图5所示。对细菌群落测序结果进行排序分析,其stress值为 0.092<0.1,排序结果良好。从图5A可知,发酵第2年与发酵第3年样品均分布在1、4象限,而发酵第1年样品独自分布在第2、3象限,表明发酵第1年样品的细菌属组成与其他样品具有较大差异,综合α多样性和菌群结构分析可知,此种差异主要来源于细菌的相对丰度改变。真菌群落的NMDS分析结果如图5B所示,其stress值为 0.075<0.1,排序结果良好。其中发酵第1年与发酵第2年样品均分布在第2、3象限,表明这两年的样品间具有一定相似性,且与发酵第3年样品距离较远,可能是由于发酵过程中产生的酸类及醇类等物质的累积,不适于某些真菌的生长繁殖,导致发酵第3年与发酵前两年的真菌群落结构具有明显差异[41]。

图5 微生物群落的NMDS分析 Fig.5 NMDS analysis of microbial communities in fermented huangjiu vinasse
3 结论
采用高通量测序分析黄酒糟固态自然发酵阶段细菌及真菌群落变化情况,黄酒糟微生物群落的多样性指数、分类学组成的变化和聚类分析等表明,黄酒糟发酵过程中微生物群落结构复杂多样。其中,水小杆菌属、短波单胞菌属、柄杆菌属为优势细菌属,这些菌属在其他酒糟中的相关报道较少,这表明微生物结构与发酵原料、发酵工艺、地理位置和发酵环境有很大的关系。其中芽孢杆菌属与乳杆菌属相对丰度位居前13 位,但对整个发酵过程起着不可忽视的作用。毕赤酵母、Tausonia、被孢霉属和曲霉属为优势真菌属。综上,黄酒糟发酵不同阶段的微生物群落存在差异,且发酵过程对微生物相对丰度具有明显影响,为进一步研究黄酒糟的发酵代谢机理及菌株筛选奠定了基础。
