枯草芽孢杆菌PW2产挥发性物质对赭曲霉的抑制作用
2023-08-05张凯歌林亲录王青云
余 璐,魏 琛,张凯歌,林亲录,王青云
(中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
赭曲霉(Aspergillus ochraceus)广泛生长在粮食、水果、咖啡、油料、茶叶等[1]食品原料及其加工产品。赭曲霉产孢能力很强,其孢子散落在空气中能够诱导儿童哮喘[2]和人类肺病[3]。其产生的次级代谢产物赭曲霉毒素A(ochratoxin A,OTA)是一种肾毒性真菌毒素,具有致癌、致畸、遗传毒性和免疫抑制作用[4]。OTA经由胃肠道吸收后,经血液流到肾脏,且在人或动物体内不易代谢消除,易在血液及消化组织器官中累积,可引发亚急性或慢性中毒[5]。OTA在1993年被国际癌症研究会定为2B组致癌物质[6]。目前,物理防霉方法常用气调控制和低温控制,但能耗费用高,辅助设施不成熟[7];传统的化学熏蒸法中常使用磷化铝、氯化苦、环氧乙烷等,其对环境造成的负面影响和对人类健康的威胁问题日益突 出[8]。因此,探寻低毒高效的绿色防霉剂已成为当今食品防霉的必然需求。
芽孢杆菌(Bacillus)对真菌的抑制作用多是源于其产生的抗菌蛋白[9]、脂肽类[10]及挥发性物质(volatile compounds,VC)[11-12],其中抗菌蛋白和脂肽类的研究已比较成熟,而具有抗霉活性的VC开始成为近年来研究的热点。研究表明,芽孢杆菌所产具有抗霉活性的挥发性复合物的主要成分有醇、醛、酮、酸、酚类化合物及硫化物等[13-14];枯草芽孢杆菌(B.subtilis)KA9产生的挥发性复合物不仅对辣椒植物生长有促进作用,还对青枯雷尔氏菌(Ralstonia solanacearum)有生防效果[15];贝莱斯芽孢杆菌(B.velezensis)所产挥发性复合物能够抑制番茄灰霉病菌(Botrytis cinerea)等病原真菌的菌丝生长[16];解淀粉芽孢杆菌(B.amyloliquefaciens)T-5产生的挥发性复合物能显著抑制引起番茄青枯病的青枯雷尔氏菌的生长[17]。芽孢杆菌所产挥发性复合物不仅可抑制上述田间型植物病原真菌,还可用于采后储藏期间的生物防治。甲基营养芽孢杆菌(B.methylotrophicus)BCN2和苏云金芽孢杆菌(B.thuringiensis)BCN10产生的挥发性复合物可以抑制从枇杷果实中分离的5 种采后病原菌生 长[18];巨大芽孢杆菌(B.megaterium)产生的挥发性复合物明显抑制了稻谷中霉菌总数的增加,显著降低了稻谷中黄曲霉毒素的含量[19]。然而,关于芽孢杆菌所产VC对赭曲霉的抑制作用迄今鲜见研究报道。
实验室在前期研究中从稻谷中分离出1 株产抗霉VC的枯草芽孢杆菌PW2[20],本实验以其所产VC为研究对象,鉴定其组分,测定所鉴定出单个化合物标准品对赭曲霉生长的抑制效果,从中筛选出关键抗霉挥发性物质(key antifungal volatile compound,KAVC),研究KAVC对赭曲霉生长及产毒的抑制效果,并探讨其抗霉作用机理,旨在为探寻新型的食品用防霉熏蒸剂提供理论依据。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌PW2菌株由本实验室在前期研究中从市售籼稻中分离、鉴定并保存;赭曲霉 中国农业微生物菌种保藏管理中心。
异辛醇(纯度≥99.5%)、2-壬酮(纯度99%)、异丁酸(纯度99%)、2,2,4-三甲基-1,3-戊二醇二异丁酸酯(纯度98.5%)上海阿拉丁生化科技股份有限公司;十二醇(纯度98%)Sigma Aldrich(上海)贸易有限公司;赭曲霉毒素酶联免疫定量检测试剂盒 上海恒远生物科技有限公司;碘化丙啶(propidium iodide,PI)、琼脂(生物试剂)北京索莱宝科技有限公司;牛肉膏、蛋白胨(均为生物试剂)北京奥博星生物技术有限责任公司;氯化钠、葡萄糖(均为分析纯)国药集团化学试剂有限公司;氯霉素(纯度98%)上海麦克林生化科技股份有限公司。
营养琼脂(nutrient agar,NA)培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,蒸馏水1000 mL,pH 7.4~7.6;营养肉汤(nutrient broth,NB)培养基:NA配方中不加琼脂;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂15~20 g,氯霉素0.3 g,蒸馏水1000 mL,自然pH值;马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基:PDA配方中不加琼脂;沙氏葡萄糖肉汤(sabouraud dextrose broth,SDB)培养基:蛋白胨10 g,葡萄糖40 g,蒸馏水1000 mL。以上培养基均在121 ℃灭菌20 min后备用。
1.2 仪器与设备
MJ-54 A 型灭菌锅 施都凯仪器设备(上海)有限公司;Airtech SW-CJ-1 FD 型超净工作台 苏州安泰空气技术有限公司;DVB/CAR/PDMS(50/30 μm)型萃取头 美国Supelco公司;7890B-5977B型气相色谱-质谱联用仪 美国Agilent公司;MJX-250B型霉菌培养箱 上海博讯实业有限公司;SpectraMax i3x型多功能酶标仪 美国Moleculer Devices公司;Quanta FEG250型扫描电子显微镜 美国FEI公司;Ni-U型正置荧光微分干涉显微镜 尼康仪器(上海)有限公司。
1.3 方法
1.3.1 赭曲霉孢子菌悬液制备
用含0.05%(V/V)吐温80的无菌水冲洗PDA斜面上的赭曲霉孢子,4 层无菌擦镜纸过滤,调节孢子悬液浓度至1×106个/mL,于4 ℃冰箱保存备用。之后提到的赭曲霉孢子悬液,如无特殊说明,均为按此方法制备的孢子悬液。
1.3.2 PW2所产VC成分鉴定
取1 环PW2斜面菌种接到装有10 mL NB培养基的顶空瓶中,以相同条件下不接菌的培养基为对照,30 ℃、150 r/min培养3 d。采用固相微萃取-气相色谱-质谱联用技术[21]对PW2菌株所产VC进行成分鉴定。采用峰面积归一法计算各成分的相对含量。
1.3.3 VC中抑制赭曲霉生长的KAVC筛选
根据VC成分鉴定结果,选取鉴定出的单个成分并购买标准品,采用平板对扣法[22]测定各标准品对赭曲霉生长的抑制作用。平板对扣法的操作为:取5 μL赭曲霉孢子悬浮液接种于PDA平板中央,另一平板中放入含20 μL单个待测化合物的滤纸片,立即用保鲜膜绕皿口3 圈进行密封。以相同条件下不加化合物的处理作为对照。30 ℃恒温培养箱内培养7 d,对照组的菌落生长完全,便停止培养。观察记录平板中赭曲霉的生长情况,测量菌落直径(cm),按下式计算各标准品对赭曲霉菌落生长的抑制率。对比分析抑制率的高低,找出抑制赭曲霉生长的KAVC。
1.3.4 倍半稀释法测定KAVC在接触条件下对赭曲霉的最低抑菌浓度(minimum inhibitory concentration,MIC)
取1 mL赭曲霉孢子悬液加到含有9 mL PDB培养基的锥形瓶中并摇匀,取190 μL加入96 孔板的第1列孔中,第2~9列孔中均加入100 μL,然后在第1列孔中加入KAVC 10 μL,采用倍半稀释法[23]进行连续稀释。在第10列孔中加入不含孢子的PDB培养基100 μL,第11列孔中加入含孢子的PDB培养基100 μL,盖上盖子用保鲜膜缠绕3 圈封口,置于30 ℃,培养5 d后对照组菌丝正常生长并产孢。在每孔加入1 mg/mL刃天青溶液10 μL,混匀,30 ℃孵育12 h,霉菌生长较多的孔中刃天青蓝色褪去,转变为粉红色甚至无色。通过目视观察,将刃天青颜色无明显变化的孔对应的KAVC的最低浓度定义为MIC值。在后续机理研究的实验中异辛醇的剂量均基于此实验结果。
1.3.5 平板对扣法测定KAVC在挥发条件下对赭曲霉的MIC和最低杀菌浓度(minimum bactericidal concentration,MBC)
平板对扣法操作如1.3.3节所述,滤纸片上KAVC添加量设置为0、10、20、30、40、50、60 μL,对应的顶空含量分别为0、56、112、169、225、281 μL/L和337 μL/L(皿内径为9 cm,高2.8 cm,容积为0.178 L)。30 ℃培养7 d后以肉眼观察PDA平板上赭曲霉无生长,转接至新鲜PDA平板上,30 ℃培养5 d后可以恢复生长处理对应的最低浓度为MIC,不能恢复生长处理对应的最低浓度为MBC。
1.3.6 KAVC对赭曲霉产毒的影响
在10 mL PDB培养基中接入100 μL赭曲霉孢子悬液,30 ℃、150 r/min培养48 h后,在无菌条件下加入KAVC,使之剂量分别为0、1/4 MIC、1/2 MIC和MIC,相同条件下继续培养5 d。培养结束后用Whatman No.1滤纸过滤,采用酶联免疫吸附法[24-25]测定滤液中OTA的含量。
1.3.7 KAVC抑制赭曲霉生长作用机理分析1.3.7.1 扫描电镜观察
用SDB培养基替代1.3.1节无菌水制备含1×107个/mL赭曲霉孢子的SDB培养基,取3 mL加入EP管中,再加入KAVC使之剂量分别为0、1/2 MIC、MIC、2 MIC,于30 ℃、150 r/min培养10 h,将孢子培养物5000×g离心5 min,弃去上清液,收集赭曲霉孢子,通过扫描电镜[26]观察KAVC对赭曲霉孢子形态的影响。
1.3.7.2 KAVC对细胞膜完整性的影响
赭曲霉孢子培养方法、KAVC 剂量分别为0、MIC、2 MIC、4 MIC,培养时间为12 h。将孢子培养物5000×g离心5 min,弃去上清液,用磷酸盐缓冲液洗涤2 次,用5 μg/mL PI对孢子样品染色,37 ℃、150 r/min孵育30 min,再用磷酸盐缓冲液洗涤3 次,除去未进入细胞内的PI后,吸取20 μL在干净的载玻片上,盖上盖玻片,用正置荧光微分干涉显微镜[27]拍照观察。
1.3.7.3 麦角甾醇含量的测定
取15 mL赭曲霉孢子悬液加入135 mL PDB培养基中,30 ℃、150 r/min培养3 d,收集菌丝,称取1 g菌丝球分别放入异辛醇剂量为0、1/4 MIC、1/2 MIC、MIC的无菌水中,于30 ℃、150 r/min培养12 h,过滤,将菌丝球放入试管中,加入5 mL 25 g/100 mL KOH-乙醇溶液,混合3 min,在85 ℃水浴中孵育4 h,冷却,加入5 mL正庚烷和2 mL无菌水,然后强力旋流搅拌3 min,静置1 h,取上层正庚烷用扫描分光光度计在230~300 nm范围内扫描,计算菌丝球中麦角甾醇含量[23]。
式中:A282nm、A230nm分别为样品在282、230 nm处的吸光度;290和518分别为麦角甾醇和24(28)DHE% 的E值。
1.3.7.4 胞内物质泄漏测定
如1.3.7.3节收集菌丝,称取1 g菌丝球分别放入异辛醇剂量为0、1/4 MIC、1/2 MIC、MIC的无菌水中,于30 ℃、150 r/min分别培养2、4、6、8 h,过滤,取滤液。用紫外-可见分光光度计[28]分别在260 nm和280 nm波长处检测吸光度。
1.4 数据统计
每个实验3 个平行,实验数据采用Excel软件整理,并用SPSS Statistics 26对数据进行Duncan检验,分析各组数据之间的差异显著性(P<0.05,差异显著),用Origin 2021软件作图。
2 结果与分析
2.1 PW2所产VC的成分组成
PW2所产VC共鉴定出41 种组分(表1),主要有酯、醛、烷烃、醇、酮、酸、烯烃等化合物。所鉴定出挥发性成分中,2-壬酮已被报道可有效抑制水果中灰葡萄孢菌(B.cinerea)等腐败真菌的生长,且已被作为水果的抗真菌剂使用[29];十二醇能有效防治黄瓜霜霉病(Pseudoperonospora cubensis)[30];异辛醇能降低柑橘采后被指状青霉(Penicillium digitatum)感染的机率[31];异丁酸可有效抑制尖孢镰刀菌(Fusarium oxysporumfsp.lactucae)菌丝生长[32]。虽然这些成分已被证明对植物病原菌具有抗霉活性,但其对赭曲霉的抑制作用鲜见报道。选取上述4 种成分和在VC中含量相对较高的2,2,4-三甲基-1,3-戊二醇二异丁酸酯,购买这5 种化合物的标准品进一步研究其对赭曲霉的抑制作用。
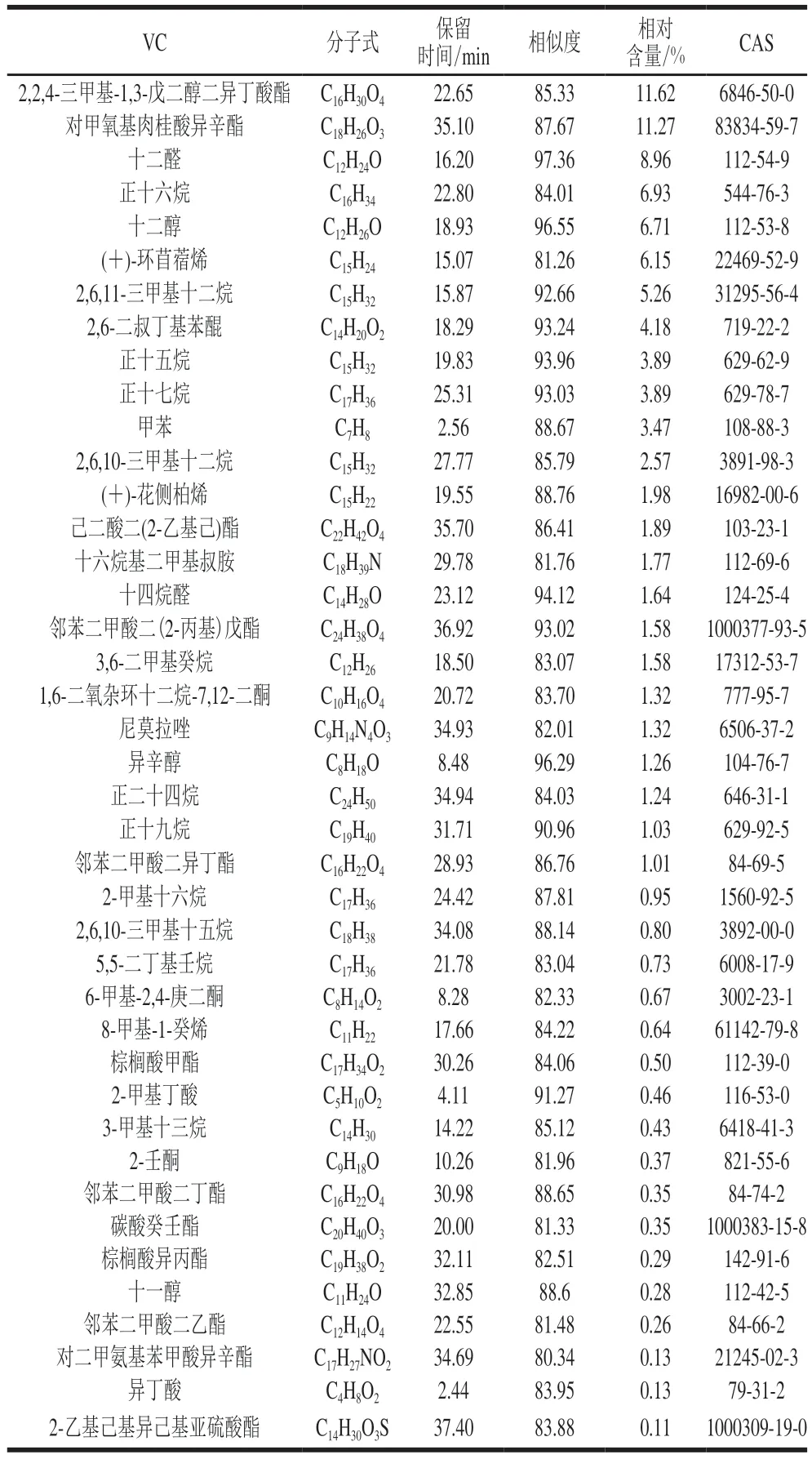
表1 PW2所产VC的固相微萃取-气相色谱-质谱联用技术鉴定结果Table 1 SPME-GC-MS identification of VC produced by strain PW2
2.2 KAVC的确定
通过平板对扣法测定5 种化合物标准品对赭曲霉生长的抑制作用,结果如图1所示。30 ℃培养7 d后,对照组赭曲霉菌落生长正常,十二醇对赭曲霉菌落生长的抑制不显著(P>0.05),其他4 种化合物对赭曲霉生长都有显著抑制作用,其中异辛醇对赭曲霉的抑菌活性最强。因此,将异辛醇确定为KAVC并进行下一步的研究。
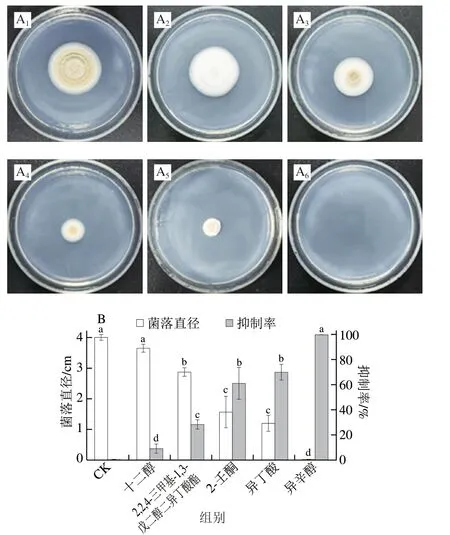
图1 不同挥发性化合物处理对赭曲霉菌落形态(A)和菌落直径、生长抑制率(B)的影响Fig.1 Effects of different volatile compound treatments on colony morphology (A),colony diameter and growth inhibition rate (B) of A.ochraceus
2.3 异辛醇对赭曲霉的MIC及MBC
2.3.1 倍半稀释法测定异辛醇在接触条件下对赭曲霉的MIC
如图2所示,能维持刃天青不变色的异辛醇最低剂量为1562.5 μL/L,在此剂量下对应的孔中未见赭曲霉菌丝生长。当剂量低于1562.5 μL/L时,对应孔中指示剂变为浅粉色或无色,肉眼可观察到孔内有菌丝体长出。因此,接触条件下异辛醇对赭曲霉生长的MIC为1562.5 μL/L。

图2 倍半稀释法测定异辛醇对赭曲霉生长的MICFig.2 Determination of the MIC of isooctanol against A.ochraceus by the sesqui-dilution method
2.3.2 平板对扣法测定异辛醇在挥发条件下测得异辛醇对赭曲霉的MIC和MBC
如图3A所示,对照皿中赭曲霉正常生长,剂量为56 μL/L的异辛醇处理组赭曲霉有少量生长,而其他处理组中赭曲霉均未见生长,将未见生长的赭曲霉孢子转接至新鲜PDA平板上培养。转接后的生长情况如图3B所示,观察到112、169、225 μL/L的处理组均恢复生长,而281 μL/L和337 μL/L的处理组均未恢复生长,可知异辛醇对赭曲霉的MIC和MBC分别为112 μL/L和281 μL/L。


图3 平板对扣法测定异辛醇对赭曲霉生长的MIC(A)和MBC(B)Fig.3 Determination of MIC (A) and MBC (B) of isooctanol against A.ochraceus by plate buckling method
2.4 异辛醇对赭曲霉产毒的影响
由图4可知,与对照组相比,各处理组的OTA产量均显著降低(P<0.05)。当异辛醇剂量为MIC时,赭曲霉产生OTA量最低,与对照组相比其抑制率为23.67%。异辛醇可以有效降低OTA的产生,其抑制率随异辛醇剂量增加而增高。
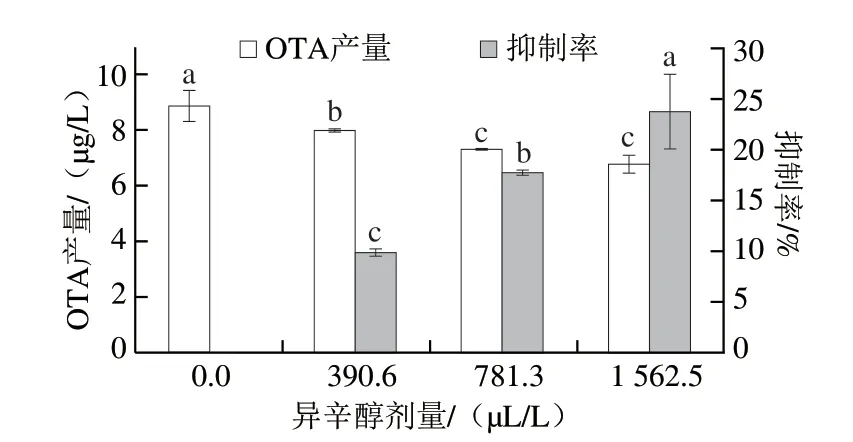
图4 不同剂量异辛醇处理对赭曲霉产OTA的抑制作用Fig.4 Inhibitory effects of different doses of isooctanol on the production of ochratoxin A by A.ochraceus
2.5 异辛醇抑制赭曲霉生长的作用机制
2.5.1 异辛醇对赭曲霉孢子形态的影响
由图5可知,未经异辛醇处理的赭曲霉孢子形态完整、表面光滑,而经异辛醇处理后部分孢子出现凹陷,随着异辛醇剂量的增加出现凹陷孢子增多,凹陷程度也在增加,且当异辛醇为2 MIC时孢子还出现干瘪,褶皱的现象。推测可能是异辛醇处理导致孢子内容物流失,从而在外形上出现干瘪和凹陷。

图5 不同剂量异辛醇处理对赭曲霉孢子形态的影响(×20000)Fig.5 Effects of different doses of isooctanol on the morphology of A.ochraceus spores (× 20000)
2.5.2 异辛醇对细胞膜完整性的影响
PI是一种核酸染料,不能透过正常完整的细胞膜,当细胞膜破损时,PI能透过破损的细胞膜继而与DNA结合产生红色荧光,从而用于检测细胞膜的完整性[33]。如图6所示,明场下观察,对照组的孢子体积明显膨大,而异辛醇处理组的孢子未出现体积膨大;暗场下观察,对照组孢子没有产生红色荧光,而异辛醇处理组产生红色荧光,还观察到异辛醇剂量为4 MIC时大量孢子被异辛醇包裹着且产生红色荧光。结果说明异辛醇处理后的赭曲霉孢子细胞膜完整性丧失。
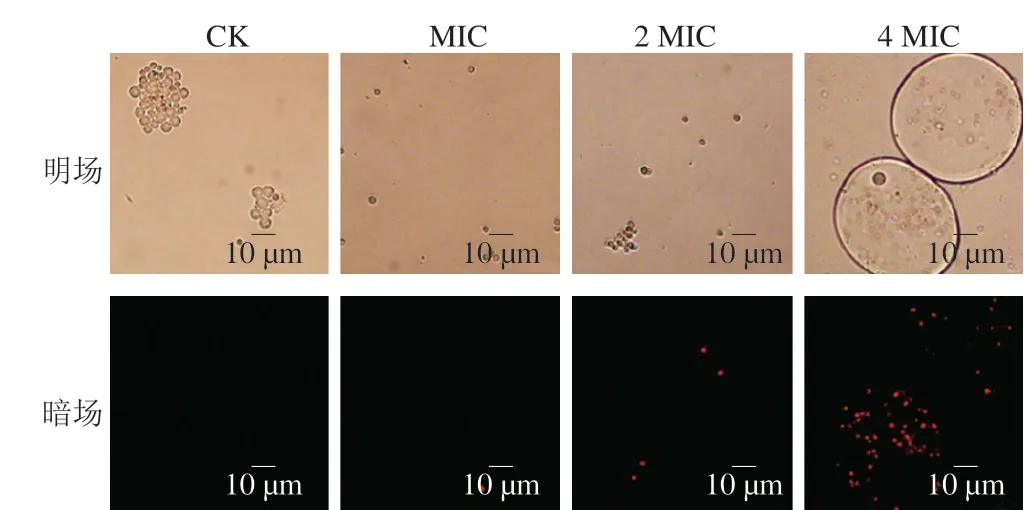
图6 不同剂量异辛醇对赭曲霉孢子细胞膜完整性的影响Fig.6 Effects of different doses of isooctanol on cell membrane integrity of A.ochraceus spores
2.5.3 异辛醇对赭曲霉麦角甾醇含量的影响
麦角甾醇是真菌中一种独特的甾醇,是细胞膜的主要成分,主要保持细胞完整性和膜流动性[34]。如图7所示,与对照组相比较,在1/4 MIC、1/2 MIC和MIC的异辛醇作用下各处理组赭曲霉的麦角甾醇含量分别降低了42.68%、65.08%和65.40%。说明异辛醇导致赭曲霉细胞膜中麦角甾醇含量降低,细胞膜的结构和功能受到破坏。这与2.5.2节中PI染色的观察结果一致。
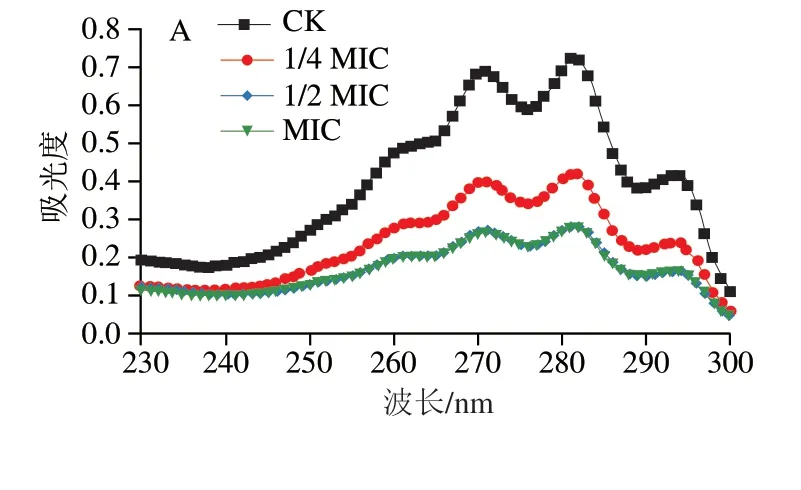

图7 不同剂量异辛醇对赭曲霉的麦角甾醇紫外吸收图谱(A)及 含量(B)的影响Fig.7 Effects of different doses of isooctanol on the ultraviolet spectrum (A) and content (B) of ergosterol from A.ochraceus
2.5.4 异辛醇对赭曲霉胞内物质泄漏的影响
如图8所示,随处理时间的延长,培养液中的核酸和蛋白含量均增加,且处理组与对照组之间差异也随着时间的延长而逐渐显著(P<0.05)。说明异辛醇对赭曲霉核酸和蛋白泄漏情况受处理时间的影响,且其作用效果存在剂量依赖性。异辛醇可能通过改变细胞膜的通透性[22],使赭曲霉的核酸和蛋白泄漏,从而导致赭曲霉的生长被抑制。
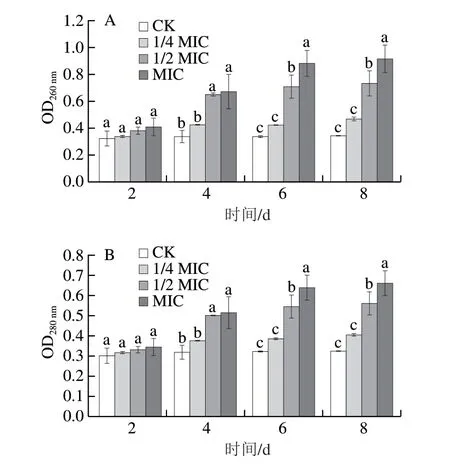
图8 不同剂量异辛醇处理不同时间对赭曲霉核酸(A)和蛋白(B)泄漏的影响Fig.8 Effects of different doses of isooctanol on nucleic acid (A) and protein leakage (B) from A.ochraceus at different treatment times
3 讨论
本研究结果表明枯草芽孢杆菌PW2所产具有抗霉活性的VC中含有酯、醛、烷烃、醇、酮、酸、烯烃类等41 种成分,从这些成分中初步筛选出5 种单体化合物,购买其标准品并测定它们对赭曲霉的抗霉活性,发现异辛醇对赭曲霉的抗霉活性最强。异辛醇,又名2-乙基己醇,是GB 2760—2014《食品添加剂使用标准》中允许使用的一种食品用合成香料。异辛醇还作为一种风味物质广泛存在于小麦面包[35]、初榨橄榄油[36]、白酒大曲[37]和发酵泡菜[38]等食品中。亚慢性吸入毒性研究表明,质量浓度为120 mg/L的异辛醇对实验大鼠在体质量、死亡率、器官质量、临床生化和血液学参数方面均未观察到不良反应[39]。早在2009年就有研究报道了芽孢杆菌产生的异辛醇可以完全抑制黄瓜菌核病菌的菌丝生长[40],后续也有研究表明异辛醇可以参与植物生长调控及病害防治[41],可以防治甘蔗的红腐病[42],还能抑制草莓灰霉病菌的分生孢子萌发和菌丝生长[43]。最近研究发现水稻根际细菌释放的包含异辛醇在内的VC对引起水稻纹枯病的病原菌生长有抑制作用[44]。说明异辛醇具有抗真菌活性和值得信赖的安全性,其挥发性质易于扩散到食物中,有望成为食物防霉的新资源,但其抗霉的作用机制还有待研究。
本研究测得异辛醇对赭曲霉有显著抗菌活性,且呈剂量依赖关系,不管是在挥发条件下还是接触条件下,赭曲霉的生长随着异辛醇剂量的增高而逐渐被抑制。异辛醇在接触条件下对赭曲霉的MIC值远高于挥发条件。这一结果与有些研究结果一致,Li Yanjun等[45]在研究山苍子精油对黄曲霉的抑制实验中发现,在挥发条件下抑制菌丝生长和黄曲霉毒素B1合成所需要的用量比接触条件下低;Wang Yanzhen等[46]发现,橙花醇在挥发条件下对黑曲霉菌丝生长的抑制效果大于接触条件;Niu Ajuan等[47]也发现肉桂醛在挥发条件下的MIC远小于接触条件。异辛醇在挥发条件下对赭曲霉生长的MIC值为112 μL/L,与互叶白千层精油(2.5 mL/L)[48]和柠檬醛(200 μL/L)[49]对赭曲霉生长的MIC值相比较,异辛醇对赭曲霉生长的MIC值低得多。因此与直接加入原料中相比,挥发条件下的抑制效果更好,异辛醇更适合以熏蒸剂的形式使用。使用熏蒸处理是防止食品腐败的理想方法,快速有效,而且残留少[47]。
本研究异辛醇处理后的赭曲霉孢子外形出现干瘪和凹陷,赭曲霉细胞膜完整性被破坏,麦角甾醇含量降低以及胞内物质泄露均可推测异辛醇对赭曲霉的作用机制可能是与破坏其细胞膜有关[50-51],目前的研究报道中丙酮酸乙酯通过破坏草酸青霉(Penicillium oxalicum)孢子的细胞膜结构从而抑制草酸青霉的生长[52];橙花醇对黑曲霉(A.niger)的抑制研究表明,橙花醇抑制了黑曲霉麦角甾醇的合成,从而破坏了黑曲霉的膜完整性,引起膜的通透性发生变化,导致细胞死亡[46];ε-聚-L-赖氨酸可通过降解扩展青霉菌(P.expansum)孢子的细胞壁,破坏细胞膜的完整性,导致大量细胞物质泄露,进而减少或抑制孢子萌发和菌丝生长[53]。异辛醇作为亲脂性化合物可能会聚集在细胞膜上,可以推测异辛醇很可能与细胞膜的磷脂双分子层结合,破坏细胞膜的正常结构及功能[46],从而影响赭曲霉正常生长和代谢并杀死赭曲霉。
由于VC具有高挥发性在应用中会受到限制,目前对VC用于防霉的应用研究中基本是将VC包埋在载体上,有将精油通过壳聚糖纳米乳剂的包埋[54],有将反式肉桂醛、甲基丁香酚和雌二醇等VC复合包埋在壳聚糖纳米生物聚合物中[55],也有将茴香精油包埋在壳聚糖纳米聚合物中[56],提高VC的稳定性和有效性以应用于食品防腐。
4 结论
枯草芽孢杆菌PW2所产具有抗霉活性的VC中异辛醇对赭曲霉生长抑制作用最强,异辛醇作为熏蒸剂使用时具有更低的MBC,其抑杀赭曲霉的作用机理与破坏细胞膜完整性有关。目前还鲜见对于异辛醇应用于防霉的研究,而异辛醇作为VC,具有高挥发性和不稳定性,后续研究可以将其采用纳米包埋的方式,提高异辛醇的稳定性和有效性,以此开发安全、高效的新型防霉熏蒸剂。异辛醇用于食品熏蒸防霉其残留量、安全性及系统的抗霉机理等问题有待进一步研究探讨。
