1 株伏马毒素B1降解真菌的筛选及降解特性分析
2023-08-05白青云高红侠胡俊强于阳光张宇航徐剑宏
白青云,高红侠,,胡俊强,于阳光,邱 涵,张宇航,徐剑宏,
(1.淮阴工学院生命科学与食品工程学院,江苏 淮安 223003;2.江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,农业农村部农产品质量安全控制技术与标准重点实验室,农业农村部农产品质量安全风险评估实验室(南京),江苏省现代粮食流通与安全协同创新中心,江苏省农业科学院农产品质量安全与营养研究所,江苏 南京 210014;3.南京农业大学生命科学学院,农业农村部农业环境微生物工程重点开放实验室,江苏 南京 210095)
伏马毒素主要由串珠镰刀菌(Fusariummoniliforme)、轮状镰刀菌(F.verticillioides)与层出镰刀菌(F.proliferatum)等镰刀菌产生[1-3],是一种由不同多氢醇和丙三羧酸组成的结构类似的双酯型水溶性次级代谢产物[4](图1)。Gelderblom等[5]于1988年首次从串珠镰刀菌的培养液中发现并分离出伏马毒素B1(fumonisin B1,FB1)。现有的伏马毒素包括FA1、FA2、FB1、FB2、FB3、FB4、FC1、FC2、FC3、FC4和FP1,共11 种。其中FB1是含量最多(约70%)、毒性最强、危害最大、影响范围最广的伏马毒素[6-7]。研究表明,伏马毒素是多种人畜病害的主要诱因,对人畜具有神经毒性[8-9]、免疫毒 性[10-12]、器官毒性[13-14]、生殖毒性[15-17]以及与其他毒素共同作用对人畜产生联合毒性[18]。伏马毒素具有易溶于水,热稳定性强,高温蒸煮也难以破坏其结构的特性[19],使其在粮食及饲料中难以祛除,从而造成巨大的经济损失,并严重危害人畜健康。国际癌症机构将伏马毒素列为2B类致癌物,表明该物质可能使人类致癌[20]。

图1 FB1化学结构式Fig.1 Chemical structural formula of FB1
粮食及其制品中伏马毒素的污染情况在世界范围内普遍存在,其中玉米及其制品受到的污染最为严重[21-22]。去除粮食作物中真菌代谢所产生的毒素是保障粮食与饲料安全的重要方法之一。实验证明,使用高温[23]、辐射[24]等物理方法处理被毒素污染的粮食或使用氨气熏蒸[25],可以一定程度上降低伏马毒素含量[23-25]。但采用物理与化学方法处理粮食会造成粮食与饲料品质的降低或药剂的残留[26]。生物法去除伏马毒素具有高效无毒等优点[27],是非常有前景的方法。Heinl等[28]发现可以对FB1进行生物降解的鞘氨醇单胞菌MTA144,MTA144中存在编码脱羧酶和氨基转移酶的2 个基因,通过这两种酶的连续作用可以将FB1降解为无毒产物。百奥明公司于2014年11月研发出了可以降解伏马毒素的酶制剂FUMzyme,并成功获得了欧盟认证[29]。为了能够获得高效降解伏马毒素的降解菌,本研究采用富集培养法,以FB1作为唯一碳源,从发霉玉米样品中分离到1 株可以完全降解FB1的菌株,旨在为粮食与饲料中的FB1的脱毒处理提供良好的菌种资源和研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品采集于江苏徐州、盐城和淮安三地的发霉玉米,具体来源见表1。
表1 玉米样品来源Table 1 Sources of corn samples collected in this study
1.1.2 试剂与培养基
FB1通过大孔吸附树脂联合高速逆流色谱制备[30],制备母液质量浓度为50 μg/mL的FB1,使用美国Sigma公司的FB1标准品进行外标法定量;胰蛋白胨、酵母提取物 赛默飞世尔科技(中国)有限公司;无机盐试剂、琼脂 生工生物工程(上海)股份有限公司;甲醇、乙腈(均为色谱纯)上海安谱实验科技股份有限公司;邻苯二甲醛 上海源叶生物科技有限公司。
无机盐培养基(minimal salt medium,MSM):NaNO30.5 g/L;KH2PO41 g/L;Na2HPO41.6 g/L;CaCl2·2H2O 0.025 g/L;MgSO4·7H2O 0.5 g/L;(NH4)2SO40.5 g/L,加去离子水定容至1 L,调节pH 7.0;马铃薯葡萄糖(potato dextrose broth,PDB)培养基:称取200 g马铃薯,切成小块后加水煮沸20 min,纱布过滤,加入20 g葡萄糖,搅拌混匀后定容至1 L;马铃薯葡萄糖固体(potato dextrose agar,PDA)培养基:在PDB基础上添加1.5 g/100 mL琼脂即为PDA培养基。分别使用50 mmol/L柠檬酸-磷酸氢二钠缓冲液(pH 4.0、5.0、6.0)、50 mmol/L磷酸缓冲液(pH 7.0、8.0)以及甘氨酸-氢氧化钠缓冲液(pH 9.0)配制不同初始pH值的PDB培养基;上述培养基均于115 ℃高温灭菌30 min;邻苯二甲醛(o-phthalaldehyde,OPA)衍生液:称取2.0 g OPA,溶于20 mL甲醇中,用硼砂溶液(0.05 mol/L,pH 10.5)定容至500 mL,加入500 μLβ-巯基乙醇后混匀,避光保存,现配现用。
1.2 仪器与设备
e2695高效液相色谱仪、2475荧光检测器 沃特世科技(上海)有限公司;SB-C18液相色谱柱 安捷伦科技(中国)有限公司;PowerPac凝胶电泳仪 伯乐生命医学产品(上海)有限公司;LabCycler系列聚合酶链式反应(polymerase chain reaction,PCR)仪 德国 SensoQuest GmbH公司;Tanon-3500凝胶成像系统 上海天能科技有限公司;HYL-C恒温摇床 太仓市强乐实验设备有限公司;5810R高速冷冻离心机 艾本德 中国有限公司;Christ ALPHA 2-4 LD冷冻干燥机 德国Martin Christ公司。
1.3 方法
1.3.1 FB1降解菌的筛选与分离
将采集的玉米样品编号并磨碎,取5.0 g于50 mL锥形瓶中,加入20 mL无菌水,180 r/min振荡1 h,静置15 min,取1 mL上清液置于含有1 mg/mL FB1的20 mL MSM中,30 ℃、180 r/min振荡培养7 d,相同的方法连续传代培养3 次后,取100 μL富集培养液,加入900 μL 50%乙腈溶液,振荡混匀,过0.22 μm滤膜,利用高效液相色谱(high performance liquid chromatography,HPLC)检测培养液中FB1含量。
将具有FB1降解能力的富集液进行梯度稀释,分别涂布在FB1质量浓度1 mg/mL的固体MSM平板上,于30 ℃倒置培养7 d。挑选表型不同的单菌落,在LB(Luria-Bertani)与PDA平板上划线分离,于30 ℃培养3~5 d。挑取单菌落于FB1质量浓度50 μg/mL的MSM中,30 ℃、180 r/min振荡培养7 d,通过HPLC检测FB1含量,验证挑选的菌株是否具有FB1降解能力。
1.3.2 FB1的HPLC检测
参照GB 5009.240—2016《食品中伏马毒素的测定》[31],其中检测器的激发波长为335 nm,发射波长为440 nm;柱温和衍生池工作温度为40 ℃。
1.3.3 FDS-2的鉴定
形态鉴定:将菌株FDS-2在PDA平板上划线,25 ℃培养5 d,观察菌落的颜色、大小、形状,通过光学显微镜观察菌株的微观形态。
分子生物学鉴定:使用十六烷基三甲基溴化铵法法抽提FDS-2的基因组DNA,使用真菌核糖体rDNA区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增FDS-2的18S rDNA部分序列。PCR体系:Master Mix 12.5 μL,ITS11 μL,ITS41 μL,ddH2O 10.5 μL。PCR程序:95 ℃预变性3 min,95 ℃变性15 s,56.5 ℃退火15 s,72 ℃延伸50 s,31 个循环,72 ℃延伸10 min。利用DiaSpin柱式PCR产物纯化试剂盒(生工生物工程(上海)股份有限公司)纯化PCR产物,并对产物进行TA克隆,连接体系如下:pMD18T-vector 1 μL,目的片段 2 μL,Solution I 5 μL,ddH2O 2 μL,16 ℃连接4 h。随后将连接产物通过热激法转化至大肠杆菌DH5α感受态中[32],涂布在含Amp抗生素的LB平板上,于37 ℃倒置培养14 h,通过蓝白斑筛选阳性克隆,验证后送生工生物工程(上海)股份有限公司测序。将测序结果上传至NCBI数据库进行序列比对,选取同源序列,使用MEGA X软件构建系统发育树。
1.3.4 FDS-2生长特性的测定
生长曲线的绘制:将1 mL孢子浓度为106CFU/mL的种子液接种至100 mL PDB培养基中,30 ℃、180 r/min连续培养10 d,每天取100 mL培养液,8000×g离心5 min收集菌丝并使用无菌水洗涤3 次,菌丝冷冻干燥后称质量并记录数据。
温度对FDS-2生长的影响:在100 mL pH 7.0的PDB培养基中接种1 mL种子液,分别于25、28、30、35 ℃条件下180 r/min培养8 d,按上述条件收集菌丝并冷冻干燥,称质量并记录数据。
培养基初始pH值对FDS-2生长的影响:在100 mL不同初始pH值的PDB培养基中接种1 mL种子液,于30 ℃、180 r/min培养8 d,按上述条件收集菌丝并冷冻干燥,称质量并记录数据。
不同质量浓度FB1对FDS-2生长的影响:在含不同初始质量浓度FB1(10、50、100 μg/mL)的MSM中按照1%接种种子液,30 ℃、180 r/min振荡培养,每隔8 h取样,测定其在OD600nm。
1.3.5 FDS-2降解特性的测定
降解曲线的绘制:吸取100 μL种子液于20 mL含50 μg/mL FB1的MSM中(pH 7.0),30 ℃、180 r/min振荡培养,每隔8 h取样,8000×g离心5 min,上清液过0.22 μm滤膜,HPLC检测上清液中FB1质量浓度。
温度对菌株降解FB1的影响:吸取50 μL种子液于5 mL含50 μg/mL FB1的MSM(pH 7.0)中,分别置于25、28、30 ℃条件下180 r/min振荡培养,每隔12 h取样,利用HPLC检测FB1质量浓度。
pH值对菌株降解FB1的影响:吸取50 μL种子液于5 mL含50 μg/mL FB1的MSM中,使用磷酸缓冲液调节培养基的初始pH值分别为5.0、6.0、7.0、8.0、9.0,于30 ℃、180 r/min振荡培养,每隔12 h取样,HPLC检测FB1质量浓度。
1.3.6 降解FB1活性物质的定位
在100 mL PDB培养基中接种 1 mL FDS-2种子液,于30 ℃、180 r/min振荡培养5 d,取培养的菌液,8000×g离心10 min。上清液过0.22 μm水性滤膜,在500 μL上清液中加入5 μg FB1反应1 d,以沸水浴灭活的上清液作为对照。菌体沉淀用10 mL磷酸盐缓冲液清洗3 次,用滤纸吸去菌体表面液体,加入液氮后研磨破碎菌体。将研磨后的菌粉加入预冷的 20 mL磷酸盐缓冲液中(pH 7.0),4 ℃、12000×g离心10 min,破碎上清液过0.22 μm滤膜,在500 μL破碎上清液中加入5 μg FB1反应1 d,同时以沸水浴灭活的破碎上清液作为对照组。分别取500 μL菌液上清和菌体破碎上清液,加入20 μL蛋白酶K后于30 ℃反应2 h,随后加入5 μg FB1反应1 d,通过HPLC检测FB1质量浓度。
1.3.7 FDS-2对FB1降解产物的初步分析
将100 μL种子液接种于10 mL含10 μg/mL FB1的MSM(pH 7.0)中,置于30 ℃、180 r/min振荡培养。每隔12 h取样200 μL,取样后立刻置于超低温冰箱冻存,共取样6 次,于冷冻干燥仪中干燥。加入200 μL乙腈超声复溶,12000×g离心10 min,上清液过0.22 μm滤膜待测。使用配备ACE UltraCore Super C18色谱柱(3.0 mm×150 mm,2.5 μm)的AB SCIEX Triple-TOFTM 5600进行质谱检测,流动相分别为0.1%甲酸溶液和乙腈,梯度洗脱条件如下:初始流动相为5%乙腈溶液,9 min内乙腈比例线性升至95%,并以0.4 mL/min流速保持2 min。
1.4 数据统计及图表绘制
HPLC图:从Waters e2695高效液相色谱仪中导出数据,使用GraphPad Prism 8绘制折线图。生长特性与降解特性图:实验均重复3 次,记录实验结果后,使用GraphPad Prism 8软件处理实验数据,得到实验结果图。
2 结果与分析
2.1 FB1降解菌株的筛选与分离
用无菌水浸提18 个玉米样品中的微生物,以FB1为碳源进行富集培养,从3号样品中分离到1 株FB1降解菌,命名为FDS-2。在5 mL含50 μg/mL FB1的MSM中,30 ℃、180 r/min条件下培养7 d,FDS-2可将250 μg FB1完全降解。如图2所示,FB1的保留时间为9.48 min,对照组样品在此时有吸收峰,而实验组样品无吸收峰,表明FDS-2将培养液中的FB1全部降解。

图2 FDS-2降解FB1的HPLC图Fig.2 HPLC chromatogram showing FB1 degradation by FDS-2
2.2 FDS-2的鉴定
FDS-2在马铃薯葡萄糖培养基上生长快,橄榄褐色至黑色,初期黏、酵母状,后期变绒毛状;背面黑褐色,色素不溶于培养基中。气生菌丝茂盛,浅到深褐色,可形成菌丝束;齿状、烧瓶状产孢细胞直接生于菌丝上或形成具1~3隔膜的分生孢子梗;特化的分生孢子梗褐色,顶端色浅、变尖,与菌丝夹角大或近于垂直,宽2.0~3.0 μm,长25~85 μm;分生孢子浅色,长椭圆形或近柱状,单细胞,2.2~5.3 μm×1.0~2.0 μm,在产孢细胞顶端聚集成团(图3)。

图3 FDS-2的菌落形态与显微特征图Fig.3 Colony morphology and microscopic characteristics of FDS-2
使用通用引物ITS1和ITS4扩增菌株FDS-2的核糖体rDNA,PCR产物长度为705 bp。BLAST结果显示,FDS-2与棘状外瓶霉(Exophiala spinifera)CBS同源性高达100%。根据菌种的培养特征、显微特征以及rRNA-ITS序列特征(图4),鉴定FDS-2为棘状外瓶霉。

图4 FDS-2的系统进化树Fig.4 Phylogenetic tree of FDS-2
2.3 FDS-2的生长特性
如图5A所示,在PDB培养基中,菌株于第2天后进入对数生长期,8 d后进行稳定期。由图5B、C可知,FDS-2的最适生长温度为30 ℃,菌株在酸性条件下(pH 5.0)生长最快,在碱性条件下生长较为缓慢。在以FB1为唯一碳源的MSM中,FDS-2累积生物量与初始FB1质量浓度呈正比(图5D),说明菌株FDS-2能以FB1为唯一 碳源生长。


图5 生长时间(A)、温度(B)、pH值(C)和初始FB1 质量浓度(D)对FDS-2生长的影响Fig.5 Effect of growth time (A),temperature (B),pH (C) and initial FB1 concentration (D) on the growth of FDS-2
2.4 FDS-2对FB1的降解特性
FDS-2降解曲线如图6A所示,在MSM中,FDS-2对FB1的最适降解温度为30 ℃(图6B),最适降解pH 5.0(图6C),这与FDS-2的最适生长条件一致。在最适降解温度和pH值条件下,FDS-2可在48 h内把250 μg FB1降解完全。

图6 生长时间(A)、温度(B)和pH值(C)对FDS-2降解FB1的影响Fig.6 Effect of growth time (A),temperature (B) and pH (C) on FB1 degradation by FDS-2
2.5 FDS-2降解活性物质的初步分析
如图7所示,菌株FDS-2菌液上清和菌体破碎液上清对FB1的降解率分别为7.4%和92.3%,沸水浴处理后菌体破碎液上清的降解率显著降低。这表明降解FB1的活性物质位于FDS-2胞内。进一步对上清液进行蛋白酶K处理,破碎液上清中的活性物质失去降解能力,推测该活性物质是菌株FDS-2的胞内酶。

图7 不同处理方法对FDS-2上清降解FB1的影响Fig.7 Effect of different treatment methods on FB1 degradation by FDS-2 culture supernatant
2.6 FDS-2降解产物的初步分析
分析6 个样本的总离子流图(图8A),与FB1标准品的总离子流图相比,FDS-2降解FB148 h的样本出现了一个新的色谱峰(保留时间5.27 min)(图8B)。提取该色谱峰的m/z信息,确定影响离子丰度的物质的m/z406.3506。提取二级质谱信息,发现碎裂离子间的m/z差值为18(图8C),首先推测该物质的化学结构上有5 个羟基,进而推测该物质是FB1脱去2 分子丙三羧酸后的产物,为水解FB1,这与Sphingopyxissp.MTA144降解FB1的初步产物一致。但6 个样本中均未检测到2-酮基-水解FB1的分子离子,因此,FDS-2降解FB1的终产物有待进一步研究分析。
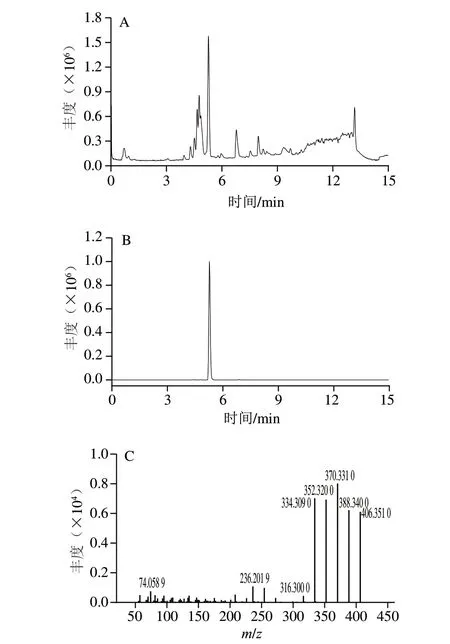
图8 菌株FDS-2降解FB1的质谱图Fig.8 Mass spectra of degradation products of FB1 by strain FDS-2
3 结论
本实验通过富集培养,从江苏徐州、盐城和淮安三地的发霉玉米样品中筛选到1 株FB1高效降解菌FDS-2。经菌落形态观察结合分子生物学分析,将FDS-2鉴定为棘状外瓶霉。FDS-2的最适生长和降解条件均为30 ℃、pH 5.0,在该降解条件下,FDS-2能以FB1为唯一碳源生长并于48 h内将250 FB1降解完全。定域实验表明,菌株FDS-2的降解活性物质是一种胞内酶。
现有的报道中,降解FB1的菌株有丛毛单胞菌[33]、鞘氨醇盒菌[29]、鞘氨醇单胞菌[34]等细菌以及棘状外瓶霉和R.atrovirens两株真菌[35]。Duvick[35]发现棘状外瓶霉降解FB1的过程中,第1步反应是水解FB1侧链的酯键;Heinl等[28]阐明了菌株MTA144的降解途径,第一步反应是也是水解FB1侧链的酯键,第2步则是在转氨酶的作用下进行转氨基反应。本研究降解菌FDS-2在降解FB1过程中也发现了降解产物水解FB1,推测FDS-2中存在一种降解FB1的羧酸酯酶。进一步以FDS-2的基因组测序草图为基因文库进行本地BLAST,并未发现与已报到菌株棘状外瓶霉的水解酶(XP_016238460)高度同源的水解酶基因序列。因此推测菌株FDS-2中存在新型的FB1水解酶。
饲料经动物胃液消化,强酸性会显著降低脱毒效果,故菌株或酶的最适反应pH值在脱毒过程中显得尤为重要。与研究较为深入的鞘氨醇盒菌MTA144相比较,细菌的最适pH值为7.0,而FDS-2的最适生长pH值和降解pH值均为5.0,故推测FDS-2中水解酶的最适反应pH值可能为5.0。菌株FDS-2中高效FB1降解酶有待进一步研究。
