陕西省番茄黄化曲叶病毒基因间隔区缺失突变体的鉴定与不同分离物间群体进化研究
2023-08-05潘嵩魏佩瑶刘晨等
潘嵩 魏佩瑶 刘晨等



中图分类号:S 432. 41;S436. 412.11 文献标识码:A DOI: 10.16688/j.zwbh 2022320
由番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)引起的番茄黄化曲叶病是番茄生产上最为严重的病害之一,每年给中国和世界上其他的主要番茄产区造成重大损失[1-3]。TYLCV属于双生病毒科Gemini-oiridae菜豆金黄花叶病毒属Begomo-oirus,是一种单组分DNA病毒,具有一个环状单链基因组。其基因组有6个开放阅读框,编码6个与病毒侵染和复制相关的蛋白。其中病毒链基因分别编码AV1(病毒的外壳蛋白)与AV2(与病毒的移动相关);互补链基因分别编码AC1(复制相关蛋白)、AC2(转录激活蛋白)、AC3(复制增强蛋白)和AC4(与AV2共同参与病毒DNA跨膜运输与病毒移动)。AC1与AV2之间的区域为基因间隔区(intergenic region,IR),是TYLCV复制起始位点与转录起始信号所在区域。
TYLCV由带毒烟粉虱Bemisia tabaci通过持久性方式传播[4],番茄感染TYLCV后会出现植株矮化、叶片卷曲、斑驳和黄化等症状,最终导致番茄产量下降[5-6]。在我国,TYLCV于2006年首次在上海被发现[3],随后由南向北、由东向西快速扩散。目前,我国已有19个省、自治区和直辖市报道了TYLCV的发生和分布。选育抗病品种是防治番茄黄化曲叶病的根本措施,然而,2018年以来,全国多个番茄产区出现了抗病品种抗性下降甚至丧失的现象。造成这一现象的可能原因之一是TYLCV分离物基因组发生变异,从而使其产生适应性进化。
自1991年首次获得以色列分离物TYLCV-IL的全长基因组序列以来[7],已有较多关于TYLCV分离物基因组的报道[8-14]。在我国,许多地区的TYLCV分离物基因组序列也被相继报道[15-20]。然而,有关TYLCV基因组IR区缺失的报道依然较少[21-22]。在GenBank数据库中登录的来自中国的TYLCV分离物基因组序列中,目前只有来自北京的分离物BJ04与BJ06报道了IR区大片段缺失的情况[22]。本研究从陕西省4个番茄产区采集了24份表现为番茄黄化曲叶病症状的样品,并对15份样品中的TYLCV分离物基因组序列进行测序及系统进化分析,旨在为明确陕西省TYLCV分离物基因组变异情况及番茄黄化曲叶病毒病的有效防控提供参考。
1材料与方法
1.1植物材料
2021年6月-10月,分别在陕西省渭南市大荔县、西安市阎良区、咸阳市泾阳县和杨凌区的大棚和日光温室中调查番茄黄化曲叶病发病情况。对发病症状明显的番茄植株进行拍照,采集发病叶片并记录番茄品种、采集地点和日期。采集的样品带回实验室置于-80℃保存。
1.2番茄样品DNA提取
采用改良的CTAB方法[23]提取番茄叶片DNA,提取的DNA置于-20℃保存备用。
1.3 PCR扩增、克隆与测序
将提取的番茄DNA用无菌水稀释20倍作为模板,采用TYLCV分离物AC2基因的特异性引物TY-DF1/TY-DR1(5′-CATGATCAACTGCTCT-GATTACA-3'/5′-TCATTGATGACGTAGACCC-G-3′) [14]进行扩增。PCR反应条件为:95℃5 min;95℃30 s,55℃30 s,72℃1 min,35个循环;72℃10 min。PCR扩增产物经1%琼脂糖凝胶电泳后回收纯化(DNA纯化试剂盒购自TIANGEN公司),连接至pMD19-T载体(TaKaRa公司)上,转化到大肠杆菌DH5a感受态细胞(TIANGEN公司)中,37 0C条件下,在含有100μg/mL氨苄青霉素的LB固体培养基上培养16 h。挑取单克隆菌落至含有氨苄青霉素的LB液体培养基中培养8h。经过菌液PCR筛选后,选取3个阳性克隆送北京擎科生物公司进行序列测定。
根据目的片段的测序结果,设计TYLCV基因组全长扩增引物TY-CG-F/TY-CG-R(5′-TCGTCTAGATATTCCCTATATGAG-3′/5′-AT-TCAGATAAGATTCAACCACA-3′),以稀释后的DNA为模板进行扩增。PCR扩增条件为:95℃5 min; 95℃30 s,52℃45 s,72℃ 2 min,35个循环;72℃10 min。目的片段回收纯化、连接和测序方法同上。
1.4序列分析
使用DNAMAN 6.0对TY-DF1/TY-DR1与TY-CG-F/TY-CG-R扩增得到的DNA片段进行拼接,获得TYLCV的AC2基因和基因组全长片段。TYLCV分离物基因组的多序列比对通过DNA-MAN及ClustaIW软件进行;利用DnaSP 6.0进行基因组变异分析;在NCBI數据库(https:∥WWW.ncbi.nlm.nih. gov/)下载TYLCV分离物基因序列,利用MEGA 6.0中邻接法(neighbor-joining,NJ)构建系统发育树,bootstrap设置为2000次。
2结果与分析
2.1番茄样品症状与TYLCV检测
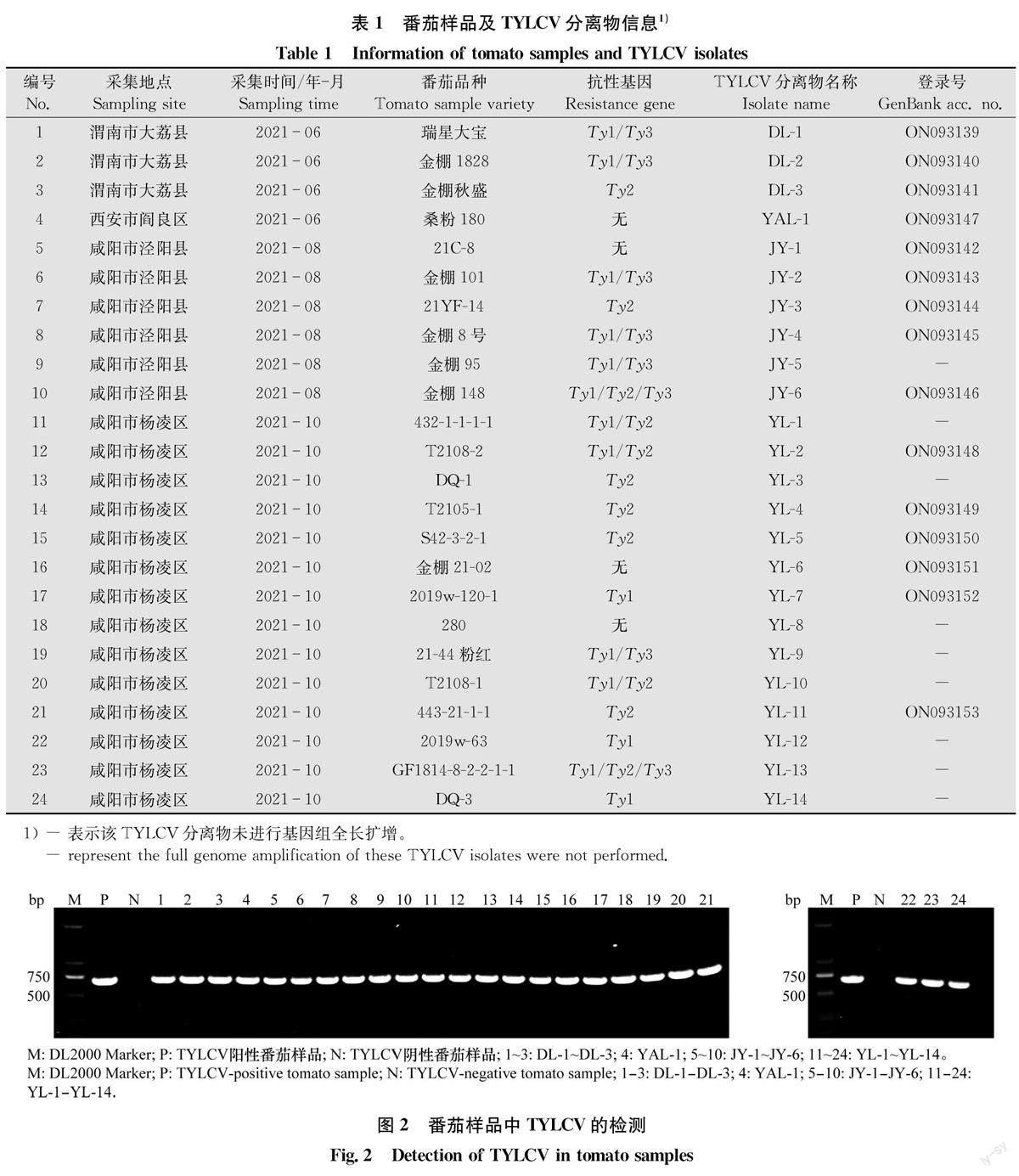
2021年6月-10月,对陕西省渭南市大荔县、西安市阎良区、咸阳市泾阳县和杨凌区日光温室和大棚中番茄样品感染TYLCV状况进行调查发现,各番茄种植地区的不同番茄品种上均出现了较为明显的番茄黄化曲叶病症状。具体表现为番茄植株矮化,番茄新叶出现明显的斑驳、皱缩和黄化,部分样品的叶片则呈现了簇缩状(图1)。采集24份具有明显番茄黄化曲叶病症状的叶片样品,其中抗病品种样品20份,感病品种样品4份(表1),带回实验室后置于-80℃保存。
以番茄叶片样品DNA为模板,采用TYLCV特异性引物TY-DF1/TY-DR1进行PCR扩增。结果显示,24个样品均可以扩增到695 bp的特异性条带(图2)。对扩增得到的条带进行纯化、克隆和测序,并将所得到的测序结果在NCBI上进行BLAST序列比对,结果表明,扩增片段均为TYLCV的AC2基因。
2.2 TYLCV分离物基因组的克隆和初步分析
选取‘瑞星大宝’‘金棚1828’‘金棚秋盛’‘桑粉180' 21C-8’‘金棚101’‘ 21YF-14’‘金棚8号’‘金棚148‘T2108-2’‘T2105-1‘S42-3-2-1’‘金棚21-02’‘2019w-120’‘443-21-1-1’共15份TYLCV检测阳性的番茄样品,采用引物TY-CG-F/TY-CG-R进行扩增,分别得到了15个TYLCV分离物的基因组全长序列并上传GenBank数据库,获得的序列登录号见表1。其中DL-1、DL-2、DL-3、JY-2、JY-3、YAL-1和YL-7分离物基因组大小为2 781 bp;而JY-1、JY-4、JY-6、YL-2、YL-4、YL-5、YL-6和YL-11分离物基因组大小为2 768 bp。15个分离物基因组均编码6个开放阅读框,基因组间序列一致性为99.35%。通过在NCBI上进行BLAST序列比对,所得的分离物基因组均与已报道的TYLCV分离物基因组同源性最高。选取所得到的15个TYLCV分离物,以及代表性的TYLCV分离物TYLCV-Israel- China、TYLCV-Gezira、TYLCV-Iran、TYL-CV-MLD和TYLCV-OM构建基因组系统进化树。结果显示,所得到的15个TYLCV分离物均与TYLCV-Israel-China分离物处于同一个分支,属于TYLCV-Israel分离物种群(图3)。
2.3TYLCV基因间隔区缺失突变体基因组差异分析
进一步对基因组大小不同的两类TYLCV分离物进行序列比对与分析,发现8个基因缺失突变体也含有AV1、AV2、AC1、AC2、AC3和AC4 6个开放阅读框。与2781 bp的正常基因组相比,8个基因缺失突变体均是在IR区2707-2719 nt处出现了13个核苷酸的缺失,缺少序列为TTGTA-AAAGTACA。该缺失位置位于IR区TATA-box与保守的9核苷酸序列(nonanucleotide motif)之间(图4)。在IR区,除出现13个核苷酸缺失外,TYLCV基因间隔区缺失突变体与2781 bp基因组分离物之间的差异还表现为:缺失突变体在2 596 nt位点处核苷酸为A,而在2781 bp分离物中,除YAL-1分离物该位点为A外,其他6个分离物均为T;TYLCV缺失突变体在2 688 nt处核苷酸为T,在2 781 bp基因组分离物中,只有DL-3该位点为T,DL-1、DL-2、YAL-1和YL-7分离物该位点为G,而JY-2和JY-3分离物该位点为C。15个TYLCV分离物在IR区核苷酸一致性为97.45%。
在编码蛋白的氨基酸差异方面,15个TYLCV分离物间AV1、AV2、AC1、AC2、AC3和AC4的编码蛋白一致性较高,分别为99.88%、99.84%、99.40%、99.31%、99.21%和99.16%。一些主要的氨基酸差异位点为:在AC1蛋白的第6位氨基酸处,TYLCV基因间隔区缺失突变体编码氨基酸为Leu,而2781 bp基因组分离物中,除YAL-1分离物该位点氨基酸为Leu外,其他6个分离物该位点均为Ile;在AC2蛋白第26位氨基酸处,2781 bp基因组分离物编码氨基酸为Pro,而在基因间隔区缺失突变体中,除JY-4、YL-4和YL-11分离物该位点编码氨基酸为Pro外,其他5个基因间隔区缺失突变体该位点为Ala;在AC4蛋白第14位氨基酸处,TYLCV基因间隔区缺失突变体编码氨基酸为Ser;而2781 bp基因组分离物中,除YAL-1与DL-1分离物该位点编码氨基酸为Ser外,其他5个分离物该位点均为Asn。
2.4 TYLCV分离物的群体变异与进化分析
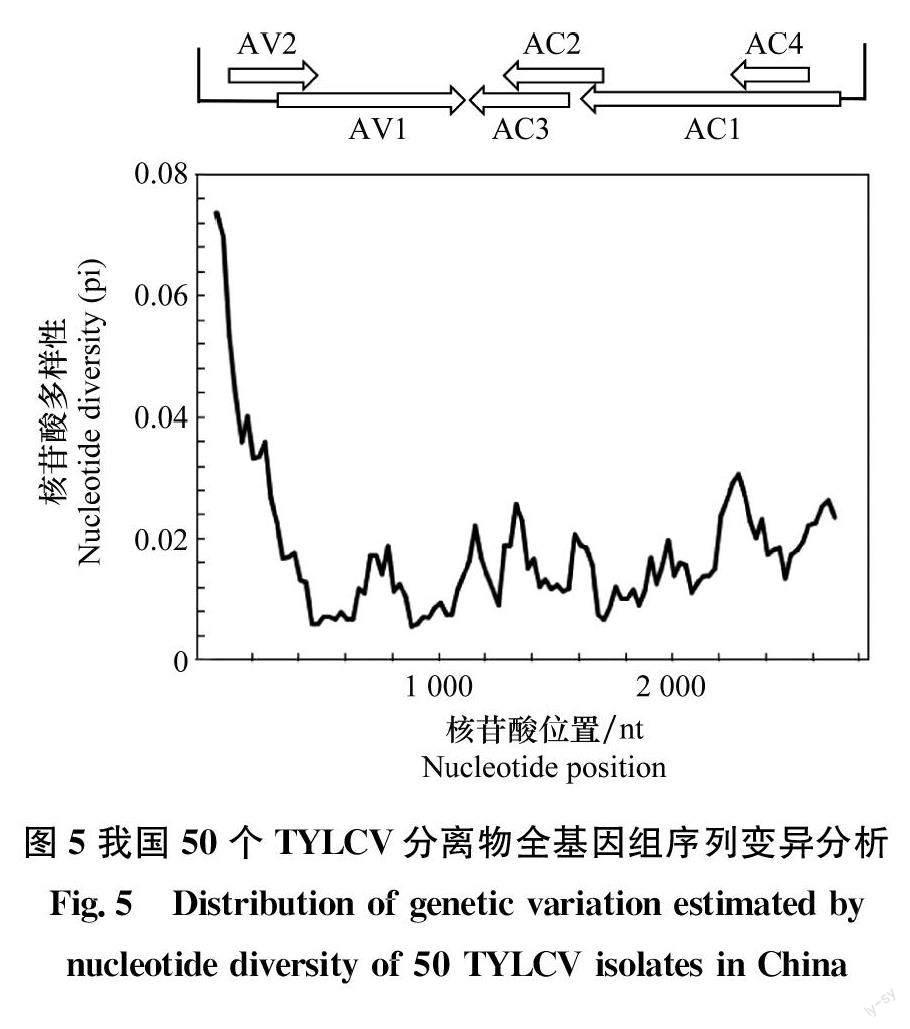
选取来自我国19个地区的35个TYLCV分离物,与本研究分离得到的15个TYLCV分离物进行基因组全序列比对,发现不同分离物间核苷酸一致性为98.31%,说明TYLCV在我国的进化比较保守。为进一步分析不同分离物在基因组不同区域的变异情况,采用DnaSP 6.0软件对上述50个TYL-CV分离物全基因组序列变异情况进行了分析,結果显示,我国TYLCV分离物基因组的变异在基因组不同区域的差异较大。IR区域是基因组变异发生最为频繁的区域,除此之外AC2与AC3基因的重叠区域,AC1与AC4基因的重叠区域,都是TYLCV基因组变异发生较为频繁的区域。与之相反,AV1基因的前端与后端区域,AC1基因的后端区域,都是核苷酸序列相对保守的区域(图5)。
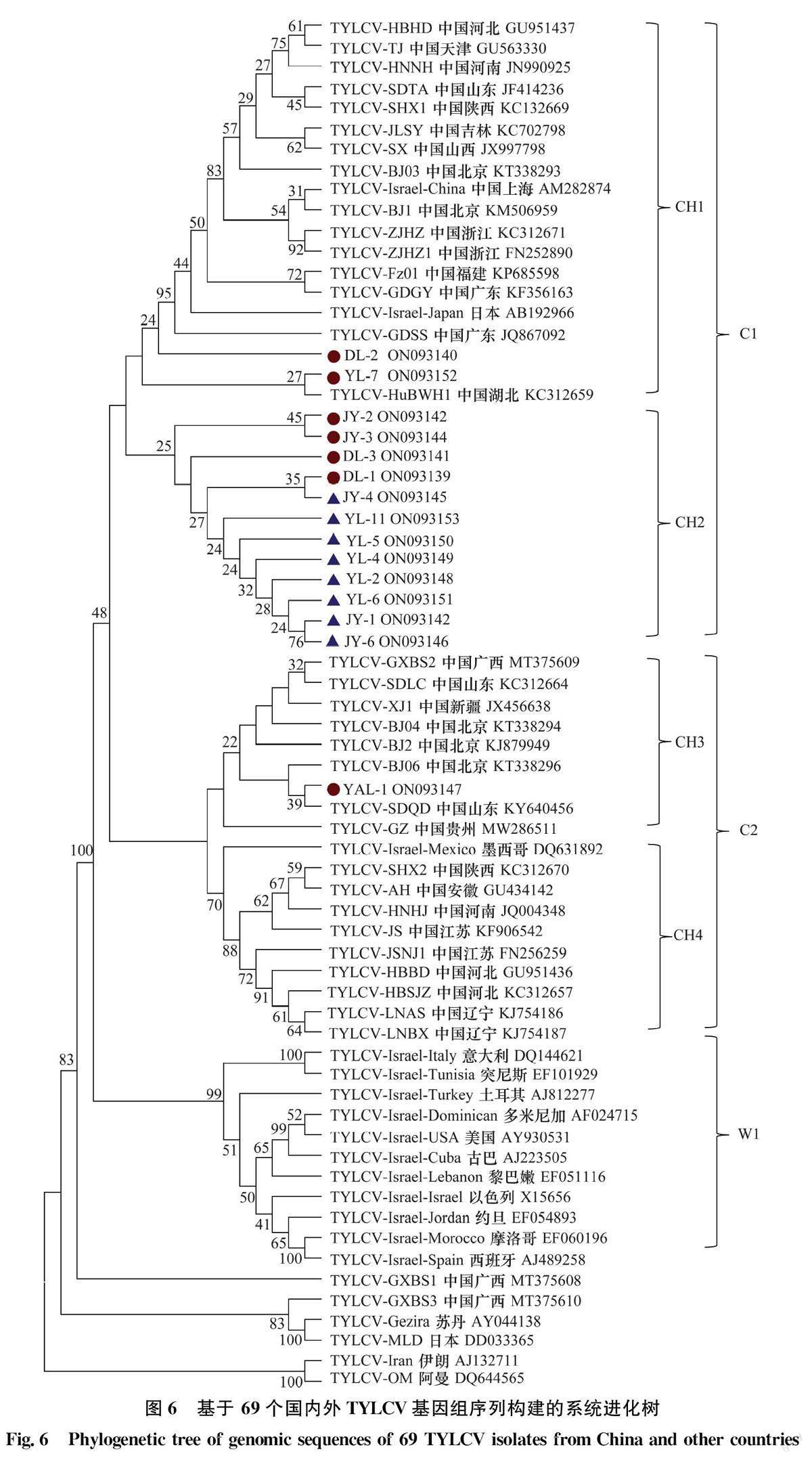
目前,我国已有19个省、自治区与直辖市的TYLCV分离物的全长基因组序列被报道。为进一步分析本研究分离到的TYLCV IR缺失突变体的可能来源,我们选取了来自国内不同地区的50个TYLCV分离物,4个国外的代表性TYLCV分离物以及15个国外典型TYLCV-Israel分离物的全基因组序列,通过MEGA 6.0进行序列比对并构建系统进化树(图6)。结果显示,来自我国的TYLCV分离物中,除广西分离物TYLCV-GXBS3与TYL-CV-GXBS1外,其他48个分离物均与TYLCV-Is-rael分离物聚为一支,为TYLCV-Israel分离物进化过程中出现的分支种群。从进化树上看,目前已报道的TYLCV-Israel分离物种群分为3个主要的亚群,分别为Cl亚群、C2亚群和Wl亚群。其中Cl亚群和C2亚群均主要由TYLCV中国分离物构成,而Wl亚群则由TYLCV-Israel国外分离物构成。在Cl和C2亚群中,根据进化关系,又分别分为2个亚群,分别为Cl亚群中的CH1和CH2亚群,以及C2亚群中的CH3和CH4亚群。DL-2和YL-7分离物属于CH1亚群,其与TYLCV湖北分离物TYLCV-HuBWHl亲缘关系较近。而本研究分离到的8个IR区缺失突变体以及DL-1、DL-3、JY-2、JY-3分离物共同构成了CH2亚群,其亲缘关系较近,表明本研究分离得到的IR缺失突变体可能是由本地正常TYLCV分离物突变而来。YAL-1分离物则位于CH3亚群,与TYLCV山东分离物TYL-CV-SDQD亲缘关系较近。本研究获得的15个TYLCV分离物均与之前报道的陕西分离物TYL-CV-SHX1和TYLCV-SHX2亲缘关系较远,表明TYLCV陕西分离物的来源可能比较分散。从不同亚群分离物分布的地理区域来看,可以初步看出在Cl亚群中的国内TYLCV分离物与日本分离物TYLCV-Israel-Japan亲缘关系最为接近,而C2亚群中的国内TYLCV分离物与墨西哥分离物TYL-CV-Israel-Mexico更为接近。
3结论与讨论
目前,关于TYLCV分离物基因组已有较多的研究。根据地区和序列的差异,一般将TYLCV分为TYLCV-Israel、TYLCV-Gezira、TYLCV-Iran、TYLCV-MLD和TYLCV-OM 5个典型株系[24]。据报道,我国的TYLCV分离物大多属于TYLCV-Israel株系[16-18, 25-27],是TYLCV-Israel分离物进化过程中出现的分支种群。根据GenBank数据库中的序列登录信息,我国所报道的绝大多数TYLCV分离物基因组大小为2781 bp,只有极少的TYLCV分离物基因组小于2781 bp[20,22],且没有来自不同地区的多个TYLCV分离物同时发生IR区大段基因片段缺失的报道。
本研究从陕西省不同地区感染TYLCV的番茄样品中分离得到了15个TYLCV分离物,并发现了一类基因间隔区缺失核苷酸的TYLCV突变体。该突变体在基因组IR区2707-2719 nt处缺失13个核苷酸,缺失位置位于TATA-box与保守的9核苷酸序列之间。相较于TYLCV基因组编码的其他基因,有关IR区功能的研究依然较少。与已报道的TYLCV北京分离物基因间隔区缺失突变体BJ04(2713-2753 nt位置缺失)相比,本研究的IR区缺失突变体的缺失序列位置与BJ04相近。前期研究结果显示,与正常基因组大小的分离物BJ03相比,BJ04的致病能力不同可能是由于IR区片段缺失引起的[22]。然而,由于本研究在进行TYLCV发生调查时,多个生产区番茄品种上番茄黄化曲叶病已经发生较为严重,且一些正常基因组大小的TYLCV分离物与TYLCV IR缺失突变体分离自相邻发病田块,因此,难以判断所分离到的IR缺失突变体是否引起TYLCV致病力的变化,还需要进一步通过构建不同分离物的侵染性克隆等试验来加以研究和证实。
值得注意的是,本研究分离到的8个TYLCV基因间隔区缺失突变体分别来自泾阳县与杨凌区,表明这类基因缺失突变体并不只在单独的地点出现,而是已经在更广泛的地域范围内发生。为了对其变异与进化关系进行进一步的研究,我们对得到的15个分离物与来自国内不同地区的35个TYL-CV分离物进行了基因组水平的核苷酸变异分析,发现我国的TYLCV分离物整体上进化保守,最大的变异峰值在IR区域。同时,我们选取了54个国内外不同地区的TYLCV典型分离物序列,与本研究分离到的15个TYLCV分离物进行了群体进化分析。结果显示,与国内其他TYLCV分离物类似,15个TYLCV分离物均属于TYLCV-Israel株系分支。不同的是,国内报道的IR缺失突变体BJ04与BJ06处于1个分支,而本研究分离到的8个TYL-CV IR突变体处于不同亚群的分支之中,亲缘关系相对较远。与之相应的是,8个TYLCV IR突变体与本研究分离的4个正常基因组大小的TYLCV分离物亲缘关系最近,表明这类TYLCV IR突变体更有可能是由陕西本地的TYLCV分离物突变而来。同时,除YAL-1分离物外,其他14个分离物均具有较近的亲缘关系,与之前报道的陕西省TYLCV分离物TYLCV-SHX1和TYLCV-SHX2的亲缘关系都相对较远,表明陕西省TYLCV分离物可能有多个来源。
TYLCV基因组变异频繁,而这可能与外部的选择压力有关[14, 28-29]。近年来,番茄生产种植中各类抗病品种大规模使用可能使原有的TYLCV分离物出现适应性变异,产生致病能力更强的毒株。2018年后,国内多个番茄产区出现了原有抗病番茄品种抗性下降甚至丧失的现象,其原因之一就是原有TYLCV分离物基因组发生了变异。因此,及时掌握番茄产区TYLCV分离物基因变异情况,分析并检测其可能导致的致病能力变化,对筛选番茄薪抗病品种,从而保障我国番茄生產安全是十分必要的。
