不同冻存方法对大鼠脂肪来源干细胞生物学特性的影响
2023-08-01王静刘洪利潘福勤唐亮
王静 刘洪利 潘福勤 唐亮
[摘要]目的:研究不同冻存方法对脂肪来源干细胞(Adipose-derived stem cells,ADSCs)生物学特性的影响。方法:体外分离培养SD大鼠腹股沟及附睾周围的脂肪组织,取第三代ADSCs冻存于液氮。实验分为三组:对照组A组为非冻存细胞,B组使用无血清非程序冻存液冻存细胞,C组使用传统冻存液(DMEM∶FBS∶DMSO=5∶4∶1)冻存细胞。12个月后复苏ADSCs,通过对比ADSCs的表面抗原、细胞凋亡、增殖及成骨分化情况,分析各组ADSCs生物学性能的差异。结果:各组细胞高表达CD29、CD90;A、B两组细胞的凋亡率显著低于C组(P<0.05);B、C两组的增殖情况和A组相比,差异无统计学意义(P>0.05),B组细胞的成骨分化能力要优于C组(P<0.05)。结论:无血清非程序冻存液冻存ADSCs的效果要优于传统冻存液。
[关键词]脂肪来源干细胞;低温保存;冻存液;凋亡率;成骨分化
[中图分类号]R331 [文献标志码]A [文章编号]1008-6455(2023)06-0108-04
Effects of Different Cryopreservation Methods on Biological Characteristics of Adipose Stem Cells in Rats
WANG Jing,LIU Hongli,PAN Fuqin,TANG Liang
(Cangzhou Medical College,Cangzhou 061000,Hebei,China)
Abstract: Objective To study the effects of different cryopreservation methods on the biological characteristics of ADSCs. Methods Tissue from groin and epididymis of SD rats was isolated and cultured invitro, the third passage cells were frozen in liquid nitrogen. The experiment was divided into three groups: control group A was non-cryopreservation cells, In group B, cells were cryopreserved with serum-free non-programmed cryopreservation method, The cells in group C were cryopreserved with conventional cryopreservation method (DMEM∶FBS∶DMSO=5∶4∶1). ADSCs were resuscitated after 12 months, Through contrast the surface antigen of ADSCs, cell apoptosis, cell proliferation assay and osteogenic differentiation results. To analyse the difference of ADSCs in each group. Results CD29 and CD90 were highly expressed in each group.The apoptosis rate of cells in group A and B was significantly lower than that in group C(P<0.05).There was no significant difference in proliferation between group B and group C(P>0.05). The osteogenic differentiation ability of group B was better than that of group C(P<0.05). Conclusion The effect of serum-free non-programmed cryopreservation method on ADSCs was better than that of conventional cryopreservation method.
Key words: adipose-derived stem cells; cryopreservation; cryoprotectants; apoptosis rate; osteogenic differentiation
ADSCs取材容易,具有自我增殖和多向分化潜能[1-2],可通过分泌各种因子促进创面愈合[3],在医疗美容中有重要作用。多项研究证实ADSCs与支架材料结合后,其成骨能力明显提高[4-7],有望成为骨组织工程理想的种子细胞,在再生医学的治疗方面具有良好的临床应用前景[8]。随着美容医学及组织工程学的发展,人们对ADSCs的需求量随之越来越大。目前,低温冷冻是细胞长期保存的常用方法,一方面可降低細胞污染的风险,另一方面能减少细胞因传代而引起的遗传变异,避免细胞衰老。然而,在细胞冻存和复苏过程产生的低温损伤会对细胞的结构、代谢途径及活性产生极大影响,因此需要找到一种适宜的冻存方法,使低温冷冻细胞的活性可以接近正常水平,从而降低细胞冻存凋亡率。
1 材料和方法
1.1 材料和试剂:雄性SD大鼠,购于河北省实验中心;L-DMEM、Ⅰ型胶原酶、胰蛋白酶、胎牛血清FBS(Gibco,美国)、细胞冻存液(普诺赛,中国)、Annexin V APC凋亡检测试剂盒(BioGems,美国)、CCK-8(博士德,中国);单克隆抗体CD29、CD90(Abcam,美国);ALP染色试剂盒(碧云天,中国);茜素红染色试剂盒(Solarbio公司,中国);RNA提取试剂盒、RT-PCR试剂盒(天根生化科技有限公司,中国);OCN、RUN-2单克隆抗体(Thermo,美国);DMSO、地塞米松、β-磷酸甘油钠、抗坏血酸、维生素D3(Sigma,美国)。
1.2 实验方法
1.2.1 大鼠ADSCs的提取:无菌条件下从SD大鼠腹股沟及附睾周围分离脂肪组织,PBS冲洗2次,去掉肉眼可见的结缔组织,眼科剪剪成浆糊状,用2倍体积的I型胶酶37℃消化60 min,终止消化后200目筛网过滤,1 000 r/min离心10 min,DMEM重悬细胞。
1.2.2 细胞的冻存与分组:①A组取正常培养的第4~6代ADSCs;②B组取第3~5代ADSCs,胰酶消化后,收集细胞,调整细胞密度为5×108/L,加入无血清非程序冻存液,装入冻存管。-80℃冰箱过夜,24 h之后转入液氮;③C组取第3~5代ADSCs,胰酶消化后,收集细胞,调整细胞密度为5×108/L,加入冻存液(DMEM∶FBS∶DMSO=5∶4∶1),装入冻存管,4℃冰箱30 min,-20℃冰箱2 h,-80℃冰箱过夜,之后转入液氮。
1.2.3 大鼠ADSCs的复苏:冻存12个月后,从液氮中将ADSCs取出,立即放入37℃水浴箱,振荡使其快速融化,向冻存管中加入少量培养基,将细胞混合液移入离心管,1 000 r/min離心5 min,弃上清,加入含10% FBS的DMEM,放置于培养箱中培养。
1.2.4 大鼠ADSCs的鉴定:取复苏的ADSCs,胰蛋白酶消化后调整细胞浓度为5×l08/L,每管加入200 ?l细胞悬液,5 ?l CD29抗体、2 ?l CD90抗体,冰上避光孵育30 min,PBS冲洗2次后重悬细胞,1 h内采用流式细胞仪检测。
1.2.5 大鼠ADSCs的凋亡:染色缓冲液清洗细胞2次,1×106/ml的细胞浓度重悬细胞,100 ?l细胞悬液中加入5 ?l的Annexin V共轭物,5 ?l 7-AAD溶液,混匀细胞,25℃避光孵育15 min,加入400 ?l Annexin V结合缓冲液,采用凋亡检测试剂盒进行检测。
1.2.6 大鼠ADSCs成骨诱导:将细胞接种到6孔板,待细胞融合达80%,用成骨诱导培养基(10% FBS的DMEM+0.1 μmol/L地塞米松+10 mmol/L β-磷酸甘油钠+0.05 g/L抗坏血酸)进行诱导,每隔2 d换液1次。
1.2.7 大鼠ADSCs的增殖情况:CCK-8法测定成骨诱导后各组ADSCs的增殖水平,分别在成骨诱导第1、3、5、7、9 d时,胰酶消化细胞,调整细胞浓度为2×1010/L,取100 ?l细胞悬液移入96孔板,每孔加10 ?l CCK-8培养基,孵育1.5 h,酶标仪测量450 nm下的OD值。
1.2.8 ALP染色和茜素红染色:成骨诱导7 d后,PBS冲洗2次,4%多聚甲醛室温固定细胞2 min,PBS清洗后用TBST润洗并浸泡,弃去TBST,每孔加入ALP染色试剂500μl,室温下避光孵育10~15 min,通过共聚焦显微镜观察细胞染色情况。成骨诱导14 d后,4℃,4%多聚甲醛,固定细胞25 min,PBS清洗,40 mmol/L茜素红(pH 4.1)室温染色20 min,观察拍照。
1.2.9 免疫荧光染色:免疫荧光染色观察OCN、RUNX2的蛋白表达情况,成骨诱导14 d后,4%多聚甲醛,室温孵育细胞25 min,PBS清洗3次,每次5 min,0.5% Triton X-100室温通透膜细胞15 min,PBS清洗3次,5%BSA室温封闭1 h,PBS清洗,分别加入一抗OCN(1∶100)和RUNX2(1∶100),孵育细胞并4℃过夜,第2天,PBS清洗3次,避光孵育二抗(1∶50)1 h,DAPI染色15 min,共聚焦显微镜观察。
2 结果
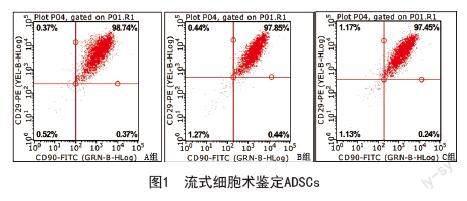
2.1 流式细胞术检测ADSCs的表面抗原:冻存组ADSCs复苏后,用流式细胞术检测ADSCs的表面特异性标记物,结果显示B、C组CD29和CD90的共同阳性表达率分别为97.85%、97.45%,与未冻存组A组(98.74%)相比,差异无统计学意义(P>0.05),表明冻存复苏对ADSCs表面抗原无明显影响,细胞并未因冻存而发生变异。见图1。
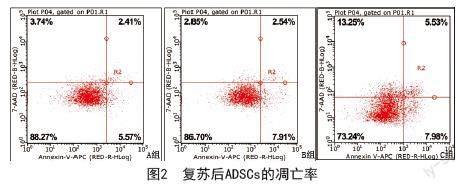
2.2 凋亡检测试剂盒检测ADSCs的凋亡情况:冻存组ADSCs复苏后,用凋亡检测试剂盒检测ADSCs的凋亡情况,其中各组细胞的凋亡率分别为2.41%、2.54%和5.53%,C组ADSCs的凋亡率明显高于其他两组,差异有统计学意义(P<0.05),而无血清非程序冻存液B组和未冻存组A组相比,差异无统计学意义(P>0.05)。见图2。
2.3 CCK-8测定ADSCs的增殖活性:CCK-8法测定细胞的增殖能力,前2 d细胞的生长处于滞留期,之后细胞进入对数生长期,生长迅速。当细胞融合达到80%~90%时,因接触抑制导致细胞进入生长抑制阶段,生长曲线呈“S”形。冻存组(B组、C组)细胞在第7天后进入生长平台期,而未冻存组A组细胞在第9天时活性依然较高,其中冻存组B、C组细胞的增殖能力与未冻存组A组比较差异无统计学意义,但B组更接近未冻存组。见图3。
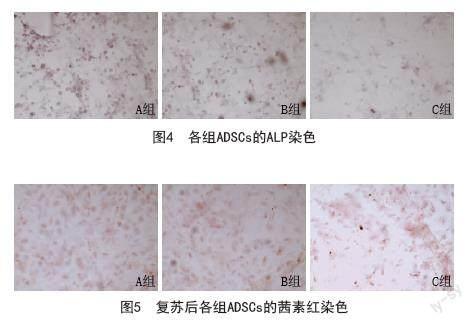
2.4 ALP染色和茜素红染色评估ADSCs的成骨分化能力:细胞成骨能力随ALP含量的增加而呈递增趋势,经成骨诱导7 d后ALP染色结果见图4,A、B组细胞内ALP染色基本持平,C组细胞ALP染色明显降低。成骨诱导14 d后茜素红染色结果见图5,与A、B两组相比,C组细胞内茜素红染色显著降低,这可能和细胞的凋亡率增加导致细胞数量减少有关。见图4~5。
2.5 免疫荧光检测OCN、RUNX2的表达:用免疫荧光染色检测特定成骨蛋白OCN,RUNX2在ADSCs的蛋白表达。A组与B组OCN荧光强度相近,且细胞数量较多。而C组OCN的荧光强度稍低,细胞数量较少。RUNX2免疫荧光染色图像和OCN显示同样的结果。见图6。
3 讨论
间充质干细胞,在骨及软骨再生、创面愈合、改善瘢痕等方面有巨大的优势和潜能[9],ADSCs属于多能间充质干细胞,除了能分泌多种生物活性因子,促进内皮细胞的增殖、迁移进而加速血管生成外,还可以通过细胞间的直接接触促进相邻组织细胞的增殖和迁移[10]。ADSCs能贴附支架材料生长,并在特定条件下(添加成骨诱导液)定向成骨分化,于体内、体外均具良好的成骨效应[11-13],是骨組织工程的理想选择。然而体外长期培养,反复传代,会使细胞的生物学特性发生改变,影响细胞功能。低温冻存是长期保存细胞的有效方法,可弥补以上不足。
低温冻存和复苏的过程,可对细胞膜产生致死性的破坏,因此需加入冷冻保护剂。目前最常用的细胞冻存液是DMSO结合一定浓度的FBS溶液。DMSO是一种渗透性保护剂,但有一定的毒性,长期保存会增加细胞死亡率。血清中含有丰富的营养物质,能稳定细胞膜、调整细胞内渗透压,减少冻存和储存中活性氧自由基对细胞的伤害[14]。但价格昂贵,且血清所含促细胞因子及活性物质的比例不同,冻存效果不一。因此,本研究应用了一种无血清非程序细胞冻存液。
该冻存液中添加了细胞沉降稳定剂,可延缓细胞在冻存过程中的沉降速率,防止细胞互相挤压,影响冻存效果。另外,添加了细胞膜保护剂、渗透性细胞膜内保护剂、非渗透性细胞保护剂等多种冷冻保护剂,这些成分在溶液中同水分子结合,发生水合作用,弱化水的结晶过程使溶液的黏性增加从而减少冰晶的形成,能大大降低细胞在冻存过程中冰晶对于细胞的损伤,有效提高细胞复苏存活率。
该冻存液冻存步骤简单,无需将细胞多次转移后再投入液氮中,减少了每次转移过程中由于温度急剧变化而造成的细胞损伤。谭菊等[15]研究发现鼠胚成纤维细胞系(STO)细胞于-70℃冰箱中平衡过夜,再转移至液氮中超低温冷冻是较为理想的保存方法。实验结果也进一步证实低温冷冻后细胞的均能成功地复苏,流式细胞术检测结果显示细胞高表达ADSCs相关的表面抗原CD29、CD90,说明细胞仍保留ADSCs表面抗原的特性,具有低免疫原性。凋亡实验表明无血清非程序冻存液B组和对照组A组凋亡率接近,显著低于C组。其原因主要在于B组在保存过程中降温相对稳定,且包含多种冷冻保护剂。
本实验从经济、合理性考虑,建立了一种较为适合ADSCs的冻存方法,为ADSCs的长期存储和应用提供了实验依据。为ADSCs在骨组织工程、口腔颌面部疾病领域中的应用提供了理论支持。
[参考文献]
[1]Post Y,Clevers H.Defining adult stem cell function at its simplest:the ability to replace lost cells through mitosis[J].Cell Stem Cell,2019,25(2):174-183.
[2]Ho T T,Warr M R,Adelman E R.Autophagy maintains the metabolism and function of young and old stem cells[J].Nature,2017,543(7644):205-210.
[3]Galipeau J,Sensebe L.Mesenchymal stromal cells:Clinical challenges and therapeutic opportunities[J].Cell Stem Cell,2018,22(6):824-833.
[4]Liu C,Dong J Y,Yue L L,et al.Rapamycin/sodium hyaluronate binding on nano-hydroxyapatite coated titanium surface improves MC3T3-E1 osteogenesis[J].PLOS One,2017,12(2):1-13.
[5]Toosi S,Naderi-Meshkin H,Kalalinia F,et al.Bone defect healing is induced by collagen sponge/ polyglycolic acid[J].J Mater Sci Mater Med,2019,30(3):1-10.
[6]Ko E,Lee J S,Kim H,et al.Electrospun silk fibroin nanofibrous scaffolds with two-stage hydroxyapatite functionalization for enhancing the osteogenic differentiation of human adipose-derived mesenchymal stem cells[J].ACS Appl Mater Interfaces,2018,10(9):
7614-7625.
[7]Liao H T,Tsai M J,Brahmayya M,et al.Bone regeneration using adipose-derived stem cells in injectable thermo-gelling hydrogel scaffold containing platelet-rich plasma and biphasic calcium phosphate[J].Int J Mol Sci,2018,19(2537):1-18.
[8]Rigato M,Fadini G P.Circulating stem/progenitor cells as prognostic biomarkers in macro-and microvascular disease:a narrative review of prospective observational studies[J].Curr Med Chem,2018,25(35):4507-4517.
[9]李嘉欣,陳伟华.脂肪来源干细胞在改善老化皮肤质地中的作用及其临床应用[J].中国美容医学,2020,29(5):187-189.
[10]王彤,刘毅.脂肪间充质干细胞在创面愈合中的应用[J].中国美容医学,2022,31(2):172-177.
[11]Rad M R,Bohloli M,Rahnama M A,et al.Impact of tissue harvesting sites on the cellular behaviors of adipose-derived stem cells:implication for bone tissue engineering[J].Stem Cells Int,2017,2017(6):2156478.
[12]Alluri R,Jakus A,Bougioukli S,et al.3D printed hyperelastic "bone" scaffolds and regional gene therapy:A novel approach to bone healing[J].J Biomed Mater Res A,2018,106(4):1104-1110.
[13]Park S,Heo H A,Lee K B,et al.Improved bone regeneration with multiporous plga scaffold and bmp-2-transduced human adipose-derived stem cells by cell- permeable peptide[J].Implant Dent,2017,26(1):4-11.
[14]游小燕,何琦琳,刘雪芹,等.一种无血清冻存液在猪胎儿成纤维细胞上的应用研究[J].基因组学与应用生物学,2019,38(1):69-73.
[15]谭菊,武彩红,文潮潮,等.不同方法对STO细胞冻存效果的影响[J].安徽农业科学,2021,49(23):130-132.
[收稿时间]2022-5-13
本文引用格式:王静,刘洪利,潘福勤,等.不同冻存方法对大鼠脂肪来源干细胞生物学特性的影响[J].中国美容医学,2023,32(6):104-111.
