云南玉溪烟区烟草黑胫病菌的生理小种鉴定及其致病性分析
2023-08-01刘迎龙王军伟陆俊平何鹏搏何鹏飞卢灿华李鹏强吴毅歆孔宝华田阳阳何月秋
刘迎龙,王军伟,陆俊平,何鹏搏,何鹏飞,卢灿华,李鹏强,吴毅歆,孔宝华,田阳阳*,何月秋*
1. 云南省云南农业大学生物资源保护与利用国家重点实验室,昆明市盘龙区沣源路452 号 650201
2. 红塔烟草(集团)有限责任公司,云南省玉溪市红塔区红塔大道118 号 653100
3. 云南省烟草农业科学院,昆明市五华区圆通街33 号 650021
由烟草疫霉菌(Phytophthora parasiticavar.nicotianae)引起的烟草黑胫病(Tobacco black shank)是一种毁灭性的土传病害,严重影响烟叶生产的发展[1]。同时,随着全球气候的变暖,单一品种大面积种植以及病原菌的抗药性增加和致病力增强等原因,导致烟草黑胫病发生面积和严重程度增大,影响了特色优质烟叶的稳定供给[2]。烟草黑胫病菌存在生理小种分化现象,既是其对寄主植物和环境适应的表现,也是此类病害难以有效防治的原因之一。烟草疫霉菌不同生理小种是在特定鉴定品种上的不同致病型[3]。迄今为止,世界范围内已报道的烟草黑胫病菌有4 个生理小种,其中美国已发现0、1、2 和3 号生理小种,非洲发现2 号生理小种[4-6]。我国云南、四川、湖北和河南等产区先后发现了0号和1 号生理小种[7-11]。烟草黑胫病的综合防治主要以种植抗病品种为主,但烟草疫霉菌新的生理小种或高毒力菌系的出现往往使一批抗病品种(尤其是具有单基因控制的垂直抗性品种)丧失抗病性而成为感病品种,造成病害的大流行[12-14]。因此,鉴定烟草疫霉菌的生理小种,明确植烟区黑胫病菌种群结构及致病力的差异对控制烟草黑胫病具有重要意义。而目前采用鉴别寄主活体植株的抗感反应来鉴定生理小种虽然结果可靠,但耗时耗力,温室幼苗或田间苗圃接种约需2 月以上,而其他替代方法如TTC 法仅能根据颜色反应区分0 号或1 号生理小种和其他生理小种具有明显局限性[15]。另外,组培苗接种法虽然能快速获得长势一致且无病原菌的寄主材料,但培养室环境没有寄主的生境复杂,致使鉴别的准确率降低[16]。因此,需要寻求一种高效的烟草黑胫病菌生理小种鉴定方法。有研究表明,云南玉溪市烟区黑胫病菌的遗传分化差异小,具有高度同源性[17],但对于该地区黑胫病菌生理小种归属及对主栽品种的致病性差异并不明确。为此,对云南玉溪烟区黑胫病菌种群结构和致病力差异,以及生理小种鉴别方法进行了研究,旨在为明确该地区病原菌的特性、指导烟叶栽培品种合理布局及科学防控烟草黑胫病提供依据。
1 材料与方法
1.1 烟草疫霉菌的分离及培养
于2020 年6 月—2021 年10 月在云南省玉溪市新平县和澄江市烟草种植区采集烟草黑胫病病株及根际土壤各200 余份,参考本实验室设计的卵菌选择性培养基分离病原物[18]。即以燕麦培养基(Oat Meal Agar,OMA)为基础培养基,灭菌后加入以下成分混匀制成培养基平板:利福平[98%,生工生物工程(上海)股份有限公司]25~75 mg/L、氨苄青霉素(98%,北京索莱宝科技有限公司)50~100 mg/L、制霉菌素(4 400 units/mg,上海麦克林生化科技有限公司)25~75 mg/L、恶霉灵(AS,总有效成分含量30%,四川国光农化股份有限公司)50~100 mg/L、五氯硝基苯[98%,阿拉丁试剂(上海)有限公司]75~150 mg/L 和甲硫·戊唑醇(SC,总有效成分含量为41%,甲基硫菌灵34.2%,戊唑醇6.8%,江苏龙灯化学有限公司)25~75 mg/L,培养基pH 6.8~7.2。分离培养3~5 d后纯化疑似菌落,之后根据烟草疫霉菌外观形态鉴定并参考柯赫氏法则[19]验证后确认病原物,以燕麦培养基中于28 ℃培养。
1.2 烟草疫霉菌生理小种的TTC法鉴定
TTC(2,3,5-氯化三苯基四氮唑)溶于水中为无色溶液,当与菌株产生的脱氢酶发生氧化还原反应时,生成红色产物三苯基甲臜(TTF),烟草疫霉菌0号、1号生理小种脱氢酶可以使TTC还原,培养基变成品红色[9,15]。因此,利用0.05%(质量体积分数)TTC的燕麦培养基平板可鉴定烟草疫霉菌株的0号和1 号生理小种[15]。具体操作:于燕麦平板上活化培养供试菌株,以无菌7 mm 打孔器取菌饼,菌丝面朝下倒置于含TTC 的燕麦培养基平板中央,同时接种至不含TTC 的燕麦平板上作为对照,每个供试菌株重复3 个平板。于28 ℃温箱中黑暗培养3~5 d,期间观察菌落变化和颜色反应,最终统计并拍照记录。
1.3 烟草疫霉菌生理小种鉴别寄主的活体接种鉴定
参考烟草疫霉菌生理小种鉴定方法[9,20-22],选择皱叶烟草(Nicotiana plumbaginifolia)、裸茎烟草(Nicotiana nudicaulis)、NC1071(G43)、Florida 301(XJ1002)、小黄金1025 和L8(BWS10)[3,23-24]6 个抗、感明显的鉴别寄主,以活体植株接种的方式对供试烟草疫霉菌株生理小种进行鉴定。预先将上述鉴别寄主的烟草种子催芽后播种至穴盘内,置于15~28 ℃的育苗棚内培养约30~50 d 后移栽至小花盆(直径×高度=12 cm×13 cm)中,并于室外还苗1周后备用。供试菌株提前于燕麦平板上活化培养,待菌丝长满培养皿后移入光照培养箱内(3 000 lx 光照/黑暗各12 h)诱导其产生孢子囊,3 d后取出,用灭菌牙签刮取表面菌丝,并于小型榨汁机(JYL-C93T 九阳豆浆机,九阳股份有限公司)内加入100 mL 无菌水将菌丝体打碎,破碎时间持续15 s,双层纱布过滤后取滤液于血球计数板上计数游动孢子,并调整孢子浓度至1×106个/mL。接种时先将上述6 个鉴别寄主烟苗进行致伤处理,即用无菌手术刀对其茎基部纵向划一长约8~10 mm,深约2~3 mm 伤口(以刺入烟苗髓部为宜)。致伤后立即对伤口处注射500 μL 上述供试菌株孢子液,以注射等量无菌水作为对照,每个供试菌株对应的鉴别寄主分别处理3 株烟苗作为重复。烟苗管理一致,按照标准方法进行病害调查及抗性评价[25-26],并根据鉴别寄主反应判断供试烟草疫霉菌的生理小种类型。
1.4 主栽品种的致病性分析
与活体植株接种鉴别生理小种方法一致,以主栽品种云烟87、K326和KRK26 作为接种对象,测定供试菌株对主栽品种的致病性。
1.5 烟草疫霉菌生理小种的离体材料鉴定
根据TTC 法及鉴别寄主鉴定结果,选择烟草疫霉菌0 号和1 号的生理小种各3 株,采用6 个鉴别寄主和3 个主栽品种的离体材料鉴定各生理小种的致病性。待烟苗长至4 叶期,采集叶片和茎秆进行致伤(叶片与茎秆均用无菌牙签扎一小孔,茎秆伤口深约1~3 mm)和未致伤处理后保湿培养,同时用打孔器在燕麦培养基平板上取7 mm 不同生理小种的烟草疫霉菌丝块,菌丝面朝下贴至接种材料的表面,同时接种无菌燕麦琼脂块作为对照,同一接种材料设置3次重复,定期观察并记录发病状况。
1.6 数据处理
采用IBM SPSS Statistics 27软件统计试验数据的平均值并进行方差分析,采用Duncan’s 法进行数据间差异的显著性(P<0.05)检验。使用Microsoft Excel 2016软件进行表格制作及图像处理。
2 结果与分析
2.1 烟草疫霉菌的分离鉴定
分离物在燕麦培养基平板上长势良好,菌落白色,菌丝无隔,无色透明,质地较紧密,孢子囊呈柠檬型,具乳突状孢囊孔,内含未成熟的游动孢子泡状颗粒。用分离物菌丝块接种健康的KRK26 离体叶片1~3 d后即可看到黄棕色水渍状病斑,随后接种部位腐烂发黑。取发病部位的菌丝体镜检观察,可见大量柠檬型具乳突状的孢子囊。通过选择性培养基分离及柯赫氏法则验证后获得172 株烟草疫霉菌。其中,新平县平甸乡69株,新化乡15株,澄江市右所镇88株。
2.2 烟草疫霉菌生理小种的TTC法鉴定
供试的172个烟草疫霉菌株在TTC培养基平板上菌落呈品红色,而不含TTC 的燕麦培养基平板上,菌落呈白色,颜色差异明显,见图1。即所鉴定的烟草疫霉菌属于0号或1号生理小种。
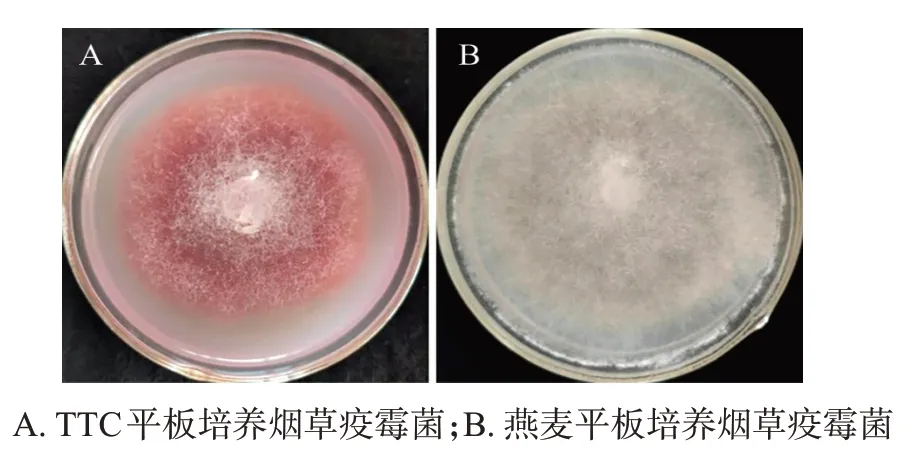
图1 TTC平板上烟草疫霉菌的显色反应Fig.1 Color reaction of P.parasitica var.nicotianae on TTC plate
2.3 烟草疫霉菌生理小种的鉴别寄主鉴定
鉴别寄主对烟草疫霉菌不同生理小种具有不同的抗感反应型[10,15,27]。172个菌株可分为0号生理小种149 株,占比86.63%;1 号生理小种12 株,占比6.98%;无致病力的有2 株(对主栽品种也无致病力),占比1.16%;另有9株对鉴别寄主的致病反应无规律,无法鉴定其生理小种类型,占比5.23%。对于新平县平甸乡、新化乡和澄江市右所镇种植区而言,平甸乡与右所镇种植区均有0、1号生理小种和其他类型菌株,而新化乡种植区仅有0号生理小种,未见其他类型菌株,见表1。因此,云南玉溪烟区烟草黑胫病菌以0号生理小种为优势种群。
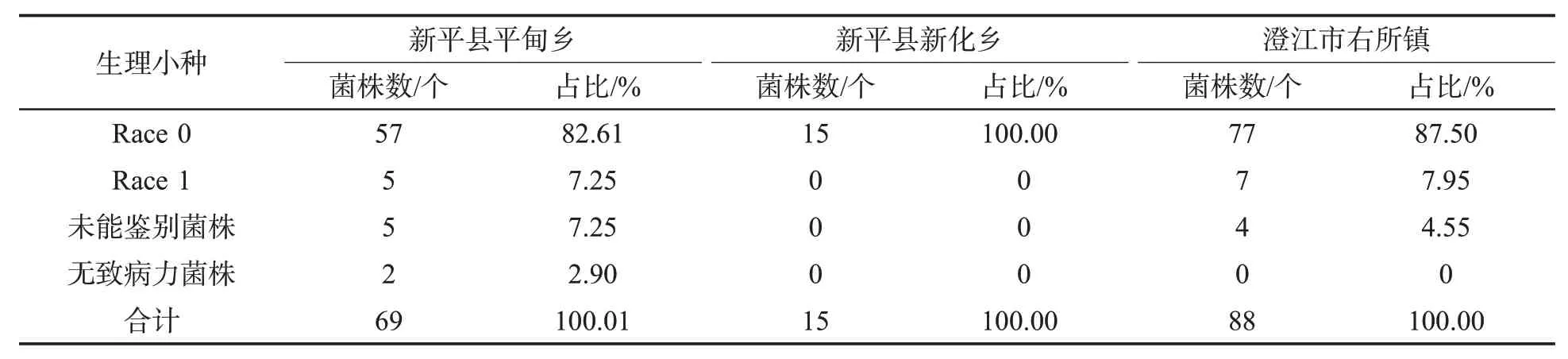
表1 云南玉溪新平县和澄江市烟区烟草疫霉菌生理小种菌株数量和占比Tab.1 Number and percentage of physiological races of P.parasitica var.nicotianae in tobacco-growing areas of Xinping County and Chengjiang City
2.4 黑胫病菌对主栽品种的致病性
根据采样点的地理分布及菌株来源,按乡镇归类分析各产区烟草黑胫病菌对3个主栽品种的致病性差异。以病情指数为依据,比较单个品种感病反应,来源于不同种植区的烟草疫霉菌对品种KRK26、K326 和云烟87 的致病性差异均不显著,3个烟草品种K326、云烟87、KRK26 病情依次加重。其中,K326 的病情指数为47.16~49.76,低于云烟87与KRK26。致病性测定结果表明,170 个菌株对主栽品种KRK26、云烟87和K326均有较强致病力,但病菌在这3个主栽品种上的致病性与来源地之间关系不密切,见图2。
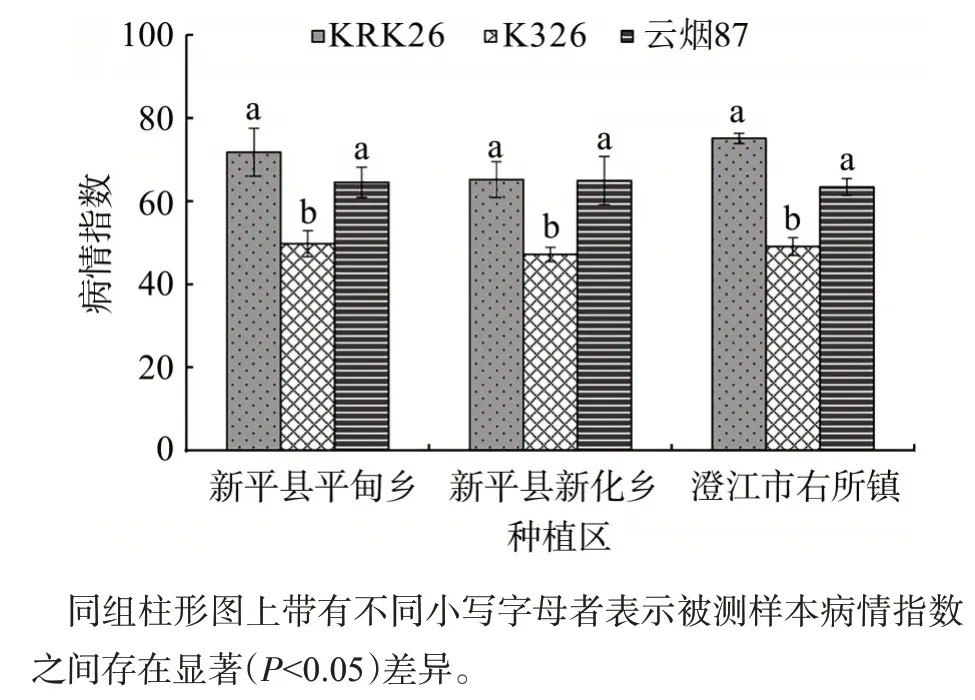
图2 供试烟草疫霉菌对主栽品种的致病性差异Fig.2 Pathogenicity difference of tested P.parasitica var.nicotianae to main tobacco cultivars
2.5 离体叶片和离体茎秆烟草疫霉菌生理小种的接种鉴定
鉴别寄主中,由于皱叶烟草长势较弱,叶片和茎秆材料较少,不适宜采集;NC1071(G43)抗感性状不够分明,稳定性较差;主栽品种云烟87 和KRK26 较感病,因此这些品种均不适合作为离体材料,而以Florida 301、K326、裸茎烟草(N.nudicaulis)、L8 及小黄金1025作为鉴别品种进行试验。离体叶片致伤接种后3 d,各处理均有不同程度的发病,其发病症状主要表现为初期叶片呈现暗绿色水渍状病斑,随后迅速扩散,后期出现黑褐色溃烂病斑,有的出现白色霉层。烟草疫霉菌0 号小种与1 号小种接种的叶片症状差异较大。其中,品种Florida 301均未发病;品种K326、裸茎烟草和L8接种0号生理小种后均未发病,接种1号生理小种后品种K326发病稍轻,病斑形成一水渍状晕圈,裸茎烟草与L8 发病稍重,病斑呈发黑腐烂状;品种小黄金1025 对于两者均表现为感病,接种后叶片发病较重,病斑呈黄棕色,见图3。

图3 烟草离体叶片致伤后接种0号和1号生理小种的发病症状Fig.3 Symptoms of in vitro injured tobacco leaves after inoculation with physiological races 0 and 1
离体茎秆尝试茎端横切面处、纵切于剖面处以及茎秆中部致伤或不致伤接种等方法。其中,茎端横切面和纵切剖面处伤口较大,接种后3~5 d茎秆发病腐烂较快,即使抗性品种Florida 301和K326也发病严重,无法区分0 号和1 号生理小种的致病性差异;茎秆中部未致伤接种后7 d 均未见明显发病,而经过致伤接种后7 d各品种茎秆对0号和1号生理小种表现出较明显的抗感反应。其中,品种Florida 301茎秆均未发病,呈现绿色;而品种K326 出现轻微发病,茎秆呈黄褐色水渍状;裸茎烟草、L8 对0 号生理小种表现为抗病,茎秆呈现绿色,较健康;1号生理小种表现为感病,茎秆呈褐色;而品种小黄金1025对两者均感病,接种后形成黑色病斑,迅速从接种点向两端扩展并变褐腐烂,见图4。
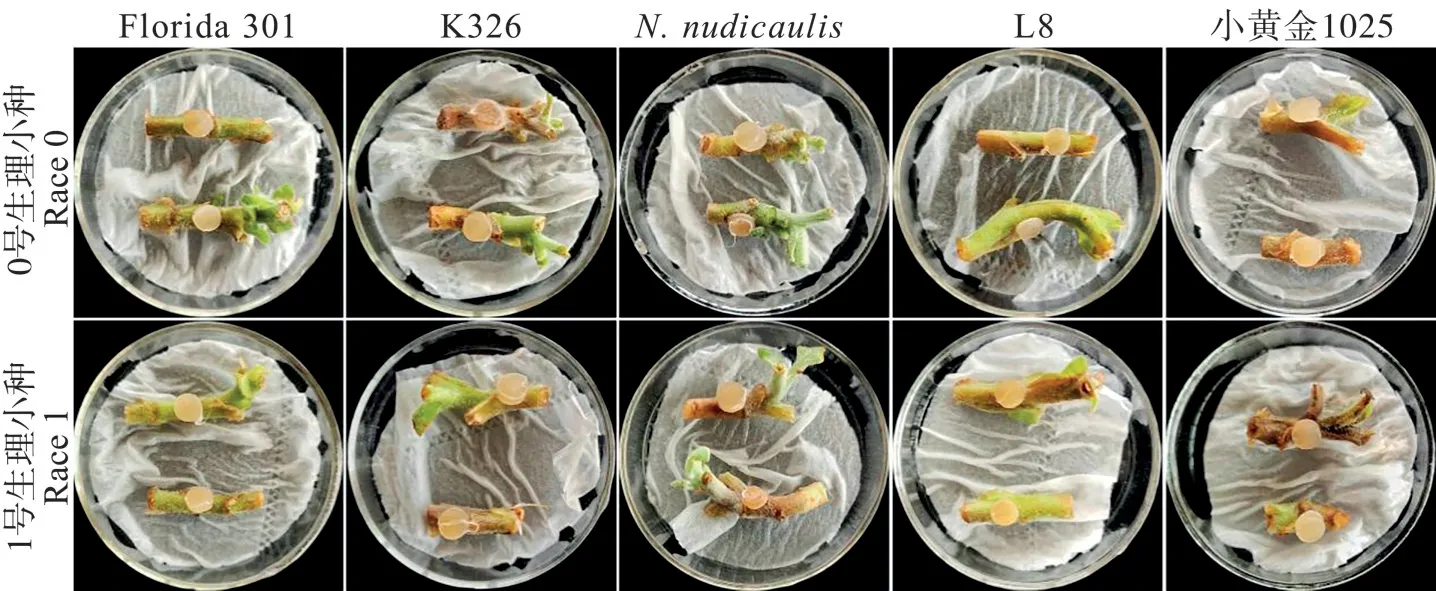
图4 烟草离体茎秆致伤后接种0号和1号生理小种的发病症状Fig.4 Symptoms of in vitro injured tobacco stalks after inoculation with physiological races 0 and 1
3 讨论
已有研究表明,云南烟区烟草黑胫病菌生理小种以0 号为主要群体[8,27]。本研究中对玉溪烟区黑胫病菌生理小种鉴定结果显示,0 号生理小种占86.63%,为该地区的优势种群,这与前人研究结果相似[7-11]。此外,本研究中将分离到的黑胫病菌接种至该地区主栽品种KRK26、云烟87、K326 活体植株上,抗性较强的品种K326病情指数超过47.16,显示该地区0 号生理小种对主栽品种具有强致病力。据报道,与1 号生理小种相比,0 号生理小种的烟草疫霉菌基因组中具有更多调控RXLR效应因子的相关基因,导致根茎腐烂的严重程度更大,具有更强的致病力;同时,0 号生理小种由于田间潜伏期较短,越冬存活率比1 号小种更高,故具有较强的生态环境适应性[28-29]。因此,这可能是0 号生理小种在该地区具有更大的群体数量的原因。此外,本研究中未鉴别出生理小种归属的有9 株,可能与接种环境有关。无致病力的烟草黑胫病菌有2 株,原因可能是由于封存菌种时间较长导致致病力下降;但总体来看,云南玉溪地区烟草黑胫病菌遗传变异小,致病性分化不明显。
本研究中尝试用鉴别寄主离体材料接种病原物鉴定其生理小种,与活体植株根基部致伤注射接种法相比,具有接种材料易得、植株可重复利用、省时高效等优点。在离体材料鉴别中,叶片与茎秆在轻微致伤的条件下对烟草黑胫病菌生理小种的抗感反应与根基部致伤后注射接种法的鉴定结果一致,具有同等的鉴别力,证实了离体材料接种法可用于区分不同烟草品种对烟草疫病的抗感特性。但与根基部致伤注射接种法相比,离体接种的寄主材料发病率略高,病斑更易扩散。这可能与病菌接种离体材料后诱发的抗性不如植株完整,抗性产生的区域较为局限等因素有关[30-31]。而比较两种材料的抗感反应发现,离体叶片更易发病,因此该方法可能更适合于烟草黑胫病菌致病性接种的快速测定;而茎秆接种则更能反映活体植株的抗感性水平,其抗感反应明显、结果稳定,可作为活体植株的替代方法。此外,选择合适的鉴别品种并把握致伤的程度,以及如何以准确判断离体材料的抗感性等有待进一步深入研究。
云南省玉溪是优质烟叶生产区,主要栽培KRK26、K326 和云烟87 等品质好但不抗病的烟草品种,烟草黑胫病发生风险较大,病原物的广泛适应性可严重威胁寄主的持久抗性。据报道,持续种植感病品种能使原本适应抗性较差品种的病原物再次具有侵染性和强致病力,并导致大面积的病害发生;但将感病品种与抗性较差品种混合种植或轮作可延长抗性一般品种的种植年限,有效降低病害发生风险,最大限度地减少病原菌在种群间转移,目前该方法也是控制烟草黑胫病的最有效途径[32-33]。因此,云南玉溪烟区在布局种植品种时应以抗烟草黑胫病菌0 号生理小种的烟草品种为主,同时采用合理的耕作制度与栽培方式来控制烟草黑胫病的发生。
4 结论
采用TTC法及活体植株接种法鉴别烟草黑胫病菌生理小种,发现来源于云南玉溪市新平县和澄江市的172株烟草疫霉菌属于0号或1号生理小种,0号生理小种占比86.63%,1 号生理小种占比6.98%;无致病力及未鉴定出小种归属的菌株分别占比1.16%和5.23%,新平县和澄江市烟草黑胫病菌生理小种以0号生理小种为主。致病性测定结果表明,170个菌株对主栽品种KRK26、云烟87 和K326 均具有强致病力。利用寄主离体叶片与茎秆轻微致伤后接种烟草黑胫病菌0和1号生理小种,所呈现的抗感反应与活体植株注射接种结果一致,具有同等的鉴别力,证实了离体材料接种法可用于区分不同烟草品种对烟草黑胫病的抗感性。
