猪瘟病毒装甲RNA颗粒质控品的研制及评估
2023-08-01邓俊花陈冬杰吴绍强
邓俊花,陈冬杰,魏 方,吴绍强
中国检验检疫科学研究院,北京100176
猪瘟(classical swine fever,CSF)是一种由经典的猪瘟病毒(CSFV)引起的高度接触性、传染性疾病,为我国二类动物传染病,同时也是OIE 必报疫病。该病的高发病率和高死亡率给全球范围内的养猪业造成巨大经济损失,严重危害畜牧业的发展。目前,国内猪瘟疫情的主要特点为温和性、散发性、多种病原混合感染、隐性感染和亚病毒感染等,非典型猪瘟病理变化的情况时有发生[1],这对CSF 的临床诊断带来了很大的困难。
目前,国内外许多研究者建立了猪瘟病毒分子生物学诊断方法[2-12]。但是,由于缺乏安全稳定的阳性质控品,使得猪瘟核酸检测方法很难做到全程监控。利用Amored RNA 技术制备的装甲RNA 颗粒稳定、易保存、安全性高,能模拟天然病毒结构特性,与临床样本保持一致,可作为核酸提取、扩增和扩增后分析等各个环节的质控,确保结果的真实可靠,可有效克服传统RNA 物质存在的缺陷[13-19]。本研究采用一种新型装甲RNA 表达载体,将猪瘟检测靶基因构入其载体,制备的装甲RNA 颗粒能够代替真病毒或质粒等物质,用于该病核酸检测的质控,为猪瘟疫病监测提供技术支持。
1 材料与方法
1.1 菌株、质粒及试剂
猪瘟活疫苗(兔源)国家参考品,源自法国Thiverval 株(S0521207),购自中国兽医药品监察所;载体质粒pTMACC,由中国检科院实验室构建保存;In-HD Cloning Kit (Clontech)及DNA 连接试剂盒(Takara)购自宝日医生物技术(北京)有限公司;异丙基硫代-β-D-半乳糖苷(IPTG),RNeasy MiNi Kit(Qiagen)购自北京宏捷科技有限公司;MagneHisTMprotein purification system(USA)购自promega 公司。
1.2 pTMACC-CSFV 装甲RNA 制备
猪瘟活疫苗提取RNA 核酸后,采用下列引物进行RT-PCR 扩增。引物序列为:CSFV-F:5’-CG GGGTACCTACGAGGTTAGTTCATTCTC-3’,CSFVR:5’CCCAAGCTTGTAGGTTCTTCAGTGTTG-3’。纯化的PCR 产物与pTMACC 质粒经KpnI 和HindIII双酶切、连接、转化,制备重组菌pTMACC-CSFV。该重组菌加入终浓度为0.5 mmol/L IPTG,28 ℃诱导表达。表达产物加入终质量浓度1.25 mg/L 溶菌酶37 ℃温和裂解,上清采用噬菌体纯化方式制备粗纯的CSFV 装甲RNA 颗粒。粗纯产物采用Magne-HisTM protein purification system 系统纯化后即为pTMACC-CSFV 装甲RNA 物质。
1.3 pTMACC-CSFV 装甲RNA 结构分析
采用SWISS-model 软件对该颗粒外壳蛋白结构进行预测分析,结合SDS-PAGE 电泳分析,以验证该颗粒为MS2 噬菌体-double CP 结构;同时,该物质经80 ℃加热5 min,观察溶液变化,并采用琼脂糖电泳分析,以验证该物质内含核酸类型为RNA。
1.4 pTMACC-CSFV 装甲RNA 形态学鉴定
CSFV 装甲RNA 物质经1%醋酸双氧铀染色,利用透射电镜(JEM1400)进行形态观察;同时,该物质颗粒溶液借助动态光散射仪,测定其粒子径的大小以及溶液的均匀状态。
1.5 pTMACC-CSFV 装甲RNA 颗粒序列溯源性分析
CSFV 装甲RNA 物质送擎科生物测序公司进行靶基因序列测定,并进行序列溯源性分析。
1.6 pTMACC-CSFV 装甲RNA质控品均匀性分析
pTMACC-CSFV 装甲RNA 质控品参考国家标准GB/T 15000-3《样品工作导则》分装,依据标准GB/T 27540—2011《荧光RT-PCR 方法》进行均匀性评价。随机抽测10 份,每份重复检测3 次,检测数据采用方差统计分析,以评估该质控品的均匀性。
1.7 pTMACC-CSFV 稳定性分析
pTMACC-CSFV 装甲RNA 质控品在4、-20 ℃分别保存14 d、1 个月、2 个月、3 个月、6 个月、12个月、24 个月、36 个月。每种条件2 份,每份重复检测3 次。检测数据采用t 检验统计,结合趋势分析,评估该质控品的稳定性。
1.8 实用性能检测
pTMACC-CSF 装甲RNA 质控品送猪瘟病毒WAOH 参考实验室中国兽医药品监察所等8 家权威检测机构进行性能评价。
2 结果与分析
2.1 CSFV 靶基因PCR 扩增
以猪瘟活疫苗为模板提取RNA,并采用靶基因两端特异性引物进行RT-PCR 扩增。琼脂糖电泳显示靶基因条带为500~750 bp,与预期大小(568 bp)相符(图1)。
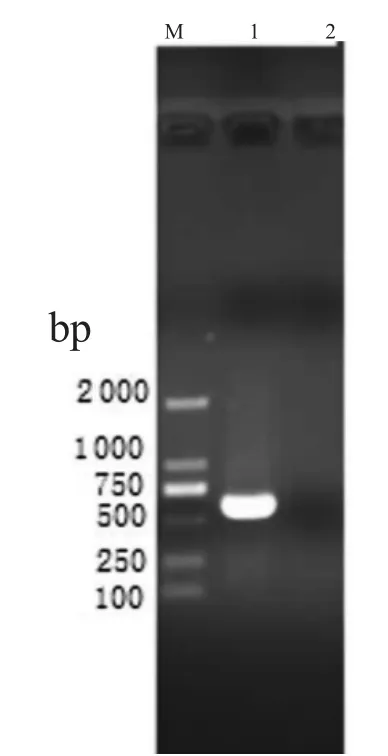
图1 靶基因PCR 产物电泳图
2.2 pTMACC-CSFV 装甲RNA 结构分析
借助蛋白三维模拟器(SWISS-model)对pTMACC-CSFV 装甲RNA 外壳蛋白(double-CP)结构与野生型MS2 噬菌体中single-CP 结构分别建模(图2)。纯化的装甲RNA 颗粒进行SDS-PAGE 电泳分析(图3、图4),显示目的蛋白位于26~42 kμ,约是野生型MS2 噬菌体外壳蛋白分子质量(13.7 kμ)的2 倍,与建模预测分析一致。该物质溶液经过80 ℃热处理后,肉眼可见溶液由透明状变乳白色,琼脂糖电泳显示:加热后该物质特征性条带呈弥散性直至消失,源自该装甲RNA 颗粒为RNA-蛋白复合物,热处理后蛋白外壳变性,包裹RNA 核酸被释放。
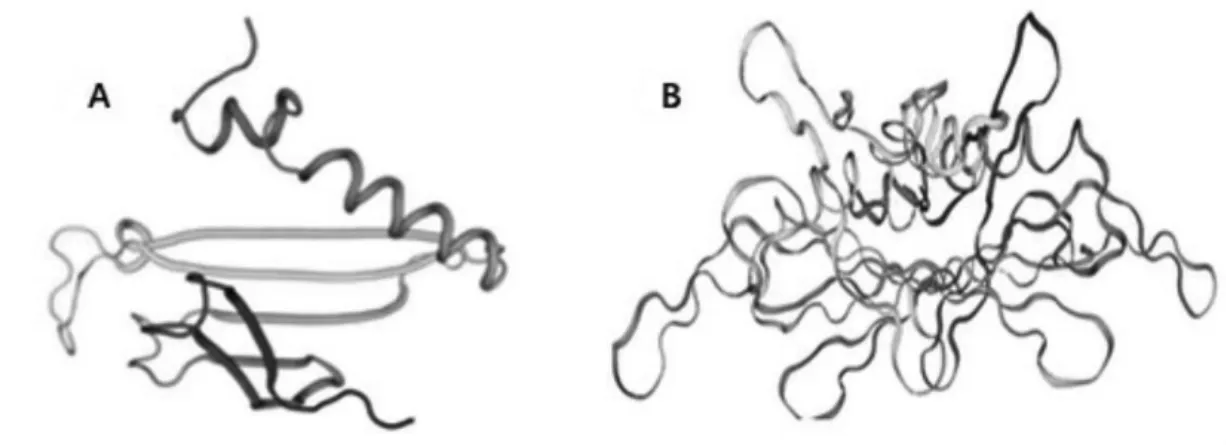
图2 噬菌体MS2 中外壳蛋白改造的蛋白三维构象模型对比分析
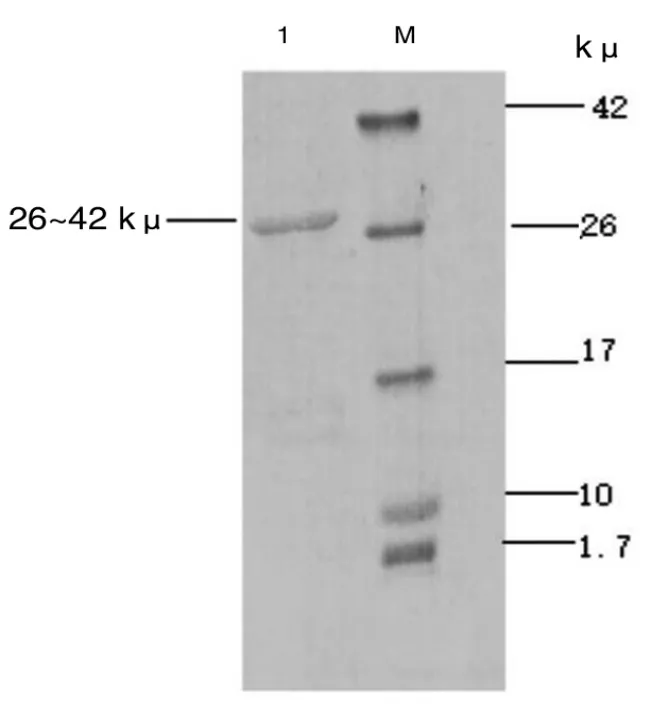
图3 pTMACC-CSFV装甲RNA颗粒SDS-PAGE 电泳分析
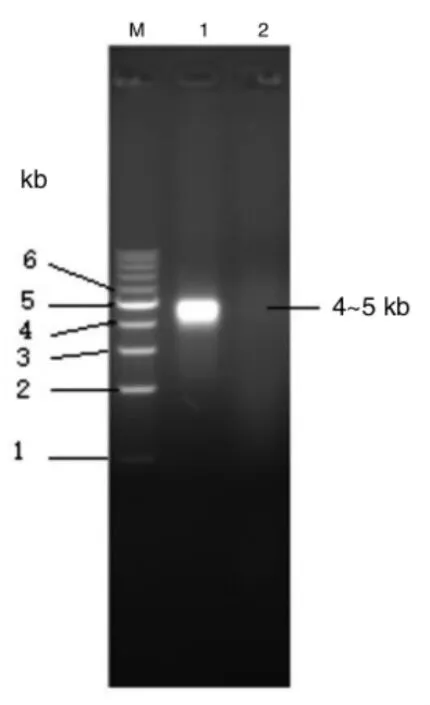
图4 pTMACC-CSFV 装甲RNA 颗粒核酸电泳分析
2.3 pTMACC-CSFV 装甲RNA 形态学鉴定
纯化的装甲RNA 颗粒,经1%醋酸双氧铀染色后,透射电镜观察(图5):颗粒为“外亮内暗”规则的多边形物质,直径约26 nm。该物质经动态光散射图谱分析(图6):光谱单一,且颗粒粒径主要分布于20~50 nm,且均值在26 nm 左右,表明溶液均匀分布,没有颗粒聚集现象,且粒径大小与透射电镜数据吻合。
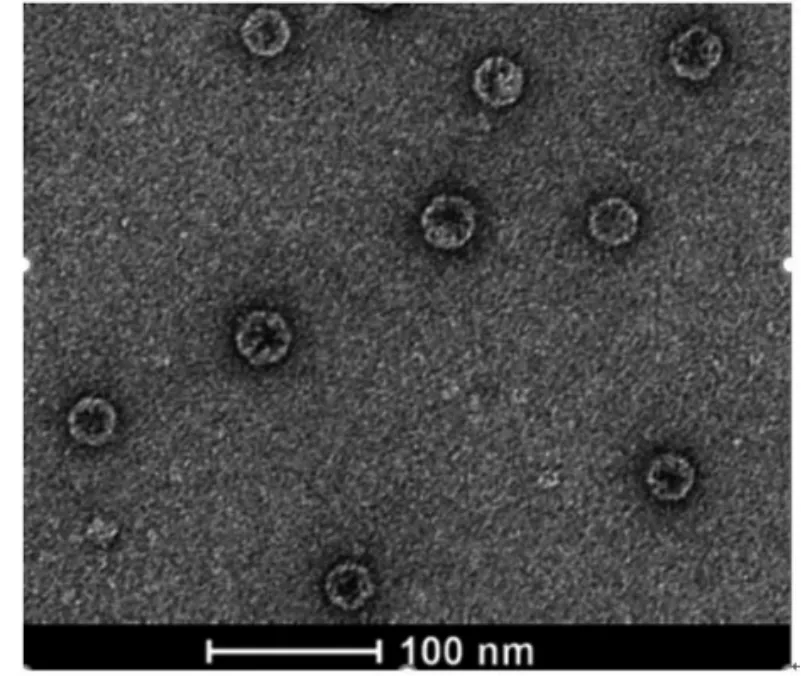
图5 pTMACC-CSFV 装甲RNA 颗粒透射电镜图
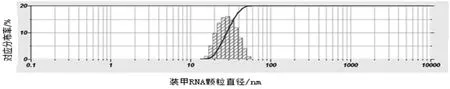
图6 pTMACC-CSFV 装甲RNA 颗粒动态光散射图谱
2.4 装甲RNA 颗粒序列溯源性分析
该物质测序后核酸序列图谱分析表明,插入靶标序列为猪瘟病毒5’UTR 特定序列,溯源至WAOH 猪瘟参考实验室法国Thiverval 株(位点1~550 bp),二者同源性达99%。
2.5 pTMACC-CSFV 装甲RNA 质控品均匀性分析
pTMACC-CSFV 装甲RNA 均匀性检测数据分布如图7。采用F 检验统计分析,F=0.513<2.94,且P=0.848,表明该质控品批内精密度和总精密度差异均无统计学意义,呈均匀分布。
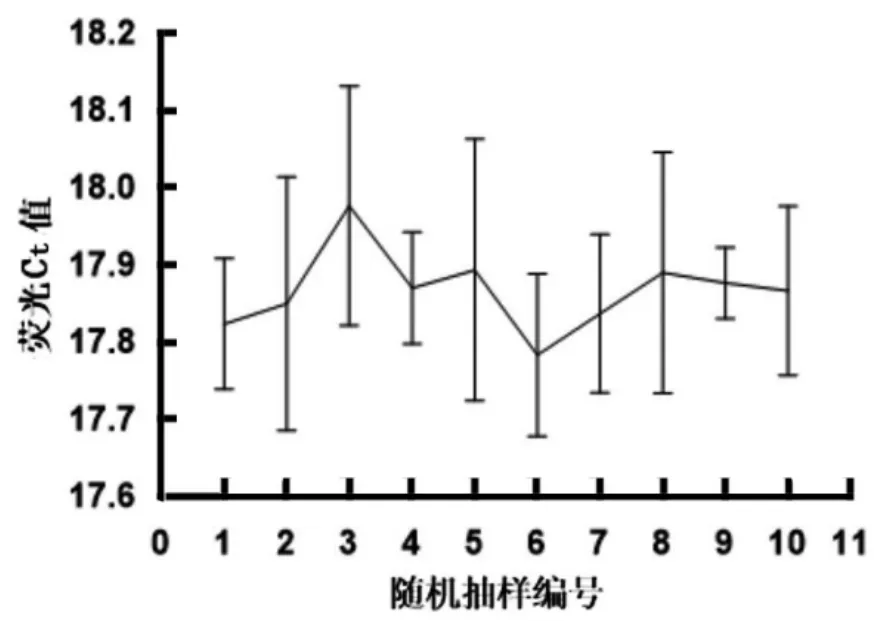
图7 pTMACC-CSFV 装甲RNA 质控品均匀性分析图
2.6 pTMACC-CSFV 装甲RNA 质控品保存稳定性分析
pTMACC-CSFV 装甲RNA 质控品在不同的保存条件下,检测数据统计分布如图8,检测Ct 值采用t 检验统计分析。结果显示,冷藏条件下,该质控品稳定保存6 个月,-20 ℃保存条件下该质控品能够稳定保存36 个月。
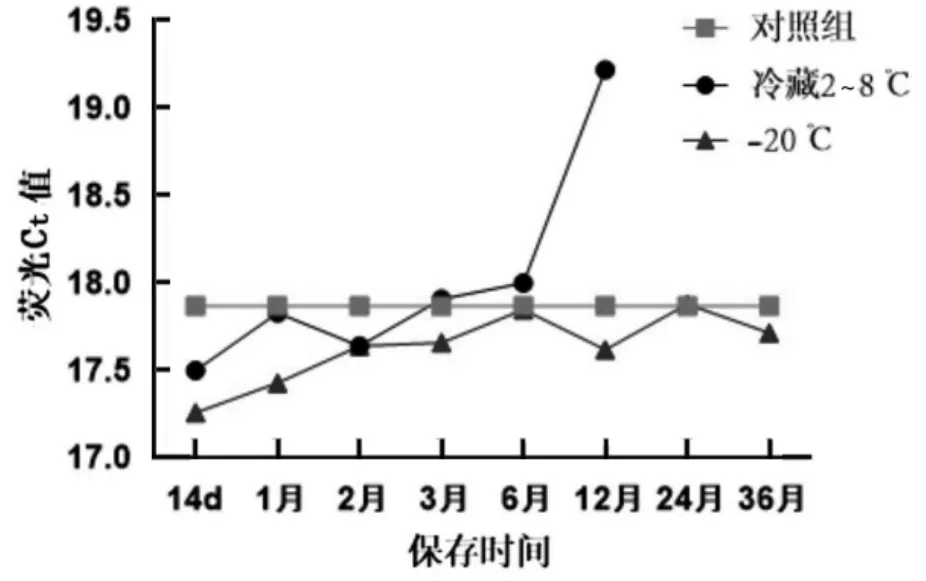
图8 pTMACC-CSFV 装甲RNA 质控品保存稳定性及趋势分析图
2.7 实用性能检测
pTMACC-CSFV 装甲RNA 质控品经8 家权威实验室进行性能评估。检测Ct 值在20.12~22.07,符合猪瘟方法核酸阳性质控品的要求,能够应用于猪瘟临床检测。
3 讨论
猪瘟和非洲猪瘟均是危害世界养猪业的严重传染病,在临床和病理方面难以区分[20]。面临非洲猪瘟疫情防控的严峻形势,猪瘟疫病的监测也刻不容缓。随着猪瘟核酸检测技术的普及,一种安全、稳定、高效的阳性质控物质迫切急需。
本研究依托改造后的Armored RNA 技术,采用了一种新型高效的装甲RNA 表达载体。此载体不仅能表达高达2 000 bp 的外源RNA 片段,而且优化了纯化工艺,在保证简化工艺的同时提高了装甲RNA 颗粒的产量。特定CSFV 靶基因插入该表达载体,制备了猪瘟装甲RNA 物质。该物质为RNA-蛋白复合物,即猪瘟靶基因对应的RNA 核酸被噬菌体外壳包裹,形成类似天然病毒的结构,即核酸不易降解、又无生物安全风险,是良好的核酸检测质控品,能够监测猪瘟病毒相关核酸检测方法中核酸抽提、反转录、扩增全流程,同时避免了质粒作为质控品易污染环境、干扰检测结果等弊端。猪瘟病毒装甲RNA 质控品均匀性良好,且稳定性强。在本研究中,-20 ℃保存环境下检测数据经t 检验,t<0.05(df-1),且0.01<P<0.05,有差异,源于36 个月检测值与对照均值差异,但该差异程度在可接受范围内。因此,-20 ℃分装保存至少可稳定36 个月。该质控品无生物传染性,核酸RNA 不易降解,稳定保存,且特殊结构能够对RNA 病原核酸检测三步流程的全程质控,更进一步保障猪瘟疫病的临床检测的准确性。
