双重数字PCR法评价Luc2P系列报告基因细胞系的稳定性
2023-07-30于雷王光裕裴德宁安怡方史新昌周勇
于雷,王光裕,裴德宁,安怡方,史新昌,周勇
中国食品药品检定研究院卫生部生物技术产品检定方法及其标准化重点实验室,北京100050
近年来,随着细胞和分子生物学技术的快速发展,基于报告基因的生物活性分析方法越来越广泛地应用于重组蛋白类药物的质量控制[1-5]。《中国药典》三部(2020版)已收录了2个品种的报告基因测活方法:Ⅰ型干扰素和康柏西普[6]。药物反应性的报告基因细胞系是此类方法的基础,细胞系的稳定性是方法稳定性的前提。因此,对于报告基因测活方法,报告基因细胞系的稳定性至关重要。可通过监测细胞传代过程中报告基因拷贝数变化来考察细胞的稳定性。目前检测基因拷贝数的常用方法是qPCR,但该法为相对定量,需要标准物质[7-10]。而对于常用的报告基因,目前尚无拷贝数测定使用的标准物质。
数字PCR(digital PCR,dPCR)是一种对目标核酸分子进行直接计数、绝对定量的新兴技术,与传统方法相比,具有无需标准品、绝对定量、高灵敏度、准确度和耐受性等优势[11-16]。dPCR 检测结果通常表示为每拷贝基因组所含目的基因的拷贝数,其准确性受限于基因组DNA 定量的准确性[17-18]。在样本制备过程中,首先需提取基因组DNA,再对其进行定量,可能会受基因组DNA 提取效率和定量准确度的影响,造成实验间误差较大。为了解决该问题,本研究利用相对拷贝数进行基因稳定性评价,选取高度保守的管家基因RPP30作为内参基因[19-20],以目的基因对内参基因的相对拷贝数变化来评价其稳定性,相对拷贝数的结果不受基因组DNA 提取效率和定量准确度的影响,检测结果更加稳定。本研究针对目前广泛应用的Luc2P系列报告基因细胞系,以RPP30为内参基因,萤光素酶(luciferase,Luc)为目的基因,建立双重dPCR 方法同时检测2 种基因的拷贝数,再利用Luc的相对拷贝数(copiesLuc/copyRPP30)评价报告基因细胞系的稳定性。
1 材料与方法
1.1细胞及质粒 4 种原始细胞(CHO-K1、Hacat、HEK293 和UT7)购自ATCC;Luc2P报告基因质粒及4种Luc2P报告基因细胞系(CHO-K1、Hacat、HEK293和UT7)均由中国食品药品检定研究院重组药物室构建并保存。
1.2主要试剂及仪器 Taqman universal Master MixⅡ、Applied Biosystems™QuantStudio™3D数字PCR20K芯片试剂盒v2、QuantStudio™3D 数字PCR Mix、荧光定量PCR 仪(7500Fast)、芯片式数字PCR 仪(QuantStudio™3D Digital PCR System)购自美国ABI公司;ddPCRSupermixforProbes、DropletGenerationOilforProbes、DG8 Cartridges and Gaskets、基因扩增仪(C1000 Touch)、液滴式数字PCR 仪(QX200 ddPCR System)购自美国Bio-Rad公司;基因组DNA提取试剂盒购自德国QIAGEN公司;Hind Ⅲ和EcoRⅠ内切酶购自日本TaKaRa公司。本研究除适用性研究外,其他试验均采用芯片式数字PCR仪。
1.3引物和探针的设计及合成 采用Primer-BLAST在线软件设计引物和探针,由生工生物工程(上海)股份有限公司合成。Luc基因全长1 776 bp,针对212 ~331 bp 区域设计引物和探针,上游引物序列为:5'-GGCTGAATACAAACCATC-3',下游引物序列为:5'-CGTTGTAGATGTCGTTAG-3',探针序列为:5'-(FAM)CACAGCCACACCGATGAACAG(MGB)-3',扩增片段长度为120 bp。RPP30内参基因(GRCh38.p13 Primary Assembly)上游引物序列为:5'-AGATTTGGACCTGCGAGCG-3',下游引物序列为:5'-GAGCGGCTGTCTCCACAAGT-3',探针序列为:5'-(VIC)TTCTGACCTGAAGGCTCTGCGCG(MGB)-3',扩增片段长度为65 bp。
1.4模板制备 收集Luc2P系列报告基因细胞CHO-K1、Hacat、HEK293 和UT7,按照试剂盒说明书提取基因组DNA,并采用紫外法定量。用Hind Ⅲ和EcoRⅠ分别进行单酶切和双酶切,酶切产物作为PCR模板。
1.5双重dPCR 反应体系共20µL,含2×dPCR Mix 10µL,10µmol/LLuc和RPP30上下游引物各1.8µL、探针各0.5µL,基因组DNA(100µg/mL)模板1.8µL。混匀后取14.5µL 进行芯片dPCR 检测。反应程序:96 ℃10 min;60 ℃1 min,98 ℃30 s,共39 个循环;60 ℃2 min。
1.6方法的验证
参考《中国药典》三部(2020 版)相关要求,对方法进行验证。
1.6.1专属性 PCR的专属性主要是考查引物探针的特异性,使用Luc引物探针,分别采用qPCR 和dPCR法检测4 种Luc2P报告基因细胞系及其原始细胞(CHO-K1、Hacat、HEK293和UT7)基因组DNA,将qPCR产物送生工生物工程(上海)股份有限公司测序。
1.6.2精密性 对同一基因组DNA 样品(HEK293_1B1),采用芯片式dPCR 法重复检测8 次,计算相对标准偏差(RSD),验证该方法的试验内精密性;对同一细胞(HEK293_1B1),采用芯片式dPCR 法检测6次独立提取的基因组DNA 样品,计算相对标准偏差(RSD),验证该方法的试验间精密性。
1.6.3线性 取基因组DNA酶切产物(HEK293-1B1),用Q水稀释至100、80、60、40、20、10µg/mL,采用dPCR法检测Luc和RPP30拷贝数,评价实测拷贝数与模板浓度间的线性关系。
1.6.4准确性 将Luc2P报告基因质粒经Hind Ⅲ酶切后(5µg/mL),稀释至0.000 1µg/mL,再与Q水等比混合,采用dPCR定量其Luc拷贝数为792 copies/µL。将此质粒溶液分别稀释至0.000 15(150%)、0.000 125(125%)、0.0001(100%)、0.00075(75%)、0.000050µg/mL(50%),分别与野生型UT7细胞基因组DNA(50µg/mL)等比混合后进行检测,计算Luc拷贝数的回收率,验证该方法的准确性。
1.6.5耐用性 分别采用芯片式和液滴式两种dPCR体系(两种体系的原理、设备、耗材和试剂均不相同)对同一HEK293-Luc细胞基因组样品检测6 ~8次,比较检测结果之间的一致性。
1.7方法的适用性分析
1.7.1不同细胞克隆的Luc拷贝数检测 利用建立的双重dPCR 法,检测同一报告基因细胞的不同细胞克隆,即在多克隆稳转细胞克隆化分离中获得的不同克隆,理论上这些细胞克隆中的外源基因拷贝数不同。
1.7.2不同细胞代次的Luc拷贝数检测 利用建立的双重dPCR 法,检测同一报告基因细胞的不同代次(P8、P12、P31),评价报告基因细胞系的稳定性。
1.8数据采集及分析 采用QuantStudio 3D AnalysisSuiteTM云软件(version 3.1.6-PRC-build2)分析芯片式dPCR结果,QuantaSoftTM软件(v1.2)分析液滴式dPCR结果。
2 结果
2.1dPCR方法的建立
2.1.1dPCR分别检测Luc和RPP30HEK293-Luc基因组DNA 分别用Hind Ⅲ和EcoRⅠ酶切,采用芯片式dPCR 分别检测Luc和RPP30,酶切后的样品检测结果阴性和阳性分离效果更好,见图1。
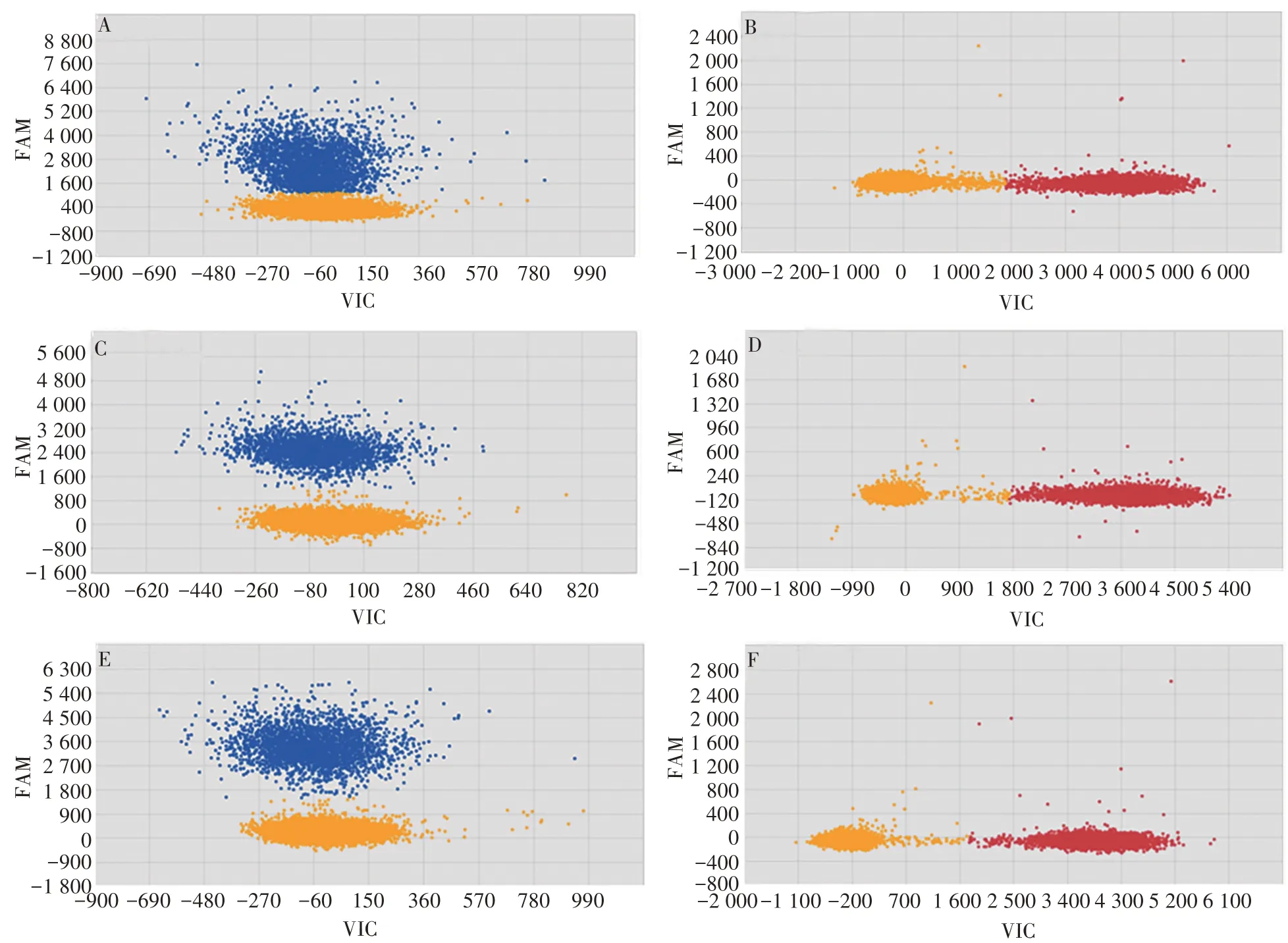
图1 基因组DNA酶切前后的dPCR检测结果Fig.1 dPCR results for genomic DNA with or without digestion
2.1.2双重dPCR同时检测Luc和RPP30经双重芯片式dPCR同时检测Luc和RPP30,HindⅢ单酶切效果最佳,见图2。确定基因组DNA模板制备条件为:HindⅢ酶切1h。
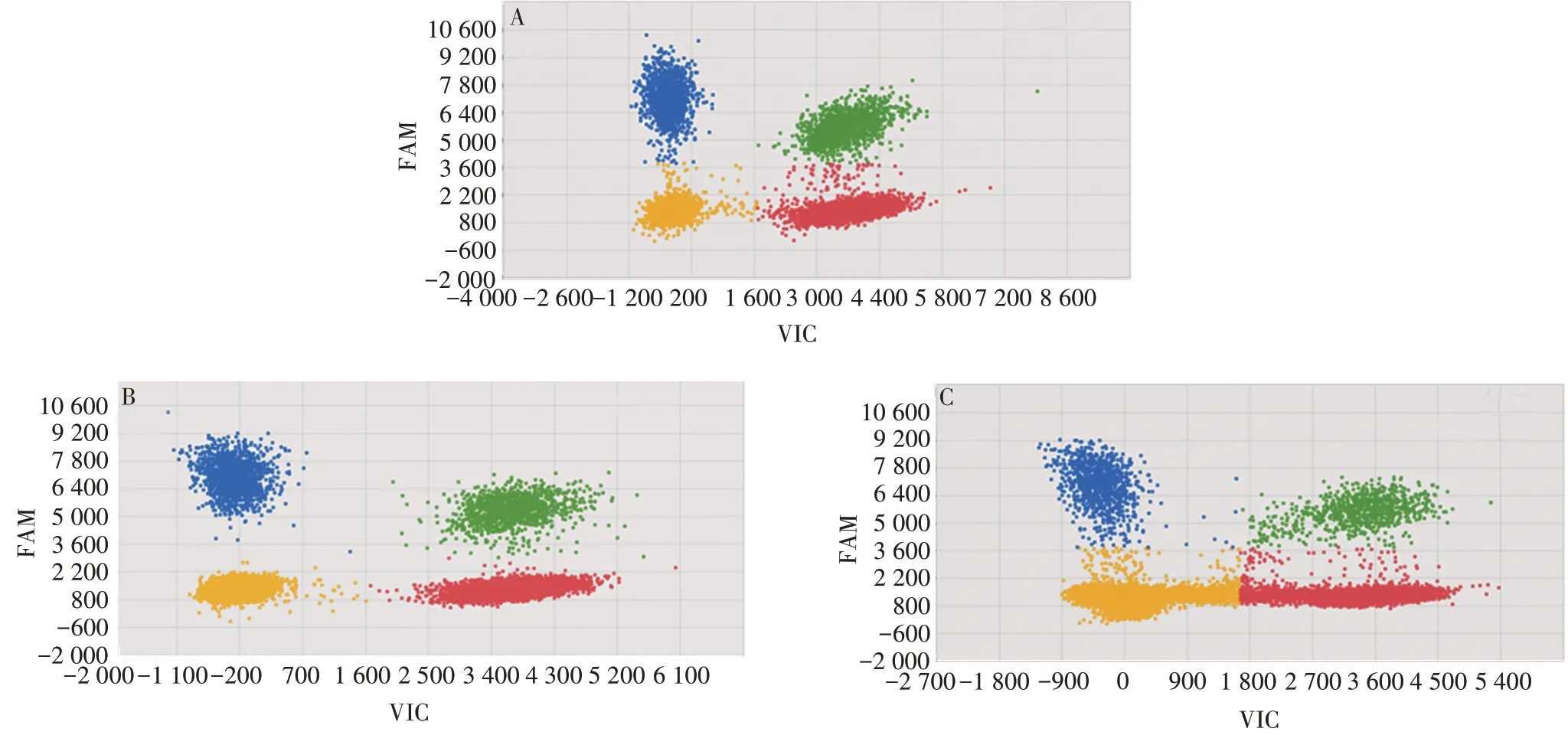
图2 基因组DNA酶切前后的双重dPCR检测结果Fig.2 Duplex dPCR results for genomic DNA with or without digestion
2.2方法的验证
2.2.1专属性 qPCR 和dPCR 检测结果见图3 和图4。未转染报告基因的原始细胞检测结果均为阴性,而4 种报告基因细胞系中均可检测到阳性结果,且dPCR 结果中阴性和阳性区可明显区分,表明所设计的引物探针特异性好。qPCR 产物测序结果与理论序列一致。
图3 qPCR检测4种不同报告基因细胞系的Luc基因Fig.3 Analysis of Luc gene in 4 different reporter cell lines by qPCR
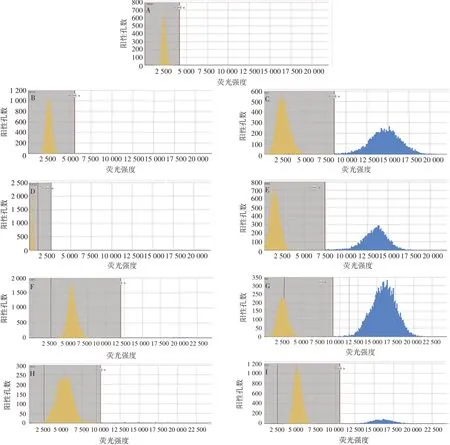
图4 芯片式dPCR检测4种不同报告基因细胞系的Luc基因Fig.4 Analysis of Luc gene in 4 different reporter cell lines by chip-type dPCR
2.2.2精密性 采用芯片式dPCR 法重复检测8次同一基因组DNA 样品Luc、RPP30拷贝数及Luc相对拷贝数(copiesLuc/copyRPP30)的RSD分别为6.09%、6.90%和3.25%,见表1。采用芯片式dPCR法检测同一细胞6 次独立提取的基因组DNA 样品Luc、RPP30拷贝数及Luc相对拷贝数(copiesLuc/copyRPP30)的RSD分别为24.53%、16.38%和8.62%,见表2。表明采用相对拷贝数(copiesLuc/copyRPP30)进行定量,结果更稳定。
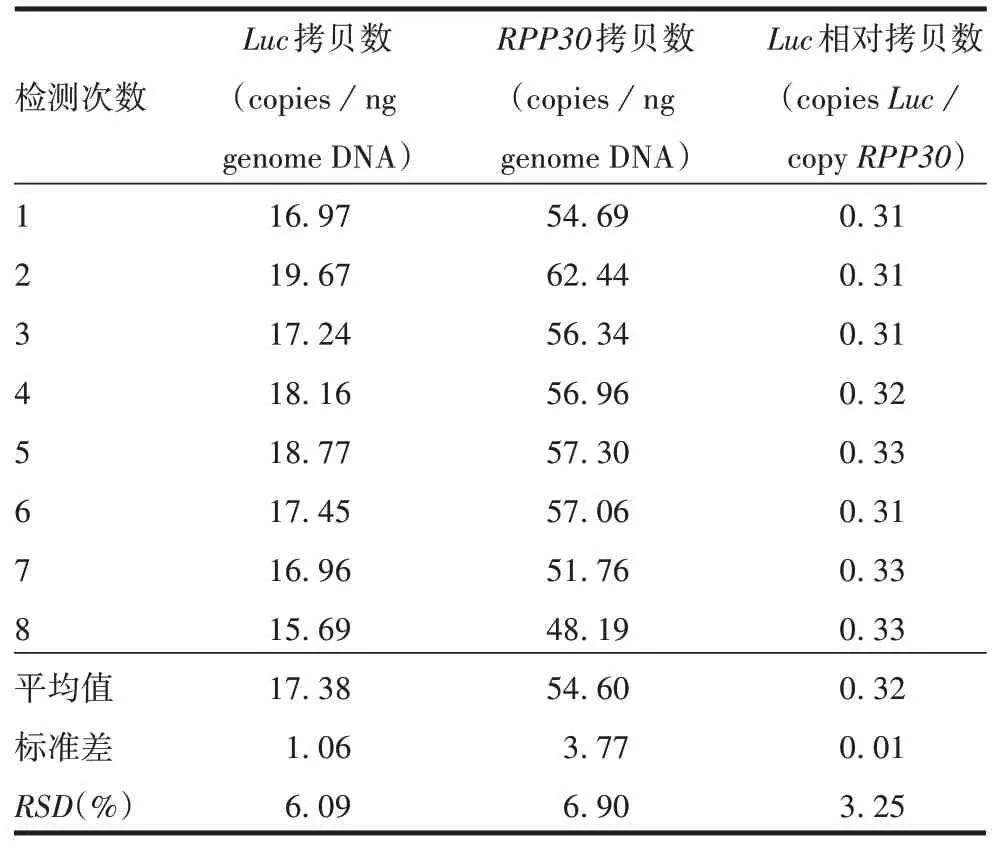
表1 双重dPCR法的试验内精密性检测结果Tab.1 Intra-assay precision of duplex dPCR
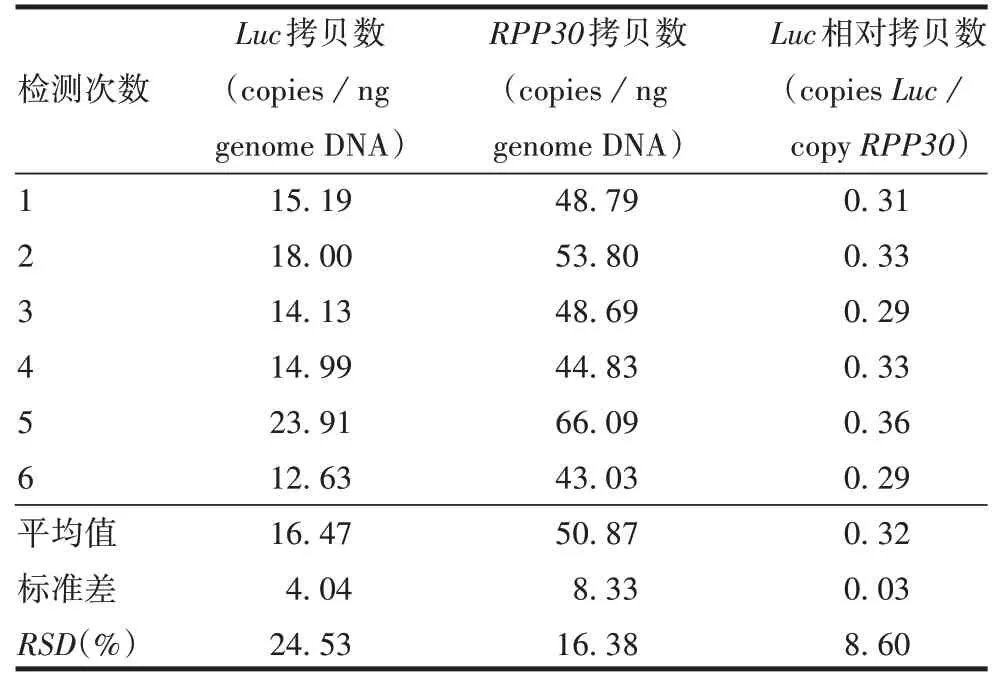
表2 双重dPCR法的试验间精密性检测结果Tab.2 Inter-assay precision of duplex dPCR
2.2.3线性 两个基因检测结果的线性均较好,线性拟合R2均大于0.99,见图5。以相对拷贝数(copiesLuc/copyRPP30)表示,6个样品的结果分别为35.0、32.1、30.0、32.3、30.9和32.2,均值为32.1,RSD为5.3%。

图5 Luc和RPP30基因拷贝数检测结果与模板浓度的线性拟合Fig.5 Linear fitting of Luc and RPP30 gene copy to template concentration
2.2.4准确性 5组加标回收样本的Luc拷贝数分别为1 053.7、942.46、613.67、476.27和220.1 copies/µL,回收率分别为88.7%、95.2%、77.5%、80.2%和55.6%。一般qPCR 定量的回收率要求为50% ~150%,本方法的回收率在可接受范围内。基因的引入,可以校正基因组DNA 提取和定量带来的误差,使检测结果更加可靠。
2.2.5耐用性 芯片式和液滴式两种体系测得的Luc和RPP30拷贝数有差异,但Luc相对拷贝数(copiesLuc/copyRPP30)的结果一致,均为0.32,见表3。体现了采用相对拷贝数作为检测指标的优势。
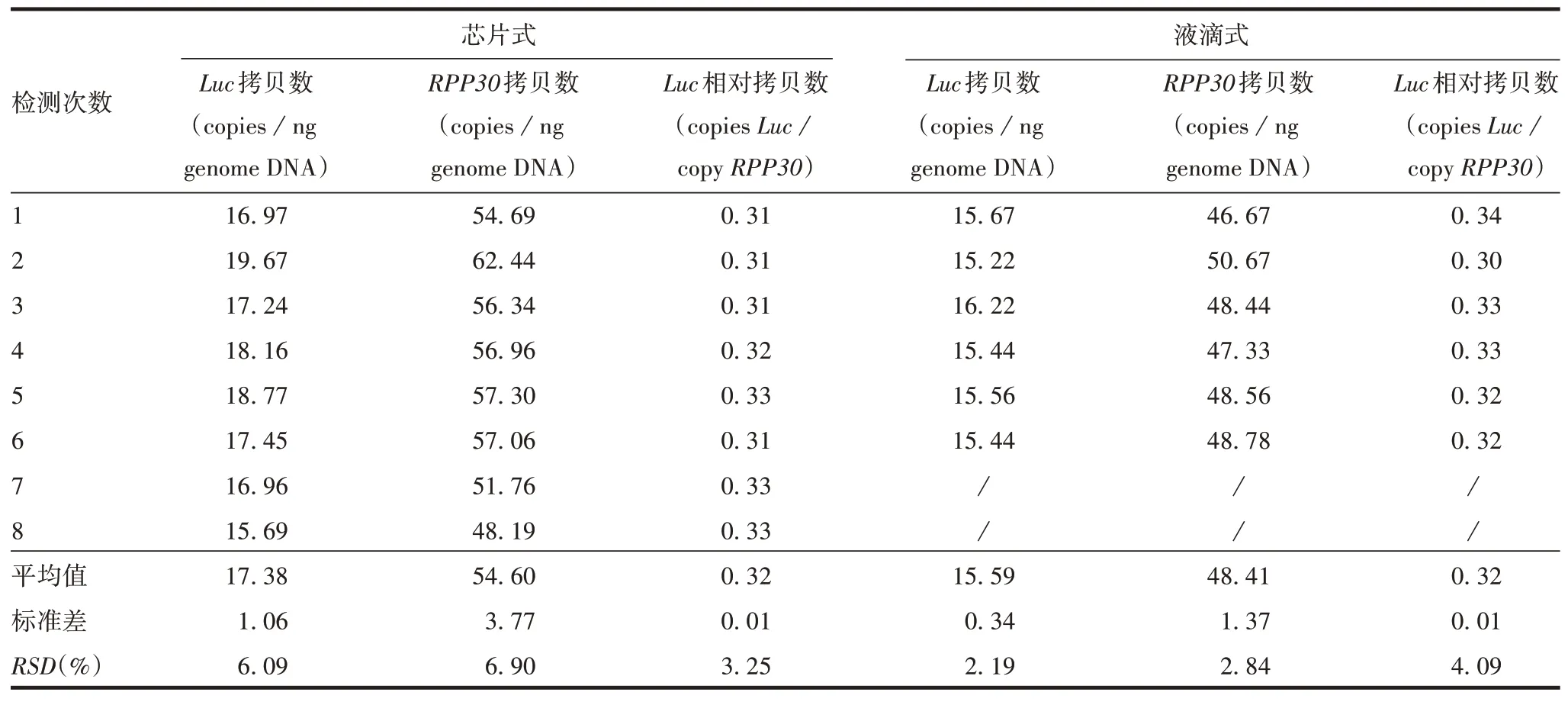
表3 两种不同体系dPCR检测结果比较Tab.3 Comparison between results of two different dPCR systems
2.3方法的适用性
2.3.1不同细胞克隆的Luc拷贝数 UT7-Luc细胞C1克隆的Luc相对拷贝数最高,C2克隆的Luc相对拷贝数最低;HEK293-Luc细胞2 个不同克隆的Luc相对拷贝数也不一致。见表4。表明该方法可区分不同细胞克隆的Luc相对拷贝数。
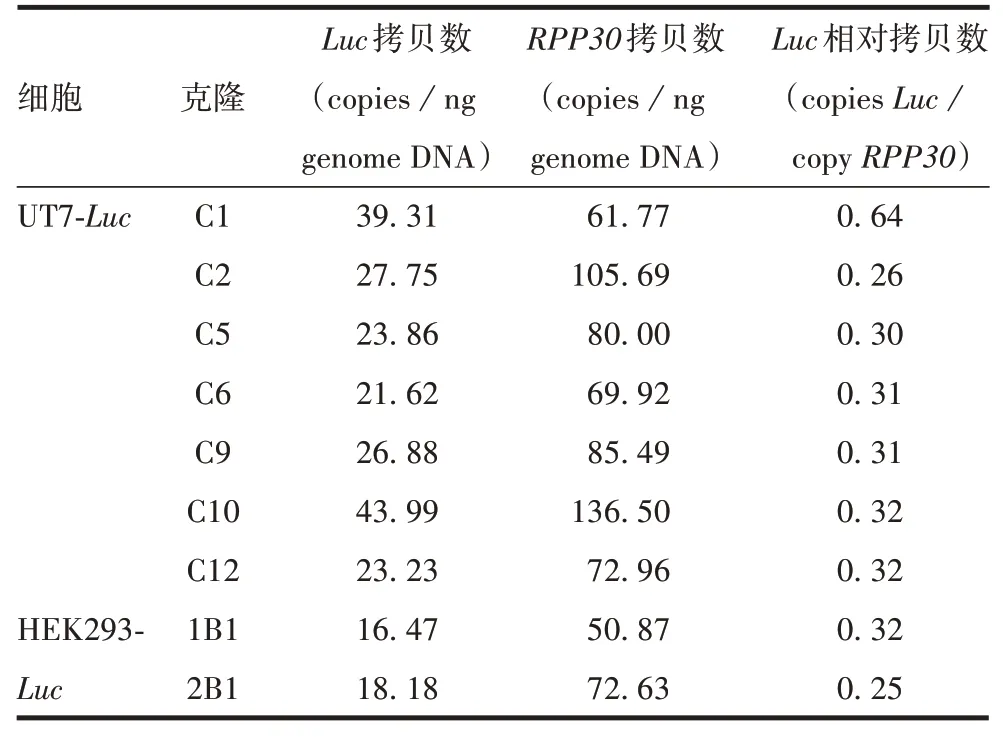
表4 不同细胞克隆的Luc拷贝数检测结果Tab.4 Luc gene copies in different cell clones
2.3.2不同细胞代次的Luc拷贝数 3 个代次细胞Luc和RPP30拷贝数检测结果间差异较大,但Luc相对拷贝数的结果高度一致,见表5。进一步表明内参
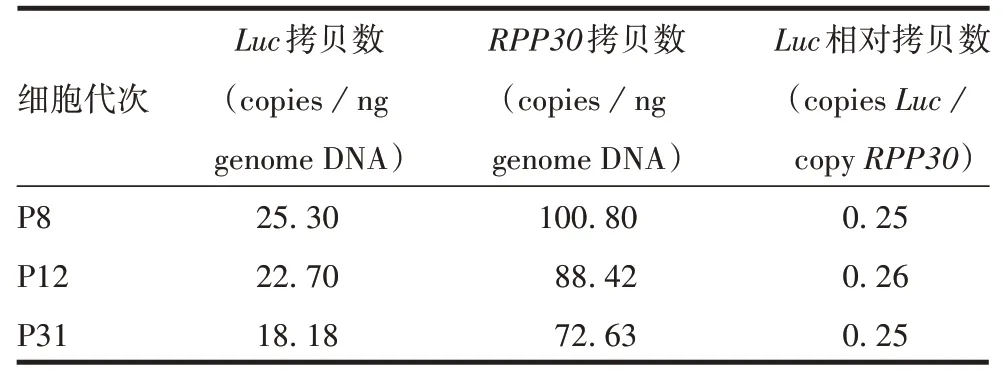
表5 不同细胞代次的Luc拷贝数检测结果Tab.5 Luc gene copies in cells of different passages
3 讨论
对于细胞基因组中特定基因(包括内源和外源基因)的拷贝数测定是个困扰多年的难题[8]。qPCR作为一种相对定量方法,需要花费大量精力制备标准品,而且非同质的标准品如质粒等,还存在扩增效率不一致等问题[8,21]。dPCR 的出现解决了核酸绝对定量的难题[11],但DNA 提取、定量,以及试验过程中带来的误差仍使检测结果不稳定、变异度大,无法检测出拷贝数的细微差异。而且,不同dPCR 体系之间也会存在差异[22]。本研究通过引入相对拷贝数的概念,校正了样本制备及试验过程中带来的误差,可以更加真实地反映报告基因细胞系中目的基因拷贝数的变化,适用于评价基因修饰细胞系的稳定性。一般PCR 体系的模板量仅有数微升,加样的细微差异引起的模板量不同也会使结果发生较大变异,而内参基因的引入具有校准模板量的作用,采用双重dPCR 在同一体系中同时检测目的基因和内参基因,可避免不同PCR 体系加入模板量的不同造成的试验偏差[17]。本研究结果证明,同一组样本的相对拷贝数检测结果比绝对拷贝数更加稳定,相对拷贝数的指标更能准确反映目的基因在细胞基因组中的拷贝数变化情况,甚至在不同dPCR 体系也表现出较好的一致性。此外,该方法可有效检测不同细胞克隆的外源基因相对拷贝数差异。
本研究不仅为Luc2P系列报告基因细胞系建立了稳定性评价方法,也提供了一种目的基因拷贝数检测的策略,如目前CAR基因拷贝数是CAR-T 细胞产品的关键检测项目[23-25],采用本研究提供的思路可更加准确地反映目标基因修饰率。
