6种转录本人早幼粒细胞性白血病基因真核表达质粒的构建及其重组蛋白的亚细胞定位分析
2023-07-30蔺玉刚马春玲杨雪龚真莉岳亚辉王芳萍郜晓虹任善会孙跃峰陈豪泰焦海宏
蔺玉刚,马春玲,杨雪,龚真莉,岳亚辉,王芳萍,郜晓虹,任善会,孙跃峰,陈豪泰,焦海宏
1.塔里木大学动物科学与技术学院,新疆阿拉尔 843300;2.中国农业科学院兰州兽医研究所,甘肃兰州730046
人早幼粒细胞性白血病(human promyelocytic leukaemia,hPML)蛋白是一种重要的抑癌及抗病毒蛋白,最早发现于急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者[1]。hPML 蛋白存在于大多数哺乳动物细胞核中[2],与DNA损伤反应、DNA修复、端粒稳态等多种细胞生理病理过程密切相关[3-6]。
hPML 蛋白也称为三方基序结构域19(tripartite motif 19,TRIM19)蛋白,属于RBBC(RING finger,2 Bbox,coiled-coil)或TRIM家族蛋白质,包括1个环指、2个B-boxes 和1 个α 螺旋卷曲结构域[6]。hPML基因由9个主要外显子与7个选择性剪接的hPML转录本组成,形成7种hPML基因亚型Ⅰ~Ⅶ(简称hPMLⅠ~Ⅶ),均含有1个相同的N-末端区域(如修剪基序)和不同的C-末端区域[5]。研究表明,不同hPML基因亚型的生物学功能可能与其亚细胞定位有关[7],7 种hPML基因亚型均包含关键的RBBC 结构域;除hPMLⅦ外,其他亚型在外显子6 中均含有核定位信号(nuclear localization signal,NLS)基因,并定位于细胞核中[7]。hPMLⅠ是7种转录本中最长、最完整,也是唯一既含有核输出信号(nuclear export sequence,NES)又含有NLS序列的转录本[8];hPMLⅣ是研究中常用的基因亚型,包含除NES外所有的关键结构,如RBBC、SIM、NLS和3个关键性的小泛素相关修饰(small ubiquitin-related modifier,SUMO)化位点(K65、K160 和K490),与hPMLⅠ的功能相似[9-10];hPMLⅦ缺乏NLS,大部分定位于细胞质中[11],hPMLⅠ~Ⅵ均定位于细胞核与细胞质中[12];大多数hPML异构体的C-末端区域驱动可与许多蛋白和病毒相互作用,并显示出独特的自组装特性[10,13]。本研究采用RT-PCR 法扩增hPMLⅠ、Ⅱ、Ⅳ、Ⅴ、Ⅵ、Ⅶ(未找到hPMLⅢ基因亚型序列,仅以6 种转录本为研究对象),构建真核表达质粒,采用Western blot法检测其在真核细胞中的表达情况,间接免疫荧光(indirect immunofluorescence assay,IFA)法检测重组蛋白的亚细胞定位情况,以期为hPML蛋白生物学功能的深入研究奠定基础。
1 材料与方法
1.1菌株、载体、基因及细胞 感受态E.coliDH5α 购自深圳康体生命科技有限公司;载体pCAGGS、hPMLcDNA、293T 细胞和Vero 细胞均由中国农业科学院兰州兽医研究所提供。
1.2主要试剂及仪器 SDS、甘油、2-巯基乙醇、溴酚蓝及2YT 固体培养基均由中国农业科学院兰州兽医研究所提供;胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;DMEM 培养基购自甘肃健顺生物科技有限公司;青霉素、链霉素和庆大霉素(100×)均购自北京索莱宝科技有限公司;Mut Express MultiS Fast Mutagenesis Kit V2 试剂盒购自南京诺唯赞生物科技股份有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;细胞转染试剂jetPRIME购自法国Poly plus公司;Alexa Fluor 488 标记的山羊抗兔IgG 购自美国Invitrogen 公司;兔抗Myc 单克隆抗体购自美国Cell Signaling 公司;小鼠抗β-actin 单克隆抗体购自上海诺莱生物科技有限公司;HRP标记的山羊抗兔和山羊抗小鼠IgG 均购自康为世纪生物科技股份有限公司;EcoRⅠ和KpnⅠ均购自宝日医生物技术(北京)有限公司;激光共聚焦显微镜(TCS SP8)购自德国徕卡公司。
1.3细胞培养 采用DMEM培养基,于37 ℃培养293T和Vero细胞,取对数生长期细胞用于后续试验。
1.4引物设计及合成 根据GenBank中登录的hPML基因序列(NM_033238),应用SnapGene 6.0.2 软件设计特异性引物,所有扩增引物上游序列均相同,为5'-CATCATTTTGGCAAAGAATTCGCCACCATGGAGCCTGCACCCGCCCGATCTCCGAGGCCCCAG-3'(下划线部分为EcoRⅠ酶切位点),下游引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 用于RT-PCR扩增的下游引物Tab.1 Downstream primers for RT-PCR amplification
1.5目的基因的扩增 以hPMLcDNA 为模板扩增hPMLⅠ、Ⅱ、Ⅳ、Ⅴ、Ⅵ、Ⅶ。PCR 扩增条件为:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min,共34 个循环;72 ℃再延伸5 min,4 ℃保存。PCR产物经1%琼脂糖凝胶电泳分析。
1.6真核表达质粒的构建 胶回收6种hPML基因,与载体pCAGGS均经EcoRⅠ和KpnⅠ双酶切,回收目的基因及载体片段,采用Mut Express MultiS Fast Mutagenesis Kit V2 试剂盒于37 ℃连接30 min;连接产物转化感受态E.coliDH5α,37 ℃培养过夜;取菌液,接种至2YT固体培养基,37 ℃培养12 h;挑取单克隆,送生工生物工程(上海)股份有限公司测序。将测序正确的真核表达质粒分别命名为pCAGGS-hPMLⅠ、pCAGGShPMLⅡ、pCAGGS-hPMLⅣ、pCAGGS-hPMLⅤ、pCAGGS-hPMLⅥ、pCAGGS-hPMLⅦ。
1.7重组蛋白hPML 的鉴定 采用Western blot 法。将293T 细胞按1.2×106个/孔加入6 孔板,于37 ℃培养24 h;用细胞转染试剂jetPRIME 分别转染6 种hPML基因真核表达质粒,继续培养24 h;用裂解缓冲液(2%SDS、10%甘油、5%2-巯基乙醇和0.1%溴酚蓝)提取总蛋白,经12% SDS-PAGE 分离后,电转移至NC 膜上,用5%脱脂牛奶室温封闭1 h;加入兔抗Myc 单克隆抗体及小鼠抗β-actin 单克隆抗体(均1∶1 000稀释),于37 ℃孵育过夜;PBS洗涤3次,加入HRP 标记的山羊抗兔和山羊抗小鼠IgG(1∶1 00 稀释),室温作用1 h;ECL法显色。
1.8重组蛋白hPML的亚细胞定位分析 采用IFA法。将Vero 细胞按5×105个/孔加入12孔板,37 ℃培养24 h;用细胞转染试剂jetPRIME 分别转染6 种hPML基因真核表达质粒,继续培养24 h;PBS 洗涤3 次,用4%多聚甲醛于4 ℃固定过夜;PBS洗涤3次,用0.5%Triton X-100(PBS 配制)室温透化10 min;再用5%BSA 于37 ℃恒温箱封闭1 h;加入兔抗Myc 单克隆抗体(1∶1 000 稀释),37 ℃避光孵育3 h;加入Alexa Fluor 488 标记的山羊抗兔IgG(1∶1 000稀释),37 ℃孵育1 h;用DAPI(1∶1 000 稀释)染色7 min,抗淬灭剂封片,干燥过夜;利用激光共聚焦显微镜观察并拍照。
1.9数据采集与分析 应用Imagej 软件进行数据分析及作图。
2 结果
2.1目的基因的鉴定hPMLⅠ、Ⅱ、Ⅳ、Ⅴ、Ⅵ、Ⅶ基因扩增产物经1%琼脂糖凝胶电泳分析,分别于2 646、2 487、1 899、1 833、1 680 和1 305 bp 处可见目的基因条带,大小与预期一致,见图1。
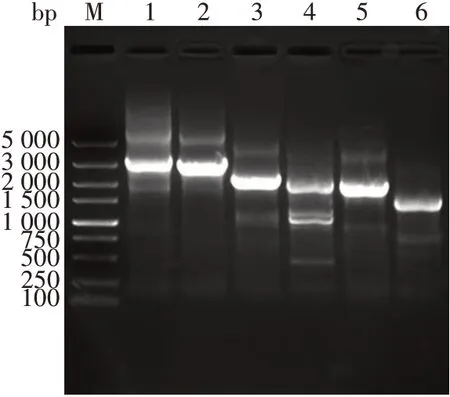
图1 6种转录本hPML基因PCR产物电泳图Fig. 1 Electrophoretic profile of PCR products of hPML gene of six transcripts
2.2真核表达质粒的鉴定 6 种真核表达质粒中的目的基因序列与GenBank 中登录的hPML基因序列(NM_033238)完全一致。表明6 种真核表达质粒构建正确。
2.3重组蛋白hPML的鉴定 hPMLⅠ、Ⅱ、Ⅳ、Ⅴ、Ⅵ和Ⅶ6种重组蛋白均可与Myc抗体发生特异性结合,分别于相对分子质量约106 000、100 000、76 000、73 000、67 000、52 000处可见特异性蛋白结合条带,大小与预期符合,见图2。表明6种重组蛋白hPML表达正确。
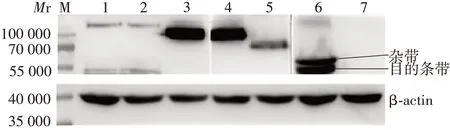
图2 6种重组蛋白hPML的Western blot检测Fig.2 Western blotting of six recombinant proteins hPML
2.4重组蛋白hPML 的亚细胞定位情况 重组蛋白hPMLⅠ、Ⅱ、Ⅳ、Ⅴ和Ⅵ均定位于细胞核与细胞质内;重组蛋白hPMLⅦ大部分定位于细胞质中,极少定位于细胞核中。见图3。表明6 种重组蛋白hPML均成功表达,但亚细胞定位略有差异,即除重组蛋白hPMLⅦ外,其他重组蛋白均定位于细胞核中。
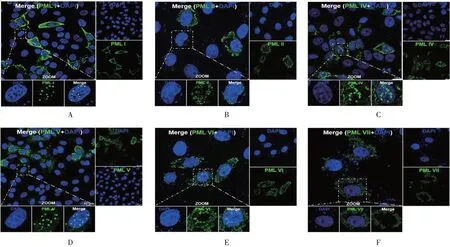
图3 6种重组蛋白hPML亚细胞定位的镜下观察(×10)Fig.3 Microscopic observation of subcellular localization of six recombinant proteins hPML(×10)
3 讨论
hPML 在细胞通路中具有多种功能,是抗病毒感染的首选靶点,且在干扰素抗病毒作用机制中发挥重要作用,这些作用均与其在细胞中的定位有关。本研究结果表明,各亚型hPML 蛋白不仅定位于细胞核中,细胞质中也存在,这是由于蛋白质产生于细胞质,有NLS 的蛋白会将hPML 蛋白运输至细胞核内,亚细胞定位图可显示出将蛋白质从细胞质转运至细胞核的瞬间;无NLS 的蛋白,如hPMLⅦ,其不会被运输入细胞核,在亚细胞定位图中显示大部分存在于细胞质。不同亚型hPML 蛋白可能由于定位模式不同而具有不同的功能[14],研究表明,hPML 可通过各种不同的机制抑制多种RNA 和DNA 病毒的感染,这些机制包括通过将病毒蛋白隔离在细胞质或细胞核、抑制病毒mRNA 合成、通过在NBS 中募集和激活p53 诱导感染细胞的凋亡、用特异性组蛋白变异或表观遗传标记对病毒DNA 进行染色、对病毒或细胞蛋白SUMO 化以改变蛋白稳定性和功能[15-16],可促进干扰素介导的信号传导及其诱导的SUMO 化、细胞凋亡、抗病毒作用,对DNA和RNA 病毒进行内在免疫[17]。如hPMLⅢ或Ⅳ蛋白的过表达可显著降低4 种血清型登革热病毒(Dengue virus,DENV)在A64 细胞中复制及肠道病毒71型(enterovirus 71,EV71)在HeLa 细胞感染中病毒蛋白的表达水平[18-19]。hPMLⅢ蛋白可通过p53 依赖性方式对脊髓灰质炎病毒(polio virus,PV)发挥抗病毒作用,研究表明,hPMLⅢ蛋白在p53 敲除的CHO 和U373MG 细胞中过表达可抑制水疱性口炎病毒(vesicular stomatitis virus,VSV)和流感病毒在mRNA 和蛋白表达水平上的复制[16];在人类Caco-2细胞中,hPMLⅣ和hPMLⅥ蛋白的表达具有流感病毒抗性[20];hPMLⅢ的外源表达不会显著抵消淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)或狂犬病病毒(rabies virus,RABV)的复制,在体内也观察到hPMLⅣ亚型的抗病毒作用,如hPMLⅣ亚型缺乏会使小鼠更易感染LCMV 和VSV[21-23];hPML 蛋白还可抑制人类巨细胞病毒的复制[24-25]。上述结论表明,hPML 蛋白具有抗病毒作用,与病毒感染和致病性密切相关,但其抗病毒机制尚未明确。
综上所述,本研究成功构建了6 种转录本hPML基因真核表达质粒,表达的重组蛋白hPMLⅠ、Ⅱ、Ⅳ、Ⅴ和Ⅵ主要定位于细胞核,hPMLⅦ主要定位于细胞质。本研究为hPML 蛋白抗病毒作用的深入研究奠定了基础。
