长链非编码RNA MALAT1对甲状腺癌细胞生长和侵袭的影响及其作用机制
2023-07-30王瑾琳郑晨魏晓霞高岚
王瑾琳,郑晨,魏晓霞,高岚
1.河南省人民医院河南大学医学院,河南郑州 450000;2.河南省肿瘤医院,河南郑州450000
甲状腺癌是常见的内分泌性恶性肿瘤之一,近年,其发病率呈不断上升趋势。该病最常见的两种类型为甲状腺乳头状癌和甲状腺滤泡状癌,占甲状腺癌的90%以上,该病普遍预后良好,但仍有部分患者在10年内出现复发或远端转移[1-2]。
甲状腺癌的发生发展涉及多种生物学过程,包括复杂的分子交互网络和调控机制,其中非编码RNA在转录和翻译水平的调控中发挥重要作用。长链非编码RNA(long non-coding RNA,lncRNA)是一组长度超过200 个核苷酸的非蛋白编码RNA,在多种肿瘤中表达异常,参与调控肿瘤细胞的增殖、转移、侵袭、凋亡等多个生物学过程。如BANCR、H19和LINC00312 等lncRNA 可通过激活生存转移信号ERK/MAKP/AKT 或结合并抑制miRNA 发挥对靶分子的调控作用,促进甲状腺癌细胞的增殖和迁移[3-4]。MALAT1也是一种lncRNA,有报道显示,其在甲状腺癌中呈高表达,与甲状腺癌的预后、恶性增殖和转移密切相关;miR-211-5p是一种miRNA,可能受lncRNA的调控,在甲状腺癌中表达水平下调,外源性过表达miR-211-5p后可有效抑制甲状腺癌细胞的增殖和转移[5-6]。上述结果表明,MALAT1可能成为甲状腺癌潜在的治疗靶点。本研究旨在检测lncRNAMALAT1对甲状腺癌细胞生长和侵袭的影响,并探讨其作用机制,以期为进一步明确lncRNA在甲状腺癌中的分子作用机制奠定基础。
1 材料与方法
1.1样本 选择2019 年1 — 12 月于河南省肿瘤医院行甲状腺癌切除术的44 例患者,其中男性17 例,女性27 例,年龄为41~63 岁。甲状腺乳头状癌35例,甲状腺滤泡状癌9 例。所有患者均签署知情同意书,术前未采用放化疗等方法进行治疗。手术切除癌组织及癌旁组织样本(编号1~44),经液氮瞬冷后置-80 ℃保存。本研究取得河南省肿瘤医院伦理学委员会批准。
1.2细胞、质粒及基因序列 人甲状腺癌细胞系SW1736、TC-1 和Hth7 均购自武汉普诺赛生命科技有限公司;人甲状腺正常滤泡上皮细胞株Nthy-ori 3-1购自ATCC;质粒pcDNA3.1-MALAT1及pcDNA3.1均购自美国赛默飞公司;阴性对照序列si-NC(正义:5'-TTCTCCGAACGTGTCACGT-3',反义:5'-ACGTGACACGTTCGGAGAA-3')、MALAT1干扰序列si-MALAT1(靶向NR_002819.4的3 006 ~3 030 区域,正义:5'- CACAGGGAAAGCGAGTGGTTGGTAA-3',反义:5'-TTACCAACCACTCGCTTTCCCTGTG-3')、miR-211-5p过表达序列miR-211-5p mimics(5'-UUCCCUUUGUCAUCCUUCGCCU-3')、乱序对照序列Scramble(5'-CCACUGUCCUGAAGUGAGAAA-3')均由上海吉玛制药技术有限公司合成。
1.3主要试剂及仪器 RPMI1640培养基、胎牛血清、PBS 和胰蛋白酶均购自美国Gibco 公司;MTT 购自美国Promega 公司;TRizol 及LipofectamineTM2000 均购自美国Invitrogen公司;逆转录试剂盒SYBR primeScript及定量PCR试剂盒SYBR GreenMix均购自日本TaKaRa公司;Transwell小室购自美国Corning公司。
1.4甲状腺癌中MALAT1及miR-211-5p基因相对表达水平的检测 根据GenBank 中登录的MALAT1(378938)、miR-211-5p(406993)及U6基因(26827)序列,应用Primer Premier 6.0 软件设计引物,MALAT1上游引物:5'-AAAGCAAGGTCTCCCCACAAG-3',下游引物:5'-GGTCTGTGCTAGATCAAAAGGCA-3';miR-211-5p上游引物:5'-GCGCTTGTCATCCTTCGCCT-3',下游引物:5'-TGGTGTCGTGGAGTCG-3';U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。引物均由上海吉玛制药技术有限公司合成。将甲状腺癌组织及癌旁组织样本剪碎,置冰上研磨为匀浆,TRizol 试剂提取总RNA,SYBR primeScript 试剂盒逆转录为cDNA,以其为模板,进行PCR扩增。PCR扩增条件为:95 ℃预变性60 s;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40 个循环。以U6为内参,采用2△△CT法计算MALAT1及miR-211-5p基因的相对表达水平,并评价MALAT1和miR-211-5p在甲状腺癌组织中的表达相关性。
1.5甲状腺细胞系中MALAT1基因相对表达水平的检测 将SW1736、TC1 和Hth7 及Nthy-ori 3-1 细胞采用含10%胎牛血清和1%青-链霉素的RPMI1640培养基,于37 ℃,5% CO2培养箱中培养至对数生长期,检测各细胞中MALAT1基因的相对表达水平,方法同1.4项。
1.6MALAT1对甲状腺癌细胞生长能力影响的检测采用MTT 法。按1.5 项方法将SW1736 细胞培养至对数生长期,在LipofectamineTM2000的介导下分别转染pcDNA3.1-MALAT1、pcDNA3.1、si-MALAT1及si-NC,37 ℃转染6 h;将SW1736 细胞按2×103个/孔的密度接种至96孔板,37 ℃贴壁培养0、24、48和72 h;加入5 mg/mL 的MTT,20µL/孔,37 ℃孵育4 h;加入DMSO 溶液,用酶标仪检测A450。每组至少设3 个复孔,同时设空白对照(未加细胞),计算结果时需减去空白对照,去除背景干扰。
1.7过表达miR-211-5p对MALAT1诱导甲状腺癌细胞高生长能力影响的检测 按1.5项方法将SW1736细胞培养至对数生长期,在LipofectamineTM2000的介导下分别转染pcDNA3.1-MALAT1、miR-211-5pmimics、Scramble及pcDNA3.1-MALAT1+miR-211-5pmimics,37 ℃转染6 h;将转染细胞按2×103个/孔的密度接种至96 孔板,37 ℃贴壁培养0、24、48 和72 h,采用MTT法检测,检测过程同1.6项。
1.8MALAT1对甲状腺癌细胞侵袭能力影响的检测采用Transwell 小室试验。按1.5 项方法将SW1736细胞培养至对数生长期,在LipofectamineTM2000的介导下分别转染si-NC、si-MALAT1、pcDNA3.1、pcDNAMALAT1、miR-211-5pmimics 及miR-211-5pmimics +pcDNA3.1-MALAT1,37 ℃转染6 h;将转染细胞按2×105个/孔接种于24 孔板,加入无血清培养基,置Transwell 小室(8 µm)的上室,同时下室加入含10%FBS 的培养基作为趋化吸引物,37 ℃培育48 h;去上室未跨膜细胞,另一侧跨膜细胞用多聚甲醛固定10 min;PBS洗涤3次,用0.1%结晶紫染色,显微镜下观察细胞分布情况,随机选择10 个细胞均匀分布的区域进行拍照和计数。
1.9MALAT1对miR-211-3p表达调控作用的检测应用Starbase数据库中的lncRNA和miRNA相互作用数据库检索MALAT1与miR-211-3p之间可能存在的调控靶序列。同1.6 项获得转染pcDNA3.1-MALAT1、pcDNA3.1、si-MALAT1和si-NC 的SW1736细胞,检测miR-211-5p的表达水平,方法同1.4项,评价MALAT1对miR-211-3p表达的调控作用。
1.10统计学分析 应用SPSS 19.0 软件进行统计学分析,GraphPad 8.0 软件绘图,计量资料以均值± 标准差(± s)表示,两组间比较采用独立t检验,多组间比较采用方差分析(One way ANOVA),事后检验采用LSD法,相关性分析采用Pearson相关分析,均以P<0.05为差异有统计学意义。
2 结果
2.1甲状腺癌中MALAT1和miR-211-5p基因的相对表达水平 与癌旁组织比较,甲状腺癌组织样本中MALAT1基因的相对表达水平明显增加(t=7.066,P<0.001),miR-211-5p基因的相对表达水平明显下降(t=-8.889,P<0.001),见图1;37 份癌组织样本中MALAT1基因相对表达水平上升(占84.1%),39份癌组织样本中miR-211-5p基因相对表达水平下降(占88.6%),见图2。甲状腺癌组织中MALAT1和miR-211-5p基因的相对表达水平呈显著负相关(r2为0.168,P=0.057),见图3。

图1 甲状腺癌组织和癌旁组织中MALAT1(A)及miR-211-5p基因(B)的相对表达水平Fig. 1 Relative expression levels of MALAT1 gene(A)and miR-211-5p gene(B)in thyroid cancer and adjacent tissues

图2 甲状腺癌组织中MALAT1(A)及miR-211-5p 基因(B)的表达水平Fig.2 Expression levels of MALAT1 gene(A)and miR-211-5p gene(B)in thyroid cancer tissues

图3 甲状腺癌组织中MALAT1与miR-211-5p基因相对表达水平的相关性Fig. 3 Correlation between relative expression levels of MALAT1 and miR-211-5p gene in thyroid cancer tissues
2.2甲状腺细胞系中MALAT1基因的相对表达水平Nthy-ori 3-1、SW1736、TC1 及Hth7 细胞中MALAT1基因的相对表达水平分别为1.01±0.02、2.76±0.29、2.05±0.31和2.58±0.03。与Nthy-ori 3-1细胞比较,SW1736、TC1、Hth7 细胞中MALAT1基因相对表达量分别增加(2.76±0.24)、(2.05±0.25)、(2.55±0.06)倍,且差异均有统计学意义(t分别为10.230、5.813、74.310,P分别为0.009、0.004、<0.001)。
2.3MALAT1对甲状腺癌细胞生长能力的影响 与si-NC组比较,si-MALAT1组SW1736细胞的生长能力降低,转染72 h时差异有统计学意义(t=7.780,P=0.001);pcDNA3.1-MALAT1组SW1736 细胞的生长能力升高,转染72 h 时差异有统计学意义(t= -7.410,P=0.002)。见图4。表明降低MALAT1表达可抑制甲状腺癌细胞SW1736的生长。

图4 过表达及抑制MALAT1 表达对甲状腺癌细胞生长能力的影响Fig. 4 Effects of overexpression and inhibition of MALAT1 expression on growth ability of thyroid cancer cells
2.4过表达miR-211-5p对MALAT1诱导甲状腺癌细胞高生长能力的影响 与Scramble组比较,miR-211-5pmimics组SW1736细胞生长能力下降,转染72 h时差异有统计学意义(t=-5.490,P=0.005);与pcDNA3.1-MALAT1组比较,pcDNA3.1-MALAT1+miR-211-5pmimics组SW1736细胞生长能力下降,转染72 h时差异有统计学意义(t=-5.640,P=0.005),见图5。表明过表达miR-211-5p能够抑制MALAT1诱导的细胞增长。
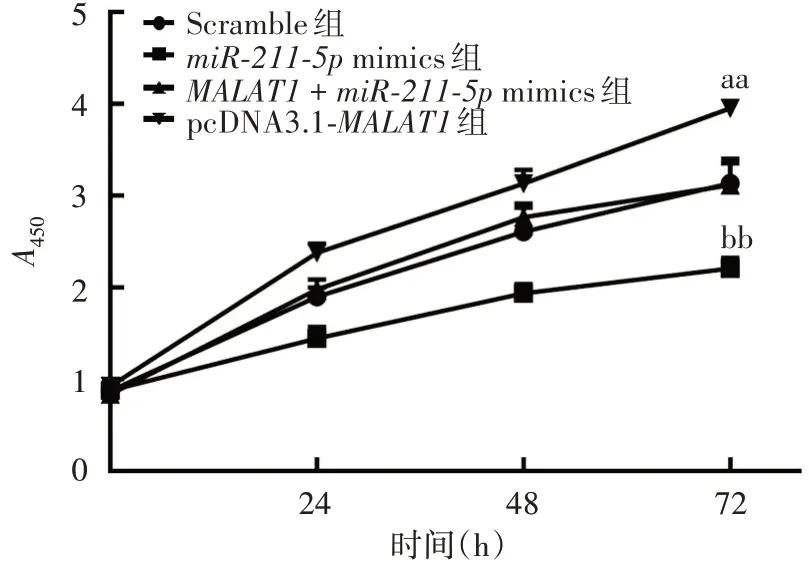
图5 MTT 法检测过表达miR-211-5p 对MALAT1 诱导甲状腺癌细胞高生长能力的影响Fig. 5 MTT detectiob of effect of overexpression of miR-211-5p on growth ability of thyroid cancer cells induced by MALAT1
2.5MALAT1对甲状细胞腺癌侵袭能力的影响 si-NC、si-MALAT1、pcDNA3.1、pcDNA3.1-MALAT1、miR-211-5pmimics及miR-211-5pmimics+pcDNA3.1-MALAT1组SW1736 细胞发生侵袭的细胞数分别为(157.00 ±11.86)、(93.67±6.13)、(169.33±12.76)、(241.67±17.15)、(94.33±7.59)、(137.00±9.79)个。与si-NC组比较,si-MALAT1及miR-211-5pmimics组SW1736细胞发生侵袭的细胞数明显减少(t分别为-6.710 和-6.290,P均=0.003),pcDNA3.1-MALAT1组则明显增多(t=5.740,P=0.005)。见图6。表明miR-211-5p过表达能抑制MALAT1过表达引发的细胞转移的增加。
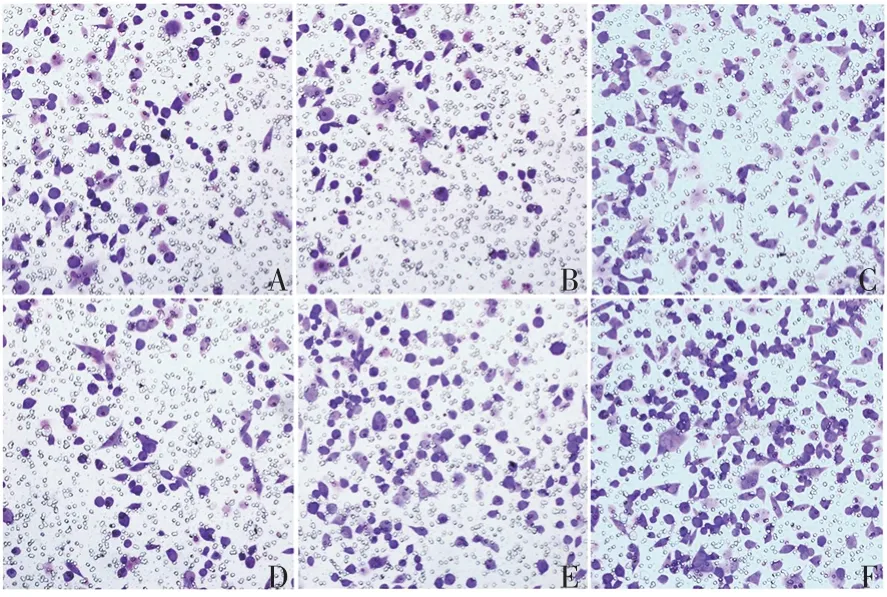
图6 Transwell小室试验检测MALAT1对甲状癌细胞侵袭能力的影响(×200)Fig. 6 Detection of effect of MALAT1 on invasionability of thyroid cancer cells by Transwell chamber assay(×200)
2.6MALAT1对miR-211-3p表达的调控作用MALAT1与miR-211-5p之间存在互补序列,见图7,表明MALAT1与miR-211-5p之间可能存在调控关系。pcDNA3.1、pcDNA3.1-MALAT1、si-NC、si-MALAT1组SW1736细胞中miR-211-5p基因相对表达水平分别为1.05±0.09、0.59±0.05、1.03±0.07、2.14±0.23。与pcDNA3.1组比较,pcDNA3.1-MALAT1组细胞中miR-211-5p基因相对表达水平明显降低(t=-7.510,P=0.002);与si-NC 组比较,si-MALAT1组则明显增加(t= 7.960,P=0.001)。

图7 MALAT1和miR-211-5p基因序列互补对照图Fig.7 MALAT1 and miR-211-5p gene sequence complementary contrast chart
3 讨论
lncRNA 表达失调可影响细胞增殖、周期调控、凋亡、转移和化疗耐药等多种生物学过程。MALAT1位于染色体的11q13,是一种相对保守的lncRNA,在多种肿瘤中表达上调,如乳腺癌、骨肉瘤、非小细胞肺癌、卵巢癌和前列腺癌等[7-12],其表达增加与肿瘤的转移、复发和预后差密切相关[13]。HUANG 等[5]发现,MALAT1在甲状腺癌中上调,通过诱导含IQ 基序的GTPase 激活蛋白(ras GTPase-activating-like protein,IQGAP)的表达增强肿瘤细胞的生长和转移能力。ZHANG等[14]通过RNA原位杂交法检测了良性、恶性甲状腺组织中MALAT1的表达情况,其中甲状腺乳头状瘤中随着良性向恶性发展,MALAT1的表达逐渐增加;作为诱发细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的主要驱动因子TGF-β 也促进了MALAT1的表达。在甲状腺滤泡状癌中,MALAT1的水平也明显高于癌旁组织,siRNA 干扰MALAT1表达后能有效抑制细胞的生长和转移[15]。WEN 等[16]对中国人群的甲状腺滤泡状癌患者的MALAT1基因多态性研究发现,MALAT1的基因多态性rs619586可降低甲状腺滤泡状癌的发病风险,体外功能试验显示,该单核苷酸多态性(single nucleotide polymorphism,SNP)可降低MALAT1水平,增加肿瘤细胞的凋亡。本研究检测了44 份甲状腺癌及癌旁组织中MALAT1基因的相对表达水平,结果发现,在大多数样本中,MALAT1基因的相对表达呈上调趋势,siRNA靶向抑制MALAT1表达后可明显抑制SW1736细胞的生长和转移,表明MALAT1可能参与了甲状腺癌的发生、发展和转移。
MALAT1可能通过与内源性miRNA 结合的方式对下游信号和分子进行调控,从而参与细胞生长、凋亡和转移的过程。ZHUANG 等[17]研究发现,结肠癌中MALAT1能与抑癌性miR-106-5p结合,阻碍miR-106-5p对靶分子SNAIL2 的负性调控作用,促进结肠癌的侵袭和转移。WU等[18]报道表明,影响miR-194-5p与MALAT1发生相互作用的MALAT1rs664589 会增加结肠癌发生的风险,miR-194-5p与野生型MALAT1结合后能引发依赖Ago2 方式的MALAT1核内降解,MALAT1rs66489 破坏两者之间的结合,使MALAT1累积,引发不良事件。MALAT1还在恶性胶质瘤中充当miR-199a的“分子海绵”,阻碍miR-199靶向ZHX1转录抑制分子,下调促凋亡蛋白Bax 的表达,有利于肿瘤细胞的生存[19]。上述研究表明,在不同肿瘤中,过表达MALAT1可结合并通过调控miRNA与下游靶基因的方式,参与肿瘤多种恶性生物学行为。本研究发现,MALAT1和miR-211-5p基因相对表达水平在临床甲状腺癌样本中呈负相关(r2=0.168,P=0.005 7),MALAT1过表达能抑制miR-211-5p的表达,而上调miR-211-5p的表达,则可明显抑制MALAT1过表达导致的生长及侵袭优势,表明MALAT1在甲状腺癌中可能通过抑制miR-211-5p来发挥其生物学作用。miR-211参与乳腺癌、结肠癌、胃癌和卵巢癌等多种肿瘤发生发展的过程,肿瘤细胞中外源性表达miR-211-5p具有抗增殖和促凋亡能力[20-21]。miR-211-5p在不同肿瘤中可靶向多种分子和信号通路,如在三阴乳腺癌中,miR-211-5p直接靶向SETBP1,从而影响乳腺癌细胞的增殖、侵袭和转移,且与患者的预后密切相关[22];在膀胱癌中,miR-211-5p通过靶向抑制表观遗传学调控因子HDAC9的表达,从而影响肿瘤细胞的生长和转移[23]。WANG等[6]报道,miR-211-5p在肾细胞癌中能够靶向调控SNAIL1,抑制肾癌细胞的迁移能力。miR-211-5p可能参与了多个lncRNA的调控网络,肾癌中上调的lncRNA EGOT 通过“分子海绵”作用吸附miR-211-5p来减轻miR-211-5p对Erb-B2 受体酪氨酸激酶4(Erb-B2 receptor tyrosine kinase 4,ErbB4)的抑制,从而促进肾癌细胞的增殖和迁移[24]。LIANG等[25]研究发现,甲状腺乳头状癌中上调MCM3AP-AS1 能通过抑制miR-211-5p/SPARC 通路促进肿瘤细胞的生长和转移,沉默MCM3AP-AS1可使miR-211-5p上调而发挥抗肿瘤作用。TAN等[26]发现,LncRNAMALAT1可靶向减少miR-211-5p的表达,促进脑缺血再灌注情况下的神经元损伤,表明MALAT1与miR-211-5p之前存在潜在的调控关系。MALAT1与其他lncRNA 在甲状腺癌中相互作用的相关性尚未明确,它们可能受到上游的激活信号来共同靶向miR-211-5p,从而参与协调下游生长和转移的生物学作用,但需进一步深入研究确认。上述结果表明,miR-211-5p可能是甲状腺癌发生和转移过程中重要的调控分子,从该miRNA 入手设计靶向lncRNA 的药物可能为甲状腺癌治疗和预后评价提供新思路。
综上所述,甲状腺癌组织中MALAT1表达水平上调,miR-211-5p表达水平下调,两者表达呈负相关。MALAT1的过表达促进了甲状腺癌细胞的生长和转移,抑制MALAT1或过表达miR-211-5p则可明显抑制甲状腺癌细胞的增殖和侵袭。MALAT1能够调节miR-211-5p的表达,表明MALAT1/miR-211-5p可能作为甲状腺癌潜在的治疗靶点。
