血清TSH、TPO-Ab、Tg-Ab水平在良恶性甲状腺结节诊断中的意义①
2023-07-28杨媛媛陈源清游琴秀
杨媛媛,陈源清,游琴秀
(龙岩市第二医院检验科, 福建 龙岩 364000)
甲状腺结节是临床常见的一种病症,由碘摄入量过高或过低、炎症等多种因素引起,好发于女性和老年人。甲状腺结节可随吞咽动作上下活动,触诊少有压痛,质地硬韧,患者自觉症状较少,通常在体检中被检出甲状腺抗体呈阳性[1]。甲状腺癌是数量增长最快的恶性肿瘤,有研究报道,近年来国内甲状腺结节发病率逐年上升,其中甲状腺癌发病率占全球新发病例的15.6%,病死率占比高达13.8%[2]。由于甲状腺结节、早期甲状腺癌无典型症状,患者不易察觉,容易延误最佳治疗时机,增加癌变风险和病死率。因此,临床应重视良恶性甲状腺结节筛查,尽早确诊、治疗,对提高患者生存质量具有重要意义。有研究指出,甲状腺结节发病与甲状腺功能有一定关联,促甲状腺激素(TSH)异常表达可能会加重病情,故TSH检测对诊断良恶性甲状腺结节具有重要作用。甲状腺过氧化物酶抗体(TPO-Ab)、甲状腺球蛋白抗体(Tg-Ab)是自身免疫性甲状腺疾病的标志物,主要参与甲状腺病变过程,但在良恶性甲状腺结节鉴别诊断中应用价值存在争议[3,4]。对此,本研究回顾性选取我院2020-03~2022-03收治的81例甲状腺结节患者,通过其术前检测的血清TSH、TPO-Ab、Tg-Ab水平,分析3项检测指标鉴别诊断良恶性甲状腺结节的效果,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取本院2020-03~2022-03收治的81例甲状腺结节患者,根据术后病理检查结果分为良性甲状腺结节组43例与恶性甲状腺结节组38例。良性甲状腺结节组:男15例,女28例;年龄28~69岁,平均(43.68±5.92)岁;甲状腺结节单发18例,多发25例;病程1~8年,平均(4.24±1.49)年。恶性甲状腺结节组:男12例,女26例;年龄30~71岁,平均(43.85±6.13)岁;甲状腺结节单发20例,多发18例;病程1~7年,平均(4.09±1.37)年。两组一般资料比较无显著差异(P>0.05)。(1)纳入标准:符合《甲状腺结节和分化型甲状腺癌诊治指南》中甲状腺结节诊断标准[5];初次接受手术治疗;术前均行超声检查、实验室(TSH、TPO-Ab、Tg-Ab)检测;术后病理检查确诊良性或恶性甲状腺结节。(2)排除标准:伴甲状腺功能减退、甲状腺功能亢进;合并其他恶性肿瘤;伴急慢性感染;免疫功能缺陷、凝血功能异常;已接受甲状腺疾病药物治疗。此次研究已获得医院伦理委员会审核批准,所有患者及家属对此次研究知情同意。
1.2 方法
抽取患者空腹状态下肘静脉血5mL,采用离心机(型号Optima XPN,贝克曼库尔特公司生产)离心处理,离心速率3000r/min,离心时间8min,离心半径10cm,离心后静置5min,将上层血清置于试管待测。采用全自动化学发光免疫分析仪(贝克曼库尔特公司生产,型号DXI800)检测两组患者血清TSH、TPO-Ab、Tg-Ab水平。
1.3 观察指标
(1)比较良性甲状腺结节组与恶性甲状腺结节组患者血清TSH、TPO-Ab、Tg-Ab水平,TSH正常值0.34~5.0mU/L,TPO-Ab正常值0~9IU/mL,Tg-Ab正常值0~4IU/mL。(2)比较两组患者血清TSH、TPO-Ab、Tg-Ab单项检测及联合检测阳性率,血清TSH>5.0mU/L,即为阳性;血清TPO-Ab>9IU/mL,即为阳性;血清Tg-Ab>4IU/mL,即为阳性。上述指标中有1个或1个以上出现阳性,表示联合检测呈阳性。同时比较单项检测与联合检测阳性率。(3)分析血清TSH、TPO-Ab、Tg-Ab单项检测及联合检测对良恶性甲状腺结节诊断灵敏度、特异度与准确率。
1.4 统计学方法
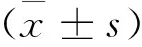
2 结果
2.1 两组患者血清TSH、TPO-Ab、Tg-Ab水平比较
恶性甲状腺结节组血清TSH、TPO-Ab、Tg-Ab水平高于良性甲状腺结节组,差异有统计学意义(P<0.05),见表1。
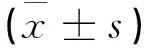
表1 两组患者血清TSH、TPO-Ab、Tg-Ab水平比较
2.2 两组患者血清TSH、TPO-Ab、Tg-Ab单项检测及联合检测阳性率比较
恶性甲状腺结节组血清TSH、TPO-Ab、Tg-Ab单项及联合检测的阳性率均高于良性甲状腺结节组,差异均有统计学意义(P<0.05),见表2。
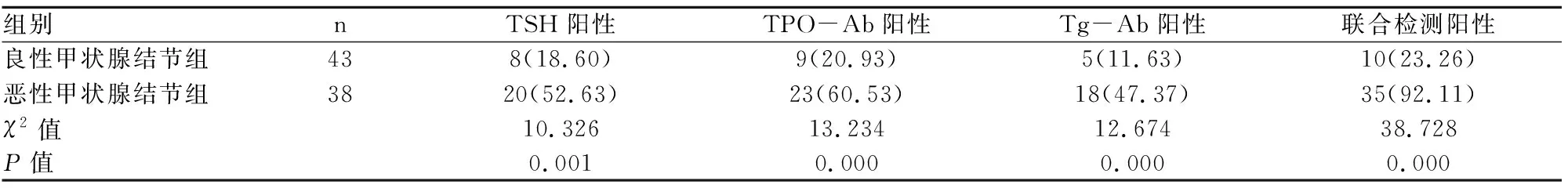
表2 两组患者血清TSH、TPO-Ab、Tg-Ab单项及联合检测阳性率比较[n(%)]
2.3 血清TSH、TPO-Ab、Tg-Ab单项检测与联合检测诊断效能比较
联合检测对良恶性甲状腺结节诊断灵敏度、准确率高于单项检测,差异有统计学意义(P<0.05);特异度方面无显著差异(P>0.05),见表3。

表3 血清TSH、TPO-Ab、Tg-Ab单项检测与联合检测诊断效能比较[n(%)]
3 讨论
近年来,甲状腺结节发病率不断递增,并呈年轻化趋势发展,大部分甲状腺结节患者经临床诊断为良性,仅少数患者为恶性,恶性甲状腺结节多为单发病灶,发病隐匿,难以察觉。随着病情进展,肿块增大,患者因颈部肿块而入院诊断,才得以确诊[6]。目前,甲状腺结节诊断主要采用影像学检查、病理检查、实验室检查,其中影像学检查可以发现很多隐匿性病灶,尤其是超声高分辨率穿刺抽吸活检技术广泛应用,使甲状腺结节检出率逐渐提升。但良恶性甲状腺结节在超声图像上存在重叠,鉴别诊断效果不佳,同时穿刺抽吸属于有创操作,患者接受度较低。因此,临床还需探索操作简便、安全的诊断方法,提高良恶性甲状腺结节鉴别诊断准确率。现阶段,相关研究报道认为,实验室指标检测可以为甲状腺癌诊断提供一定参考依据[7,8]。TSH是人体垂体分泌的一种激素,可以调节甲状腺激素合成、分泌与甲状腺细胞增殖、分化,还能维持甲状腺血供,反映人体甲状腺功能情况,在甲状腺癌诊疗指南中,其是首选检查指标,表达水平升高表示甲状腺结节恶变风险较大[9]。TPO-Ab是甲状腺细胞针对性破坏性抗体,通常伴有甲状腺球蛋白抗体的出现,能通过细胞介导的细胞毒作用,减少甲状腺激素分泌,造成甲状腺功能减退。Tg-Ab是人体自身免疫性甲状腺疾病患者常见的自身抗体,与甲状腺球蛋白结合后,刺激机体NK细胞,攻击靶细胞,破坏甲状腺细胞,进而引起各种甲状腺疾病[10]。
本研究显示,恶性甲状腺结节组患者的血清TSH、TPO-Ab、Tg-Ab水平高于良性甲状腺结节组(P<0.05)。提示在恶性甲状腺结节患者中血清TSH、TPO-Ab、Tg-Ab水平显著提升,血清TSH、TPO-Ab、Tg-Ab表达与甲状腺结节发生、发展密切相关。分析原因,TSH与其受体结合后,刺激合成甲状腺细胞,分泌胰岛素样生长因子、细胞生长因子与血管内皮生长因子,可诱发甲状腺结节及肿瘤的发生;TPO-Ab、Tg-Ab与甲状腺组织免疫性损伤密切相关,是自身免疫性甲状腺疾病的主要诊断指标,TPO-Ab、Tg-Ab表达水平提高,反映患者甲状腺功能情况和炎症程度,而炎症可促进甲状腺结节、甲状腺癌的发生和发展,故间接提示恶性甲状腺结节的发生[11]。
本研究显示,恶性甲状腺结节组血清TSH、TPO-Ab、Tg-Ab单项及联合检测阳性率高于良性甲状腺结节组(P<0.05);联合检测对良恶性甲状腺结节的诊断灵敏度、准确率高于单项检测(P<0.05)。提示血清TSH、TPO-Ab、Tg-Ab联合检测可以提高恶性甲状腺结节诊断效能。分析原因,甲状腺癌是来源于甲状腺滤泡上皮的恶性肿瘤,而TSH是一种促甲状腺生长因子,其大量分泌会刺激甲状腺滤泡上皮细胞增生,并促进环磷酸腺苷合成,导致环磷酸腺苷依赖性蛋白激酶信号传导系统被激活,使表皮生长因子介导甲状腺结节细胞增殖,故TSH在一定程度上参与甲状腺结节恶化过程[12]。但是TSH表达水平也会受到其他甲状腺疾病的影响,单独检测该指标并不能完全反映恶性甲状腺结节,误诊率较高。此外,甲状腺具有分泌甲状腺激素和增强免疫力的作用,当甲状腺病变时,免疫力降低,会引发一系列炎症疾病,导致甲状腺抗体高表达,而甲状腺抗体高表达在甲状腺结节上癌变几率较高。Tg-Ab是甲状腺抗体之一,本身无破坏性,但通过结合甲状腺球蛋白后,参与酪氨酸残基碘化的耦联过程,激活自然杀伤细胞,破坏甲状腺细胞,加快甲状腺结节进展、恶变。恶性甲状腺结节发展改变甲状腺球蛋白表面抗原结构,引起免疫反应,进而刺激Tg-Ab表达水平提高。TPO-Ab也是甲状腺抗体之一,当恶性甲状腺结节增生、发展而破坏甲状腺组织,导致甲状腺细胞受损,使细胞内的甲状腺过氧化物酶进入血液,刺激机体产生炎症免疫反应,从而引起该指标高表达。TPO-Ab的特异性与敏感性高于甲状腺球蛋白抗体,可以预判甲状腺疾病的发生,同时还具有抑制转化生长因子β1合成与释放的作用,刺激甲状腺细胞生长,增加甲状腺结节癌变的风险。甲状腺抗体主要反映甲状腺自身免疫疾病和自身免疫性甲状腺机能减退,单纯出现甲状腺炎或桥本氏疾病,也会引起甲状腺抗体高表达,单独检测可能存在误诊情况。因此,相比于单独检测,血清TSH、TPO-Ab、Tg-Ab联合检测发挥互补作用,能更显著提升恶性甲状腺结节诊断效能。
综上所述,恶性甲状腺结节患者血清TSH、TPO-Ab、Tg-Ab水平显著高于良性甲状腺结节患者,血清TSH、TPO-Ab、Tg-Ab联合检测可提高良恶性甲状腺结节的鉴别诊断效能,为临床诊断提供准确依据。
