单菌与多菌接种发酵对多轮发酵四川泡菜风味的影响
2023-07-27史梅莓杨恺吕鹏军张其圣陈功王勇汪冬冬尹礼国伍亚龙
史梅莓,杨恺,吕鹏军,张其圣,,陈功,,王勇,汪冬冬,尹礼国,伍亚龙*
1(四川省食品发酵工业研究设计院有限公司,四川 成都,611130) 2(四川东坡中国泡菜产业技术研究院,四川 眉山,620000) 3(四川益动源生物科技有限公司,四川 眉山,620000)4(固态发酵资源利用四川省重点实验室,四川 宜宾,644000)
泡菜是我国典型的传统发酵食品,因其独特的风味、脆嫩清香的口感受到大众喜爱。随着市场需求的增长,泡菜大规模工业化生产发展迅速,而采用传统自然发酵方式,其复杂的微生物群落演替容易受环境的影响,工业化生产其品质难以稳定,且发酵周期长。研究表明,人工接种发酵是稳定产品品质的有效方法[1]。泡菜是以乳酸菌为主导发酵而成,包括乳杆菌属、明串珠菌属、魏斯氏菌属等优势菌[2-3]。其中,肠膜明串珠菌、植物乳杆菌等常用作四川泡菜发酵菌株。如朴泓洁等[4]接种肠膜明串珠菌发酵四川泡菜,发现可以缩短发酵周期,加强了泡菜食用安全性;隋明等[5]利用植物乳杆菌与鼠李糖乳杆菌作为发酵剂,获得了口感和质量较好的甘蓝泡菜;经骐源等[6]研究表明布氏乳杆菌、植物乳杆菌、毛榛毕赤酵母发酵泡萝卜,能赋予产品良好的营养价值和风味。
风味是评价泡菜品种的重要指标之一,在发酵过程中,除原辅料本身赋予风味之外,微生物的代谢活动是泡菜独特风味形成的重要因素[7]。有研究表明,接种泡菜发酵过程中菌种相对单一,其细菌群落结构更加稳定,易实现工业化生产中的品质把控,但其风味较为单一,自然发酵泡菜风味物质更为丰富[8-9]。而LUO等[10]研究表明混合发酵剂发酵泡菜其感官性能更好,具有替代老卤水制备四川泡菜的潜力。多轮发酵作为四川泡菜最常见的发酵方式,一般是泡菜成熟后保留原有的泡菜水,更换新鲜蔬菜,反复循环后形成含有大量微生物、有机酸等的稳定系统[11],而目前对于不同菌株对多轮发酵四川泡菜品质影响的报道较少。因此,本研究以植物乳杆菌、肠膜明串珠菌、食窦魏斯氏菌作为发酵菌株,研究单菌与多菌对多轮发酵四川泡菜风味品质的影响,以期开发出泡菜品质稳定、风味接近自然发酵泡菜的发酵剂。
1 材料与方法
1.1 材料与试剂
新鲜红皮萝卜、甘蓝、红小米椒、姜等蔬菜,均购于超市;植物乳杆菌PC45(LactobacillusplantarumPC45)、肠膜明串珠菌PC137(LeuconostocmesenteroidesPC137)、食窦魏斯氏菌PC149(WeissellacibariaPC149),四川省食品发酵工业研究设计院有限公司实验室保藏;氯化钠、氢氧化钠、邻苯二甲酸氢钾,成都市科隆化学品有限公司;MRS肉汤培养基,广东环凯微生物科技有限公司。
1.2 仪器与设备
GCMS-TQ8040气相色谱质谱联用仪,日本岛津仪器公司;VF-WAXms(60 m×0.25 mm,0.25 μm)色谱柱,美国安捷伦公司;ESJ200-4A电子天平,沈阳龙腾电子有限公司;XH-B旋涡混合器,江苏天翎仪器有限公司;LDZF-75L-II立式压力蒸汽灭菌器,上海申安医疗器械厂;BSP-150生化培养箱,上海博讯实业有限公司医疗设备厂;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;PHSJ-3F pH计,上海仪电科学仪器股份有限公司;LC-MS-M1磁力搅拌器,上海力辰邦西仪器科技有限公司;TG-16高速离心机,四川蜀科仪器有限公司;DW-86L338 J超低温保存箱,青岛海尔生物医疗股份有限公司。
1.3 实验方法
1.3.1 菌悬液制备
将植物乳杆菌PC45、肠膜明串珠菌PC137和食窦魏斯氏菌PC149分别接种于MRS液体培养基,37 ℃静置培养18 h(菌体浓度约为108CFU/mL),6 000 r/min离心5 min后弃去上清液,用同体积的无菌生理盐水(0.85% NaCl,质量分数)洗涤2次后重悬备用。
1.3.2 泡菜的制备与取样
(1)泡菜配方(g):红皮萝卜300、甘蓝200、水 1 000、白砂糖10、食盐42、红小米椒5、老姜片20、花椒0.3。
(2)泡菜的制备:红皮萝卜、甘蓝、红小米椒、生姜等用清水除去表面杂质污物,再用纯净水清洗,沥干、切分,其中红皮萝卜切成2 cm×1 cm×1 cm小长方块,甘蓝清洗干净切成2 cm×3 cm小段,生姜切成厚薄均匀的薄片,鲜红小米辣均匀切段;玻璃坛子先用沸水烫洗2~3遍后用酒精棉擦洗备用;将所有原料加入坛中后加入15 mL菌悬液,混匀后坛沿加水密封,20 ℃恒温培养,以不加菌悬液的自然发酵泡菜作为对照组。
(3)取样:采用3轮发酵方式,0~5 d为第1轮发酵,第5天进行换菜;6~8 d为第2轮发酵,第8天进行换菜;9~11 d为第3轮发酵。即取0、1、2、3、4、5、6、8、9、11 d的泡菜水测定pH、总酸;取0、3、5、8、11 d泡菜水测定挥发性风味成分;取第5天的泡菜进行感官评价。
1.3.3 pH和总酸的测定
用pH计测定泡菜水pH;总酸的测定按照GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的pH计电位滴定法进行测定,pH 8.2为滴定终点,总酸含量以乳酸计。
1.3.4 泡菜挥发性风味物质分析
样品处理和检测条件[12]:取样液2 mL和5 μL内标(4-甲基-2-戊醇甲醇溶液,质量浓度为0.5 μg/mL)加入15 mL顶空进样瓶中,混匀密封置于40 ℃恒温槽中水浴加热平衡30 min,将老化后的固相微萃取(solid-phase microextraction,SPME)萃取头插入到顶空进样瓶中吸附30 min,于250 ℃条件下解析5 min,每个样品独立测定2次。GC条件:不分流进样模式;进样温度40 ℃;进样口温度250 ℃;总流量50 mL/min;载气He;载气流量1.2 mL/min。柱温40 ℃(0 min)以16 ℃/min到75 ℃(保持0 min),以2 ℃/min到94 ℃(保持1 min),以2 ℃/min到110 ℃(保持1 min),以3 ℃/min到122 ℃(保持1 min),以2 ℃/min到130 ℃(保持1 min),以2 ℃/min到136 ℃(保持1 min),以2 ℃/min到143 ℃(保持1 min),以6 ℃/min到200 ℃(保持5 min)。MS条件:电子离子源(EI),电子能量70 eV,离子源温度230 ℃;接口温度250 ℃;检测器电压0.1 kV;Scan采集方式,扫描质量范围m/z35.00~350.00 amu。
定性和定量分析:色谱峰对应的质谱与NIST17、FFNSC1.3谱库检索对比,保留匹配度>80%的鉴定结果,得到各挥发性风味物质。采用4-甲基-2-戊醇甲醇(0.5 μg/mL)为内标进行半定量分析,响应值都设为1,计算出各组分的质量浓度。
气味活度值(odor activity value,OAV)分析:查阅各挥发性风味物质的阈值,以OAV表示每种香气物质的浓度与其阈值的比值来评估该物质对样本整体风味的贡献程度,OAV>1作为重要香气成分。
1.3.5 感官评价
邀请6名有品评经验的人员对泡菜样品进行感官评定。分别从色泽、酸味、脆度、香气、形态5个方面进行评价,分数为1~5分,即可忽略的、小、中、强和非常强。
1.4 数据处理
采用Excel 2019进行数据统计分析,Origin 2018软件进行绘制结果图,SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 不同单菌和多菌发酵泡菜
2.1.1 不同单菌和多菌对泡菜pH和总酸的影响
发酵过程中泡菜pH和总酸的变化情况如图1所示,单菌和多菌接种发酵对泡菜发酵速度具有显著的影响,尤其是在发酵初期。单菌发酵组如图1-a和图1-c所示,各组pH和总酸分别在发酵第1、2天和前3 d的差别较大,发酵至第2天时,接种肠膜明串珠菌pH下降至3.64,总酸为0.19 g/100 mL,而自然发酵pH和总酸分别为4.79、0.08 g/100 mL;3 d后各组之间差距减小,单菌接种发酵速度为肠膜明串珠菌>食窦魏斯氏菌>植物乳杆菌。混菌发酵组(图1-b、图1-d)对泡菜发酵速度也有一定影响,尤其是添加了肠膜明串珠菌的各个组合,其发酵速度显著快于其他组,发酵至第2天时,添加肠膜明串珠菌的组合pH均在3.7左右,总酸为0.16~0.18 g/100 mL,而L-W组pH为4.13,总酸为0.10 g/100 mL;3 d后各组别的pH差异较小,总酸则略有差异,尤其是前期发酵速度较快且以肠膜明串珠菌主导发酵的单菌和多菌发酵组,其整个发酵过程中的总酸显著高于其他组别,一直延续到发酵结束。

a-单菌pH值;b-多菌pH值;c-单菌总酸含量;d-多菌总酸含量图1 不同单菌和多菌对四川泡菜pH和总酸的影响Fig.1 Effects of different single-bacteria and multi-bacteria on pH and total acid of Sichuan pickles注:LP:植物乳杆菌;Leu.m:肠膜明串珠菌;WC:食窦魏斯氏菌;L-E:植物乳杆菌∶肠膜明串珠菌(体积比1∶1);E-W:肠膜明串珠菌∶食窦魏斯氏菌(体积比1∶1);L-W:植物乳杆菌∶食窦魏斯氏菌(体积比1∶1);L-E-W:植物乳杆菌∶肠膜明串珠菌∶食窦魏斯氏菌(体积比1∶1∶1)(下同)
接种发酵对发酵前期影响较大,单一菌株接种发酵显示接种肠膜明串珠菌、食窦魏斯氏菌可以显著加快发酵速度;混合接种发酵结果表明,与肠膜明串珠菌组合的各发酵组发酵速度较快。大量研究表明,肠膜明串珠菌、食窦魏斯氏菌是启动泡菜发酵的优势菌株,在接种发酵初期会迅速繁殖,改变泡菜酸性环境,显著加速泡菜的发酵速度[13-14]。泡菜的菌群结构复杂,在发酵过程中会逐步演变为群落结构较为单一的稳定体系,且蔬菜本身携带有大量乳酸菌,经过不断地群落演替和换菜,接菌对后期发酵已不起主导作用[15]。而发酵后期总酸存在差异,可能与肠膜明串珠菌具有高产酸能力,早期产生大量酸并不断积累,使发酵结束总酸含量不同有关[16]。
2.1.2 泡菜中挥发性风味成分
通过顶空固相微萃取-气相色谱-质谱联用(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析接种单菌和多菌泡菜多轮发酵过程中的挥发性风味物质,发酵0、3、5、8、11 d的泡菜液共检测到挥发性风味物质85种,包括醇类27种、醛酮类17种、酯类16种、酸类2种、烃类13种、含硫化合物2种、苯环类5种、其他化合物3种。如图2所示,随着发酵的进行,各组泡菜的风味成分更加丰富,酯类、含硫化合物、酸类等多种物质增加。
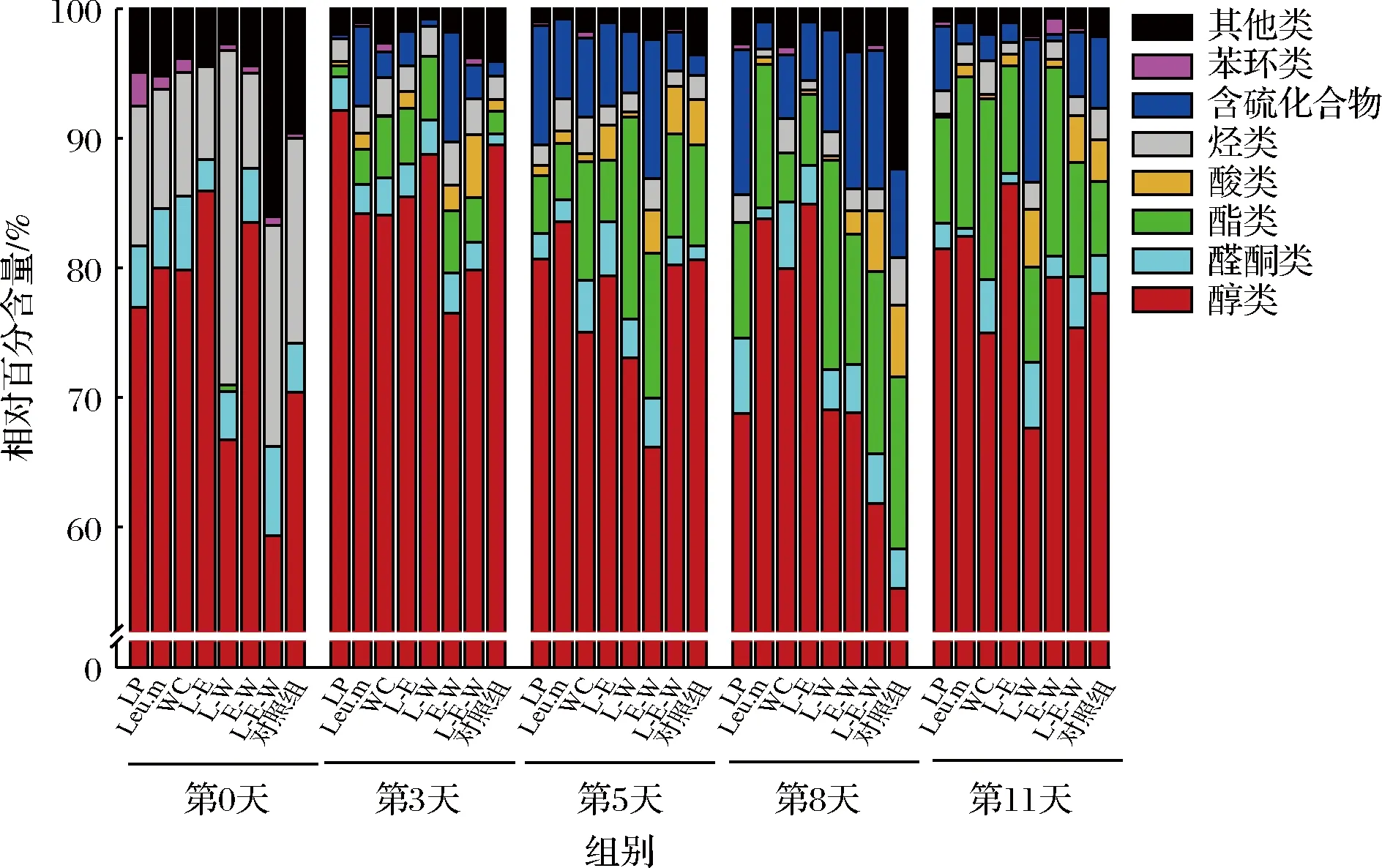
图2 不同单菌和多菌对四川泡菜挥发性成分的影响Fig.2 Effects of different single-bacteria and multi-bacteria on the volatile components of Sichuan pickles
所有组泡菜风味成分均以醇类为主,相对含量在55%以上;醇类物质对泡菜风味有重要作用,是酯化反应的重要前体物质,到发酵后期,乙醇、桉叶油醇、芳樟醇、4-萜品醇、α-松油醇等物质含量增加,并产生异戊醇、己醇、2-十一醇、6-甲基-5-庚烯-2-醇等,多种醇类物质赋予了泡菜愉快的香气。醛类物质阈值较低,可以赋予泡菜花香、果香,尤其是在第8、11天时,壬醛、正葵醛、甲基壬基甲酮、2-十三烷酮、乙偶姻等醛酮类物质含量较高。酯类是赋予泡菜风味的重要物质之一,在发酵中后期醇类与有机酸反应形成了丰富的酯类物质,其中异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、3-(甲硫基)丙基异硫氰酸酯、三芥子酸甘油脂等酯类含量较高,这些香气物质主要来源于是十字花科蔬菜,是十字花科蔬菜中大量存在的硫苷酶解产物,具有杀菌、抗癌等作用[17],其香气浓郁,使泡菜呈现辛辣风味,有研究表明异硫氰酸酯类是甘蓝泡菜的特征风味物质[18]。随着微生物的生长繁殖,酸类物质含量增加,不仅可增加泡菜的酸味,对酯类物质的生成也作出了一定的贡献。烃类物质包括烷烃和烯烃,其香气阈值较高,对泡菜的风味贡献不大。含硫化合物主要包括二甲基二硫醚和二甲基三硫,在第5、8天的泡菜中相对含量较高,发酵结束时由于微生物的作用部分发生降解,有研究表明含硫化合物是萝卜泡菜的重要风味物质[19]。苯环类物质主要以2,4-二叔丁基苯酚为主,发酵后期有少量的对乙基苯酚、1,3-二叔丁基苯等物质出现。此外,茴香脑、4-烯丙基苯甲醚等物质具有茴香香气,对泡菜的风味作出了一定的贡献。
泡菜中的香气不仅与其含量有关,与其阈值也有很大关系。采用OAV法确定第5、11天时对泡菜风味起重要贡献的风味成分,以OAV>1作为重要香气成分。由表1可知,共得到16种重要香气成分,且各组均以二甲基三硫、桉叶醇、芳樟醇3种成分贡献度最大,与第5天相比,第11天时新增加乙偶姻、乙酸苯乙酯两种成分,乙偶姻具有令人愉快的奶油香,乙酸苯乙酯则具有似玫瑰、蜂蜜香气。其中第5天时,二甲基三硫、桉叶醇、芳樟醇、α-松油醇物质在Leu.m组中贡献最大;正辛醛、壬醛、正葵醛在L-E组贡献最大。第11天时,二甲基三硫、二甲基二硫醚、乙偶姻、异硫氰酸烯丙酯、3-(甲硫基)丙基异硫氰酸酯、三芥子酸甘油酯均在L-W组贡献最大;其次,桉叶醇、芳樟醇、α-松油醇、乙酸苯乙酯在E-W组中贡献最大。此外,D-柠檬烯、大茴香脑其OAV值始终在对照组中较高。

表1 泡菜发酵第5、11天时的重要风味成分Table 1 Important flavor components of pickles fermentation at the 5th and 11th days
对各组发酵0、3、5、8、11 d泡菜的挥发性风味成分进行无监督的PCA,共得到3个主成分,R2X=0.846,Q2=0.617,二者均大于0.5,说明PCA效果较好。如图3所示,除个别样品外绝大部分样品均在置信区间内,不同的发酵时间以及不同的组别之间距离存在差异。第0天时,各组较为集中,且和其他发酵时间的样品能很好的区分开,表明随着发酵的进行,泡菜液中的挥发性成分发生了变化。第3、5天的样品距离较近,同一发酵时间里各组距离有差异,而第8、11天同一发酵时间各组更为分散,说明接菌发酵对多轮泡菜的挥发性风味成分具有较大的影响,同一组别在不同的发酵时间挥发性成分具有差异。发酵结束时,LP、L-W两组与CK组距离较近,说明该两组在风味上更加接近自然发酵泡菜,XIANG等[20]研究结果表明相对于单菌发酵,植物乳杆菌和食窦魏斯氏菌共接种可以提高四川泡菜挥发性风味物质的种类及含量,从而提高整体的感官接受度。

图3 不同单菌和多菌接种发酵四川泡菜挥发性成分PCAFig.3 PCA of volatile components in Sichuan pickles inoculated with different single-bacteria and multi-bacteria
2.1.3 感官评价
感官评价是判断泡菜品质的重要方法,发酵泡菜的感官评分结果如图4所示,不同的接种发酵泡菜的感官品质具有一定差异。各组泡菜在形态上差异不大,Leu.m、L-E两组泡菜颜色鲜艳,色泽较好,Leu.m和对照组表现出更强的酸味,而在脆度上对照组的泡菜表现最佳;在泡菜风味上,Leu.m组泡菜具有令人较为不愉悦的气味,普遍较难接受,且所有添加肠膜明串珠菌的组均有该令人不愉悦的气味,强烈程度不一;在所有接菌发酵组中,L-W组泡菜香气得分值最高,其风味更接近传统自然发酵泡菜,更受大家喜欢。

图4 感官评价结果Fig.4 Sensory evaluation results
综上所述,L-W组泡菜尤其在风味上与传统自然发酵泡菜相似,因此确定L-W组为最佳组。
2.2 不同比例植物乳杆菌和食窦魏斯氏菌对泡菜的影响
2.2.1 不同比例植物乳杆菌和食窦魏斯氏菌对泡菜pH和总酸的影响
前期试验中接种发酵3 d后各组差异较小,且泡菜基本成熟,因此采用发酵时间为3 d,观察不同比例的食窦魏斯氏菌和植物乳杆菌对泡菜pH和总酸的影响。如图5所示,各组泡菜的pH和总酸变化趋势基本一致。随着植物乳杆菌比例的增加,泡菜pH更低,总酸更高,当植物乳杆菌和食窦魏斯氏菌的体积比为6∶4、8∶2时,pH和总酸差异不大,因此确定植物乳杆菌和食窦魏斯氏菌体积比为6∶4较佳。

a-pH变化;b-总酸变化图5 不同比例植物乳杆菌与食窦魏斯氏菌发酵泡菜中pH和总酸的变化Fig.5 Changes of pH and total acid in pickles fermented with Lactobacillus plantarum and Weissella cibaria with different proportions
2.2.2 感官评价
不同比例植物乳杆菌和食窦魏斯氏菌发酵泡菜的感官评价结果如图6所示,所有组泡菜在形态和脆度上差异较小。接种较高比例植物乳杆菌发酵泡菜,其色泽更佳,酸味表现更突出,泡菜风味较好。

图6 感官评价结果Fig.6 Sensory evaluation results
3 结论
本研究以植物乳杆菌、肠膜明串珠菌、食窦魏斯氏菌为出发菌株,研究不同单菌及多菌对泡菜pH、总酸、挥发性风味成分以及感官评价的影响。结果表明,接菌可以快速启动泡菜发酵,3种单菌产酸速度为肠膜明串珠菌>食窦魏斯氏菌>植物乳杆菌,且可以快速丰富泡菜的色泽,呈现为肠膜明串珠菌组>植物乳杆菌组>食窦魏斯氏菌组,泡菜质量更加稳定。通过GC-MS分析泡菜挥发性风味成分,结果显示到发酵结束时,7组发酵泡菜共检出挥发性风味物质包括醇类、醛酮类、酯类、酸类、烃类、含硫化合物、苯环类以及其他化合物共85种,其中以醇类为主;OAV分析共得到16种重要香气成分;PCA结果显示植物乳杆菌、植物乳杆菌-食窦魏斯氏菌2组泡菜风味更接近于自然发酵泡菜。而在感官评价中发现,接种肠膜明串珠菌的单菌组及其多菌组的泡菜,均产生令人不愉悦的气味,较难接受,其余组中以植物乳杆菌-食窦魏斯氏菌组泡菜最佳。当植物乳杆菌与食窦魏斯氏菌复配,且体积比为6∶4时,泡菜风味好,可接受度高。综上所述,发酵速度并不是判断接菌发酵泡菜品质的主要因素,合理的发酵速度和适宜的菌种组合才是关键,研究结果可作为一种发酵剂为进一步应用于多轮泡菜发酵奠定基础。
