重组地衣芽孢杆菌全细胞转化产(R)-柠苹酸的研究
2023-07-27沈佳颖李由然石贵阳
沈佳颖,李由然,石贵阳*
1(江南大学,粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
(R)-柠苹酸 (R-citramalate) 是一种五碳羟基二羧酸,广泛存在于某些细菌的代谢途径当中,例如,詹式甲烷球菌(Methanococcusjannaschii)[1]、硫还原地杆菌(Geobactersulfurreducens)、黄杆菌(Chlorobaculumtepidum)中异亮氨酸的生物合成途径;破伤风梭菌(Clostridiumtetanomorphum)中谷氨酸的厌氧代谢等,均涉及(R)-柠苹酸的合成[2-4]。(R)-柠苹酸是重要的多功能有机酸,其作为聚合物中间体甲基丙烯酸(methacrylic acid,MAA)的化学合成前体[5-7],不仅可以用于树脂生产工业[8-10],而且可以作为酸化剂、除皱剂在食品加工、美容、医疗等领域发挥重要作用[11-13]。因此,(R)-柠苹酸具有广阔的应用和市场前景。
柠苹酸的合成方法主要为化学法,以氰化氢和乙基乙酰酯为底物通过缩合反应合成[13]。但是,由于前体物质的毒性及其所带来的高成本等问题,难以满足可持续发展的需求,极大限制了该方法的应用。近些年来,随着合成生物学的发展,柠苹酸的生物合成已经成为了更具吸引力的替代方案:以丙酮酸和乙酰-CoA为前体物质,在柠苹酸合酶的催化下特异性缩合形成柠苹酸[14](图1)。PARIMI等[15]、WU等[16]在大肠杆菌(Escherichiacoli)中异源表达柠苹酸合酶——CimA3.7(该酶来源于詹式甲烷球菌[1],是由ATSUMI等[17]经过筛选和定向进化后得到的稳定性更高的酶),由此成功引入柠苹酸合成途径,得到高产柠苹酸的重组大肠杆菌菌株。该研究以葡萄糖为底物,最终在摇瓶发酵水平产生2.9 g/L柠苹酸[15]。虽然大肠杆菌遗传操作简单,但在工业化发酵过程中,其噬菌体侵染的问题仍缺乏有效的解决策略[18];再者,对于利用重组大肠杆菌生产柠苹酸的过程,由于大肠杆菌对底物葡萄糖的耐受性以及产物积累造成环境pH值降低而导致细胞生长代谢受损,不利于高浓度柠苹酸的积累[19-20]。地衣芽孢杆菌(Bacilluslicheniformis)属于厚壁菌门,可在酸性、高温、营养匮乏等不利的外界环境中以芽孢的形式存在,具有抗逆性强、酶系丰富等众多的优势,是理想的外源基因表达宿主[21],因此,有关地衣芽孢杆菌柠苹酸合成途径的构建及优化有很大的研究价值。

图1 地衣芽孢杆菌中柠苹酸合成途径Fig.1 Biosynthesis pathway of citramalate in Bacillus licheniformis注:cimA(柠苹酸合酶);gltA(柠檬酸合酶);PEP(磷酸烯醇式丙酮酸,phosphoenolpyruvate);TCA(三羧酸循环,tricarboxylic acid cycle)
目前,有关柠苹酸生物生产的研究主要集中于传统发酵法,尚未提出利用全细胞转化这一生产工艺进行产物合成。与发酵法相比,高菌体浓度(OD600值)条件下的全细胞转化法凭借着副产物少、产率高等众多优势被广泛应用。当菌体处于高密度的环境中时,生长受到限制从而更多的用于细胞转化;此外,全细胞转化过程中,完整的细胞体保护胞内酶不受外界条件的影响,比游离酶更稳定,从而使转化能够发生在高温、低pH等较恶劣的环境中。如通过高密度培养大肠杆菌表达4-羟基苯乙酸酯3-羟化酶并进行全细胞催化香豆酸高效生产咖啡酸,使得咖啡酸的最终产量可达到18.74 g/L[22];采用重组枯草芽孢杆菌(Bacillussubtilis)作为工程菌株全细胞转化生产N-乙酰神经氨酸可达到93.78 g/L[23]。研究表明微生物体内的乙酰-CoA作为柠檬酸与柠苹酸的前体,主要与草酰乙酸缩合形成柠檬酸进入三羧酸循环而用于细胞生长[16],使得柠苹酸合成的代谢流受到抑制。由此,首次提出重组地衣芽孢杆菌全细胞转化合成柠苹酸的研究,在限制生长的基础上有效减少三羧酸循环的代谢流以增加柠苹酸产量。
本研究首次以地衣芽孢杆菌作为底盘细胞,引入异源柠苹酸合酶搭建了柠苹酸合成途径,以葡萄糖为底物实现了柠苹酸的合成与积累,将地衣芽孢杆菌全细胞转化系统应用于柠苹酸的合成,通过优化重组菌株全细胞转化产柠苹酸的条件,以提高其产量及转化率。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中使用的菌株、质粒如表1所示。
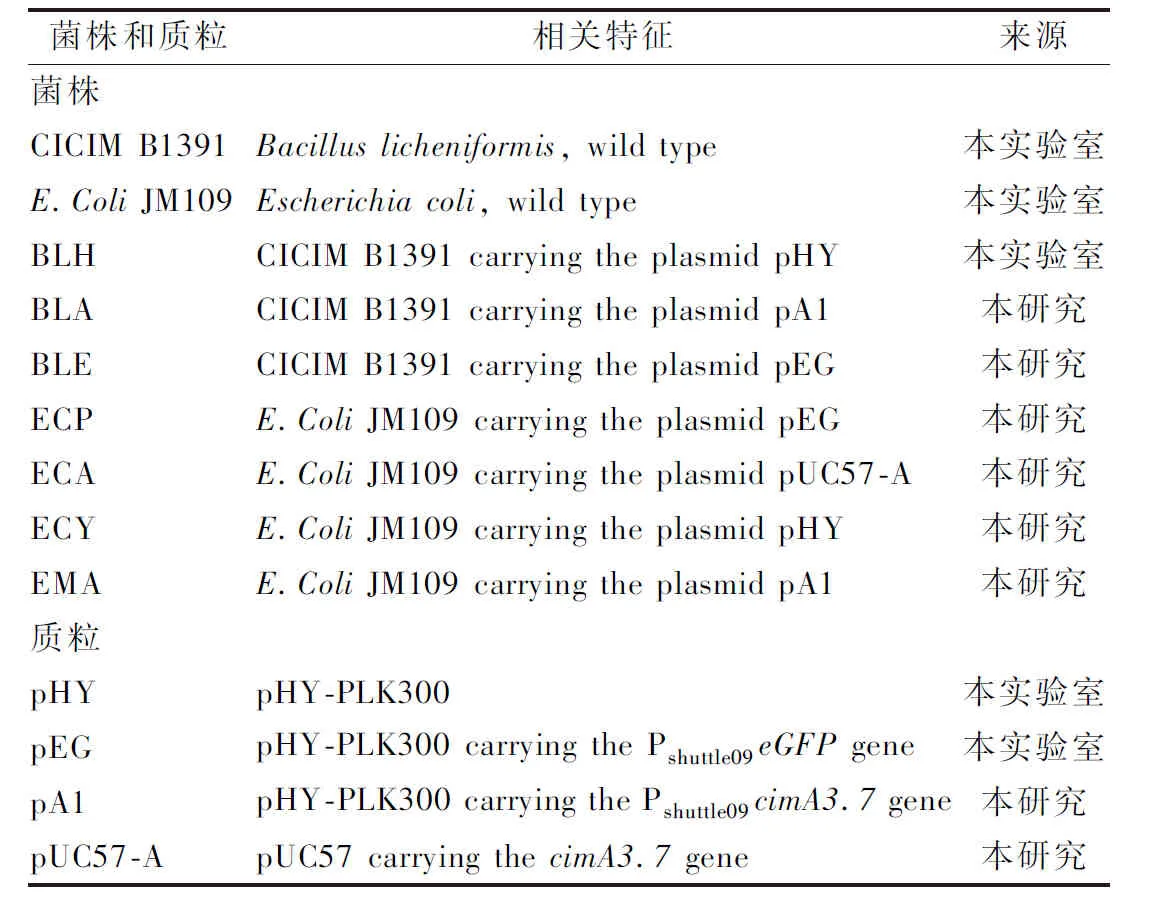
表1 本研究所用的菌株及质粒Table 1 Strains and plasmids used in this study
1.1.2 试剂与仪器
(R)-柠苹酸标准样品、氨苄青霉素、四环素,美国Sigma公司;2×Phanta Max Master Mix(Dye Plus)、DNA提取、纯化、凝胶回收试剂盒均,南京诺唯赞生物科技有限公司;2×Rapid Taq PCR Master Mix、T4 DNA连接酶、限制性核酸内切酶,美国Thermo Fisher公司;棉籽蛋白,北京鸿润宝顺科技有限公司。
HYL-C组合式摇床,太仓市实验设备厂;可见分光光度计,上海美谱达仪器有限公司;CF16RXⅡ型冷冻离心机,日本HITACHI公司;DYY-6C核酸电泳仪,北京六一厂;Sonics VCX-750型超声波细胞破碎仪,美国Sonics公司;DIONEX Ulitimate U3000液相色谱仪,美国赛默飞Thermo公司。
1.1.3 培养基与培养条件
(1)LB培养基(g/L):蛋白胨10、酵母粉5、NaCl 10(固体培养基加15 g/L的琼脂粉)。
(2)CMA发酵培养基(g/L):蛋白胨FP321 20、酵母粉FM408 10、葡萄糖100、玉米浆干粉5、K2HPO4·3H2O 9.12、KH2PO41.36、CaCl20.5、MgSO4·7H2O 0.5、(NH4)2HPO410[24]。
(3)CMB发酵培养基(g/L):蛋白胨FP321 20、酵母粉FM408 10、葡萄糖200、玉米浆干粉5、K2HPO4·3H2O 9.12、KH2PO41.36、CaCl20.5、MgSO4·7H2O 0.5、(NH4)2HPO410。
(4)CMC发酵培养基(g/L):蔗糖100、棉籽蛋白30、K2HPO4·3H2O 9.12、KH2PO41.36、(NH4)2HPO410(pH 7.5)[25]。
(5)TB转化培养基(g/L):蛋白胨12、酵母粉24、K2HPO412.54、KH2PO42.31、甘油5(pH 7.0)。
上述培养基所添加的氨苄青霉素或四环素的终质量浓度分别为100、20 μg/mL。
1.2 实验方法
1.2.1 重组质粒的构建
参照ATSUMI等[17]关于柠苹酸合酶基因(cimA)的突变结果,得到稳定性更好的柠苹酸合酶——CimA3.7,按照地衣芽孢杆菌密码子偏好性优化合成该基因,以其为模板,使用正向引物CimA-F和反向引物CimA-R进行PCR扩增,并纯化回收得到目的片段cimA3.7。以质粒pEG(本实验室保藏)为模板,使用正向引物pHY-S09-F和反向引物pHY-S09-R反向PCR扩增得到表达载体pHY-Pshuttle09。引物的两端均引入酶切位点XhoI和EcoR I,分别双酶切后使用T4连接酶将目的片段cimA3.7和表达载体pHY-Pshuttle09连接形成重组质粒PA1。连接产物转化E.coliJM109,挑测序正确的阳性转化子,提取质粒并电转于地衣芽孢杆菌细胞中,获得重组地衣芽孢杆菌BLA。所用引物序列如表2所示。

表2 本研究所涉及引物序列Table 2 Primer sequences involved in this study
1.2.2 重组地衣芽孢杆菌全细胞转化生产柠苹酸
1.2.2.1 全细胞催化剂的制备
种子活化:将在-70 ℃甘油管保藏的重组地衣芽孢杆菌BLA划线至带有四环素抗性的固体LB平板,37 ℃培养12~16 h。从平板上挑取单菌落,接种于装有15 mL LB培养基(含有终质量浓度为20 μg/mL的四环素)的锥形瓶中,置于37 ℃、250 r/min的摇床中培养24 h得到种子液。
摇瓶培养:种子液以10%的接种量转接于装液量为30 mL的不同发酵培养基中,37 ℃、250 r/min培养。每隔24 h取1 mL发酵液,记录菌株的光密度OD600值;将发酵液于12 000 r/min条件下离心20 min,上清液用于HPLC分析检测柠苹酸及样液中各组分含量。
菌体收集:将重组地衣芽孢杆菌置于筛选出的最优的发酵培养基中,37 ℃、250 r/min发酵培养48 h后进行9 000 r/min、4 ℃离心15 min弃去上清液,收集菌体。
1.2.2.2 全细胞转化
使用预冷的TB溶液洗涤菌体2次,然后将菌体重悬于TB溶液中以形成细胞悬浮液,使得菌体浓度OD600值为60,加入终质量浓度为100 g/L的葡萄糖以及20 μg/mL的四环素。全细胞转化反应体系25 mL在250 mL摇瓶中于37 ℃、250 r/min恒温摇床上反应24 h。
1.2.3 产物的检测与鉴定
将发酵液于12 000 r/min条件下离心20 min,取上清液加入等体积95%(体积分数)的乙醇溶液于4 ℃条件下沉淀蛋白8~12 h。离心后上清液经0.22 μm有机滤膜过滤。
HPLC检测条件如下:流动相为硫酸-水(0.05%,体积分数);洗脱方式为等度洗脱;流速0.8 mL/min;示差检测器;液相色谱柱为Dikma CarboPac H+(300 mm×8.0 mm,6 μm);柱温50 ℃;进样量10 μL。
1.2.4 全细胞转化条件的优化
以发酵48 h后的菌体作为全细胞催化剂,后加入终质量浓度为100 g/L的葡萄糖,于37 ℃、250 r/min反应24 h的基础上,分别考察菌体浓度(40~80)、摇床转速(150~270 r/min)、转化温度(30~50 ℃)、葡萄糖质量浓度(50~200 g/L)以及初始pH(4.5~8.5)和转化时间(24~132 h)对全细胞转化合成柠苹酸的影响。
2 结果与分析
2.1 柠苹酸合酶基因的克隆与表达
如图2-a所示,构建质粒pA1。首先以pEG重组质粒(本实验室)为模板,通过反向PCR扩增获得表达载体pHY-Pshuttle09;以pUC57-A重组质粒为模板进行PCR扩增,获得cimA3.7目的基因片段。
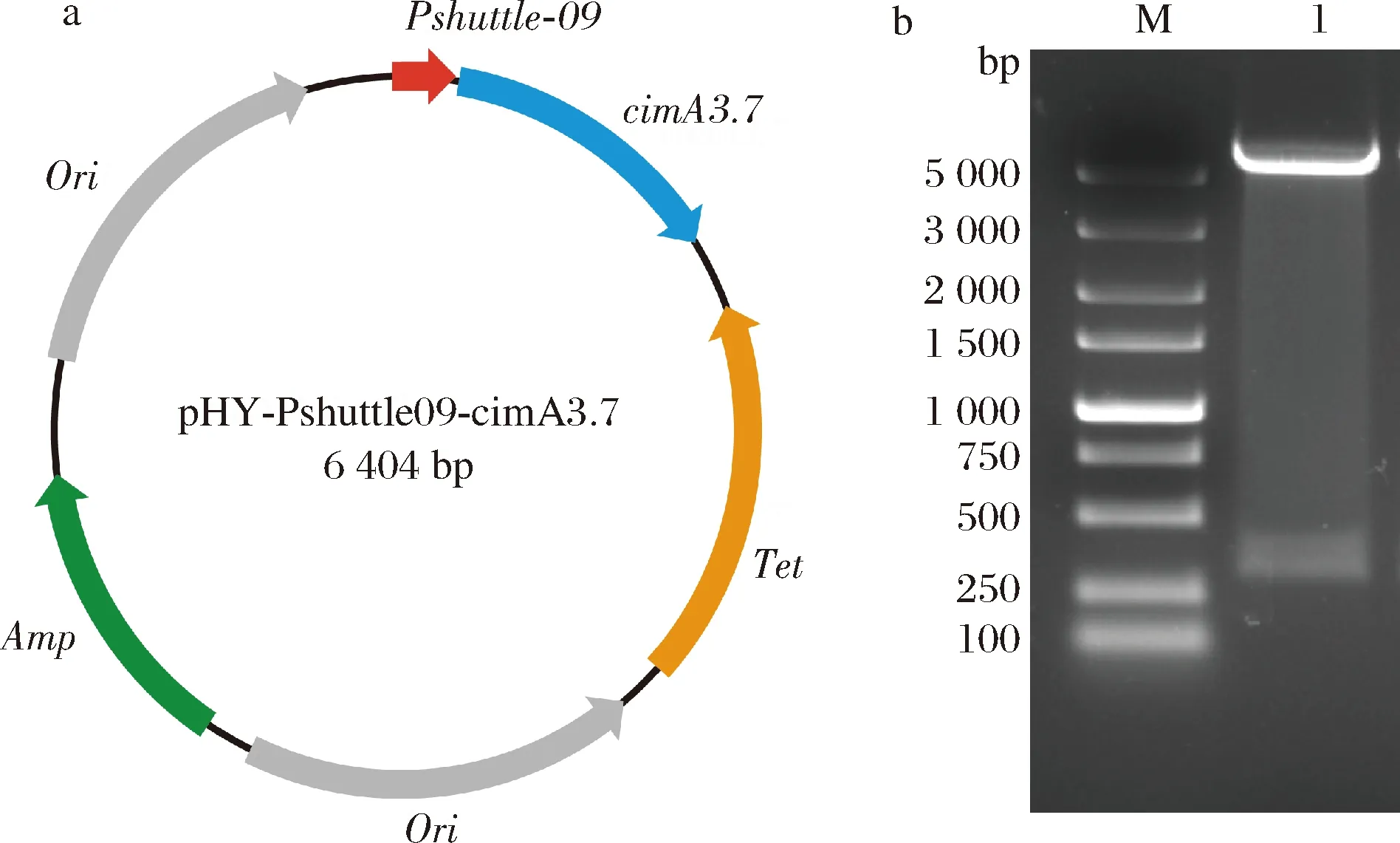
M-5000 Marker;1-重组质粒pA1a-质粒pA1图谱;b-重组质粒酶切鉴定图2 质粒pA1图谱及酶切鉴定电泳结果Fig.2 Construction map of plasmid pA1 and result for agarose gel electrophoresis of recombination vector
将表达载体pHY-Pshuttle09以及目的片段cimA3.7分别使用XhoI和EcoR I双酶切,按照1.2.1的方法构建了重组质粒pA1。将重组质粒用XhoI和EcoR I双酶切,酶切后理论条带大小是275 bp和5 152 bp,结果如图2-b所示,电泳条带大小与理论值一致,表明重组质粒构建成功。
2.2 重组地衣芽孢杆菌全细胞催化剂的制备
2.2.1 发酵培养基的选择
全细胞转化实质上就是利用菌体内的酶作为催化剂,将底物转化成产物的过程,所以通过发酵培养以获取具有高密度、高催化活性的细胞是制备全细胞催化剂的关键因素。适宜的发酵培养基对微生物的生长代谢、酶的表达以及产物产出均会产生较大影响。分别选择CMA、CMB、CMC 3种不同发酵培养基对重组地衣芽孢杆菌进行发酵,探究其对菌体生长及柠苹酸产出的影响,实验结果如图3所示,经过168 h的发酵,使用CMB培养基与CMC培养基产生的柠苹酸要明显多于CMA培养基,且当发酵培养基为CMC时,菌体生长状况最好,最终菌体浓度OD600值达到29.13,柠苹酸产量可达1.94 g/L,说明柠苹酸合酶在该条件下能更好地表达。根据陆一鸣等[25]研究,分析其原因是培养基中碳源及氮源对重组菌产生的影响:CMA、CMB培养基均以葡萄糖为碳源,葡萄糖的快速利用使得发酵后期缺乏足够碳源维持菌体生长;而CMC培养基以蔗糖作为唯一碳源,其作为二糖在发酵后期可以继续为重组菌的生长提供碳源,更有利于菌体生长。除此之外,CMC发酵培养基使用棉籽蛋白作为氮源,蛋白质含量高且含有维生素、游离氨基酸等营养成分,十分适合芽孢杆菌中酶的表达。因此,最终选择CMC培养基作为发酵培养基来制备全细胞催化剂。
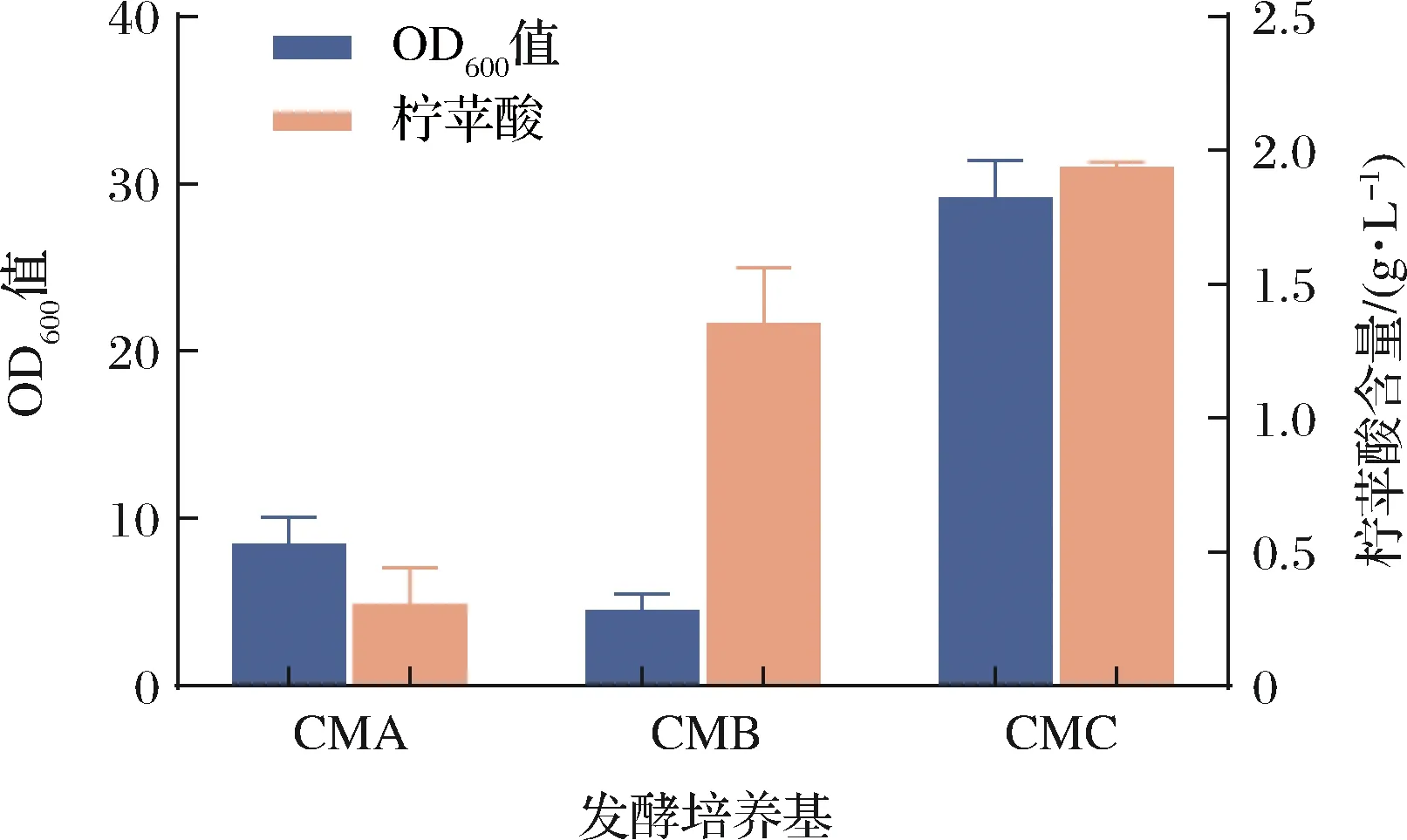
图3 发酵培养基的选择Fig.3 Selection of fermentation medium
2.2.2 产物的检测与鉴定
将发酵后的样品根据1.2.3所示的方法检测产物的出峰,液相结果如图4所示,在9.50 min葡萄糖被洗脱下来,在10.29 min产物被洗脱下来,且产物与葡萄糖、柠苹酸标准样品的出峰时间一致(图4-a),由此判断该产物为柠苹酸,进一步验证了重组地衣芽孢杆菌具有合成柠苹酸的潜力。

a-葡萄糖、(R)-柠苹酸混合标准样品液相色谱图;b-样品液相色谱图图4 标准样品(葡萄糖、R-柠苹酸)和样品的液相色谱图Fig.4 Liquid chromatogram of standard (glucose、R-citramalate) and sample
2.2.3 重组地衣芽孢杆菌的发酵
选择CMC发酵培养基进行重组地衣芽孢杆菌的发酵,结果如图5所示,对于重组菌BLA,0~6 h为其生长对数期,菌体浓度迅速增加,24 h后开始逐渐进入稳定期,随着发酵时间不断延长,菌体量OD600值均呈现持续增长的趋势。结合发酵过程中柠苹酸生成的曲线可得,发酵36~48 h正处于菌体生长的稳定期,且该阶段柠苹酸生成的速率最快,可能是因为此阶段菌体生物活性特征最好,综合考虑柠苹酸产量以及时间成本的问题,初步选择发酵48 h后的菌体作为全细胞催化剂。
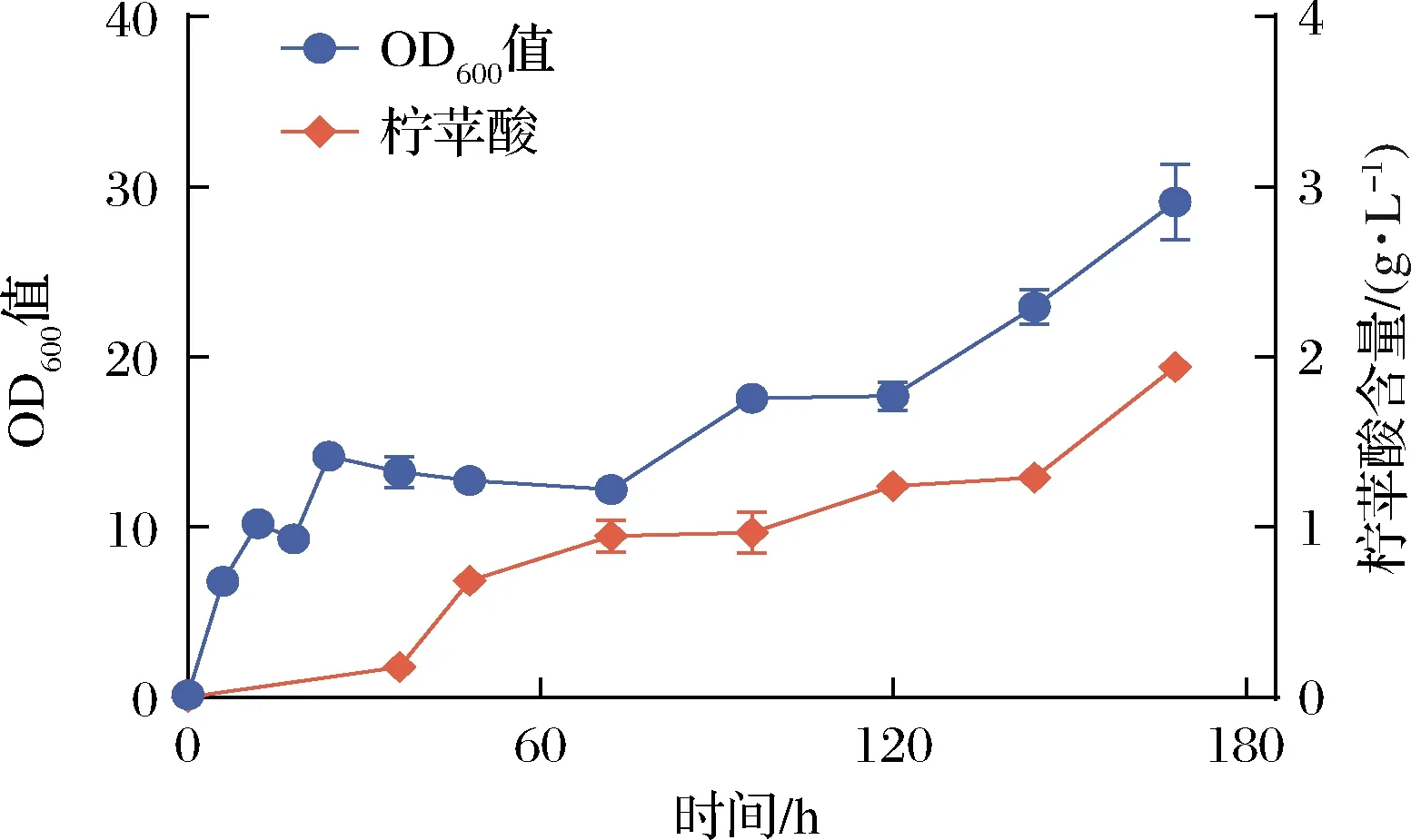
图5 重组地衣芽孢杆菌BLA发酵过程分析Fig.5 Analysis of the fermentation process of recombinant Bacillus licheniformis BLA
2.3 重组地衣芽孢杆菌全细胞转化产柠苹酸条件优化
2.3.1 菌体浓度对柠苹酸产量的影响
全细胞转化过程实质上是胞内酶的催化过程,不同的菌体浓度(OD600值)代表不同的添加酶量。在初始条件的基础上,考察OD600值对全细胞转化合成柠苹酸的影响,结果如图6-a所示,当OD600值为70时,柠苹酸的产量及转化率最高,可能是因为当菌体浓度过低时,产生的酶量难以满足细胞转化所需,造成柠苹酸产量低;当菌体浓度过高时,溶氧等因素受到了一定的限制,不利于产物的合成。所以OD600值为70是最适合柠苹酸合成的条件。
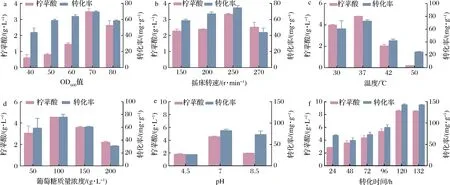
a-菌体浓度;b-摇床转速;c-温度;d-葡萄糖质量浓度;e-pH;f-转化时间图6 不同条件对柠苹酸产量及转化率的影响Fig.6 Effects of different conditions on yield and conversion rate of citramalate
2.3.2 摇床转速对柠苹酸产量的影响
为探究溶氧对全细胞转化合成柠苹酸的影响,通过控制摇床转速来调节不同溶氧的供应。转速较慢时,发酵液中的溶氧量少,无法满足细胞转化所需;当转速过快的时候,可能会使菌体损伤大,影响酶的表达和柠苹酸的合成[26]。结果如图6-b所示,随着转速的升高,柠苹酸的产量及转化率逐渐升高,到250 r/min时柠苹酸产量达到最大,为3.35 g/L,转化率为76.60 mg/g葡萄糖,之后过高的转速不仅造成菌体损伤严重,而且主要副产物2,3-丁二醇的量也急剧增多,导致柠苹酸的产量及转化率下降。
2.3.3 转化温度对柠苹酸产量的影响
转化温度关系着酶活性的高低,同时温度成本的控制也是实现产物工业化的重要因素。通过选择不同的温度进行全细胞转化产柠苹酸的验证,如图6-c所示,随着转化温度的升高,柠苹酸的产量随之升高,在37 ℃达到最高为4.78 g/L,转化率为74.13 mg/g葡萄糖,之后产量逐渐降低。可能是因为在37 ℃时,柠苹酸合酶的活性以及稳定性相对较高,因此选择37 ℃为最适转化温度。
2.3.4 葡萄糖浓度对柠苹酸产量的影响
柠苹酸产生的直接前体物质是丙酮酸和乙酰-CoA,但考虑到成本问题,选择更加经济适用的间接前体物质葡萄糖作为全细胞转化生产柠苹酸的底物。本实验考察了50、100、150、200 g/L葡萄糖对柠苹酸产量的影响。如图6-d所示,当葡萄糖浓度过高或过低时,均不利于柠苹酸的产生,可能的原因是较少底物的添加不足以形成更多的产物,而过高浓度的葡萄糖可能会对菌体本身的代谢产生一定的抑制作用,不利于柠苹酸的合成。当葡萄糖质量浓度为100 g/L时,柠苹酸的产量最高,为4.55 g/L,转化率为78.85 mg/g葡萄糖,此浓度的葡萄糖在足够维持菌体代谢循环的基础上又不造成原料的浪费。因此本研究最终选择100 g/L的葡萄糖作为最佳反应条件。
2.3.5 初始pH对柠苹酸产量的影响
控制转化时的pH环境关系着胞内酶的活性及稳定性的高低,不同的pH会改变细胞的代谢通路以及细胞膜的通透性,从而影响菌体生长和产物合成[26]。因此针对全细胞转化初始时的pH进行优化以确定最适pH。结果如图6-e所示,最佳初始pH值为7.0,此时柠苹酸产量为4.62 g/L,转化率达到79.81 mg/g葡萄糖。可能因为此pH条件最适合柠苹酸合酶的表达。
2.3.6 转化时间对柠苹酸产量的影响
转化时间对柠苹酸合成的影响十分显著,随着转化时间的延长,菌体所处的环境及其本身的状态均会发生变化,因此,本实验考察了转化时间为24、48、72、96、120、132 h对柠苹酸产量的影响。如图6-f所示,转化120 h后柠苹酸产量达到8.57 g/L,转化率为142.84 mg/g葡萄糖,继续延长发酵时间,柠苹酸产量不再增加,考虑到时间成本的问题,确定最优的转化时间为120 h。
3 结论与讨论
本研究首次以地衣芽孢杆菌作为底盘细胞构建了柠苹酸生产途径,通过优化培养条件,实现了柠苹酸合酶在重组地衣芽孢杆菌胞内的高效表达,并将重组菌用作全细胞生物催化剂合成柠苹酸,利用优化后的全细胞转化条件,采用CMC培养基制备全细胞催化剂,在37 ℃、pH 7.0、底物质量浓度为100 g/L、菌体浓度OD600值为70、摇床转速为250 r/min 进行全细胞转化120 h后,生成柠苹酸8.57 g/L,转化率为142.84 mg/g葡萄糖,这是目前报道的摇瓶水平细胞转化合成柠苹酸的最高产量,且没有额外添加中和剂来维持细胞生长,进一步证明了地衣芽孢杆菌凭借其高耐受性更有利于产物的合成,为生物法生产柠苹酸的研究奠定了基础。
由于柠苹酸前体物质的特殊性,在接下来的研究中,以柠苹酸的产量为指标,通过代谢调控其前体物质丙酮酸和乙酰-CoA,确定影响柠苹酸合成的限速步骤,进一步平衡二者的供应、细胞生长和产物合成,从而构建高产柠苹酸的菌株,同时也为其他与该途径相关物质的形成提供研究依据。
