宫颈癌组织ERCC1、hMSH2表达及病理特征与铂类药物抵抗的相关性研究
2023-07-25吴培培施朕善李东鹏马家芹翟璠
吴培培,施朕善,李东鹏,马家芹,翟璠
(1.安徽医科大学附属亳州医院妇科,安徽 亳州 236800;2.安徽医科大学附属亳州医院肿瘤科,安徽 亳州 236800;3.安徽医科大学附属亳州医院病理科,安徽 亳州 236800)
宫颈癌为女性常见恶性肿瘤,发病率、死亡率较高,是造成女性死亡的主要恶性肿瘤[1]。宫颈癌发病隐匿,多数患者初次确诊已进展为中晚期,丧失手术治疗时机,只能采用保守治疗方式延长患者生存时间[2]。以顺铂为基础的同步放化疗为中晚期宫颈癌主要治疗方式,能有效降低局部复发及远处转移率,延长患者生存时间[3]。但研究表明铂类药物同期放化疗治疗效果存在明显个体差异,部分宫颈癌患者在承受药物毒副作用、经济负担的同时,却无法获取良好的治疗效果[4]。因此,能否通过相关检测筛查出能在同步放化疗中收益的患者,对于宫颈癌患者个体化治疗具有重要意义。铂类药物可与癌细胞内DNA发生交联,引发DNA单链损伤,发挥抗肿瘤效果,而DNA修复是影响宫颈癌患者铂类药物耐药的主要机制[5]。核苷酸切除修复交叉互补基因1(ERCC1)属修复家族重要成员,在DNA修复中具有重要作用[6]。而错配修复基因2(hMSH2)能识别复制中错配碱基及插入缺失环,是完成DNA修复的必需组件[7]。以上两种基因均与DNA修复有关,在DNA修复中具有重要作用,由此推测是否可通过分析ERCC1、hMSH2表达情况来预测宫颈癌患者铂类药物反应性。基于此,本研究尝试探究宫颈癌组织ERCC1、hMSH2表达与病理特征及铂类药物抵抗的相关性。报道如下。
1 资料和方法
1.1 一般资料 本研究经我院医学伦理委员会审核通过。收集2019年1月—2022年3月我院86例宫颈癌患者病理组织为观察组。纳入标准:均经病理检查确诊为宫颈癌;均为中晚期,无法实施手术治疗;病例资料及随访资料完整。排除标准:合并其他恶性肿瘤;远处转移;急慢性炎症;合并心、肝、肾等重要脏器严重病变;血液性疾病;严重感染性疾病或免疫性疾病;精神异常、认知障碍。另收集同期72例因子宫肌瘤手术切除的正常宫颈组织为对照组。
1.2 方法 ①病理特征收集:通过查阅电子病历获取患者病理特征信息,包括年龄、分化程度、肿瘤直径、肌层浸润深度、组织类型、分期、淋巴结转移等;②ERCC1、hMSH2检测:与病理医生共同,将获取的组织经福尔马林固定,石蜡包埋,连续切片,高温抗原修复15 min,磷酸缓冲盐溶液(PBS)冲洗3次,每次5 min,二甲苯脱蜡,孵育10 min(0.3%过氧化氢),灭活内源性过氧化物酶;PBS冲洗3次,每次5 min,山羊血清封闭,室温下孵育30 min,分别滴加一抗鼠抗人hMSH2抗体、ERCC1抗体(美国Pharmingen公司),过夜孵育(4 ℃),加入相应二抗,孵育2 h(室温),显色、复染、脱水封片。结果判定:阳性细胞数≤5%、6%~25%、26%~50%、51%~75%、>75%(分组区间数值有问题)分别计0分、1分、2分、3分、4分;不着色、颜色浅、颜色深分别为0分、1分、2分;二者乘积为最终判定结果,其中0~3为阴性,3~8为阳性;③治疗方案:所有患者均予以放疗,即以15MV-X进行盆腔前后野照射,全盆腔照射剂量为1.8~2.0 Gy/次,5次/周,总量DT 45~50 Gy,在照射25~30 Gy后中间挡铅;然后进行腔内后装治疗,后装当天不进行盆腔照射,后装治疗6 Gy/次,1次/周,A点剂量30 Gy/5次。与放疗第1天开始单药使用奈达铂进行化疗增敏,每次40 mg·m-2,1次/周,共使用6次。在放化疗结束后进行疗效评估,以实体瘤疗效评价标准[8]评估,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),其中CR、PR为铂类药物敏感,SD、PD为抵抗。
1.3 观察指标 ①比较2组ERCC1、hMSH2表达情况;②癌组织ERCC1、hMSH2表达与病理特征相关性;③铂类药物抵抗患者病理特征及ERCC1、hMSH2表达情况;④影响宫颈癌患者铂类药物抵抗的多因素分析;⑤ERCC1、hMSH2表达对铂类药物抵抗的预测价值。
1.4 统计学方法 采用统计学软件SPSS 25.0处理数据,计数资料以例数描述,采用χ2检验,影响因素采用Logistic回归分析,预测价值采用受试者工作特征(receiver operating characteristic curve,ROC)曲线,获取AUC、置信区间、敏感度、特异度,联合预测实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。均采用双侧检验,α=0.05。
2 结果
2.1 宫颈癌组织、正常组织ERCC1、hMSH2表达情况 观察组ERCC1、hMSH2阳性率较对照组高(P<0.05),结果见表1。

表1 宫颈癌组织、正常组织ERCC1、hMSH2表达情况[n(%)]
2.2 癌组织ERCC1、hMSH2表达与病理特征相关性 癌组织ERCC1、hMSH2表达与年龄、肿瘤直径、分化程度、病理类型无关(P>0.05),与肌层浸润深度、分期、淋巴结转移有关(P<0.05),结果见表2。
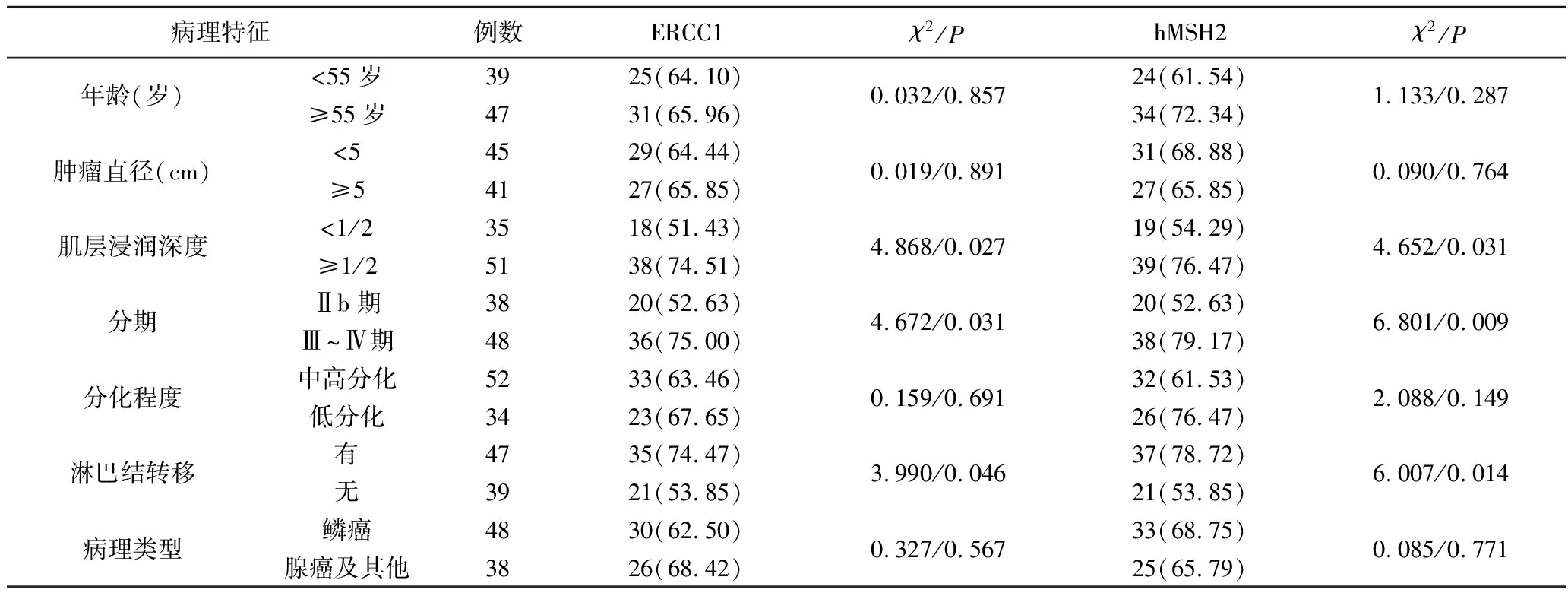
表2 癌组织ERCC1、hMSH2表达与病理特征相关性
2.3 铂类药物抵抗患者病理特征及ERCC1、hMSH2表达情况 所有患者在经治疗后47例铂类药物敏感(9例CR、38例PR),39例铂类药物抵抗(25例SD、14例PD),铂类药物抵抗患者与肌层浸润深度、分期、分化程度、淋巴结转移、ERCC1、hMSH2阳性有关(P<0.05),结果见表3。

表3 不同铂类药物反应性患者病理特征及ERCC1、hMSH2表达情况
2.4 影响宫颈癌患者铂类药物敏感的多因素分析 以宫颈癌患者经铂类药物治疗后反应性作为因变量(敏感=0,抵抗=1),以单因素分析中有差异的变量作为自变量,应用多因素Logistic回归方程分析,结果显示,将肌层浸润深度、分期、分化程度、淋巴结转移控制后,癌组织ERCC1、hMSH2阳性仍为宫颈癌患者铂类药物抵抗的危险因素(P<0.05),结果见表4。

表4 影响宫颈癌患者铂类药物敏感的多因素分析
2.5 ERCC1、hMSH2表达对铂类药物敏感的预测价值 以宫颈癌患者经铂类药物治疗后抵抗为阳性样本,以敏感为阴性样本,绘制ERCC1、hMSH2阳性预测经铂类药物治疗后抵抗的ROC,结果显示,ERCC1阳性、hMSH2阳性预测经铂类药物治疗后抵抗的AUC分别为0.631、0.634;应用SPSS软件的联合应用ROC理论模式,构建各指标联合预测的ROC模型,结果显示,联合预测AUC最大,为0.702,见表5、图1。

图1 ERCC1、hMSH2阳性预测铂类药物抵抗的ROC曲线
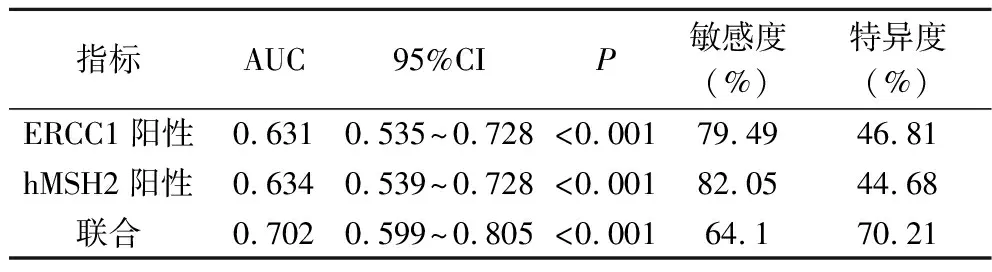
表5 ERCC1、hMSH2表达对铂类药物敏感的预测价值
3 讨论
3.1 完善宫颈癌患者诊疗机制可提高患者生存率 早期宫颈癌患者通过手术切除病灶可达到根治效果,而对于无法进行手术治疗的患者则需要采用放疗或化疗方式延长患者生存时间[9]。既往研究指出,对于进行放疗的宫颈癌患者,建议同步接收顺铂实施化疗,可使患者明显受益,但顺铂的毒副反应导致部分患者无法耐受,从而无法顺利完成治疗[10]。而奈达铂作为第二代铂类药物,其机制与顺铂相同,但毒副作用小,与顺铂具有同样的疗效。因此本研究选用奈达铂为化疗药物。但即便如此,仍有部分患者对化疗不敏感,具体表现为PD、SD明显延长。因此探究宫颈癌患者铂类药物抵抗的原因对完善该病诊疗机制、提高患者生存率十分重要。
3.2 DNA损伤修复与铂类药物抵抗的相关性分析 研究指出,药物疗效存在个体差异在临床十分常见,临床医师也一直关注这一问题,随着分子遗传学、分子药理学发展,越来越多的学者认为这一差异源于基因的差异[11]。一般来说宫颈癌患者发生铂类药物抵抗为继发性耐药,即随药物服用次数增加,导致药物脱敏,对药物呈现低敏感性,从而导致治疗效果较差[12]。我们分析铂类药物的作用机制发现,奈达铂主要作用靶点为DNA,进入机体后可水解为双氯双氨铂,与肿瘤细胞DNA形成奈达铂-DNA加合物,从而使DNA复制、转录受到影响,导致DNA损伤,但临床中发现,不同患者对DNA损伤程度不同,这也是出现个体疗效差异的重要原因[13]。研究指出,癌症患者采用铂类药物后出现DNA损伤程度不同的原因在于机体存在可使受损DNA恢复正常的有效修复系统,因此DNA损伤修复可能是铂类药物抵抗的重要原因[14]。ERCC1基因为DNA损伤、识别、修复重要组成部分,核苷酸切除修复为其减轻DNA损伤的主要机制,ERCC1表达量直接影响DNA修复的生理过程[15]。目前已有研究证实,ERCC1与多种癌症的发生有关,与病理特征具有明显相关性,其中发现宫颈癌组织中ERCC1表达与淋巴结转移和患者临床分期有关,说明ERCC1高表达的宫颈癌细胞浸润性更强,恶性程度更高,可能在宫颈癌发生发展中发挥作用[16]。本研究结果显示宫颈癌组织ERCC1呈高表达状态,与肌层浸润深度、分期、淋巴结转移有关,与上述研究类似,说明ERCC1在宫颈癌的发生、发展中具有重要作用。此外,本研究通过分析不同铂类药物反应性患者ERCC1表达发现,铂类药物抵抗患者ERCC1阳性率较高,且ERCC1阳性为宫颈癌患者铂类药物抵抗的危险因素。分析原因在于DNA损伤修复为影响铂类药物敏感性的重要原因,而核苷酸切除修复时DNA损伤修复系统中的重要组成,ERCC1在核苷酸切除修复中具有关键作用,ERCC1可将距损伤位点15~24个核苷酸处将DNA单链切开,这一表达产物可结合DNA修复酶缺乏互补基因,形成异二聚体,参与核苷酸切除修复中的调节或限速,从而导致肿瘤细胞DNA损伤减轻,发生药物抵抗[17-18]。
3.3 ERCC1、hMSH2预测宫颈癌患者铂类药物反应性的价值 研究指出,基因不稳定性是导致癌症发生的重要原因,错配修复(MMP)系统为遗传不稳定性的守护者,可特异性识别、修复DNA复制过程中碱基错配,维持基因组稳定性,降低自发性突变过程,hMSH2为错配修复过程必须参与基因,能识别复制中错配碱基,是完成修复必须组成[19]。陶萍萍等[20]研究指出,hMSH2蛋白在宫颈癌患者中呈高表达状态,其在宫颈癌的发生、发展中具有重要作用,同时hMSH2高表达与患者临床分期、淋巴结转移、肿瘤浸润深度有关,原因可能是在DNA复制过程中,hMSH2功能缺陷,不能及时修复DNA复制时的碱基错配,使突变的癌基因和抑癌基因得不到有效修复,基因突变累积,错配修复系统启动,反馈性诱发hMSH2蛋白表达增加。本研究同样发现宫颈癌组织hMSH2呈高表达状态,与肌层浸润深度、分期、淋巴结转移有关,说明hMSH2可能参与了宫颈癌的发生、发展。正常生理状态下DNA修复处于休眠状态,当细胞DNA受损时,修复基因被激活,从而发挥修复功能,而肿瘤细胞属于异己突变细胞,在这一状态下,细胞修复系统可能被激活,从而出现hMSH2表达增多现象[21]。本研究还发现,铂类药物抵抗患者hMSH2阳性率较高,且hMSH2阳性为宫颈癌患者铂类药物抵抗的危险因素。这可能是由于肿瘤细胞DNA损伤时,为修复这一损伤,使细胞修复系统被激活,hMSH2表达明显增加,且其表达水平越高,导致机体对铂类药物的耐药性越大[22]。结合以上ERCC1、hMSH2与宫颈癌组织中的生物学特征及与铂类药物抵抗的关系,推测ERCC1、hMSH2或许可用于预测宫颈癌患者铂类药物反应性。本研究通过绘制ERCC1、hMSH2阳性预测宫颈癌患者铂类药物抵抗的ROC曲线发现,ERCC1、hMSH2阳性预测铂类药物抵抗的AUC分别为0.631、0.634,且联合预测预后的AUC为0.702,大于单一指标预测。可见将ERCC1、hMSH2联合用于预测宫颈癌患者铂类药物抵抗可提升预测评估价值,对治疗方案的完善具有重要意义。
综上所述,宫颈癌组织ERCC1、hMSH2呈高表达状态,且与病理特征及铂类药物抵抗有关,二者可用于预测铂类药物反应性,从而指导临床干预方案。
