淫羊藿激活CREB/BDNF信号通路改善APP/PS1双转基因小鼠的认知功能
2023-07-25崔琳肖洪贺李贺田雨田晋明赵宇萌杨静娴
崔琳,肖洪贺,李贺,田雨,田晋明,赵宇萌,杨静娴
(辽宁中医药大学药学院,辽宁 大连 116000)
阿尔茨海默病(Alzheimer′s disease,AD)是一种由多因素引起的,最常见的中枢神经退行性疾病,以记忆力减退和认知障碍为主要表现。随着当今社会人口结构的不断变化,老龄化人口不断增加,该病的发病率逐年增加,给人类带来了沉重的经济及社会负担[1-2]。迄今为止,该病的发病机制并不十分明确,普遍认为tua蛋白过度磷酸化形成神经纤维缠结(NFT)、β-淀粉样蛋白沉积形成老年斑和突触丢失是其主要病理特征。目前,国内外现有药物只能部分缓解AD早期症状,无法阻止或逆转AD病情进展。因此,我们需要在更广阔的领域寻找并开发能够修复、替代受损神经元的药物,对治疗AD等神经退变性疾病具有重要的社会意义和经济价值[3-4]。
淫羊藿(EpimediumbrevicornuMaxim.)属小檗科草本植物,又名仙灵脾,始载于《神农本草经》,性温,味辛、甘,归肝、肾经,具有神经保护、补肾壮阳、祛风除湿、强筋骨等功效[5-6]。近年研究发现,传统医学中补肾益精的中药如淫羊藿、人参、独活等,能够抑制Aβ沉积,促进神经再生,发挥神经保护作用[7-9]。大量研究证实,淫羊藿及其活性成分具有广泛的神经保护作用[10],但是否能通过激活环磷酸腺苷效应元件结合蛋白/脑源性神经营养因子(CREB/BDNF)信号通路来改善APP/PS1双转基因小鼠的认知功能尚未见报道。本研究拟采用筑巢试验和Morris水迷宫试验探究淫羊藿能否改善APP/PS1双转基因小鼠的认知功能,然后采用H&E染色、Nissl染色、免疫荧光等方法评价其作用途径,最后采用Western bot方法检测CREB/BDNF信号通路关键蛋白表达情况,明确淫羊藿的作用机制,以期为淫羊藿用于治疗AD提供进一步的科学依据。
1 材料
1.1 主要仪器 MS-1型水迷宫分析系统(成都仪器厂);Ti-S型荧光倒置显微镜(日本Nikon公司);HM525NX型冷冻切片机(赛默飞世尔仪器有限公司);DW-86L386型超低温冰箱(青岛海尔公司);PowerPac Universal Power Supply型通用电泳仪(美国Bio-Rad公司);Trans-Blot SD型半干式蛋白转膜仪(美国Bio-Rad公司);Tanon-5200Multi凝胶成像系统(上海天能科技有限公司)。
1.2 主要药品与试剂 淫羊藿(阳光大药房);Nissl染色试剂盒、苏木素伊红染色试剂盒(碧云天生物技术有限公司,批号分别为C0117、C0105S);兔抗Aβ多克隆抗体(Signalway Antibody,批号:#40587);兔抗BDNF多克隆抗体、兔抗GAPDH多克隆抗体(万类生物科技有限公司,批号分别为WL0999、WL01114);FITC标记山羊抗兔IgG、兔抗CREB多克隆抗体、兔抗磷酸化CREB(p-CREB)多克隆抗体(北京博奥森生物技术有限公司,批号分别为bs-0295G、bs-0035R、bs-0036R);辣根过氧化物酶标记的山羊抗兔IgG二抗(武汉赛维尔生物科技有限公司,批号:GB23303)。
1.3 动物 3月龄SPF级APP/PS1小鼠(雄性)[合格证号:SCXK(苏)2020-0009,江苏华创信诺医药科技有限公司];SPF级C57BL/6小鼠[雌性,合格证号:SCXK(辽)2017-0001,辽宁长生生物有限公司]。饲养于温度20~25 ℃,相对湿度 40%~60%环境中,每天12 h光照维持,昼夜循环,自由摄食、饮水。雄性APP/PS1小鼠和雌性C57BL/6小鼠合笼繁殖,鉴定APP/PS1阳性小鼠,饲养至7月龄用于试验,同窝出生的阴性C57BL/6小鼠作为空白对照组。本研究已通过辽宁中医药大学动物伦理审查,批号:21000042021133。
2 方法
2.1 动物分组与给药 取7月龄雄性APP/PS1双转基因小鼠30只,按体重随机分为模型对照组和淫羊藿组,每组15只;另取15只同龄的雄性C57BL/6小鼠作为空白对照组。淫羊藿组灌胃给予3 g·kg-1的药物溶液,每天1次,连续28 d;空白组和模型组给予等体积0.3% CMC-Na。
2.2 筑巢试验 淫羊藿给药第17天后,将小鼠按不同组别进行单笼饲养,垫料换为玉米芯,适应2 d后,试验当天下午更换新的玉米芯垫料,并在投料口处放置两叠卫生纸片(5 cm×5 cm),每叠10张。观察各小鼠筑巢,参照5分法进行评分,连续观察3 d,并拍照记录。评分标准为:纸片没有明显触碰和撕咬(1分):部分纸片被撕碎(2分):大部分纸片被撕成碎片,但没有形成明显的巢状(3分);纸巾被撕成碎片,并聚集形成一个比较成扁平的巢状结构(4分);纸片被撕成碎片,并聚集形成一个完整或接近完整的巢状结构(5分)。
2.3 Morris水迷宫试验 Morris水迷宫(Morris water maze,MWM)装置由一个黑色内壁的圆桶(直径120 cm×高60 cm)、摄像头及自动图像采集分析系统组成。将桶内分成东、西、南、北4个象限,将逃生平台(直径10 cm)置于其中一个象限内,水面没过平台0.5 cm,温度控制在(20±1)℃。给药第22天后采用水迷宫试验检测小鼠学习和记忆能力。MWM试验历时6 d,试验前5 d进行定位航行实验,第6天进行空间探索实验。①定位航行实验:训练时将小鼠从任一象限1/2弧度处面朝池壁、沿池壁边缘轻放于水中,如果小鼠在60 s内未找到平台,则引至平台停留20 s,每天4个象限各训练一次。连续训练5 d,每只小鼠的学习能力等相关数据经拍摄系统采集、分析,以每天小鼠的平均逃避潜伏期来评估小鼠的学习能力。②空间探索实验:第6天,撤去平台,将小鼠由原平台所在的对侧象限面朝池壁放入水中,根据小鼠在60 s内的穿越原平台次数、平台所在象限停留时间百分比和第1次穿越平台前的游泳距离,评估小鼠的空间记忆能力。
2.4 取材 行为学实验结束后,各组小鼠腹腔注射4%水合氯醛深度麻醉小鼠并处死,取脑组织,部分置于预冷的磷酸盐缓冲液中暂时保存,备用。另一部分置于30%蔗糖溶液,4 ℃沉降过夜。次日,冰冻包埋剂包埋,-80 ℃放置过夜,采用冰冻切片机对脑组织进行连续冠状切片(厚度为10 μm),-20 ℃冻存,备用。
2.5 H&E染色 取“2.4”项下脑组织冰冻切片,室温平衡5 min后,用4%多聚甲醛固定15 min,ddH2O润洗3次,置于50 ℃的苏木素染液中染色5 min,ddH2O润洗3次;置于1%盐酸-乙醇分化液中分化10~15 s,ddH2O润洗3次,置于0.5% 氨水反蓝液中10 s,ddH2O润洗;依次经70%、80%、95%乙醇脱水,二甲苯透化5 min,中性树脂胶封片,在显微镜下观察皮层和海马组织形态变化情况。
2.6 Nissl染色 取“2.4”项下脑组织冰冻切片,室温平衡5 min后,用4%多聚甲醛固定15 min;ddH2O润洗3次,放入Nissl染液中,待尼氏体清晰后终止反应,ddH2O洗涤3次;快速在70%、100%乙醇中脱水5 s,二甲苯透化5 min,中性树胶进行封片。显微镜下观察皮层、海马CA3和海马DG区尼氏体数量。
2.7 小鼠脑组织中氧化应激指标水平的检测 取“2.4”项下各组小鼠的脑组织,去除嗅球、小脑和脑干部分,保留大脑皮层和海马组织,合并后制成组织匀浆液,再根据试剂盒说明书方法操作,检测小鼠脑组织中SOD、MDA水平。
2.8 免疫荧光化学法检测β-淀粉样蛋白的表达 取脑组织冰冻切片,室温平衡5 min后,用4%多聚甲醛固定30 min;PBS清洗3次;0.5% Triton X-100透化30 min;PBS清洗3次;5% BSA溶液室温封闭1 h,加入兔抗Aβ1-42一抗稀释液(1∶300),4 ℃避光孵育过夜,PBS清洗3次,然后加FITC标记的山羊抗兔二抗稀释液(1∶300),室温避光孵育1~2 h,DAPI染细胞核3 min,PBS清洗3次,滴加抗荧光淬灭剂,封片,倒置显微镜下观察并拍照。
2.9 Western blot法检测CREB、BDNF通路相关蛋白表达情况 取小鼠脑组织,剥离海马组织,加入RIPA裂解液、1% PMSF和50×蛋白酶-磷酸酶抑制剂提取总蛋白,BCA法检测蛋白浓度。蛋白样品按4∶1体积比加入5×Loading buffer,煮沸5 min,进行凝胶电泳,2 h后转膜,室温条件下5% 脱脂奶粉封闭2 h,PBST缓冲液清洗3次,分别加入兔抗CREB、p-CREB、BDNF一抗稀释液(1∶300),和兔抗GAPDH一抗稀释液(1∶500),4 ℃孵育过夜,次日加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶500),室温孵育2 h;滴加ECL工作液,并以凝胶成像系统成像。采用Image J软件分析灰度值。
3 结果
3.1 筑巢试验检测APP/PS1双转基因小鼠的生活能力 如图1所示,空白对照组小鼠在投放纸片的24 h内即出现筑巢行为,在72 h之内纸片被撕成小碎片,并筑成完整的巢状结构(见图1A),而模型组APP/PS1双转基因小鼠没有将纸片撕成碎片,在72 h内纸片散落在鼠笼里,没有筑成完整的巢状结构(见图1A),筑巢评分明显低于空白对照组(见图1B,P<0.01);淫羊藿组小鼠在24 h 内出现筑巢行为,72 h内大部分纸片被撕成碎片,形成较为完整的巢状结构(见图1A),筑巢评分与模型组比较明显提高(见图1B,P<0.01)。以上结果表明,淫羊藿能够明显改善APP/PS1双转基因小鼠生活能力。
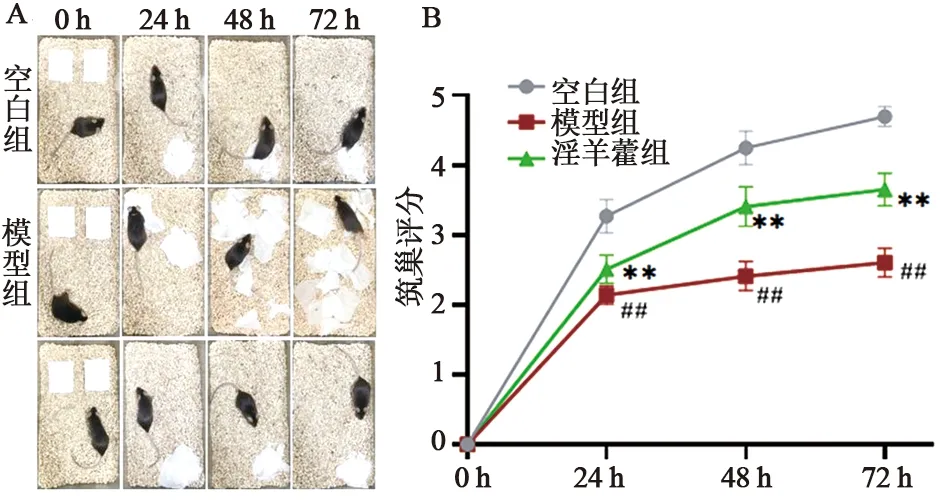
A.筑巢行为经典图;B.筑巢评分统计图图1 筑巢试验检测淫羊藿对APP/PS1双转基因小鼠生活能力的影响(n=10) 注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
3.2 淫羊藿对APP/PS1双转基因小鼠学习记忆能力影响 如图2所示,从训练的第3天开始,与空白组比较,APP/PS1双转基因小鼠的逃避潜伏期明显增加(见图2B,第5天时P<0.01),目标象限停留时间减少(见图2F,第5天时P<0.01),游泳距离增加(见图2D,第5天时P<0.01),而穿越平台次数显著降低(见图2E,第5天时P<0.01)。与模型组比较,淫羊藿组逃避潜伏期和游泳距离显著缩短,目标象限停留时间百分比和穿越平台次数显著增加。各组小鼠的游泳速度无明显差异(见图2C,P<0.01),说明以上指标的改变并不是游泳速度不同导致的。以上结果提示,淫羊藿能够改变APP/PS1双转基因小鼠学习和记忆能力。

A.定位航行轨迹图;B.逃避潜伏期;C.游泳速度;D.游泳距离;E.穿越平台次数;F.第三象限停留时间百分比图2 Morris 水迷宫试验检测淫羊藿对APP/PS1双转基因小鼠学习记忆能力的影响(n=10) 注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
3.3 淫羊藿对APP/PS1双转基因小鼠脑组织病理损伤的影响 如图3A所示,空白组小鼠皮层、海马CA3区和DG区的神经细胞数量多,层次清晰,胞质丰富,细胞核大而圆,胞浆、胞核染色均匀,组织形态结构正常;模型组小鼠皮层、海马CA3区和DG区的神经细胞数目明显减少,且排列松散,形态不规则,细胞核深染、固缩,神经细胞空泡化明显,说明模型组小鼠脑组织明显受损;经淫羊藿治疗后,神经细胞数目较模型组明显增多,层次较为清晰,胞浆、胞核染色均匀,细胞核固缩明显减轻,说明淫羊藿可减轻APP/PS1双转基因小鼠脑组织损伤。

A.H&E染色;B.Nissl染色;C~E.尼氏体数量统计图图3 淫羊藿对APP/PS1双转基因小鼠脑组织结构的影响(n=3) 注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
如图3B所示,与空白组比较,模型组小鼠皮层、海马CA3区和DG区的尼氏体模糊不清,排列疏松,数量明显减少(图3C~E,皮层:P<0.01,海马CA3区:P<0.01,海马DG区:P<0.01);经淫羊藿治疗后小鼠皮层、海马CA3区和DG区的尼氏体颜色加深,排列紧密,数量明显增多(图3C~E,皮层:P<0.01,海马CA3区:P<0.01,海马DG区:P<0.05)。以上结果表明,淫羊藿能够明显改善APP/PS1双转基因小鼠脑组织结构损伤。
3.4 淫羊藿对APP/PS1双转基因小鼠脑组织中氧化应激指标水平的影响 如图4所示,与空白组比较,模型组小鼠脑组织中MDA水平显著升高(P<0.01),SOD水平显著降低(P<0.01);与模型组比较,淫羊藿组小鼠脑组织中上述指标水平均显著逆转(P<0.01)。

图4 淫羊藿对APP/PS1双转基因小鼠脑组织中MDA和SOD水平的影响(n=8) 注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
3.5 淫羊藿对APP/PS1小鼠脑内β-淀粉样蛋白沉积的影响 如图5所示,与空白组比较,模型组小鼠脑内β-淀粉样蛋白沉积明显增多,而经淫羊藿治疗后,小鼠脑内斑块数量明显减少。以上结果表明,淫羊藿能够减少小鼠脑内β-淀粉样蛋白沉积。

图5 淫羊藿对APP/PS1小鼠脑内β-淀粉样蛋白沉积的影响 注:绿色代表Aβ斑块;DG:Dentate gyrus,海马齿状回;Cortex:大脑皮层
3.6 淫羊藿对CREB、BDNF通路相关蛋白表达的影响 如图6所示,与空白组比较,模型组小鼠脑组织中CREB蛋白磷酸化水平和BDNF蛋白表达水平均显著下调(P<0.01);与模型组相比,淫羊藿组小鼠脑组织中CREB蛋白磷酸化水平和BDNF蛋白表达水平均显著逆转(P<0.01)。以上结果表明,淫羊藿通过激活CREB/BDNF信号通路改善APP/PS1双转基因小鼠的认知功能。

图6 淫羊藿对APP/PS1双转基因小鼠CREB/BDNF信号通路相关蛋白表达的影响 注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
4 讨论
中医将AD归属于“呆病”“痴呆”等范畴,其病位在脑,与肾密切相关。《灵枢·海论》曰:“脑为髓之海”“髓海有余,则轻劲多力,自过其度”“髓海不足,则脑转耳鸣,胫酸眩冒,目无所见,懈怠安卧”。髓海不足则出现痴呆[11-12]。因此中医认为治疗AD应注重补肾填精、益髓养脑。淫羊藿是临床上常用的补肾填精药,《本草备要》载其“补命门,益精气,坚筋骨”,可用于肾阳虚衰,阳痿遗精,风湿痹痛,筋骨痿软[13]。本研究发现,给予模型动物淫羊藿治疗后,小鼠逃避潜伏期减少和穿越平台次数增加,这说明淫羊藿可改善APP/PS1双转基因小鼠的学习和记忆能力。
CREB-BDNF信号通路在神经细胞修复和神经功能的恢复中具有重要作用。CREB是神经系统中重要的核转录因子,在基因转录、促进神经元再生与保护、突触形成、学习记忆及生活能力等方面发挥重要调节作用,可通过促进下游BDNF的分泌,发挥神经细胞的修复及保护作用。上述内容的发挥主要依赖于其磷酸化产物p-CREB,当转录因子CREB的Ser133位点被磷酸化后,与靶基因CRE答应元件(cAMP response element,CRE)结合,随后p-CREB与BDNF启动子区域的cAMP反应元件结合,调节BDNF的转录[14-15]。研究发现,随着AD患者脑内Aβ神经毒性的释放,CREB-BDNF信号转导通路减弱,从而导致其下游信号分子p-CREB和BDNF表达降低。BDNF的低表达难以抵抗应激下神经元的损伤,这可导致记忆功能的缺陷,甚至海马体积的缩小[16]。此外,有研究显示,BDNF可抑制H2O2诱导的PC12细胞凋亡[17],脑室注射BDNF可减轻脑缺血再灌注引起的大鼠脑内氧化应激和神经细胞凋亡,过表达CREB可以减轻高浓度H2O2所致的内皮细胞氧化损伤[18],这说明CREB/BDNF信号通路可能与氧化应激存在某种内在联系。
本实验为探究淫羊藿的神经保护作用是否与CREB/BDNF信号通路有关,分别检测了各组小鼠海马组织中CREB和BDNF信号通路相关蛋白的表达。结果发现,与空白组比较,模型组小鼠海马组织中CREB蛋白磷酸化水平和BDNF蛋白表达水平均显著降低;给予淫羊藿治疗后,小鼠海马组织中上述指标均显著逆转,说明淫羊藿改善APP/PS1双转基因小鼠的认知功能,减轻小鼠脑组织病理损伤和氧化应激,其抗AD作用的潜在机制可能与激活CREB/BDNF信号通路有关。
