门冬氨酸鸟氨酸与利福昔明联用减少肝性脑病复发风险的效果评价
2023-07-22周静静施玲玲颜小丹陈依娜
周静静,施玲玲,颜小丹,陈依娜
·药物研究·
门冬氨酸鸟氨酸与利福昔明联用减少肝性脑病复发风险的效果评价
周静静1,施玲玲2,颜小丹1,陈依娜3
1.浙江省台州医院消化内科,浙江台州 317000;2.浙江省台州医院儿科,浙江台州 317000;3.浙江省余姚市人民医院消化内科,浙江余姚 315400
探讨门冬氨酸鸟氨酸联合利福昔明治疗肝性脑病的疗效及对疾病复发的预防效果。选取浙江省台州医院2018年1月至2019年1月84例肝性脑病患者作为研究对象,采用随机数字表法分为两组,每组各42例,对照组单用门冬氨酸鸟氨酸,观察组在对照组基础上加用利福昔明,比较两组患者治疗前后的血氨、谷丙转氨酶(alanine transaminase,AST)、总胆红素(total bilirubin,TBIL)水平、血清S100钙结合蛋白B(serum S100 calc-binding protein B)、β-内啡肽(β-endorphin,β-EP)水平、神经特异性烯醇化酶(transspecific enolase,NSE)和及神志、意识变化情况,并随访两组的复发情况。两组治疗后血氨、ALT和TBIL水平均显著低于治疗前(<0.05),且观察组治疗后血清中的血氨、ALT和TBIL水平显著低于对照组(<0.05);两组治疗后血清中的S100B、β-EP及NSE的表达水平均显著低于治疗前(<0.05),且观察组较对照组下降明显(<0.05);观察组的神志转清醒时间、数字连接试验(digital connection test,NCT)和数字符号试验(digital symbol test,DS)水平均较治疗前明显改善(<0.05),与对照组比较,观察组明显改善(<0.05);观察组总有效率(95.24%)明显高于对照组(81.40%),差异有统计学意义(<0.05);两组不良反应发生率比较(7.14%4.76%),差异无统计学意义(>0.05);两组肝性脑病复发住院率比较(02.38%),差异无统计学意义(>0.05)。门冬氨酸鸟氨酸与利福昔明联用治疗肝性脑病能有效降低血氨浓度,提高治疗效果,对肝性脑病的转归有良好作用。
肝性脑病;门冬氨酸鸟氨酸;利福昔明;血氨;复发
肝性脑病是由严重肝病引发的一组以代谢紊乱为主要表现的中枢神经系统功能失调综合征。本病是多种因素共同作用的结果,患者的临床表现以行为失常、意识障碍、昏迷等为主。肝性脑病的发病机制复杂,如氨基酸失衡、γ-氨酸丁酸学说、氨中毒、假性神经递质学说等,其中氨中毒是普遍较为认同的一种肝性脑病发病机制[1-3]。针对该发病机制,临床治疗通常以降低血氨水平来达到治疗目的。利福昔明为利福霉素半合成衍生物,其具有抗菌活性强、抗菌谱广的特点,能有效杀灭肠道细菌,减少肠道细菌产氨,且口服给药极少被肠道吸收,所以药物不良反应较少[4]。门冬氨酸鸟氨酸为左旋门冬氨酸和鸟氨酸的复合物,其在肝细胞的核酸及谷氨酸氨合成过程中均有参与,能有效改善肝细胞能量供应,促进肝细胞修复。本研究中,浙江省台州医院2018年1月至2019年1月应用门冬氨酸鸟氨酸与利福昔治疗肝性脑病取得了较好的效果,现报道如下。
1 资料与方法
1.1 临床资料
选取浙江省台州医院2018年1月至2019年1月收治的84例肝性脑病患者作为研究对象。纳入标准:①年龄≥18岁;②符合肝性脑病诊断标准[5];③有严重肝病或广泛门体侧支循环形成基础;④有意识或情绪异常、精神紊乱、兴奋和嗜睡交替、定向障碍等精神症状;⑤血氨浓度升高,肝功能提示肝功能损害;脑电图显示两侧前额、顶部均有特征性θ波或极慢δ波;⑥近1个月内未应用过中枢神经系统抑制剂或镇静药物。排除标准:①伴有心力衰竭或呼吸衰竭者;②合并其他代谢性脑病;③慢性肾功能不全;④自发性细菌性腹膜炎或其他严重感染性疾病;⑤依从性不佳。采用随机数字表法分为观察组和对照组,每组各42例,其中,观察组男29例,女13例,年龄38~70岁,平均(46.25±7.58)岁,基础肝病:乙肝肝硬化25例,酒精性肝硬化11例,重型肝炎6例,肝性脑病分级:Ⅰ级21例,Ⅱ级17例,Ⅲ级4例;对照组男27例,女15例,年龄40~75岁,平均(47.32±6.98)岁,基础肝病:乙肝肝硬化23例,酒精性肝硬化10例,重型肝炎9例,肝性脑病分级:Ⅰ级25例,Ⅱ级14例,Ⅲ级3例,两组患者的性别构成比、年龄、基础肝病、病情分级组间比较,差异均无统计学意义(>0.05),具有可比性。本研究经浙江省台州医院伦理委员会批准通过(伦理审批号:K20220839)。
1.2 治疗方法
两组患者均采取常规对症治疗措施,包括输注白蛋白、血浆、支链氨基酸,纠正水电解质紊乱,低流量吸氧,应用乳果糖等。在对症治疗基础上,对照组患者加用门冬氨酸鸟氨酸[批准文号:国药准字H20113459,生产单位:福安药业(集团)股份有限公司,规格:10ml:5g],剂量15g/次,将15g门冬氨酸鸟氨酸注射液与250ml的葡萄糖溶液(5%)混合均匀后,静脉滴注给药,每日1次,持续用药2周。观察组患者在应用门冬氨酸鸟氨酸的同时加用利福昔明(批准文号:国药准字H20060613,生产单位:江苏华信制药有限公司,规格:0.2g)0.2g/次,口服给药,每日3次,持续用药2周。
1.3 观察指标
①治疗前1d及治疗结束后1d,分别采集患者的空腹静脉血以肝素抗凝保存,离心后分离血清和血浆。保存血浆用于检测血氨水平,保留血清用于测定谷丙转氨酶(alanine transaminase,ALT)、总胆红素(total bilirubin,TBIL)水平,仪器均使用AU5800型全自动生化分析仪。②采用电化学发光法检测血清S100钙结合蛋白B(serum S100 calc-binding protein B,S100B)、β-内啡肽(β-endorphin)β-EP以及神经特异性烯醇化酶(transspecific enolase,NSE)水平。③记录两组患者的神志转清醒时间,并在治疗后对患者进行数字连接试验(digital connection test,NCT)和数字符号试验(digital symbol test,DS)以评估患者的智力状况。④记录两组患者治疗期间的不良反应情况,包括恶心呕吐、腹泻、周围水肿、头晕、头痛、腹痛、腹胀、咳嗽、肌肉痉挛、便秘等。⑤两组患者治疗后均随访12个月,记录两组随访期间因肝性脑病复发住院情况。
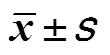
表1 两组患者治疗前后的血氨、ALT及TBIL水平比较()
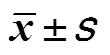
表2 两组患者治疗前后血清中的S100B、β-EP和NSE表达水平比较()
1.4 疗效评价[6]
显效:治疗24h内神志清醒,临床症状消失,治疗7d后肝功能指标及血氨浓度均恢复正常;有效:治疗48h内神志清醒,临床症状明显减轻,血氨浓度降低,肝功能指标好转);无效:治疗72h后仍未清醒,症状、肝功能指标、血氨浓度均无改善或有加重。总有效率=显效率+有效率。
1.5 统计学方法
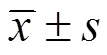
2 结果
2.1 两组患者治疗前后的血氨、ALT及TBIL水平比较
治疗前,两组的血氨、ALT及TBIL水平比较,差异无统计学意义(>0.05);治疗后,两组的血氨、ALT、TBIL水平均明显降低(<0.05),与对照组比,观察组的血氨、ALT、TBIL水平明显降低(<0.05),见表1。
2.2 两组患者治疗前后血清中的S100B、β-EP和NSE表达水平比较
治疗前,两组的血清中S100B、β-EP和NSE表达水平比较,差异无统计学意义(>0.05),治疗后均显著下降(<0.05),且观察组患者经治疗后S100B、β-EP和NSE在血清中的表达水平显著低于对照组(<0.05),见表2。
2.3 两组患者的神志转清醒时间、NCT及DS测试结果比较
观察组患者的神志转清醒时间明显低于对照组NCT值明显低于对照组,DS值明显高于对照组(<0.05),见表3。
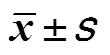
表3 两组患者的神志转清醒时间、NCT及DS测试结果比较()
2.4 两组的临床疗效与不良反应比较
观察组的总有效率明显高于对照组(2=4.086,<0.05),见表4。两组的主要不良反应事件包括腹泻、恶心呕吐、乏力、头痛、头晕、瘙痒等。治疗期间,观察组的不良反应发生率为7.14%(3/42),对照组的不良反应发生率为4.76%(2/42),两组的不良反应发生率比较,差异无统计学意义(2=0.213,>0.05)。

表4 两组的临床疗效比较
2.5 两组复发情况比较
观察组随访期间0例因肝性脑病复发住院,对照组1例(2.38%)因肝性脑病复发住院,观察组的肝性脑病复发住院率略低于对照组,但差异无统计学意义(=0.314)。
3 讨论
肝性脑病是临床常见的一种神经精神综合征,其临床表现以持续性的精神状态退化、精神运动障碍为主,如记忆力减退、反应迟钝、感觉异常、注意力涣散等,病情严重时还可能出现昏迷[7]。临床对于肝性脑病的诊断主要以精神状态损害和神经活动功能受损为依据,其中神经状态损害主要根据Conn记分进行评定。临床认为肠道内神经毒素会增加肠道内氮负荷,尤其是门体分流和肝功能受损患者,其肠道内会产生大量,致使血氨升高,而高血氨可诱发机体发生神经生理功能异常。另一方面,肝病患者的机体处于严重炎症状态,肝脏难以彻底清除影响神经活性的毒性物质,来自肠道的毒性物质则可经侧支循环进入体循环,并最终进入脑部而引发大脑功能紊乱。从肝性脑病的发病机制来看,加速氨转化,促进氨排泄,减少氨吸收,降低肠道内氨负荷是治疗肝性脑病的主要思路[8-9]。
门冬氨酸鸟氨酸的主要成分为鸟氨酸和左旋门冬氨酸,其中鸟氨酸会参与机体内尿素合成过程,激活其中的鸟氨酸氨基甲酰转移酶、氨基甲酰磷酸合成酶等关键酶的活性,促进尿素合成,加快氨代谢,从而减轻氨氮负荷,降低血氨水平,促进氨代谢[10]。在肝细胞的核酸及谷氨酰胺合成过程中,门冬氨酸均有参与,其能有效改善肝细胞的能量供应,促进受损细胞修复,对于降低转氨酶水平,改善肝功能具有积极作用。门冬氨酸是氨的储存与运输形式,是氨的解毒产物,能够增强肝脏对血氨的解毒能力,提高肝细胞的胆红素排泄能力,细胞转化及摄取能力,加速肝细胞恢复,提高肝脏解毒能力,促进意识恢复[11]。门冬氨酸鸟氨酸在肝性脑病治疗中的应用较为普遍。王红启[12]的报道指出,相比常规治疗组,加用门冬氨酸鸟氨酸治疗肝性脑病的观察组,其治疗后的血氨水平明显比对照组更低,治疗总有效率明显更高。本研究中,应用门冬氨酸鸟氨酸的对照组,其治疗后的血氨、ALT、TBIL水平明显降低,与前述文献报道结论相符,证实门冬氨酸鸟氨酸治疗肝性脑病的有效性。
利福昔明是一种主要针对局部肠道感染的抗菌药物,是利福霉素的衍生物,不仅抗菌活性较强,且抗菌谱较广,可同时作用于革兰阳性菌和革兰阴性菌[13]。该药物主要通过与细菌DNA所依赖的RNA聚合酶β-亚单位结合来抑制细菌RNA合成,以达到杀灭细菌的目的。对于肠道中具有升氨作用的细菌,利福昔明可发挥强有效的杀灭作用,其能通过杀灭此类细菌来减少氨生成,降低血氨浓度,达到治疗的目的[14]。美国食品和药品管理局在2010年批准利福昔明用于治疗肝性脑病,之后的多项研究显示利福昔明治疗肝性脑病的疗效并不亚于非吸收二糖类,且前者的腹痛、腹泻不良反应更少,其用于肝性脑病的治疗比非吸收二糖类更具有优势[15-16]。本研究中,观察组患者加用利福昔明,结果显示观察组治疗后的血氨、ALT、TBIL水平比对照组更低,治疗总有效率达95.24%,且神志转清醒时间更短,智力测试结果比对照组更好,与相关文献报道[17-18]一致,表明利福昔明的加用能够通过结合细菌DNA-依赖RNA聚合酶的β亚单位来抑制细菌蛋白质合成,减少细菌RNA合成,杀灭生氨细菌,从而降低血氨水平,减少氨吸收,进而使肝性脑病患者的脑电图异常及神志不清得到有效改善。
S100B为神经胶质细胞分泌的一种钙结合蛋白,是反馈急性脑损伤、神经退行性等疾病严重程度的重要标志,在肝性脑病患者血清中呈高表达[19]。β-EP是人体中内源性吗啡样物质的一种,在神经系统中广泛存在,在慢性肝病患者中血清及组织中含量升高,脑损伤可导致β-EP水平上升,而肝性脑病患者易发生脑水肿,使得血清中β-EP大量释放[20]。NSE为烯醇化酶5种同工酶中的一种,特异性地存在于神经元和神经内分泌细胞中,是反映脑神经元损伤严重程度的重要指标之一。肝性脑病患者发病后,血清中的NSE水平也随之上升,动态监测患者血清NSE水平,亦可作为反映疾病归转的指标[21]。本研究结果显示,观察组患者治疗后血清中的S100B、β-EP和NSE表达水平均较对照组显著降低,提示门冬氨酸鸟氨酸联合利福昔明可显著改善肝性脑病患者的神经功能,但具体作用机制还有待进一步研究。
在不良反应方面,两组未见明显差异,说明利福昔明治疗肝性脑病并不会增加不良反应发生风险,有较好的用药安全性,考虑可能是由于利福昔明经口服后,不易被胃肠道吸收,药物只能在肠道内达到较高浓度,血药浓度几乎可忽略,所以利福昔明的不良反应较少,药物联用有较高的安全性[22]。国内关于利福昔明预防肝性脑病复发的报道显示,应用利福昔明组的肝性脑病事件发生率、肝性脑病复发住院率均比安慰剂组更低,而不良事件发生率与安慰剂组接近[23]。本次随访也显示观察组的肝性脑病复发住院率比对照组略低,与前述报道相似,证实利福昔明对于减少肝性脑病复发有确切效果。
综上所述,门冬氨酸鸟氨酸与利福昔明联用治疗肝性脑病能有效降低血氨浓度,减轻临床症状,提高治疗效果,且不会增加不良反应发生风险,对肝性脑病的转归有良好作用,值得推广应用。
[1] 张纵, 王晓花. 肝性脑病诊断及治疗进展[J]. 山东大学学报(医学版), 2018, 56(2): 1–8.
[2] 乐滢玉, 张荣臻, 肖伟松, 等. 肝性脑病发病机制的研究进展[J]. 中西医结合肝病杂志, 2022, 32(5): 468–472.
[3] 李洁, 赵江明, 王黎, 等. 轻微型肝性脑病发病机制的研究进展[J]. 山东医药, 2019, 59(35): 103–105.
[4] 叶院宁, 毛华, 汪芳裕. 利福昔明在消化道疾病中的应用进展[J]. 胃肠病学和肝病学杂志, 2018, 27(2): 97–100.
[5] 邢卉春. 肝性脑病诊断治疗专家共识[J]. 中国肝脏病杂志(电子版), 2009, 1(2): 46–55.
[6] 中华医学会肝病学分会. 肝硬化肝性脑病诊疗指南[J]. 传染病信息, 2018, 31(5): 403–420.
[7] 程小韵, 张春清. 经颈静脉肝内门体分流术后肝性脑病研究进展[J]. 中国介入影像与治疗学, 2019, 16(2): 58–61.
[8] 李梦羽, 周希乔. 肝性脑病发病机制的研究进展[J]. 胃肠病学, 2020, 25(2): 116–120.
[9] 杨健, 植中敬, 何国开, 等. 血氨、血清腹水清蛋白梯度及APRI与肝性脑病分期的相关性[J]. 深圳中西医结合杂志, 2021, 31(15): 83–84.
[10] 张志华, 顾天翊, 陈柳莹, 等. 门冬氨酸鸟氨酸治疗脂肪肝疗效Meta分析[J]. 实用肝脏病杂志, 2018, 21(2): 233–236.
[11] 张莉. 门冬氨酸鸟氨酸结合乳果糖对慢性肝性脑病患者炎症指标及血氨水平的影响[J]. 航空航天医学杂志, 2021, 32(5): 560–561.
[12] 王红启. 门冬氨酸鸟氨酸在肝性脑病治疗中的应用[J]. 中国现代药物应用, 2020, 14(4): 102–103.
[13] 吕新月, 李磊. 利福昔明在肝硬化相关并发症中的应用[J]. 临床肝胆病杂志, 2018, 34(7): 190–193.
[14] AHMED A R, NASSER M, WALAA S, et al. Rifaximin in nonalcoholic fatty liver disease: Hit multiple targets with a single shot[J]. Europ J Gastroenterol Hepatol, 2018, 30(10): 1237–1246.
[15] DAVID SCHLOSSBERG,RAFIK SAMUE. XIFAXAN (Rifaximin)[M]. Antibiotics Manual: A Guide to Commonly Used Antimicrobials, Second Edition. John Wiley & Sons, Ltd, 2017.
[16] 杨长青, 郭晓姝, 李季, 等. 利福昔明经TRPV1- VGLUT2/3通路影响大鼠内脏敏感性的研究[J]. 胃肠病学, 2019, 24(11): 650–654.
[17] 钟桂平, 周良注, 甘拜泉. 非吸收性抗生素利福昔明治疗肝性脑病的疗效观察[J]. 北方药学, 2019, 16(9): 38–39.
[18] 范静, 徐静, 袁雪. 利福昔明联合乳果糖治疗肝性脑病患者疗效及其血清S100B蛋白和神经元特异性烯醇化酶变化[J]. 实用肝脏病杂志, 2021, 24(1): 103–106.
[19] 林玫君, 区铭乾, 孙芙蓉, 等. S100B蛋白在中枢神经系统疾病中的临床意义及研究进展[J]. 海南医学, 2020, 31(6): 767–771.
[20] 杨从意, 胡敬宝, 鲁艳平, 等. 大黄合剂联合雅博司对早期肝性脑病临床疗效及血氨、内毒素影响[J]. 辽宁中医药大学学报, 2017, 19(7): 188–191.
[21] 范静, 徐静, 袁雪. 利福昔明联合乳果糖治疗肝性脑病患者疗效及其血清S100B蛋白和神经元特异性烯醇化酶变化[J]. 实用肝脏病杂志, 2021, 24(1): 103–106.
[22] 贺秋凤, 胡蓉, 曾义岚, 等. 乳果糖联合利福昔明治疗肝性脑病患者优于单用乳果糖: 一项Meta分析[J]. 中国肝脏病杂志(电子版), 2019, 11(4): 32–36.
[23] 樊硕, 孙静波, 李静, 等. 利福昔明联合乳果糖对肝性脑病转归的影响及其机制探讨[J]. 实用药物与临床, 2019, 22(6): 606–609.
Evaluation of the effect of ornithine aspartate combined with rifaximin in reducing the risk of recurrence of hepatic encephalopathy
ZHOU Jingjing, SHI Lingling, YAN Xiaodan, CHEN Yina
1.Department of Gastroenterology, Taizhou Hospital of Zhejiang Province, Taizhou 317000, Zhejiang, China; 2.Department of Paediatrics, Taizhou Hospital of Zhejiang Province, Taizhou 317000, Zhejiang, China; 3.Department of Gastroenterology, Yuyao People’s Hospital of Zhejiang Province, Yuyao 315400, Zhejiang, China
To investigate the efficacy of ornithine aspartate combined with rifaximin in the treatment of hepatic encephalopathy and its preventive effect on disease recurrence.A total of 84 patients with hepatic encephalopathy were randomly divided into two groups in Taizhou Hospital of Zhejiang Province from January 2018 to January 2019, 42 cases per group. The control group was treated with ornithine aspartate only, and the observation group was given rifaximin on the basis of the control group. The levels of blood ammonia, alanine aminotransferase (ALT), total bilirubin (TBIL), serum S100 calc-binding protein B (S100B), β-endorphin (β-EP) and transspecific enolase (NSE), as well as changes in consciousness and consciousness were compared between the two groups before and after treatment, and the recurrence of the two groups were followed up.The serum ammonia, ALT and TBIL levels in both groups were significantly lower after treatment than before treatment (<0.05), and the serum ammonia, ALT and TBIL levels in the observation group were significantly lower than those in the control group after treatment (<0.05). The expression levels of S100B, β-EP and NSE in serum of two groups after treatment were significantly lower than before treatment (<0.05), and the observation group was significantly lower than the control group (<0.05). The time to wakefulness, digital connection test (NCT) and digital symbol test (DS) in observation group were significantly improved compared with before treatment (<0.05), and compared with control group, the observation group was significantly improved (<0.05). Compared with the control group, the total effective rate (95.24%81.40%) had improved significantly in the observation group(<0.05), the difference was statistically signifcant. There had no difference in the incidence of adverse reactions (7.14%4.76%) and the recurrence hospitalization rate of hepatic encephalopathy (02.38%) between the two groups (>0.05).Ornithine aspartate combined with rifaximin in the treatment of hepatic encephalopathy can effectively reduce the blood ammonia concentration, improve the treatment effect, and have a good effect on the prognosis of hepatic encephalopathy.
Hepatic encephalopathy; Ornithine aspartate; Rifaximin; Blood ammonia; Recurrence
R575
A
10.3969/j.issn.1673-9701.2023.18.019
台州市科技计划项目(1901ky18)
陈依娜,电子信箱:zhoujj7726@enzemed.com
(2022–08–02)
(2023–05–18)
