血浆游离脂肪酸与三酰甘油的比值预测脓毒症患者预后的价值
2023-07-22杨江江姬晓伟谢波
杨江江,姬晓伟,谢波
·论 著·
血浆游离脂肪酸与三酰甘油的比值预测脓毒症患者预后的价值
杨江江,姬晓伟,谢波
湖州市中心医院重症医学科,浙江湖州 313000
探讨血浆游离脂肪酸(plasma free fatty acid,FFA)与三酰甘油(triglyceride ,TG)比值在预测脓毒症患者预后中的价值。收集2019年1月至2020年12月因脓毒症收治湖州市中心医院重症医学科的患者78例,统计患者的信息及实验室指标,根据患者预后将其分为存活组(=40)和死亡组(=38),比较两组患者基线资料与实验室指标的差异,筛选出影响预后的单因素指标,进行Logistic回归分析及受试者操作特征(receiver operator characteristic,ROC)曲线分析。单因素分析结果显示,死亡组患者APACHE-Ⅱ评分、FFA及FFA/TG显著高于存活组(<0.001),TG、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇组间比较,差异无统计学意义(分别为0.215、0.992、0.124、0.695),两组其他基线资料比较,差异无统计学意义。多因素Logistic分析显示,APPACHE-Ⅱ评分、FFA、FFA/TG是影响脓毒症患者预后的独立危险因素(<0.05),ROC曲线下面积(area under the curve,AUC)分别为(0.721±0.058)、(0.755±0.056)、(0.836±0.044),均<0.001,FFA/TG在预测脓毒症患者预后方面优于APPACHE-Ⅱ和FFA。脓毒症患者存在脂质代谢紊乱,FFA/TG在预测脓毒症患者的预后价值优于APPACHE-Ⅱ评分,且比值越高预后越差。
游离脂肪酸;三酰甘油;脓毒症;预后价值
游离脂肪酸(free fatty acid,FFA)又称非酯化的脂肪酸,生理状态下,FFA是脂质代谢的中间产物,能够直接为机体提供能量。人体中另一种形式的脂肪酸为酯化脂肪酸,包括三酰甘油(triglyceride,TG)、磷脂、胆固醇酯,它们在脂肪酶的作用下不断分解为FFA。FFA通过相关酶的介导进入线粒体进行氧化,被人体组织利用,剩余的FFA则再次酯化为TG,储存在脂肪细胞中[1]。当机体出现脂肪代谢异常时,TG等脂肪酸酯化增强,而FFA的再酯化减弱同时FFA氧化障碍,导致FFA浓度增加[2]。研究提示,高FFA血症在心血管疾病和动脉粥样硬化性疾病的发病中起着不利的作用,肥胖和2型糖尿病患者血浆FFA水平也偏高[2]。越来越多的证据表明FFA在介导内皮功能障碍(endothelial dysfunction,ED)中起重要作用,具体来说,氧化应激、胰岛素抵抗和炎症是FFA诱导ED的重要原因[3-4]。脓毒症被定义为机体对感染反应失调引起的器官功能障碍[5],炎症反应的失调导致内皮细胞损伤是脓毒症发展的关键因素之一。脓毒症时体内释放大量应激激素,导致大量以葡萄糖、脂肪酸、氨基酸和乳酸的形式的能量底物生成[6]。脓毒症还影响脂质代谢,脂肪组织中的脂质溶解作用被上调,导致血液中脂肪酸和三酰甘油水平增加。目前已有研究提示血脂的异常对脓毒症患者的预后的判断具有一定的价值[7]。但患者的基础疾病、营养状态等均会影响基础血脂水平,而血浆中FFA的转化速率受到机体内增加的脂肪组织的影响,基础TG水平的差异,可能会影响基础的FFA水平[8]。单独研究FFA可能影响研究的准确性,而FFA与TG存在动态平衡,其比值可能更有利于对疾病的研究。本研究旨在明确血浆FFA及FFA与TG的比值(FFA/TG)在预测脓毒症预后中的价值。
1 资料与方法
1.1 临床资料
收集2019年1月至2020年12月所有因脓毒症收治入湖州市中心医院重症医学科的患者电子病例信息。纳入标准:①符合脓毒症3.0诊断标准[5];②年龄≥14岁。排除标准:①中重度肥胖患者[体质量指数(body mass index,BMI)>27kg/m2];②合并肝硬化、肝脏恶性肿瘤及慢性肾脏疾病;③孕产妇。根据患者预后将好转或治愈的患者纳入存活组,将死亡或救治无效自动出院的患者纳入死亡组。本研究经湖州市中心医院伦理委员会审核批准(伦理审批号:202204015-01)。
1.2 方法
1.2.1 资料收集 使用医院内电子信息系统以及重症医学科监护系统,收集记录患者入重症医学科时的基本信息、APACHE Ⅱ评分、序贯器官衰竭评分(,SOFA)、感染部位、治疗史、重症医学科住院天数、疾病转归、实验室指标等。
1.2.2 研究内容 根据患者预后分为死亡组及存活组,比较两组患者的基线资料、APACHE Ⅱ评分、SOFA评分、感染部位、治疗史、重症医学科住院天数、入重症医学科时血浆TG、FFA、FFA/TG、脏器功能指标、感染指标、血气分析等之间有差异无统计学意义,筛选出影响预后的单因素指标,进行多因素回归分析,并绘制受试者操作特征(receiver operating characteristic,ROC)曲线。
1.3 统计学方法
采用SPSS 23.0统计学软件对数据进行处理及分析。计数资料用例数(百分率)[(%)]表示,比较采用2检验;计量资料符合正态分布者用均数±标准差,比较采用独立样本检验;计量资料不符合正态分布者用中位数(四分位数间距)[(1,3)]表示,使用Mann-Whitney检验进行比较。对差异有统计学意义的单因素进行多因素Logistic回归分析,引入水平为0.05,剔除水平为0.10,筛选出影响患者预后的指标,并使用Prism 8.0软件绘制ROC曲线。<0.05为差异有统计学意义。
2 结果
2.1 基线资料
本研究最终纳入符合标准的脓毒症患者78例,男49例(62.8%),女29例(37.2%),年龄14~94岁,其中死亡组38例,存活组40例,两组患者年龄、性别、基础疾病、吸烟、酗酒等比较,差异均无统计学意义(>0.05),死亡组患者APACHEⅡ评分显著高于存活组患者(<0.001),但两组患者SOFA评分、感染来源、入院生命体征、血降钙素原、血细胞计数、D-二聚体、总胆红素、血肌酐等比较,差异均无统计学意义(>0.05),见表1。
2.2 两组患者TG、FFA、FFA/TG等比较
死亡组FFA、FFA/TG均显著高于存活组(<0.001),两组总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇及TG比较,差异均无统计学意义(>0.05),见表1。
2.3 多因素Logsitic回归分析
选择表1中可能影响脓毒症患者预后的因素,进行二元Logistic回归分析,提示APPACHE-Ⅱ评分(=1.229,95%:1.006~1.501)、FFA/TG(=1.008,95%:1.002~1.014)是影响脓毒症患者预后的独立危险因素(<0.05),而FFA无明显预测价值(>0.05),见表2。
2.4 预测价值评价
对上述筛选出的影响脓毒症患者预后的危险因素APPACHE Ⅱ评分、FFA、FFA/TG,用ROC曲线下面积(area under the curve,AUC)评价各因素的预测价值,分别为(0.721±0.058,95%:0.608~0.834)、(0.755±0.056,95%:0.645~0.865)、(0.836±0.044,95%:0.750~0.922),可见FFA/TG在预测脓毒症患者预后方面优于APPACHE-Ⅱ、FFA,见图1。
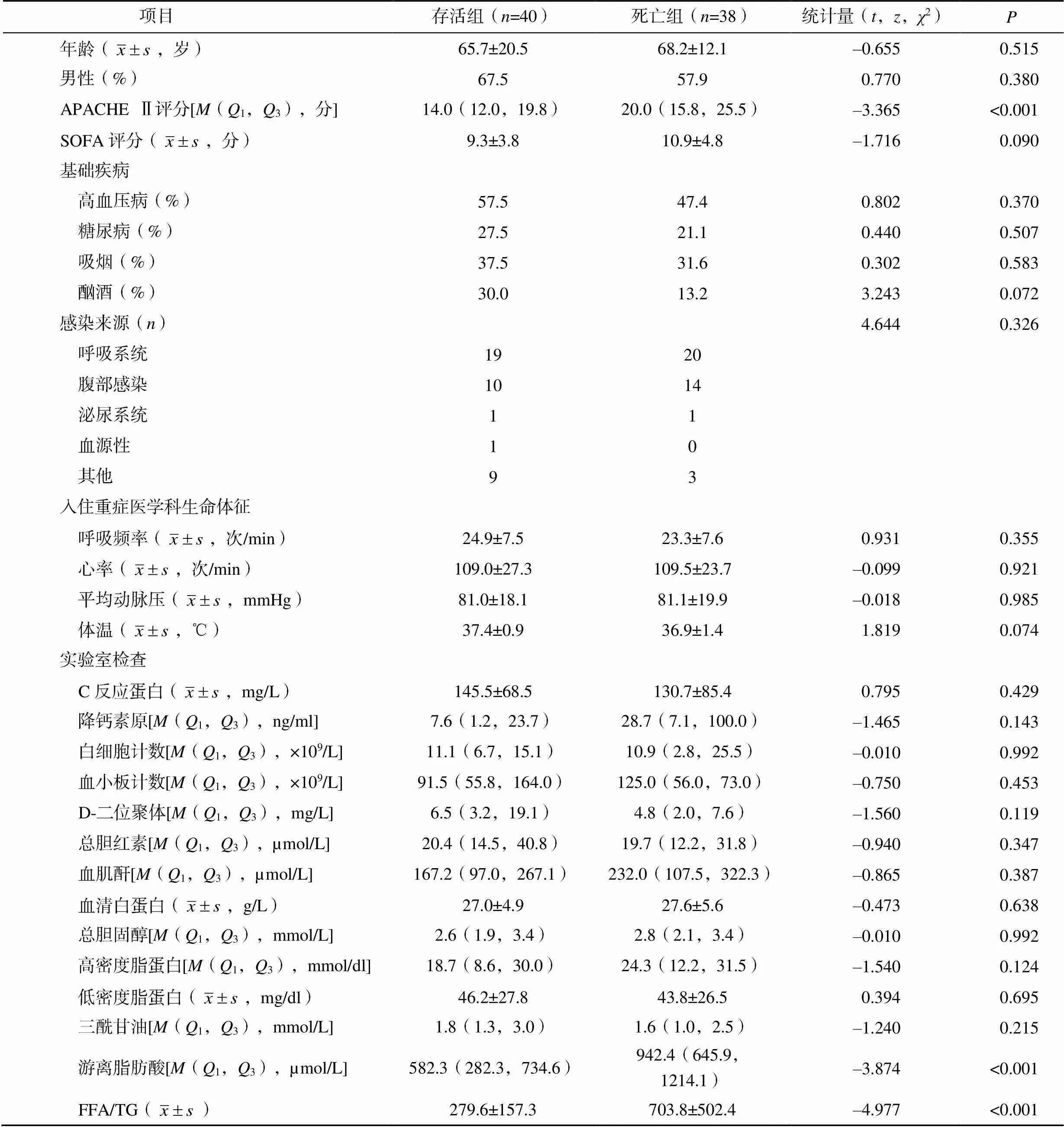
表1 两组患者基线资料比较
注:1mmHg=0.133kPa
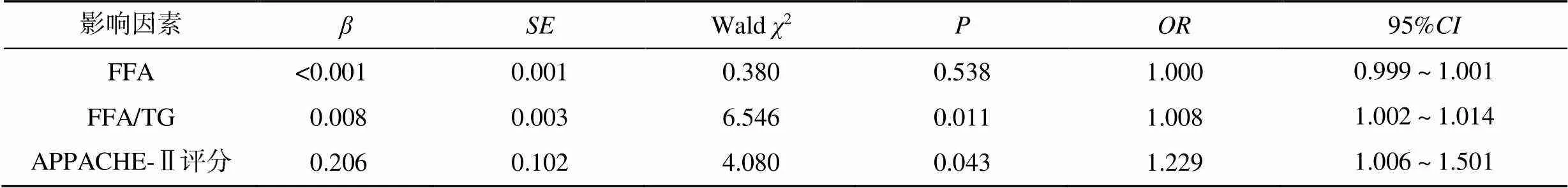
表2 脓毒症患者预后相关危险因素Logistic回归分析
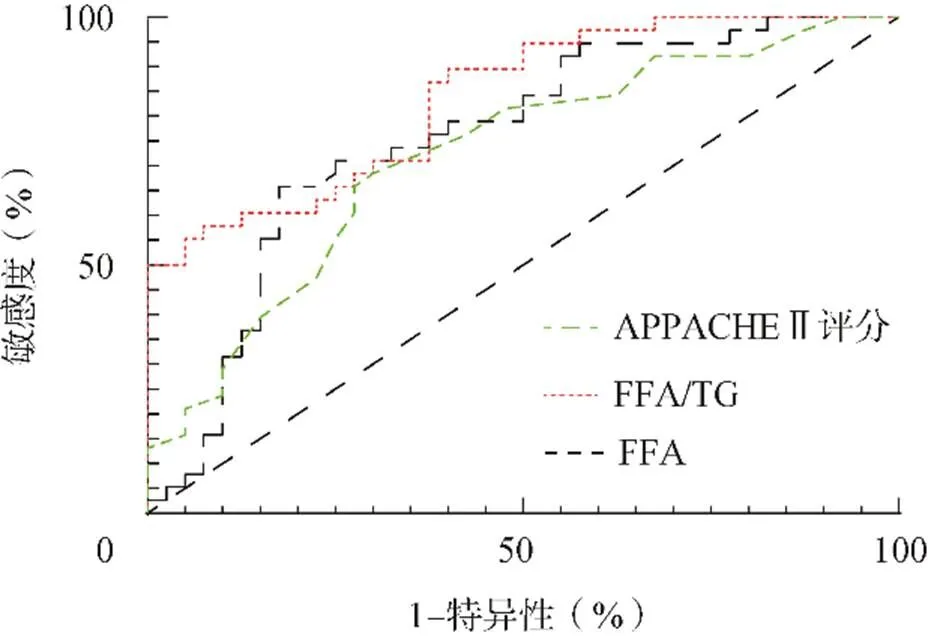
图1 APPACHE-Ⅱ评分、FFA、FFA/TG的ROC曲线
3 讨论
脂肪细胞的细胞质中积累的TG是人体能量的最大储存库,在脓毒症初始阶段,脂肪组织中TG分解增加[9]。一项研究表明,脂多糖能导致部分激素敏感的脂肪酶磷酸化,脂肪分解增加[10]。而脂多糖已被证明在脓毒症时诱导炎症反应[11]。在脓毒症时,已经有研究发现血浆中FFA与TG的水平比健康受试者高4倍[12]。此外,脂多糖和促炎细胞因子可诱导肝脏合成TG和新生脂肪酸[13]。而脓毒症过程中,过氧化物酶体增殖物激活受体-α下调,使FFA不能通过β-氧化充分代谢,导致FFA积累和脂肪毒性的发生,使线粒体损伤,最终导致细胞损伤[14]。
FFA介导的ED涉及多个机制,包括胰岛素信号传导和一氧化氮生成受损、氧化应激、炎症、肾素–血管紧张素系统的激活和内皮细胞的凋亡[15]。研究表明,FFA在胰岛素靶向的组织中会诱导炎症反应,可能是与其介导的磷酸肌醇3-激酶的失活有关[16-17]。FFA升高,直接影响转录因子,从而触发内皮细胞的炎症和氧化应激[18]。此外,FFA还可促进内皮祖细胞的凋亡或者坏死,并介导内皮祖细胞的多种有害作用[19-20]。Steinberg等[21]研究表明,FFA水平升高会损害内皮依赖性的血管的舒张功能,而不影响内皮非依赖性血管,表明FFA对内皮细胞中一氧化氮的产生具有特定的抑制作用。另一项研究证实了FFA作用于内皮细胞钙信号传导和随后的内皮型一氧化氮合酶活性,导致一氧化氮生成减少[22]。此外,研究表明,FFA在诱导吡啉结构域蛋3炎症小体方面的作用可以导致内皮细胞通透性的增加[23]。
目前脓毒症患者血脂代谢方面的研究仍然偏少,关于FFA与脓毒症的研究更是罕见。黄雨晴等[24]研究提示血清总胆固醇、低密度脂蛋白胆固醇可以作为预测脓毒症预后的指标。刘霖敏等[25]回顾了脓毒症患者血脂水平,发现总胆固醇、低密度脂蛋白胆固醇及高密度脂蛋白胆固醇可作为预测脓毒症预后的良好指标。国外一项系统性综述提示血脂水平,尤其是高密度脂蛋白胆固醇水平与脓毒血症炎症反应的强度有关,与预后存在一定的关系[26]。晋正敏等[27]研究了影响脓毒症患者预后的因素,认为年龄、APACHE Ⅱ评分、血乳酸、血降钙素原及血清白蛋白是独立危险因素。而本研究中年龄、血降钙素原、血清白蛋白、血浆总胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇浓度不同预后组差异均无统计学意义,多因素Logistic分析也未纳入,可能与样本量较少有关,但APPACHE-Ⅱ对于脓毒症的预后预测是有价值的。有研究显示,肥胖人群表现出较高的全身血浆FFA转化率,仅提高脂肪量可能就足以提高血浆FFA的含量,基础血脂水平可能影响基础的FFA水平[28]。本研究发现,FFA与脓毒症患者的预后相关,但考虑到不同患者基础血脂水平的差距,以FFA与TG的比值进行研究,发现FFA/TG比单独FFA具有较高的AUC,且比APPACHE-Ⅱ评分的预测价值更大。
综上所述,在脓毒症短期预后预测方面,APPACHE-Ⅱ评分、FFA/TG是脓毒症患者死亡的独立危险因素,而FFA/TG预测价值更大,能提示脓毒症患者的严重程度,考虑FFA提示脓毒症患者能量代谢异常,后续可以进行相关能量代谢方面的研究。
[1] MISTRY J J, HELLMICH C, MOORE J A, et al. Free fatty-acid transport via CD36 drives β-oxidation-mediated hematopoietic stem cell response to infection[J]. Nat Commun, 2021, 12(1): 7130.
[2] 张雁凌, 席建军, 曹中朝. 血清游离脂肪酸与心血管疾病相关性研究进展[J]. 中国心血管杂志, 2021, 26(6): 585–588.
[3] 李想. 范春雨. 游离脂肪酸与冠心病发生发展关系的研究进展[J]. 中西医结合心脑血管病杂志, 2020, 18(3): 446–448.
[4] VIRDIS A. Endothelial dysfunction in obesity: Role of inflammation[J]. High Blood Press Cardiovasc Prev, 2016, 23(2): 83–85.
[5] RHODES A, EVANS L E, ALHAZZANI W, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304–377.
[6] PREAU S, VODOVAR D, JUNG B, et al. Energetic dysfunction in sepsis: A narrative review[J]. Ann Intensive Care, 2021, 11(1): 104.
[7] 许青宗, 郭力鹏, 王向杰, 等. 血脂水平对老年脓毒症患者预后的影响及关联因素分析[J]. 中国医师进修杂志, 2020, 43(2): 122–125.
[8] MITTENDORFER B, MAGKOS F, FABBRINI E, et al. Relationship between body fat mass and free fatty acid kinetics in men and women[J]. Obesity, 2009, 17(10): 1872–1877.
[9] WASYLUK W, ZWOLAK A. Metabolic alterations in sepsis[J]. J Clin Med, 2021, 10(11): 2412.
[10] RITTIG N, BACH E, THOMSEN H H, et al. Regulation of lipolysis and adipose tissue signaling during acute endotoxin-induced inflammation: A human randomized crossover trial[J]. PLoS One, 2016, 11(9): e0162167.
[11] DING J, JIANG H, SU, et al. DNMT1/miR-130a/ZEB1 regulatory pathway affects the inflammatory response in lipopolysaccharide-induced sepsis[J]. DNA Cell Biol, 2022, 41(5): 479–486.
[12] NOGUEIRA A C, KAWABATAM V, BISELLI P, et al. Changes in plasma free fatty acid levels in septic patients are associated with cardiac damage and reduction in heart rate variability[J]. Shock, 2008, 29(3): 342–348.
[13] NONOGAKI K, FULLER G M, FUENTES N L, et al. Interleukin-6 stimulates hepatic triglyceride secretion in rats[J]. Endocrinology, 1995, 136(5): 2143–2149.
[14] VAN WYNGENE L, VANDEWALLE J, LIBERT C. Reprogramming of basic metabolic pathways in microbial sepsis: Therapeutic targets at last?[J]. EMBO Mol Med, 2018, 10(8): e8712.
[15] MALLICK R, DUTTAROY A K. Modulation of endothelium function by fatty acids[J]. Mol Cell Biochem, 2022, 477(1): 15–38.
[16] HAUS J M, SOLOMON T P, MARCHETTI C M, et al. Free fatty acid-induced hepatic insulin resistance is attenuated following lifestyle intervention in obese individuals with impaired glucose tolerance[J]. J Clin Endocrinol Metab, 2010, 95(1): 323–327.
[17] STEINBERG H O, BARON A D. Vascular function, insulin resistance and fatty acids[J]. Diabetologia, 2002, 45(5): 623–634.
[18] NILSSON J, ARES M P, DICHTL W. VLDL and atherosclerosis[M]. Blackwell Publishing, 2007: 85–94.
[19] LEE C H, LEE S D, OU H C, et al. Eicosapentaenoic acid protects against palmitic acid-induced endothelial dysfunction via activation of the AMPK/eNOS pathway[J]. Int J Mol Sci, 2014, 15(6): 10334–10349.
[20] JIANG H, LIANG C, LIU X, et al. Palmitic acid promotes endothelial progenitor cells apoptosis via p38 and JNK mitogen-activated protein kinase pathways[J]. Atherosclerosis, 2010, 210(1): 71–77.
[21] STEINBERG H O, TARSHOBY M, MONESTEL R, et al. Elevated circulating free fatty acid levels impair endothelium-dependent vasodilation[J]. J Clin Investig, 1997, 100(5): 1230–1239.
[22] ESENABHALU V E, SCHAEFFER G, GRAIER W F. Free fatty acid overload attenuates Ca2+signaling and NO production in endothelial cells[J]. Antioxid Redox Signal, 2003, 5(2): 147–153.
[23] WANG L, CHEN Y, LI X, et al. Enhancement of endothelial permeability by free fatty acid through lysosomal cathepsin B-mediated Nlrp3 inflammasome activation[J]. Oncotarget, 2016, 7(45): 73229–73241.
[24] 黄雨晴, 龙春艺, 陈翔, 等. 血脂水平预测脓毒症患者预后的研究[J]. 右江民族医学院学报, 2018, 40(1): 1–4.
[25] 刘霖敏, 陈金良, 徐慧芳, 等. 脓毒症患者血脂水平与其预后的关系[J]. 中国现代医生, 2016, 54(13): 1–4.
[26] GOLOCCI A P B S, MARSON F A L, RIBEIRO A F, et al. Lipid profile associated with the systemic inflammatory response syndrome and sepsis in critically ill patients[J]. Nutrition, 2018, 55–56: 7–14.
[27] 晋正敏, 朱琴, 龙云霞. 严重脓毒症/脓毒症休克患者预后的高危因素[J]. 中华肺部疾病杂志(电子版), 2020, 13(5): 607–611.
[28] HENDERSON G C. Plasma free fatty acid concentration as a modifiable risk Factor for metabolic disease[J]. Nutrients, 2021, 13(8): 2590.
Prognostic value of plasma free fatty acid to triglyceride ratio in patients with sepsis
Department of Intensive Care Unit, Huzhou Central Hospital, Huzhou 313000, Zhejiang, China
To investigate the value of plasma free fatty acid (FFA) and triglyceride (TG) ratio in predicting the prognosis of sepsis.Electronic case information of all patients with sepsis admitted to the Department of Intensive Care Unit Huzhou Central Hospital from January 2019 to December 2020 was collected, and patients meeting the diagnostic criteria for sepsis were included. The patient’s ICU case information and laboratory test data were collected, and the patients were divided into two groups according to their prognosis: survival group (=40) and death group (=38). The differences of baseline data and laboratory indexes were compared between the two groups, and the single factor indexes affecting prognosis were screened out for Logistic regression analysis and receiver operator characteristic (ROC) curve analysis.In univariate analysis, APPACH-Ⅱ score, FFA and FFA/TG in death group were significantly higher than those in survival group (<0.001), and TG, total cholesterol, high density lipoprotein and low density lipoprotein showed no significant difference between the two groups (=0.215, 0.992, 0.124 and 0.695, respectively). There was no statistically significant difference in the companion of other baseline data between two groups. Multivariate Logistic analysis showed that APPACH-Ⅱ score, FFA and FFA/TG were the independent risk factors affecting the prognosis of sepsis patients (<0.05). Area under the curve (AUC) of ROC curev was used to evaluate the predictive value of APPACHE-Ⅱ score, FFA and FFA/TG (0.721±0.058) (0.755±0.056), (0.836±0.044),all<0.001. FFA/TG was superior to APPACHE-Ⅱ and FFA in predicting the prognosis of patients with sepsis.Lipid metabolism disorders exist in patients with sepsis. The prognostic value of FFA/TG in predicting sepsis patients is better than that of APPACHE-Ⅱ score, and the higher the ratio, the worse the prognosis.
Free fatty acids; Triglycerides; Sepsis; Prognosis value
R63
A
10.3969/j.issn.1673-9701.2023.18.005
湖州市科技局公益性应用研究项目(2019GYB10)
谢波,电子信箱:wxystcd@163.com
(2022–09–19)
(2023–05–26)
