垂体促甲状腺激素腺瘤合并桥本甲状腺炎1例并文献复习
2023-07-22姚佳佳刘维徐书杭谢绍锋
姚佳佳,刘维,徐书杭,谢绍锋
患者,男,57岁,因“反复心慌手抖、怕热多汗4年余,加重2个月”于2021年7月14日入院。4年前无明显诱因下出现心慌手抖,怕热多汗,多食易饥伴体质量下降,查甲状腺功能示FT434.76 pmol/L、TSH 10.98 mIU/L、TPOAb 245.6 IU/ml;心电图:心房颤动伴快速心室率;垂体MR:右侧结节;基因检测未发现甲状腺激素抵抗综合征相关基因突变。诊断为“垂体促甲状腺素瘤,甲状腺功能亢进性心脏病”。建议奥曲肽皮下注射控制甲状腺功能亢进症状后手术治疗,患者未遵医嘱,口服倍他乐克(酒石酸美托洛尔)控制心率,用药期间觉症状稍改善。近2个月来自觉心慌手抖、多食易饥、乏力等症状加重。入院后查体:T 36.5℃,P 95次/min,R 18次/min,BP 126/88 mmHg。身高1.72 m,体质量74.6 kg,BMI 25.21 kg/m2。心律绝对不齐,第一心音强弱不等,脉搏短绌,各瓣膜听诊区未闻及病理性杂音。甲状腺功能及相关抗体检查:FT312.30 pmol/L,FT435.59 pmol/L,TSH 6.92 mIU/L,TPOAb 206.10 IU/ml,TRAb、TGAb均为阴性。甲状腺彩色超声:甲状腺弥漫性病变。垂体MR(图1):右翼结节(5 mm×10 mm),考虑腺瘤。心电图:心房颤动。诊断:(1)垂体促甲状腺激素腺瘤;(2)甲状腺功能亢进性心脏病;(3)桥本甲状腺炎。治疗予甲巯咪唑抑制甲状腺素合成,缓解甲状腺功能亢进症状,盐酸普萘洛尔控制心率,病情减轻,2021年8月12日于外院行经鼻腔蝶窦入路鞍区占位切除术,病理结果:垂体腺瘤。免疫组化:肿瘤细胞表达GH(+++),LH(-),ACTH(+++),PRL(+++),FSH(++),TSH(-)。术后未服用抗甲状腺药物,复查TSH恢复至正常范围。2023年4月复查甲状腺功能正常,TPOAb 375.0 IU/ml,进一步证实该患者合并桥本甲状腺炎。
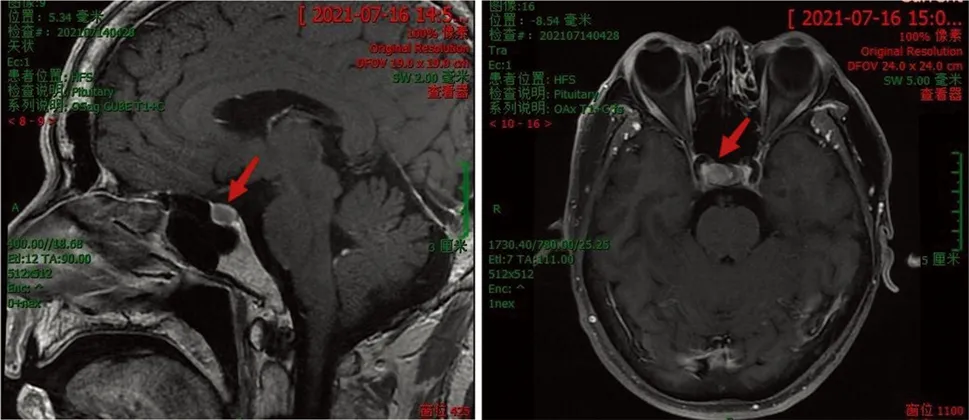
图1 患者2021年7月MR示垂体腺瘤
讨 论垂体促甲状腺激素腺瘤(thyroid-stimulating hormone adenoma,TSH腺瘤)罕见,发病率不足1/100万,占垂体腺瘤的0.5%~3.0%,目前国内外文献报道较少[1]。TSH腺瘤早期体积较小不易检出,易出现漏诊误诊,但近年来随着临床医生对TSH腺瘤的了解增多、影像技术进一步发展,垂体瘤的检出率有升高趋势[2]。
该病起病隐匿,发病初期症状与单纯性甲状腺功能亢进相似,主要包括:(1)TSH分泌过多引起甲状腺毒症症状及甲状腺肿大;部分患者可出现甲状腺功能亢进性心脏病甚至甲状腺功能亢进危象。患者甲状腺肿程度不显著、无突眼和胫前黏液性水肿。(2)垂体压迫症候群:包括肿瘤压迫导致的头痛;视神经通路压迫导致视野缺损、视神经萎缩;垂体前叶功能减退(性腺功能减退)。主要与甲状腺激素抵抗综合征(resistance to thyroid hormone,RTH)进行鉴别诊断。RTH也非常少见,其主要缺陷在甲状腺激素受体,80%~90%的RTH有TRβ或TRα基因突变[3]。本例患者一级亲属中未有甲状腺功能异常者,结合基因检测结果证实无相关基因突变,排除RTH的可能性。
桥本甲状腺炎也称慢性淋巴细胞性甲状腺炎,是一种自身免疫性疾病,临床诊断要点在于TPOAb、TgAb,初期可无症状,随着疾病发展可出现一过性甲状腺功能亢进,最终出现甲状腺功能减退症状。本例患者多次甲状腺功能结果TPOAb均显著升高,彩色超声显示甲状腺弥漫性病变,2017年5月短期内体质量显著下降,伴明显怕热多汗、心慌症状,表示患者当时处于桥本甲状腺炎一过性甲状腺功能亢进期。
本例患者有垂体腺瘤病史4年,有明显代谢亢进症状。结合病史、症状及体征,推测TSH存在自主性分泌,垂体性甲状腺功能亢进可能性大。本次住院期间复查垂体MR示存在垂体瘤,甲状腺功能三项、TPOAb升高,TRAb、TSI未见异常。视野检查出现双眼局限性视野缺损,提示出现垂体瘤占位效应,支持TSH腺瘤合并桥本甲状腺炎诊断。
该患者未见明确手术禁忌证,术前准备阶段需用药物控制甲状腺功能亢进症状,使TSH恢复正常水平。生长激素类似物为术前准备一线用药,二线用药为抗甲状腺药物(ATD),必要时使用普萘洛尔降低心率,避免术中出现甲状腺功能亢进危象引发心力衰竭[4]。药物除了用于围手术期控制症状,亦可用于术后辅助治疗,但长期应用ATD抑制TSH,可能会因为下丘脑—垂体—甲状腺轴的负反馈调节机制导致TSH腺瘤增大[5]。既往有研究表明,使用生长抑素类似物可有效控制TSH腺瘤引起的促甲状腺激素分泌过多和相关甲状腺功能亢进表现,部分患者治疗后肿瘤明显缩小[6-7],且较少出现药物不良反应[8],局限性在于无法彻底清除病灶,且价格高昂。部分肿瘤呈浸润性生长,术后存在复发可能,可采取手术联合术后放疗,然而可能导致垂体功能减退,需要终身服用激素替代药物,因此需要谨慎选择该治疗方式。故对本例患者采用ATD治疗控制甲状腺功能亢进症状作术前准备,治疗4周后患者高代谢症状缓解,病情稳定时于外院行经鼻腔蝶窦入路鞍区占位切除术治疗。
术后免疫组化显示TSH染色阴性,复核结果同前。本例患者临床表现较为典型,尽管免疫组化结果与术前内分泌检查及临床表现不符合,亦不能排除诊断。既往研究中也有相似病例,机制尚不明确,有学者认为这与试剂敏感性有关[9],考虑为术前口服ATD控制症状,抑制了TSH分泌,可能出现TSH免疫组化假阴性。结合患者术后甲状腺毒症症状消失,TSH水平降低等结果,综合分析,维持TSH腺瘤合并桥本甲状腺炎诊断。
此外,本例患者为57岁男性,体型消瘦,否认既往使用糖皮质激素抗甲状腺治疗史,骨密度检查结果提示骨量减少,不能排除与甲状腺功能亢进有关。正常的甲状腺功能对维持骨代谢至关重要,既往文献报道显示,甲状腺功能亢进患者更容易发生骨质疏松[10]。类似地,对于TSH腺瘤患者而言,过量分泌的甲状腺激素可使骨代谢速度加快,导致骨吸收速率大于骨形成速率,最终机体骨密度及骨矿化量水平下降,进而导致骨质疏松,甚至发生脆性骨折,影响患者生活质量,及时进行治疗干预,控制好甲状腺功能对患者骨骼健康十分重要。
本例患者病史较长,病程中未遵医嘱进行规范的抗甲状腺激素治疗,症状逐渐加重,术前MR已提示进展为垂体大腺瘤。既往有研究显示TSH腺瘤术后缓解率较高,约70%的TSH腺瘤患者术后甲状腺功能亢进症状缓解[11],之后将对该患者进行长期随访,观察术后长期疗效。
