抗感染药物致严重药品不良反应/事件5 490例帕累托图分析
2023-07-22黄小理陆海鹏吕聪曾尚勇许江芬赵小英
黄小理,陆海鹏,吕聪,曾尚勇,许江芬,赵小英
由病毒、细菌、真菌等所导致的感染性疾病,是临床常见病与多发病,长期以来严重威胁人类健康。抗感染药物在治疗感染性疾病、挽救患者生命、保障公共卫生安全中,发挥极其重要的作用。但随着抗感染药物的广泛应用,也会导致药品不良反应/事件(adverse drug reaction/event,ADR/ADE)的发生。根据国家药品不良反应监测年度报告(2021年)显示,抗感染药物ADR/ADE报告数量一直居于首位,抗感染药物是ADR监测工作关注的重点[1]。严重ADR/ADE可致患者组织或器官受损,甚至威胁生命安全[2]。严重ADR/ADE是不良反应监测工作的重点,也是衡量不良反应报告可利用度的重要指标之一[1]。本文对广西地区上报至国家药品不良反应监测系统的5 490例抗感染药物致严重ADR/ADE进行帕累托图分析,分析其发生规律和主要影响因素,以期为临床合理使用抗感染药物提供参考。报道如下。
1 资料与方法
收集2017年1月—2019年12月广西地区上报至国家药品不良反应监测系统的抗感染药物致严重ADR/ADE报告5 490例,采用Excel表统计患者年龄、性别、怀疑药品等资料,采用帕累托图分析患者性别、年龄、怀疑药品的药物分类及累及系统/器官,将影响因素分为3类,A类为主要影响因素,其影响程度的累计构成比0~80%,A类为关键的少数;B类为次要影响因素,其影响程度的累计构成比81%~90%;C类为一般影响因素,其影响程度的累计构成比91%~100%[3-4]。
2 结 果
2.1 患者性别和年龄分布 5 490例患者中,男3 174例(57.81%),女2 316例(42.19%)。年龄1 d~96岁,61~70岁患者严重ADR/ADE发生率最高(18.32%),其次是51~60岁患者(16.23%),≤10岁患者发生率为12.90%,51~70岁和≤10岁患者累计构成比为47.45%,见表1。41~80岁和≤10岁为主要影响因素,21~40岁为次要影响因素,11~20岁、≥81岁为一般影响因素,见图1。
2.2 致严重ADR/ADE药品的药物分类 参考《新编药物学》(第17版)将抗感染药物致严重ADR/ADE的怀疑药品进行归类。抗感染药物致严重ADR/ADE怀疑药品种类主要为抗生素(3 464例次,50.35%)和抗结核药(2 140例次,31.10%),见表2。将抗菌药物分类进行帕累托图分析,其中β-内酰胺酶抑制剂及复方制剂(1 300例次,31.56%)、头孢菌素类(1 206例次,29.28%)、喹诺酮类(571例次,13.86%)为主要抗感染药物,见图2。

表1 抗感染药物致严重ADR/ADE患者的性别、 年龄分布

图1 抗感染药物致严重ADR/ADE患者年龄的帕累托图
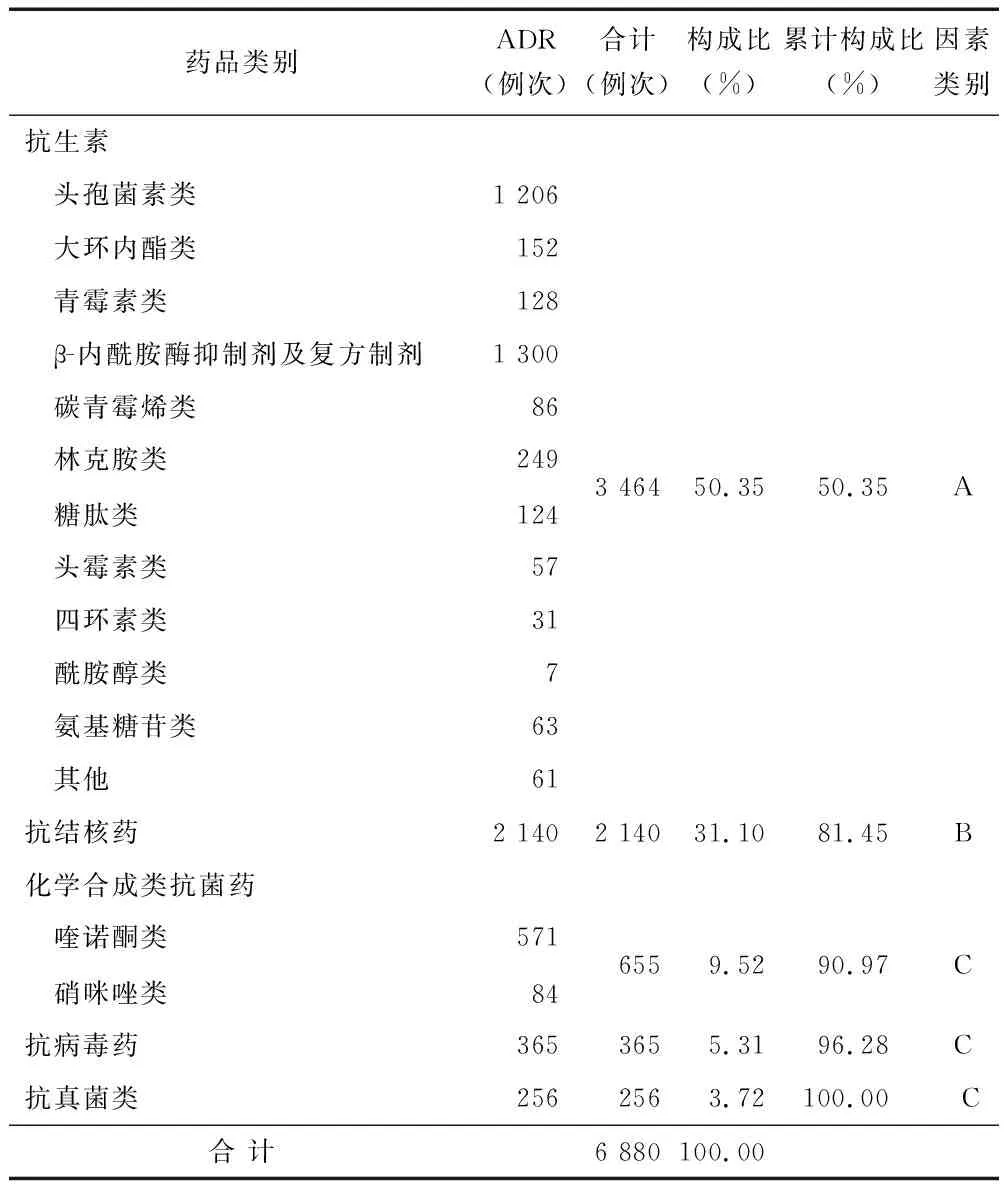
表2 致严重ADR/ADE药品的药物分类
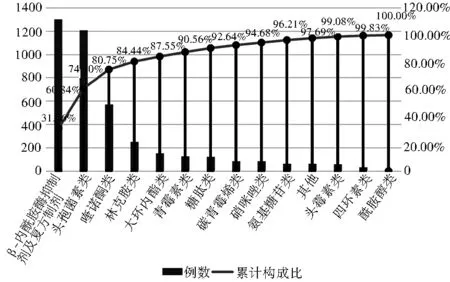
图2 严重ADR/ADE的抗菌药物分类帕累托图
2.3 累及系统/器官及临床表现 依据WHO药品ADR分类方法,将抗感染药物致严重ADR/ADE按照累及系统/器官进行归纳和总结。累及系统/器官及临床表现中全身症状最为常见(22.25%),见表3;累及系统/器官及临床表现主要为全身症状(2 414例次,22.25%)、皮肤及其附属器(2 290例次,21.10%)、肝胆系统(1 385例次,12.76%)、内分泌系统(1 105例次,10.18%)、血液系统(820例次,7.56%),见图3。

图3 严重ADR/ADE累及系统/器官的帕累托图
3 讨 论
3.1 患者性别、年龄与严重ADR/ADE 5 490例抗感染药物致严重ADR/ADE中男性多于女性,与熊波等[5]报道的男女比例1∶1.55不一致,但与姚欢等[6]报道的男女比例1.35∶1相似。发生严重ADR/ADE患者年龄的帕累托图显示,41~80岁和≤10岁为主要影响因素,其中51~70岁和≤10岁发生严重ADR/ADE的比例最高。老年患者生理功能减退,常合并基础疾病同时服用多种药物,可能导致抗感染药物与其他药物产生药物相互作用,导致严重ADR/ADE的发生率增加。≤10岁儿童的肝肾尚未发育成熟、酶系统不足或缺乏,药物的吸收、代谢、排泄与成人有较大差异,且部分儿童尚不能清晰描述用药引起的不适症状,故儿童用药应严格把握适应证,病毒性感染不宜应用抗菌药物,应根据体表面积或体质量计算药物剂量,加强患儿治疗过程中的疗效监护和不良反应监护。因此,在使用抗感染药物治疗过程中,应重点关注老年和儿童患者,加强药学监护和患者教育,加强血药浓度监测,根据血药浓度监测结果调整给药方案,个体化用药,使抗感染治疗安全有效。
3.2 药品种类与严重ADR/ADE 抗感染药物致严重ADR/ADE怀疑药品种类主要是抗生素(3 464例次,50.35%)和抗结核药(2 140例次,31.10%)。抗生素致严重ADR/ADE比例最高可能与临床用量大有关。结核病是严重危害公众健康的全球性公共卫生问题,中国是全球第二大结核病高负担国家[7]。我国大多数结核病患者的收入处于平均水平以下,结核病在中国是贫困病[8]。我国西部地区患病率约为中部地区的1.7倍,是东部地区的2.4倍;农村地区的患病率约为城镇地区的1.6倍[9]。文献报道南宁市农村地区结核病年均报告发病率为68.15/10万[8]。抗结核药致严重ADR/ADE居第二位可能与广西地区结核病的流行趋势有关。且抗结核须多药联合治疗,大大增加过敏反应和肝肾损害发生率。在开展抗结核治疗前,应全面了解患者的药物过敏史、肝肾疾病史,根据患者的肝肾功能情况选择抗结核药物种类及剂量,临床药师应向患者作详细的用药宣教,治疗期间定期监测肝肾功能。
由于抗菌药物在抗感染药物中用量最大,本研究对严重ADR/ADE的抗菌药物分类作帕累托图分析,结果显示β-内酰胺酶抑制剂及复方制剂(1 300例次,31.56%)、头孢菌素类(1 206例次,29.28%)、喹诺酮类(571例次,13.86%)为主要影响因素。β-内酰胺酶抑制剂能抑制大多数β-内酰胺酶,使β-内酰胺类抗菌药物抗菌活性增强、抗菌谱增加,因此β-内酰胺酶抑制剂及复方制剂是临床治疗产β-内酰胺酶细菌感染的重要选择[10]。但不合理配比的β-内酰胺酶抑制剂复方制剂可能导致细菌耐药性增加,因此尽量避免使用指南未推荐的非典型β-内酰胺酶抑制剂类药物[11-12]。在制定抗感染方案时应明确患者的感染部位,尽可能寻找病原学证据,评估患者感染严重程度,结合患者近3个月住院史和抗感染药物使用情况选择抗菌药物,不超前使用β-内酰胺酶抑制剂复方制剂,防止发生严重ADR/ADE和过早产生细菌耐药性。β-内酰胺酶抑制剂及复方制剂和头孢菌素类均属β-内酰胺类,该类抗菌药物最常见不良反应是过敏反应[13]。因此,使用β-内酰胺类药物应密切进行不良反应监护。

表3 严重ADR/ADE的临床表现、累及系统/器官
本研究结果显示,喹诺酮类也是引起严重ADR/ADE的主要抗菌药物。喹诺酮类药物因抗菌谱广、抗菌力强、组织浓度高,一直作为临床治疗细菌感染性疾病的重要选择[14]。计紫超等[14]统计喹诺酮类ADR/ADE中2.42%为严重ADR/ADE,喹诺酮类药物ADR/ADE发生与患者年龄、给药途径、合并用药有一定关系。因此,使用喹诺酮类药物应关注老年患者,对于轻、中度感染的大多数患者尽量选择口服治疗,同时尽量避免选择产生严重药物相互作用的合并用药。
3.3 严重ADR/ADE累及系统/器官 严重ADR/ADE累及系统/器官的帕累托图显示,抗感染药物致严重ADR/ADE主要累及全身症状(2 414例次,22.25%)、皮肤及其附属器(2 290例次,21.10%)、肝胆系统(1 385例次,12.76%)、内分泌系统(1 105例次,10.18%)、血液系统(820例次,7.56%)。
全身症状占比最高,主要表现为过敏性休克(854)、高热(446)、发热(358)、寒战(369)。抗感染药物导致的过敏性休克大多数是特异性IgE介导的变态反应,通常在给药后数分钟到1 h之内发生[15]。因此,《β-内酰胺类抗菌药物皮肤试验指导原则(2021年版)》[16]建议临床使用抗菌药物除规范皮试操作外,还强调甄别过敏史、配备抢救药品和设备、规范抢救流程的重要性。临床使用抗感染药物应在用药开始1 h内密切监护患者症状和体征,一旦发生过敏性休克及时抢救。药物热是严重ADR/ADE全身症状中最主要的表现,包括高热、发热和超高热。本研究均是发生在抗感染过程中的药物热,容易误诊、漏诊。因此,医师和临床药师应仔细评估患者临床症状与体征,血常规、降钙素原、C反应蛋白等炎性指标,影像学检查变化情况,结合患者每天开始发热时间与输液时间(应核对护理输液单),鉴别患者是否药物热,最有效的鉴别方式和治疗手段是停用致热药物。大部分药物热一般在停药48~72 h内退热,极少数因伴随斑丘疹等高敏表现或药物清除率低,发热持续数天到数周[17]。因此,在抗感染治疗过程中如果患者再次发热,医师和临床药师对患者是否感染加重还是药物热的鉴别是患者转归的关键点之一。
抗感染药物致严重ADR/ADE累及皮肤及基附属器居第二位,主要表现为过敏样反应(814例次)、皮疹(497例次)、瘙痒(465例次),均为过敏症状,因此应重点关注患者使用抗感染药物后的过敏症状和体征。
抗感染药物致严重ADR/ADE累及肝胆系统居第三位,主要表现为肝功能异常(1 016例次)、肝损害(227例次),均为药物性肝损伤。有研究报道,抗感染药物为引发药物性肝损伤的常见药物类别之一,其中发生频次最高的是抗生素、抗结核药和化学合成类抗菌药[18]。研究还发现,抗感染药物相关的药物性肝损伤多发生在用药2周内[18]。因此在使用有肝损伤风险的抗感染药物时,在用药2周内密切观察患者临床症状,监测肝功能以期尽早发现药物性肝损伤。
抗感染药物致严重ADR/ADE累及内分泌系统居第三位,主要表现为高尿酸血症(838例次)、血尿酸增加(257例次),均为血尿酸升高。引起血尿酸升高的抗感染药物主要为抗结核药,其中吡嗪酰胺和乙胺丁醇可通过减少尿酸排泄和增加尿酸重吸收而增加尿酸水平[19]。研究报道吡嗪酰胺显著降低尿酸排泄,而利福平和异烟肼可增加尿酸排泄[20]。因此,吡嗪酰胺和利福平或异烟肼联合应用,可能减少高尿酸血症的发生[21]。吡嗪酰胺停药后血尿酸水平很快降至正常水平,不影响抗结核方案的实施[21]。本研究提示,在抗结核治疗(含吡嗪酰胺和乙胺丁醇)时要定期监测血尿酸水平。
抗感染药物致严重ADR/ADE累及血液系统居第四位,主要表现为血小板减少(226例次)和白细胞减少(208例次)。文献报道,药源性血小板减少中抗感染药物导致血小板减少构成比最高(40.53%),其中利奈唑胺为最常见的致血小板减少的药物[22]。真实世界研究结果显示,利奈唑胺致血小板减少发生率为8.67%[23]。此外,本研究提示白细胞减少也是累及血液系统的主要表现。抗感染药物中β-内酰胺类药物引起白细胞减少最常见[24]。因此,在抗感染治疗过程中,白细胞减少可能是疗效的体现,但也应警惕药物不良反应,尤其是血小板减少。
综上所述,广西地区使用抗感染药物时,应重点关注中老年和儿童患者的不良反应,尤其是在使用抗菌药物(β-内酰胺酶抑制剂及复方制剂、头孢菌素类、喹诺酮类)和抗结核药物时更加密切监护,重点监护患者是否发生过敏症状、发热、肝损伤、血尿酸升高、血小板减少和白细胞减少等不良反应。为减少抗感染药物导致的严重ADR/ADE,临床药师应协助开展抗菌药物科学化管理(antimicrobial stewardship,AMS),通过多学科合作对抗菌药物进行精细化管理,采用最佳抗菌治疗的药物选择、剂量和用药时间,以期达到临床治疗或预防感染的最佳结果并最大可能减少患者的药物毒性和耐药的产生[25-26]。
利益冲突:所有作者声明无利益冲突。
