黄豆黄素纯度标准物质研制
2023-07-20刘清毅李全发周剑王敏杨梦瑞王彤彤于寒松
刘清毅,李全发,周剑,王敏,杨梦瑞,王彤彤,于寒松
(1.中国农业科学院农业质量标准与检测技术研究所,农业农村部农产品质量安全重点实验室,北京 100081;2.吉林农业大学食品科学与工程学院,长春 130118)
黄豆黄素是一种大豆异黄酮,具有雌性激素及抗雌激素性质。它对于降低前列腺癌、乳腺癌等疾病的发病率,减轻骨质疏松症和其它因雌激素缺乏导致的综合症具有重要功效,而且它还可以预防心血管等疾病[1]。大豆异黄酮也可以用作动物生产的调节剂和促进剂,起到促进动物繁殖、泌乳和生长的作用[2]。鉴于其具有多种有益功效,黄豆黄素常被作为一种功能强化剂添加入食品、保健品或饲料产品中[3],然而,经国家标准物质资源平台查询,目前还没有黄豆黄素纯度标准物质,市售标准品良莠不齐,存在量值偏差,制约了黄豆黄素的准确测量。
标准物质作为保证测量准确性的重要因素,在量值传递、评价方法和仪器校准中发挥着重要作用。笔者采用市售标准品,经过纯化处理和定性确证后,采用两种不同原理的高准确度纯度定值方法定值,满足JJF 1855—2020[4]对于纯度标准物质研制的要求,对于保证黄豆黄素含量的准确测量提供了技术支撑。
1 实验部分
1.1 主要仪器与试剂
红外光谱仪:IRT racer-100型,日本SHIMADZU公司。
质谱仪:(1)Triple Quad 3500 型;(2)TOF MS6600型。美国AB SCIEX公司。
核磁共振仪:AVANCE Ⅲ型,400 MHz,瑞士布鲁克公司。
电子天平:(1)UMX2 型,感量为0.001 mg;(2)XS105 型,感量为0.01 mg。瑞士梅特勒-托利多公司。
水分滴定仪:DL32 型,瑞士梅特勒-托利多公司。
气相色谱仪:7890型,配有7697 A顶空进样器,美国安捷伦科技有限公司。
高效液相色谱仪:2695型,美国沃特世公司。电感耦合等离子体质谱仪:X series 2 型,美国赛默飞世尔科技公司。
真空冷冻干燥机:Genesis 25L 型,中国香港德祥公司。
电恒温培养箱:DHP-600 s型,温度范围为25~65 ℃,上海科恒实业发展有限公司。
黄豆黄素标准品:标称纯度(质量分数)大于98%,四川格纯生物医药有限公司。
苯甲酸标准物质:国家一级标准物质,标准物质编号为GBW 06117,纯度(质量分数)为99.993%,中国计量科学研究院。
氘代乙酸、氘代甲醇、氘代N,N-二甲基甲酰胺、氘水和氘代二甲基亚砜:分析纯,北京百灵威科技有限公司。
甲醇、乙醇、乙腈、丙酮、二氯甲烷、乙酸乙酯、异丙醇、二甲苯、正己烷:色谱纯,德国默克公司。
磷酸、硝酸、双氧水:优级纯,上海阿拉丁生化科技股份有限公司。
铝、钙、铜等单元素溶液标准物质:标准物质编号、各元素质量浓度见表1,中国计量科学研究院。

表1 单元素溶液标准物质
1.2 实验方法
1.2.1 原料纯化
选用黄豆黄素标准品作为标准物质候选物,使用烘箱和真空冷冻干燥机对样品进行加热和冷冻干燥除水,使用卡尔费休库伦滴定法确定样品含水量为0.30%。初测液相纯度大于99%。
1.2.2 定性分析
分别采用红外光谱法、质谱法和核磁氢谱法,对纯化后的黄豆黄素原料进行定性确认。
1.2.3 均匀性检验
根据JJF 1343—2012[5]的技术要求,对分装好的黄豆黄素标准物质随机抽样,抽样原则应尽量覆盖分装过程各个时间段,随机抽取11个包装单位进行均匀性检验,每个单元配制三个子样,称样量均为5 mg,分别配制成质量浓度为500 mg/L 的甲醇溶液,对配制的溶液进行编号,从1到11。每个溶液进行3次测定,测定顺序依次为1,2,3,…,11;11,10,9,…,1;1,2,3,…,11。
1.2.4 稳定性检验
标准物质的稳定性是其基本属性,主要包括长期保存的稳定性和运输过程中的稳定性。以JJF 1343—2012的基本要求为基础,设计了长期稳定性检验试验和短期稳定性检验试验,均采用拟合直线对试验结果进行统计分析。长期稳定检验采用规范推荐的经典评估方式,时间点为0、1、3、6、12 个月;短期稳定性检验采用规范推荐的同步检验方式,温度分别设定为20、40、60 ℃,考察时间为0、1、3、5、7天。
1.2.5 纯度定值
(1)质量平衡法纯度定值。质量平衡法[6]也叫杂质扣除法,是一种对目标化合物主成分纯度、各个杂质分别测量,并获得目标物最终纯度的方法。本实验采用液相色谱主成分色谱峰面积归一化法[7]测定黄豆黄素纯度,采用卡尔费休库伦法[8]测定水分含量,采用顶空气相色谱法[9]测定挥发性杂质含量,采用电感耦合等离子体质谱法[10]测定不挥发性杂质含量。测量设备如天平、容量瓶、液相色谱等仪器均经过计量检定,以保证测量结果的准确性、溯源性。
(2)定量核磁法纯度定值。定量核磁法[11]是通过测量目标物和内标的不同原子核共振吸收峰的面积,并结合吸收峰对应的原子数计算目标物纯度值,这种纯度定值方法主要通过选择国家一级纯度标准物质作为内标物,采用内标法定值,通过优化核磁条件,准确测量不同原子核吸收峰,进一步实现纯度的准确测量,并将定量核磁测量结果通过有证纯度标准物质直接溯源到SI单位。
1.2.6 不确定度评定
研制的纯度标准物质的不确定度来源主要包括三个方面,分别是(1)定值过程引入的不确定度;(2)纯度不均匀引入的不确定度[12];(3)不稳定性引入的不确定度[13]。其中定值过程引入的不确定度按照JJF 1855—2021 进行评定,主要包括质量平衡法定值引入的不确定度和定量核磁法定值引入的不确定度。
2 结果与讨论
2.1 标准物质候选物选择及纯化
选用四川格纯生物医药有限公司市售的黄豆黄素作为标准物质候选物,使用烘箱和真空冷冻干燥机对样品进行加热和冷冻干燥除水后,使用卡尔费休库伦滴定法确定样品含水量为0.30%。初测液相纯度大于99%。使用1.5 mL 棕色进样小瓶对充分混匀的样品,在洁净、干燥的环境下[温度(20±5) ℃,湿度(40±10)%进行分装。每瓶样品包装量为20 mg,共分装113个单元,分装好的样品贮存于干燥器内,于(20±5) ℃下干燥避光保存。
2.2 定性分析
图1 为黄豆黄素标准物质候选物红外光谱图,对特征峰进行归属分析,主要特征吸收峰跟黄豆黄素结构相符合。图2为黄豆黄素标准物质候选物的质谱图,主要碎片离子质荷比(m/z)分别为285.1、270.1、242.2,与文献[14]记载的定性离子对相符合,经过分析可知,这些质谱峰分别属于[M+H]+、[M+H-OH]+和[M+H-CHO]+。
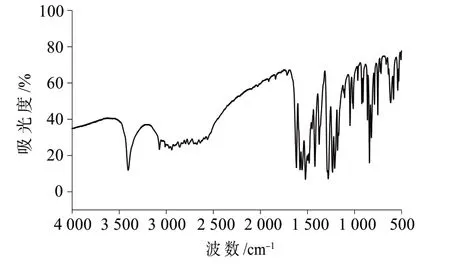
图1 黄豆黄素标准物质候选物的红外光谱图
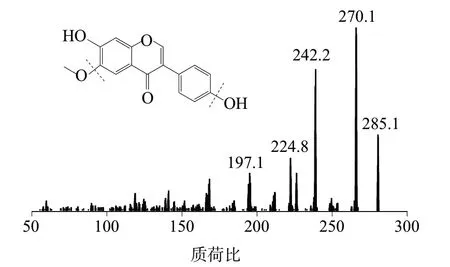
图2 黄豆黄素标准物质候选物的质谱图
图3 为黄豆黄素标准物质候选物的核磁氢谱图,典型的化学位移值均与黄豆黄素结构相对应,分别为3.86×10-6对应于21 号C 上所连的氢;6.79×10-6~6.83×10-6对应于14、16 号碳上所连的氢;6.94×10-6对应于6 号碳上所连的氢;7.37×10-6~7.39×10-6对应于13、17 号碳上所连的氢;7.43×10-6对应于3 号碳上所连的氢;8.26×10-6对应于22 号C上所连的氢;9.50×10-6对应于18 号C 上所连的氢。经红外、质谱和核磁多种定性手段分析,可以确认标准物质候选物为黄豆黄素。
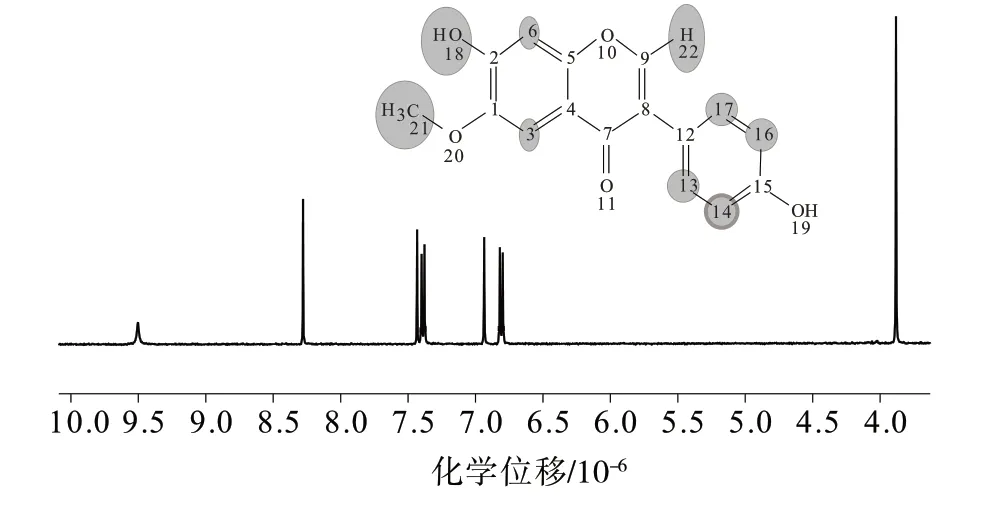
图3 黄豆黄素标准物质候选物的核磁氢谱图
2.3 均匀性检验
按照1.2.3 方法进行黄豆黄素纯度标准物质均匀性检验,测量结果见表2。由表2数据计算得总标准偏差s=0.02,总平均值为99.19%,组间方差和为0.000 58,组内方差和为0.000 35,F=1.64。查表知F0.05(10,22)=2.30,F<F0.05(10,22),表明当取样量为5 mg时,样品均匀性良好,因此,在本标准物质研制项目中,黄豆黄素纯度标准物质以5 mg 作为最小取样量。
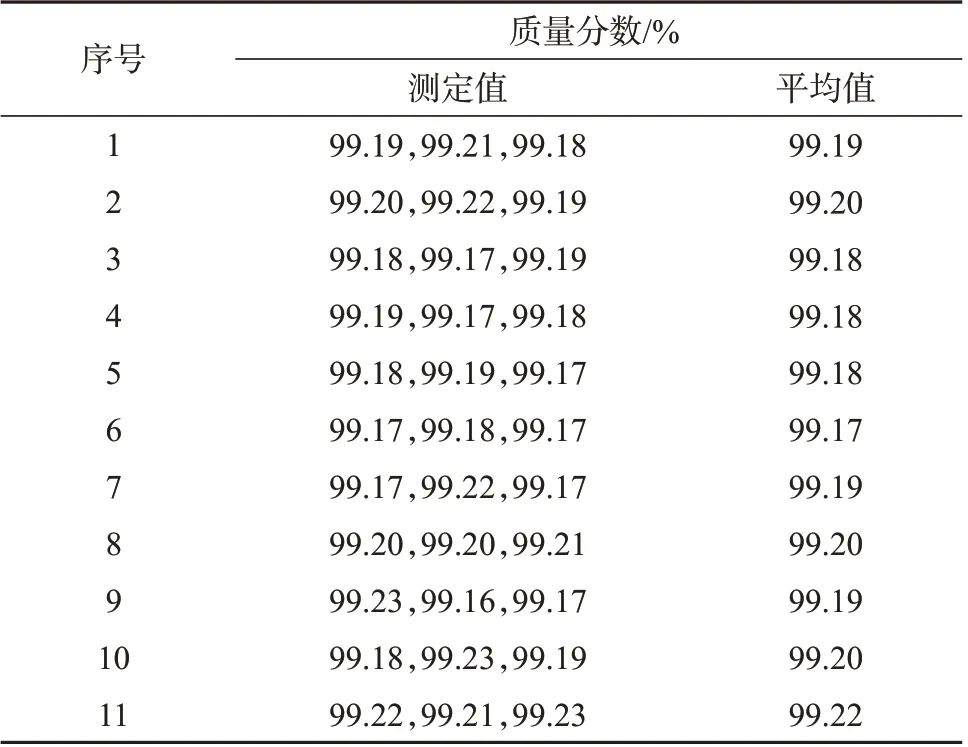
表2 黄豆黄素纯度标准物质量值均匀性评定结果
2.4 稳定性检验
按照1.2.4方法,按照先密后疏的原则对黄豆黄素纯度标准物质稳定性进行检验,表3和表4分别为长期稳定性检测结果和统计结果,表5和表6分别是短期稳定性检验结果和统计结果。斜率β1和截距β0是对各个时间点检测结果平均值拟合直线获得,统计结果均显示|β1|<t0.95,3∙s(β1)。所以判断本标准物质在设定的保存温度下,12个月内量值没有趋势性变化。在低于60 ℃的运输条件下,7天内可保证纯度量值稳定。
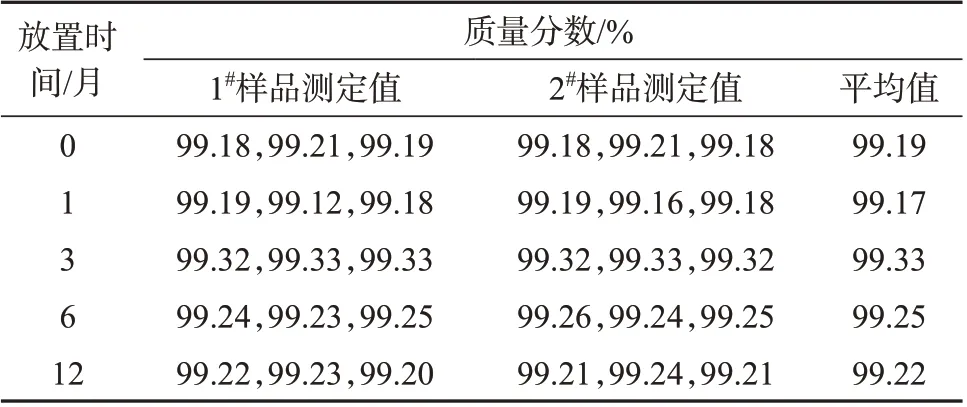
表3 黄豆黄素纯度标准物质长期稳定性检测结果

表4 黄豆黄素纯度标准物质长期稳定性统计结果
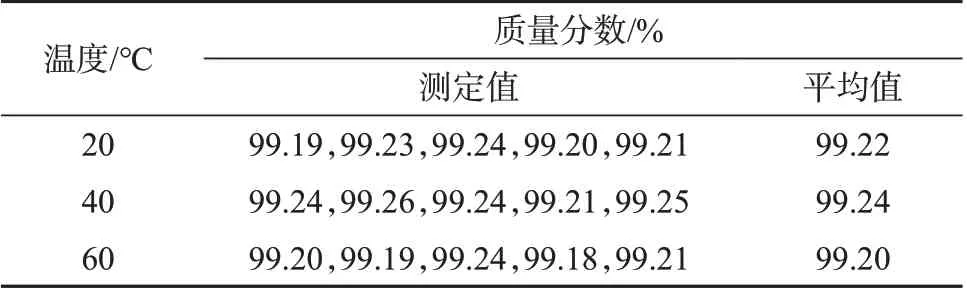
表5 黄豆黄素纯度标准物质量值短期稳定性检验结果

表6 黄豆黄素纯度标准物质量值短期稳定性检验结果
2.5 纯度定值
2.5.1 质量平衡法纯度定值
质量平衡法按照式(1)对黄豆黄素纯度标准物质定值:
式中:PMB——样品质量分数;
P0——主成分质量分数;
XW——水分质量分数;
Xn——非挥发性杂质质量分数;
Xv——挥发性杂质质量分数[15]。
通过比较不同色谱柱、不同流动相、不同分析波长,确定最优的检测条件,主要包括采用Agilent Plus -C18(250 mm×4.6 mm,5.0 μm)液相色谱柱,采用乙腈和0.15%磷酸水溶液作为流动相,流动相体积比为25:75,流量为1.0 mL/min,检测波长选择261 nm。将目标标准物质样品配制成500 mg/L 的甲醇溶液,在上述色谱条件下平行测定6次,得到主成分的质量分数。
采用卡尔费休法进行水分测定,测定前采用固体水分标准物质校准测量方法,对黄豆黄素水分含量进行6 次平行测定,每次取样质量为5~7 mg,因为是固体进样,测量过程中开盖容易引入空气中的水分,造成测量不准确[16],因此水分测定结果应扣除试验过程中开盖引入的空气中水分值,该水分值采用模拟加样过程测定获得。
采用基于氢火焰检测器的顶空气相色谱法对挥发性杂质进行测定,称取20 mg 黄豆黄素于20 mL顶空瓶中,加入2 mL 二甲亚砜溶解,采用甲醇、乙醇、乙腈、丙酮、二氯甲烷、乙酸乙酯、异丙醇、二甲苯、正己烷9种有机溶剂为挥发性杂质的对照,用单点法定量。
采用电感耦合等离子体质谱法分析黄豆黄素中23种常见元素含量,以元素含量之和作为不挥发性杂质含量。
黄豆黄素纯度标准物质主成分、水分、有机挥发性杂质、无机非挥发性杂质含量测定及标准物质定值结果列于表7。

表7 黄豆黄素纯度标准物质质量平衡法纯度(质量分数)定值结果%
2.5.2 定量核磁法纯度定值
定量核磁法按照式(2)对黄豆黄素纯度标准物质定值[17]:
式中:PNMR——黄豆黄素质量分数;
Ix——黄豆黄素定量峰的积分面积;
Istd——内标物苯甲酸定量峰的积分面积;
nstd——内标物苯甲酸化学式中定量峰对应的H原子数量;
nx——黄豆黄素在化学式中定量峰对应的H原子数量;
Mx——黄豆黄素的相对分子质量;
Mstd——内标物苯甲酸的相对分子质量;
mstd——添加的内标物苯甲酸的质量,g;
mx——黄豆黄素的称样质量,g;
Pstd——内标物苯甲酸的纯度(质量分数)。
为保证定量核磁法定值的准确性,针对氘代溶剂、内标物、定量峰位置、激发脉冲角度、弛豫时间以及累计采样次数进行了试验,经优化确定定值用核磁条件:激发脉冲角度为30°,采样时间为4.823 5 s,时间域数据点为64 K,扫描谱宽(SWH)为17.0×10-6,激发中心(O1P)为8.15×10-6,扫描宽度为6 793.478 Hz,弛豫延迟(D1)为13.99 s,偏置频率为3 253.22 Hz,接收增益为322,探头温度为293.8 K,脉冲序列为zg30,累计采样次数为128次,定量峰为8.36×10-6(Hz)和8.02×10-6(dt,J = 8.0,2.0 Hz)。定量核磁法对黄豆黄素纯度标准物质6 次定值结果均值为99.13%,标准偏差为0.023%。
按照JJF 1855—2020 要求,对不同的定值结果应采用F检验进行等精度检验,然后再采用t检验进行平均值一致性检验,本研究中,两种定值方法的结果均通过了F和t检验,说明两种方法等精度且平均值一致,因此,黄豆黄素纯度标准物质的量值以两种定值结果的平均值表示,最终定值结果为99.1%。
2.6 定值不确定度
黄豆黄素纯度标准物质的定值不确定度主要来源于:(1)样品均匀性;(2)样品稳定性;(3)定值方法。表8列出了各不确定度分量,将表8数据合成,得到定值结果的相对标准不确定度urel=0.15%,取包含因子k=2,则相对扩展不确定度Urel=k·urel=0.3%,扩展不确定度为0.3%,定值结果为(99.1±0.3)%。
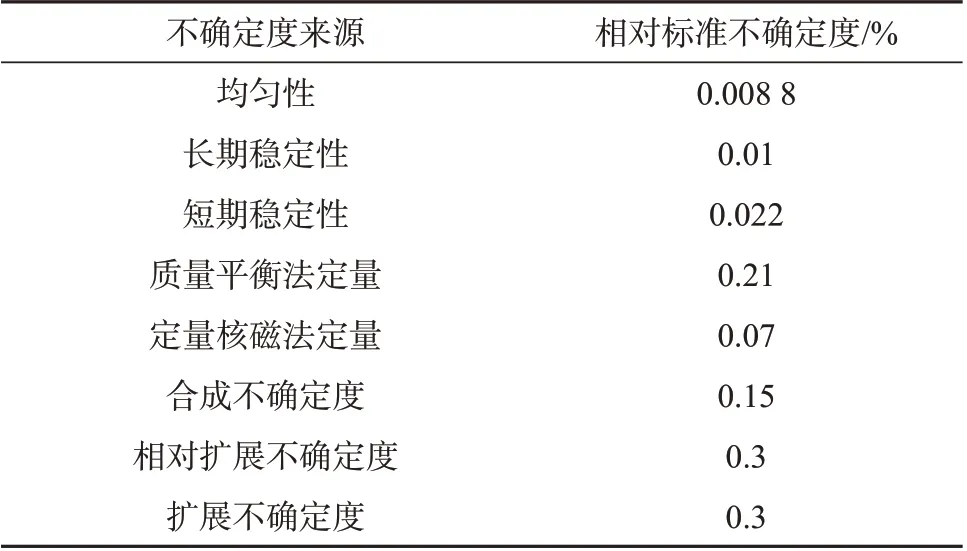
表8 黄豆黄素标准物质不确定度评定结果
3 结语
采用三种方法对经纯化处理后的黄豆黄素标准物质进行定性分析,并确证样品。采用两种不同原理的方法对标准物质进行纯度定值,采用质量平衡法进行均匀性检验和稳定性检验,并对定值结果的不确定度进行了系统评定。研制的黄豆黄素纯度标准物质已经成功申报国家一级标准物质。
