基于Y型DNA结构和磁分离的荧光生物传感器同时检测Pb2+和Cd2+
2023-07-20毋培培丁国涛梁瑞瑞索志光
马 军,郭 蕊*,毋培培,丁国涛,游 静,梁瑞瑞,索志光*
1.河南省产品质量检验技术研究院, 河南 郑州 450002
2.河南工业大学 粮油食品学院,河南 郑州 450001
重金属离子具有分布广泛、蓄积性和高毒性等特征,生物危害性较强。调查研究发现,包括Pb2+、Cd2+在内的多种重金属经常共存于食物和生物系统中[1]。Pb2+作为最危险的重金属之一,机体摄入主要导致神经系统紊乱、肝肾疾病、生育能力下降[2]。国际癌症研究机构(IARC)已在1993年将镉列为第Ⅰ类人类致癌物[3]。研究表明,呼吸系统疾病及肾脏疾病的发生与Cd2+关系密切[4]。饮用水中Pb2+和Cd2+的最大允许浓度为世界卫生组织(WHO)所规定的48 nmol/L和27 nmol/L[5]。有学者在水果和蔬菜样品中发现Pb2+、Cd2+及Hg2+等重金属离子共存,浓度较多在100~200 nmol/L范围内[6]。因此,迫切需要开发灵敏有效的方法对多种重金属离子进行同时检测。
目前,常采用原子吸收光谱(AAS)[7]、电感耦合等离子体质谱(ICP-MS)[8]、电感耦合等离子体原子发射光谱(ICP-AES)[9]或者与高效液相色谱相结合[10]的方法对Pb2+和Cd2+进行检测。上述传统检测方法依赖大型精密仪器,存在操作费时费力、仪器昂贵复杂、无法实时检测等缺点[11]。因此,建立灵敏、可靠、便捷的方法同时检测和定量两种或两种以上的重金属离子具有重要意义。
适配体(Aptamer,Apt)是通过指数富集配体进化技术从体外筛选出的单链寡核苷酸序列(DNA或RNA),能特异性识别靶标并形成特殊的二级结构[12]。有研究报道,金属类靶标分子通常与适配体的嘌呤和嘧啶基团上带负电的部分结合而被识别[13]。核酸酶(DNAzyme)是具有催化活性的DNA或RNA分子,大多数DNAzyme需要金属离子作为辅助因子才能表现出催化活性[14]。两者作为功能核酸中的两大类,相比抗体、多肽等其他生物识别元件,以特异性强、稳定性好和易于设计修饰等优点而被广泛使用。
功能核酸通常与不同信号转换方式相结合构建出不同类型的生物传感器,实现对靶标的定性和定量分析。其中,比色、光电化学及电化学生物传感器存在准确度低和耗时等缺点,而荧光生物传感器具备灵敏度高、成本低、操作方便、效率高的优势,更适用于金属离子的检测。近年来,已经报道了许多用于食品及环境中重金属离子检测的荧光生物传感器[15-16]。利用DNA的可编程性设计而成的高阶结构往往具有优异的机械刚度和稳定性,如Y型和四面体型DNA纳米结构。这些结构已经被运用到荧光生物传感器的构建当中,有利于实现目标物的多重检测[17]。根据均一体系中荧光基团与猝灭基团之间的荧光共振能量转移作用所构建的荧光传感器往往存在背景信号高、成本昂贵的缺点[18]。利用磁性材料——磁珠(Magnetic beads, MBs)的固载和磁分离能力不仅能起到降低背景信号、增强灵敏度的作用,还能在不使用猝灭基团的情况下,实现靶标存在时荧光信号的变化[19-20]。
作者利用特异性高、稳定性好、易于修饰的适配体和DNAzyme对靶标进行识别,Y型DNA结构的设计可以实现双目标物的同时检测,MBs的使用不仅可以减少成本,还可以降低背景信号,提高检测的灵敏度。基于以上策略所设计的荧光生物传感器,操作简便、灵敏度高且稳定性好,可用于实际样品中Pb2+和Cd2+的检测。
1 材料与方法
1.1 材料
Cd2+的核酸适配体(Apt-FAM): 5’-GGA CTG TTG TGG TAT TAT TTT TGG TTG TG-FAM-3’;Pb2+DNAzyme的底物链(Cy5-S-DNA): 5’-Cy5-TTC CAC TAT rA GGA AGA GATTAC AGT CCA AAA AA-(CH2)6-bio-3’、酶链(E-DNA): 5’-ATA ATA CCA CTA TCT CTT CTC CGA GCC GGT CGA AAT AGT GGA A-3’(其中下划线部分为Cd2+适配体的互补序列),由上海生工生物工程有限公司合成。链霉亲和素包被的磁珠(Streptavidin-MBs,粒径300 nm、10 mg/mL):苏州海狸生物医学工程有限公司。矿泉水、绿茶饮料、皮蛋:郑州永辉超市。茶叶(编号CFAPA-QC485A)和海带样品(编号GB/T 5009.12—2017):河南省产品质量检验技术研究院。
1.2 试剂与仪器
Pb(NO3)2:天津市科密欧化学试剂有限公司;Cd(NO3)2·4H2O:上海金山亭新化工试剂厂;G9800A荧光分光光度计:安捷伦(马来西亚)。
1.3 试验方法
1.3.1 传感器的制备及同时检测Pb2+、Cd2+
取5 μL链霉亲和素包被的MBs置于200 μL离心管中,用50 μL磁珠清洗液清洗3次。将1 μmol/L 生物素(Biotin)修饰的S-DNA 20 μL以及10 mmol/L Tris缓冲液5 μL加入上述离心管中,充分涡旋混匀之后置于37 ℃振荡孵育1 h,通过链霉亲和素与生物素之间的特异性结合,使S-DNA固定在MBs表面,获得MBs@S-DNA;与此同时,将1 μmol/L E-DNA和Apt各20 μL加入另一个离心管中,同样37 ℃振荡孵育1 h,获得E-DNA@Apt。随后,将第2个离心管中40 μL溶液加入第1个离心管中,混匀,37 ℃孵育1 h。混合物经磁分离并洗涤3次,制备出固载在MBs上的Y型DNA结构,即MBs@S-DNA/E-DNA@Apt体系。
向MBs@S-DNA/E-DNA@Apt体系中分别加入2 μL终浓度为1 μmol/L的Pb2+、Cd2+溶液以及6 μL Tris缓冲溶液,充分涡旋混匀后37 ℃孵育30 min,反应物进行磁分离,保留上清液,并用Tris缓冲溶液补充至200 μL,在室温下进行荧光扫描。设置激发波长480 nm,发射波长500~600 nm,记录在520 nm处FAM的荧光强度,同理,设置激发波长625 nm,发射波长645~750 nm,记录在664 nm处Cy5的荧光强度。
1.3.2 实际样品处理
矿泉水和绿茶饮料不进行预处理。采用微波消解法对皮蛋进行预处理,精确称取1.000 0 g皮蛋,与8 mL硝酸和2 mL过氧化氢加入微波消化炉的消化罐中。微波消化炉的反应温度、压力、加热时间和保温时间分别设置为180 ℃、2.8×106Pa、12 min、10 min。消化结束后,将含有消化溶液的消化罐在电加热板(160 ℃)上加热,排酸,然后室温冷却,用超纯水定容至10 mL。将Pb2+和Cd2+标准溶液分别与矿泉水、绿茶饮料及皮蛋样品混合进行加标回收试验,使传感体系中Pb2+和Cd2+的终浓度均为1、10、50 μmol/L。
1.4 数据处理与分析
采用SPSS 26进行数据处理与分析,采用Origin 2021制图。
2 结果与分析
2.1 基于Y型DNA结构和磁分离的荧光生物传感器同时检测Pb2+、Cd2+的原理
如图1所示,首先通过生物素和链霉亲和素的强结合作用,将生物素修饰的S-DNA固定在包被有链霉亲和素的MBs上,得到MBs@S-DNA结构。同时,包含有Cd2+适配体互补序列的E-DNA与Cd2+适配体通过碱基互补配对形成双链,获得E-DNA@Apt结构。然后将MBs@S-DNA体系与E-DNA@Apt体系充分混合,S-DNA中一部分序列与E-DNA进行碱基互补配对构成Pb2+DNAzyme,另一部分序列与Cd2+的Apt结合,进而杂交形成稳定的Y型DNA结构,即MBs@S-DNA/E-DNA@Apt,该传感器制备成功。
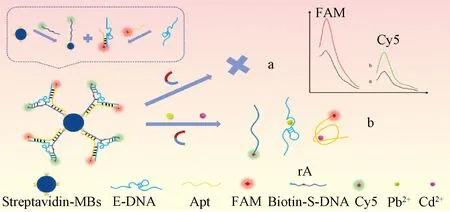
图1 基于Y型DNA结构和磁分离的荧光生物传感器同时检测Pb2+、Cd2+的原理示意图
当传感体系中不存在Pb2+和Cd2+时,DNAzyme的rA位点不会被激活,Cd2+的Apt与其两段互补序列仍然紧密结合,Cy5和FAM荧光基团分别位于Y型DNA结构的两分支端。经磁分离,所得上清液中Cy5和FAM荧光信号较弱;当Pb2+和Cd2+并存于传感体系中时,rA位点能够特异性识别Pb2+,导致S-DNA发生裂解并释放出5’端标记有Cy5的ssDNA,同时,Cd2+与标记有FAM的Apt特异性结合使其从传感器中脱离,这是由于Cd2+与胸腺嘧啶(T)和鸟嘌呤(G)碱基上的O和N发生配位造成的[21]。磁分离后,上清液中Cy5和FAM荧光信号明显增强。通过Cy5与FAM的荧光信号的变化,可以实现对Pb2+和Cd2+的同时检测。
2.2 传感器同时检测Pb2+和Cd2+的可行性分析
图2中不同的荧光光谱表征了该传感器检测Pb2+和Cd2+时荧光信号的变化情况。初始状态下,Cy5和FAM分别随S-DNA和Apt位于Y型DNA结构中,并与MBs一起从溶液中分离,上清液中只能检测到较弱的Cy5和FAM荧光强度(图2(a))。当向传感体系中加入不含Pb2+及Cd2+的缓冲溶液时,可以看到Cy5和FAM的荧光强度没有明显变化(图2(a))。当传感体系中仅存在Pb2+时,所获得的荧光光谱中Cy5的荧光强度明显增加,而FAM的荧光强度没有明显变化(图2(b)),说明Pb2+激发DNAzyme对S-DNA进行剪切,标记有Cy5的ssDNA从Y型DNA结构中释放,而Cd2+适配体没有脱离结构,随MBs一起被分离。当传感体系中仅存在Cd2+时,FAM的荧光强度明显增强,而Cy5的荧光强度未发生明显变化,表明Cd2+与标记有FAM的Apt特异性结合形成了Cd2+-Apt复合物,使Apt构象发生改变,从Y型DNA结构中脱离,而Pb2+-DNAzyme结构仍固定在MBs表面(图2(c))。当Pb2+及Cd2+均存在于传感体系中时,Cy5和FAM的荧光强度都明显增加,说明Pb2+诱导的ssDNA和Cd2+-Apt复合物均脱离了Y型DNA结构(图2(d))。因此,根据加入Pb2+和Cd2+前后上清液中Cy5和FAM的荧光强度变化,可以实现对Pb2+和Cd2+的同时检测。
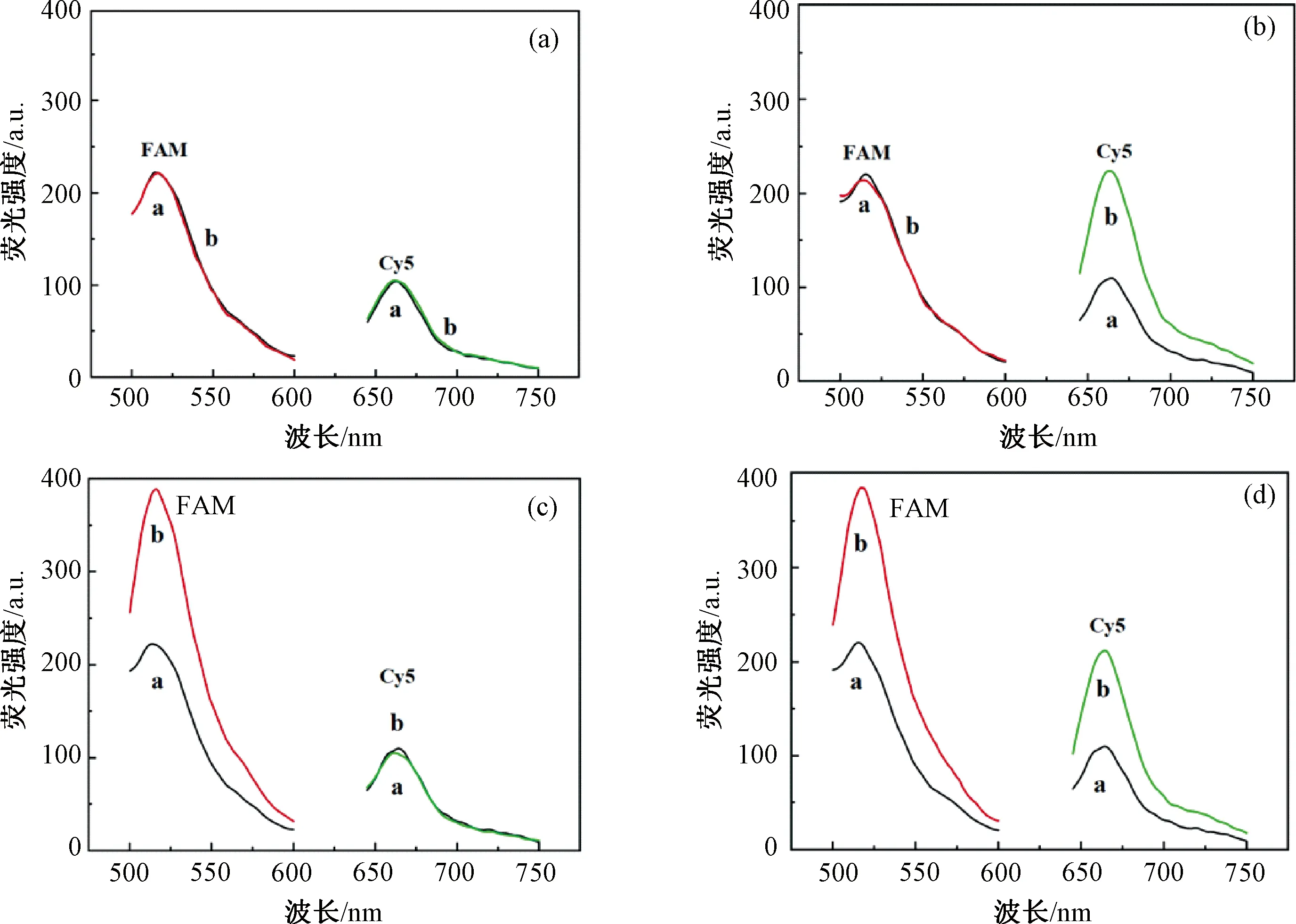
注:(a)Pb2+和Cd2+均不存在;(b)Pb2+存在,而Cd2+不存在;(c)Cd2+存在,而Pb2+不存在;(d)Pb2+和Cd2+均存在;CPb2+=CCd2+=1 μmol/L。曲线a表示体系中不存在Pb2+和Cd2+时的荧光光谱;曲线b表示体系中存在Pb2+和Cd2+时的荧光光谱。
2.3 传感器的试验条件优化
MBs作为固载Y型DNA结构的材料,其用量至关重要,如图3所示,分别比较了不同MBs用量下,加入Pb2+和Cd2+前后的Cy5和FAM的荧光强度差值ΔF。从图3(a)和(c)可以看出,ΔF随着MBs用量的逐渐增加而逐渐增大,并在MBs用量为5 μL时达到最大值,主要是由于MBs固载了更多的靶标识别探针使得ΔF增大。当继续增加MBs用量时,ΔF逐渐减小,是因为过量的MBs发生聚集从而导致传感器检测性能降低[22]。因此选择5 μL为MBs的最佳用量。
由于DNAzyme和Apt对目标物的识别起着直接作用,所以对构成Y型DNA结构的3条链的比例进行了优化。如图4(a)和(c)所示,首先保持E-DNA与Apt的浓度比不变,随着S-DNA与E-DNA的用量比逐渐降低,ΔF逐渐增大,当3条链为1∶1∶1时,ΔF达到最大值,这是因为通过碱基互补配对能够形成更加稳定的Y型DNA结构。之后,保持S-DNA与E-DNA用量比不变,逐渐增加Apt与E-DNA的用量比,可以看到ΔF趋于稳定,不再明显变化,主要是因为多余的E-DNA@Apt双链结构会通过MBs的清洗过程被除去。因此,选择S-DNA、E-DNA和Apt的用量比为1∶1∶1进行以下试验。

注:(a)、(b)分别为不同用量比下Cy5荧光强度差值的变化及对应的荧光光谱;(c)、(d)不同用量比下FAM荧光强度差值的变化及对应的荧光光谱。
为了节省时间和获得最佳检测结果,对目标物孵育的时间进行了优化。如图5(a)和(c)所示,当孵育时间为30 min时,ΔF达到最大值,进一步增加孵育时间,ΔF没有明显增大。因此,选择30 min为最佳时间对目标物进行孵育。
2.4 基于Y型DNA结构和磁分离的荧光生物传感器对Pb2+和Cd2+同时检测
由图6可以看出,在最佳的试验条件下,随着Pb2+和Cd2+浓度的逐渐增加,Cy5和FAM的荧光强度逐渐增强。在0.5~100 μmol/L范围内,Cy5的荧光强度差值ΔF与lg(CPb2+)呈线性相关,拟合可得到方程ΔF=74.47 lgC+57.8 (R2=0.991),检出限为9.7 nmol/L;在0.01~100 μmol/L范围内,FAM的荧光强度差值ΔF与lg(CCd2+)之间的线性方程为ΔF=28.534 lgC+65.929 (R2=0.994),检出限为0.4 nmol/L。将该传感器与之前同时检测Pb2+和Cd2+的方法进行比较,如表1所示,该传感器有较宽的线性范围和较低的检测限,具备良好的检测性能。

表1 传感器与其他同时检测Pb2+和Cd2+的检测方法比较
2.5 传感器的特异性研究
在最佳的试验条件下,传感器分别测定了Pb2+、Cd2+、10倍于Pb2+、Cd2+浓度的干扰离子(Mn2+、Zn2+、Cu2+、Mg2+、K+、Ba2+、Ni2+、Co2+、Li+)以及Pb2+和Cd2+与所有干扰离子的混合样。从图7可以看出,仅有干扰离子存在时,传感器的响应值ΔF均较小,荧光强度没有明显增强。只有当Pb2+和Cd2+存在于传感体系中时,Cy5和FAM的荧光强度才会发生显著增强,表明该传感器对Pb2+和Cd2+具有良好的特异性。

图7 传感器对Pb2+和Cd2+的特异性
2.6 传感器的重复性和再现性
在相同的试验条件下,使用同一个传感器对Pb2+和Cd2+(终浓度均为1 μmol/L)进行了6次测定,相对标准偏差(RSD)分别为3.3%和5.4%;同时,分别使用6个相同的传感器对Pb2+和Cd2+(终浓度均为1 μmol/L)进行检测,RSD分别为4.7%和3.4%。以上结果表明,该荧光生物传感器具备较好的重复性和再现性。
2.7 实际样品检测
为了评估该传感器的可靠性,利用所制备的传感器对矿泉水、绿茶饮料及皮蛋样品进行加标检测,结果如表2所示,加标样品中Pb2+的回收率为82.33%~107.25%,Cd2+的回收率为88.71%~101.65%,RSD均低于10%。另外,对质控样品海带和茶叶中含有的Pb2+和Cd2+进行检测,结果见表3,使用单一样本T检验法对数据进行分析,海带样品的t为1.058,茶叶样品的t为2.857,均小于4.303(0.95,n=3),说明检测值与认证值之间没有显著性差异。以上结果表明,所制备的传感器在实际样品检测方面性能优异。

表2 实际样品的检测结果

表3 质控样的检测结果
3 结论
利用DNAzyme和适配体识别靶标的高特异性,成功构建了以Y型DNA结构和磁分离为基础的荧光生物传感器。巧妙设计的Y型DNA结构实现了对Pb2+和Cd2+的同时检测,利用MBs的固载和磁分离能力达到了降低背景信号、提高灵敏度的作用。结果表明,所构建的传感器具有较低的检测限和较宽的检测范围,不受其他常见重金属离子的干扰,特异性高,并且在实际样品的检测中也获得了较好的回收率,质控样的检测结果与认证值之间没有明显差异。因此,本研究所构建的荧光生物传感器在食品及环境中多种重金属检测方面拥有巨大潜力。此外,通过替换靶标适配体序列,本研究策略也可用于其他目标物的检测,为食品及环境中有害物质检测提供了技术支撑。
