产富含甘油二酯的油脂的内生真菌筛选及油脂组成分析
2023-07-20徐文强何鸿伟付桂明毕浩然
彭 红,徐文强,何鸿伟,万 茵,付桂明,毕浩然
1.南昌大学 食品科学与资源挖掘全国重点实验室,江西 南昌 330047
2.南昌大学 生物质转化教育部工程研究中心,江西 南昌 330047
利用微生物发酵技术是生物合成功能性油脂的一条重要途径,具有诸多独特的优点,如产油微生物与陆生作物相比生长时间短、对环境友好、不占用耕地、对食品供应链没有影响等[1]。产油脂微生物包括酵母、藻类、细菌和真菌[2-5],其中丝状真菌具有一些更加有利的特性,如丝状真菌细胞更容易收获,尤其是当它们以小球或菌丝体的形式生长时[3]。有研究表明,产油真菌可以积累大量高价值的多不饱和脂肪酸,如亚油酸[3]、γ-亚麻酸[4]和花生四烯酸[5]。
内生真菌(Endophytic fungi)是指生活史的部分或整个阶段生活在植物细胞间或细胞内,宿主植物无明显感染症状的一类真菌。在内生真菌的生长过程中,根据协同进化理论,宿主与内生真菌之间会发生水平基因转移,内生微生物也能产生与其宿主植物相同的代谢产物[6],如紫杉醇[7]、喜树碱等[8]。据此推测,众多油料植物的内生真菌也具有丰富的产脂能力。红豆杉属树种是特殊油脂和一些特殊脂肪酸的良好来源[9-11],因此推测红豆杉属植物中的内生真菌具有很强的脂质积累能力。在以往的研究中,红豆杉内生真菌一般用于生产抗癌药物紫杉醇[12],关于其内生真菌产油脂的研究很少。
随着人们生活水平日益提高,越来越多的人正被肥胖问题所困扰。由于过量摄入包括高脂肪食物在内的高热量食物所导致的肥胖可引起多种疾病,如心血管疾病、骨质疏松症、大脑萎缩等[13]。甘油二酯(Diacylglycerol,DAG)作为一种结构脂质,与甘油三酯(Triacylglycerol,TAG)相比热量更低,而且将其作为脂肪替代品添加到食品中时,不会破坏产品的质地和感官属性。同时DAG作为一种抗肥胖剂,能够降低餐后脂肪酸水平[14]、改善血清胆固醇[15]、降低血糖浓度[16],从而对人类健康产生积极影响[17]。DAG还显示出促进心血管健康[17]和预防全身炎症性疾病[18]的潜力。因此DAG作为功能性脂质已引起了人们的广泛关注。在大豆油、菜籽油、猪油等天然常见动植物油脂中DAG的含量较低,一般不超过10%[19-21]。而传统的生产DAG的方法如化学法和酶法都存在诸多不足,从而在一定程度上限制了DAG的商业生产[22]。相反,从植物组织中筛选出高DAG含量的内生真菌从某种意义上为生产DAG提供了一种有效的新途径。
作者从野生南方红豆杉树组织中分离筛选出内生真菌菌株,对其进行生物学鉴定,评估内生真菌的产油脂能力,并通过对油脂组成的分析,最终筛选出具有产甘油二酯潜力的菌株。
1 材料与方法
1.1 材料与试剂
植物组织(茎、树皮和叶子)采集于南昌市梅岭风景区野生南方红豆杉(Taxuschinensisvar.mairei)。样品采集后立即存放在无菌自封袋中并带回实验室,于4 ℃保存备用。
正己烷(AR)、三硬脂酸甘油酯(99%)、二油酸甘油酯(99%):上海麦克林生化科技有限公司;酵母浸粉(BR):南京全隆生物技术有限公司;琼脂粉(MW3 000~9 000)、蛋白胨(BR):北京索莱宝科技股份有限公司;葡萄糖(AR):西陇科学股份有限公司;植物DNA提取试剂盒(通用型)、高纯度低电渗琼脂糖、DL5000 Marker和引物:北京擎科生物科技有限公司。
1.2 主要仪器与设备
HHWS-Ⅲ-250恒温恒湿培养箱:上海跃进医疗器械有限公司;ZWY-240恒温摇床:上海智城分析仪器制造有限公司;YB-F1-D冷冻干燥机:上海亿倍实业有限公司;SW-CJ-2FD超净工作台:苏州安泰空气技术有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;ATY224电子天平:日本岛津公司;2720 Thermal Cycler PCR仪:Applied Biosystems;JY300C电泳仪、JY04S-3C凝胶成像仪:君意东方公司;Advance 6001H NMR核磁共振仪:德国Bruker公司;Agilent 6890N气相色谱-质谱仪:美国Agilent公司。
1.3 试验方法
1.3.1 内生真菌分离纯化
南方红豆杉内生真菌的分离纯化采用马铃薯葡萄糖琼脂培养基(PDA)。
PDA培养基配方:马铃薯葡萄糖26 g/L,琼脂20 g/L。培养基中添加10 mg/L的链霉素和3 mg/L的四环素。培养基配制完成后于121 ℃高压灭菌20 min,然后倒入9 cm平板中使用。
1.3.2 内生真菌的分离
将采集来的红豆杉的茎、叶以及树皮用自来水冲洗3~5 min,除去尘埃杂物,转移至超净工作台内,用无菌滤纸吸干表面水分。进行外植体表面消毒处理,先用75%的乙醇浸泡30~60 s,然后用无菌水冲洗3~5次,接着用2%次氯酸钠溶液浸泡1~2 min,再用无菌水冲洗3~5次,最后用无菌滤纸吸干外植体表面水分。用解剖剪和解剖刀将茎、树皮以及叶子剪成0.5 cm小段,按外植体部位分别接种于已经准备好的PDA固体培养基上,每皿均匀接3块外植体,每个部位的外植体接4个皿。接入标记完成后将其倒置于28 ℃恒温培养箱中黑暗培养3~10 d,每天观察记录菌丝生长情况。
1.3.3 内生真菌的纯化
当接种于PDA固体培养基中的南方红豆杉外植体长出菌丝后,根据所长出的菌落颜色、形态以及分泌物,分别挑取不同菌落菌丝的尖端接种于新的PDA固体培养基上,28 ℃倒置于电热恒温培养箱中黑暗培养3~7 d,每天观察记录菌丝生长情况,当有不同颜色或形态的菌落生长出来后,继续以菌丝顶端纯化法进行纯化操作直至各个菌落为单一纯培养为止,然后将纯化后的单一菌株分别编码,记录备用。
1.3.4 内生真菌的生物学鉴定
真菌菌株生物学鉴定委托北京擎科生物科技有限公司。使用TSINGKE植物DNA提取试剂盒(通用型)提取菌种样品的DNA,然后通过引物进行扩增,扩增产物通过琼脂糖凝胶电泳分析PCR产物条带是否与目的大小相符、是否单一、有无拖带。PCR产物检测合格后,切割目的条带进行纯化回收,用回收后的产物进行PCR测序,测序结果用软件ContigExpress进行拼接,并去除两端不准的部分。批量对拼接序列进行blastn(最新版本 V2.13)比对核酸数据库。其中,核酸数据库选择最新版本的nt库,通过与nt库进行blastn比对,即可得到同源序列的物种鉴定结果。所用鉴定引物如表1所示。

表1 真菌鉴定引物
1.3.5 油脂的提取和组成分析
取培养3~7 d的长有菌丝的各内生真菌的PDA平板,切取2片直径1 cm的生长均匀的带培养基的菌块,然后接入装有100 mL PDB培养基(马铃薯葡萄糖26 g/L、MgSO4·7H2O 0.5 g/L、蛋白胨0.5 g/L、酵母提取物0.8 g/L、(NH4)2SO43.0 g/L、KH2PO42.0 g/L)的250 mL三角瓶中,用封口膜封好。将接种后的三角瓶放入恒温培养箱中发酵培养,28 ℃、120 r/min培养7 d。然后将菌丝体经4层纱布过滤,用蒸馏水洗净表面培养液后,冷冻干燥48 h后称质量,测定菌丝体干重,计算生物量。生物量=m1/V,其中,m1为菌丝体干重,g;V为发酵液体积,L。
将冻干的菌丝体充分研磨后用正己烷进行索氏抽提8 h,然后旋转蒸发去除正己烷得到粗脂肪,计算菌丝体中油脂含量。油脂含量=(m2/m3)×100%,其中,m2为提取的油脂质量,g;m3为真菌菌丝干重,g。
油脂的组成采用1H NMR法确定。1H NMR分析在核磁仪上进行,谱宽10 822 Hz,扫描次数64,脉冲宽度90°。分析前,将10 mg脂质抽出物溶解在425 μL含内标物四甲基硅烷(TMS)的CDCl3中。同时获得标准品TAG、1,2-DAG、1,3-DAG和MAG的1H NMR谱。
1.3.6 油脂的脂肪酸组成分析
称取油脂样品100 mg,加入适量2 mol/L甲醇钠的甲醇溶液,50 ℃振荡10 min,然后加入5 mL正己烷和适量无水Na2SO4,充分振荡,取上层正己烷层进行GC-MS分析。
GC-MS分析条件:Agilent 6890N气相色谱-质谱仪,色谱柱HP-PONA 50 m×0.2 mm×0.5 μm,EI源,电子能量70 eV,离子源温度230 ℃,载气He,载气流速1.0 mL/min,程序升温。进样量1 μL,分流比50∶1。升温程序:80 ℃保持5 min,然后以4 ℃/min升至290 ℃,保持5 min。
2 结果与分析
2.1 菌种的生物学鉴定
经分离、筛选和纯化后获得18株内生真菌,部分代表性菌落如图1所示,基本不含有杂菌。
图1 纯化后的部分代表性菌落
提取菌种样品的DNA,然后使用真菌ITS或细菌16 S的通用引物对其进行扩增测序,利用测序结果在NCBI数据库(blast.ncbi.nlm.nih.gov)中进行比对,选择同源度最高的物种,获得18株菌株的分子生物学鉴定结果如表2所示。编码为2.S33Y和S331的2个菌株均为镰刀菌属真菌;编码为2.S51和2.S31的2个菌株均为毛色二孢属真菌;编码为2.L43、S121和S221的3株菌株均为刺盘孢属真菌;编码为S511、S141和S131的3株菌株均为甜樱间座壳属真菌,且S141和S131属于同一种菌株;编码为B322和B121的2个菌株均为木霉属真菌;编码为2.S11、S431、S321、S521、S251和S322的菌株分别被鉴定为拟茎点霉属、枝孢菌属、拟盘多毛孢属、葡萄座腔菌属、青霉属和篮状菌属。
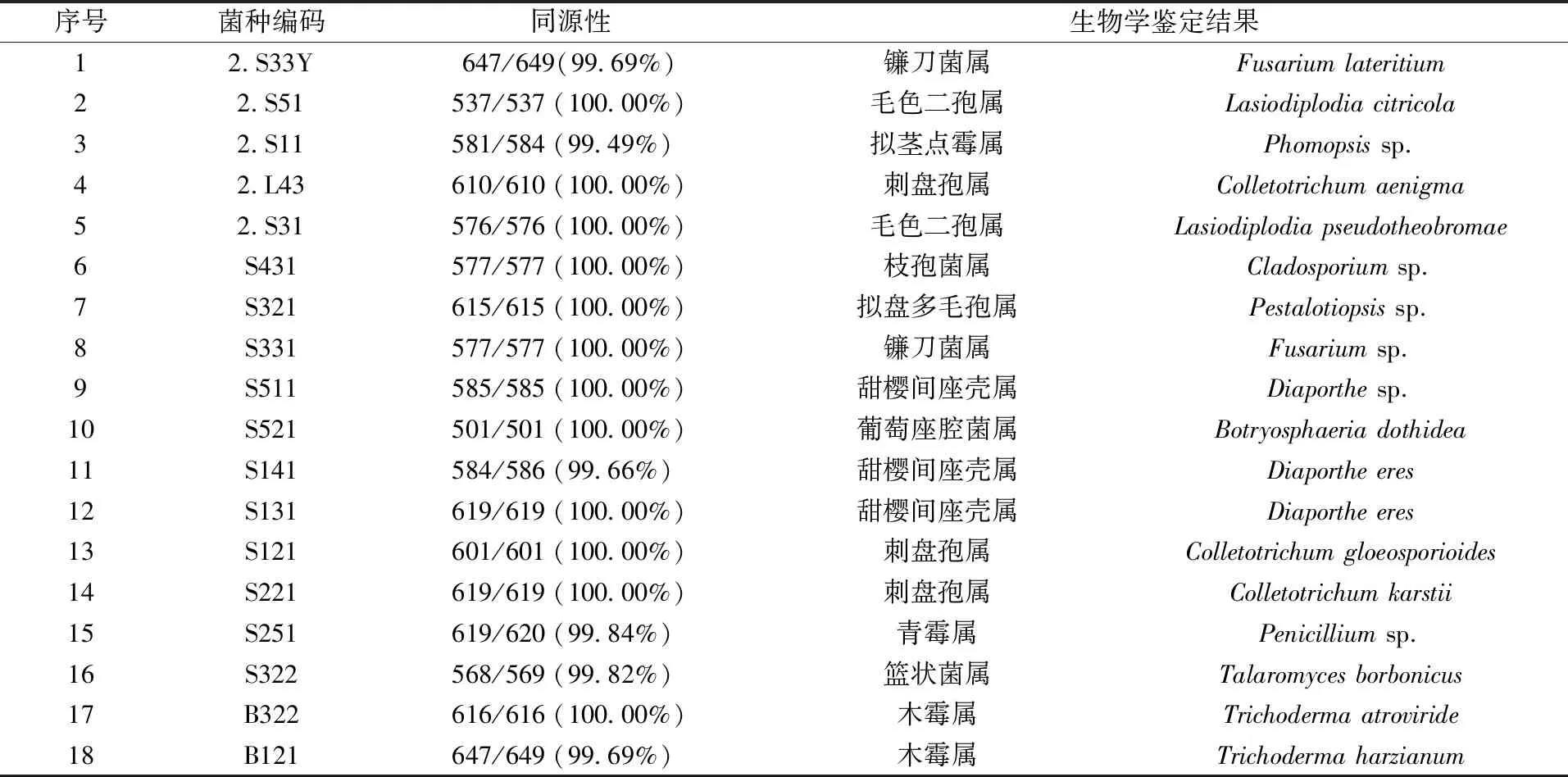
表2 内生真菌菌种生物学鉴定结果
2.2 真菌油脂的产脂能力分析
筛选出的18株菌株经液态有氧发酵培养7 d后的生物量、油脂含量和油脂产量如表3所示。限制微生物油脂商业化应用的两个重要因素是固有的产生大量脂质的能力并具有合适的脂肪酸分布和在廉价底物上生长的能力[23]。每种微生物都可以合成脂质,但只有那些脂质积累能够高达其细胞干重20%的微生物才被称为产油微生物[24]。从表3可知,筛选获得的18株菌株中,仅有2.S33Y、2.S31、S321和S331菌株中油脂含量达到了细胞干重的20%,分别为27.60%、21.41%、20.67%和24.73%,其中2.S33Y的油脂含量最高;另有2.S51、S511、B322和B121菌株中油脂含量达到了细胞干重的15%~20%;其余菌株的含油量均低于细胞干重的15%。另外,由于受生物量的影响,干细胞中油脂含量与油脂产量并不完全一致,例如菌株2.S31的油脂产量最大,为1.91 g/L,但其油脂含量只有21.41%。对于菌株2.L43,尽管生物量最高(11.06 g/L),但由于其油脂含量只有14.04%,导致最终油脂产量仅为1.55 g/L。结果表明,在相同的培养条件下,菌株的生长速度与菌细胞中油脂的积累并不完全一致,可能的原因是不同菌株细胞中油脂合成所需的相关酶的活性不同,即代谢差异所导致[25]。
2.3 真菌油脂的组成分析
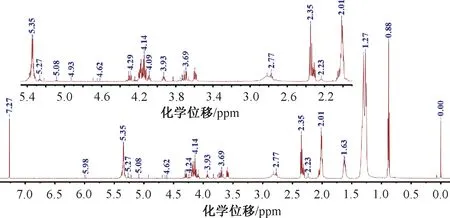
图2 含1,3-DAG、1,2-DAG、TAG和MG的标准物的1H NMR谱

图3 真菌2.S33Y油脂的1H NMR谱

表4 1H NMR谱中油脂主要成分的化学位移和归属
在1H NMR谱中峰的积分面积与产生该峰的氢质子的数量相关[27],因此可在此理论基础上根据1H NMR谱中峰的积分面积定量分析真菌油脂中TAG、DAG、MAG和游离脂肪酸(FFA)的含量。将CDCl3中内标物TMS(化学位移0.00 ppm)的信号的积分值标准化为1.000 00,各甘油酯与游离脂肪酸的物质的量(n)可按式(1)—(6)计算:
n1-MAG=C×A3.91~3.95,
(1)
n2-MAG=(C×A3.82~3.84)/4,
(2)
n1,2-DAG=(C×A3.72~3.74)/2,
(3)
n1,3-DAG=C×A4.05~4.10,
(4)
nTAG=(C×A4.11~4.38-2n1-MAG-2n1,2-DAG-4n1,3-DAG)/4,
(5)
nFFA=(C×A2.28~2.38-6nTAG-4n1,2-DAG-4n1,3-DAG-2n1-MAG-2n2-MAG)/2,
(6)
式中:C为1H NMR谱中信号峰的积分面积和产生该信号峰的质子数量相关联的比例常数;A为相对应峰的积分面积,例如A3.91~3.95是指在3.91~3.95 ppm的1H NMR峰的积分面积。
MAG、DAG、TAG和FFA的物质的量分数(X)按式(7)—(12)计算:
XMAG=100(n1-MAG+n2-MAG)/(n1-MAG+n2-MAG+n1,2-DAG+n1,3-DAG+nTAG+nFFA),
(7)
X1,2-DAG=100n1,2-DAG/(n1-MAG+n2-MAG+n1,2-DAG+n1,3-DAG+nTAG+nFFA),
(8)
X1,3-DAG=100n1,3-DAG/(n1-MAG+n2-MAG+n1,2-DAG+n1,3-DAG+nTAG+nFFA),
(9)
XDAG=X1,2-DAG+X1,3-DAG,
(10)
XTAG=100nTAG/(n1-MAG+n2-MAG+n1,2-DAG+n1,3-DAG+nTAG+nFFA),
(11)
XFA=100nFA/(n1-MAG+n2-MAG+n1,2-DAG+n1,3-DAG+nTAG+nFFA)。
(12)
根据本团队前期研究结果,内生真菌微生物油脂的脂肪酸构成主要是C16和C18(≥94%),因此可计算得内生真菌微生物油脂的脂肪酸平均链长为17.5,且含十八碳的脂肪酸占总脂肪酸组成的65%以上[30]。因此,为了便于计算,以含有一个双键的油酸(C18∶1)作为参考,按式(13)—(18)计算各甘油酯和游离脂肪酸的质量分数(ω),结果如表5所示。
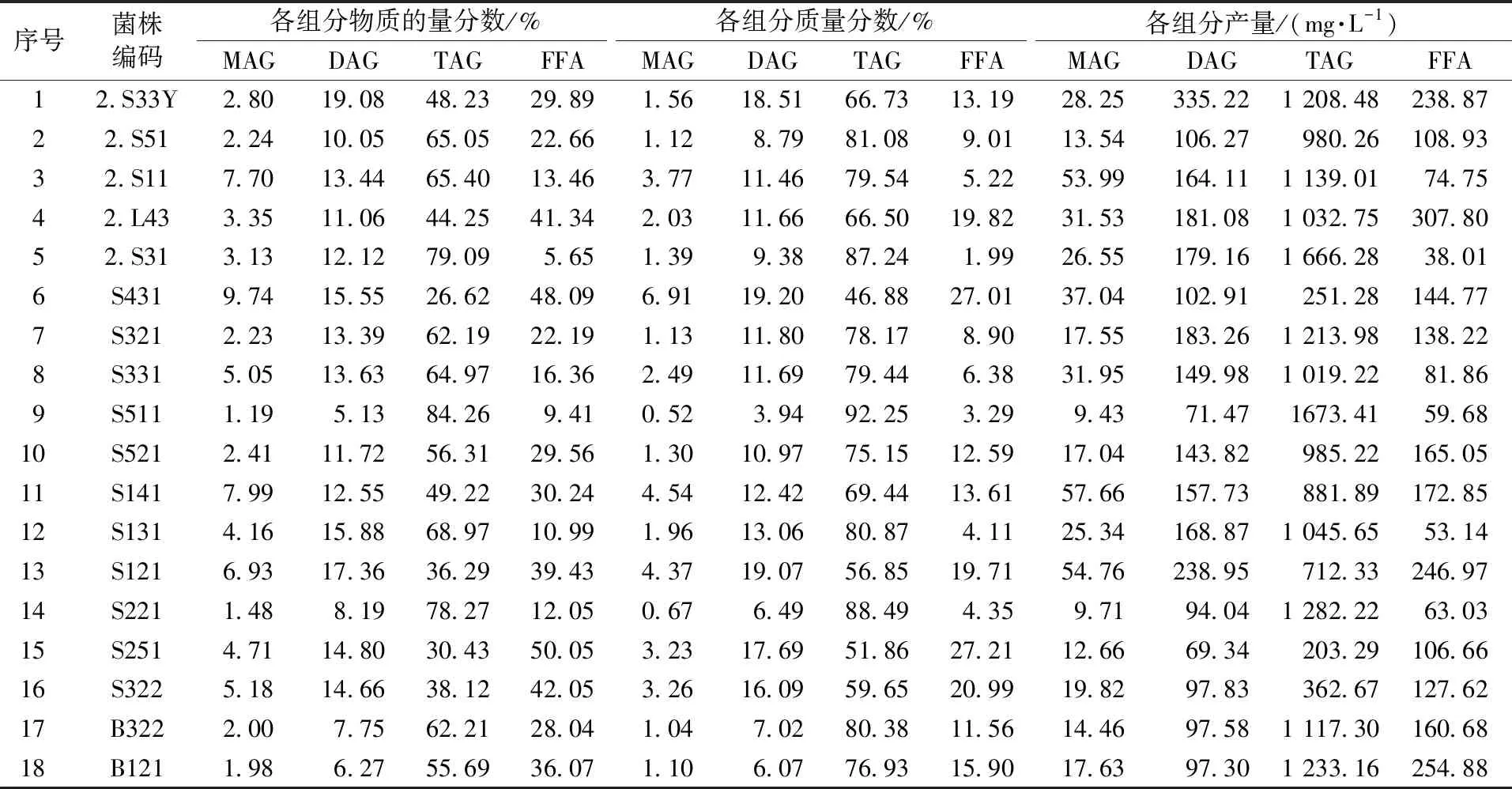
表5 内生真菌油脂的组成
ωMAG=(XMAG×MMAG)/(XMAG×MMAG+XDAG×MDAG+XTAG×MTAG+XFFA×MFFA),
(13)
ω1,2-DAG=(X1,2-DAG×MDAG)/(XMAG×MMAG+XDAG×MDAG+XTAG×MTAG+XFFA×MFFA),
(14)
ω1,3-DAG=(X1,3-DAG×MDAG)/(XMAG×MMAG+XDAG×MDAG+XTAG×MTAG+XFFA×MFFA),
(15)
ωDAG=ω1,2-DAG+ω1,3-DAG,
(16)
ωTAG=(XTAG×MTAG)/(XMAG×MMAG+XDAG×MDAG+XTAG×MTAG+XFFA×MFFA),
(17)
ωFFA=(XFFA×MFFA)/(XMAG×MMAG+XDAG×MDAG+XTAG×MTAG+XFFA×MFFA),
(18)
式中:MMAG、M1,2-DAG、M1,3-DAG、MTAG和MFFA分别代表甘油一酯、1,2-甘油二酯、1,3-甘油二酯、甘油三酯和游离脂肪酸的平均分子量,取平均烷基链长为C18,则MMAG=356.54、MDAG=620.98、MTAG=885.43、MFFA=282.46。
从表5可看出,18种内生真菌油脂中主要含有甘油三酯、甘油二酯和游离脂肪酸,甘油三酯含量大于甘油二酯和游离脂肪酸含量,同时含有少量甘油一酯。18种内生真菌油脂中,来自菌株S511的油脂中甘油三酯含量最高,达到92.25%,根据该菌株中油脂含量18.99%(表3),计算甘油三酯产量也达到最大值1 673.41 mg/L,同时只含有少量的甘油一酯、甘油二酯和游离脂肪酸,说明菌株S511适合于甘油三酯的合成。在相同培养条件下,菌株2.S33Y的甘油二酯产量最高,达到335.22 mg/L;尽管菌株S121的油脂含量和产量分别只有12.41%和1.25 g/L(表3),但来自该菌株的油脂中甘油二酯含量最高,达到19.07%,同时游离脂肪酸含量相当高(19.71%),导致甘油二酯和游离脂肪酸产量均较高,分别为238.95、246.97 mg/L。说明菌株2.S33Y最适合用于生物合成功能性脂质甘油二酯,后续可通过诱变途径和发酵条件优化进一步提高甘油二酯产量。菌株S431的油脂中虽然甘油二酯含量最高,达到19.20%(表5),但油脂产量极低(0.54 g/L)(表3),同时甘油二酯产量也不高,只有102.91 mg/L(表5)。另外3株菌株S431、S251和S322的油脂中虽然同时含有较多的甘油二酯和游离脂肪酸,但由于油脂含量低于15%,且油脂产量较低,导致甘油二酯和游离脂肪酸产量并不高。菌株2.S31、S321和S331中虽然油脂含量高于20%,但油脂中甘油二酯含量也十分有限。结合表3和表5可知,真菌菌丝体中油脂含量高的菌株并不一定适合于用来生物合成甘油三酯或者甘油二酯。
2.4 油脂的脂肪酸组成
采用GC-MS对从真菌2.S33Y中提取的油脂进行脂肪酸组成分析,结果如图4所示。真菌2.S33Y油脂主要由棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)和亚油酸(C18∶2)组成,含量分别达到29.79%、29.36%、11.07%和27.14%,其中棕榈酸含量最高,亚油酸含量较高;另含有极少量十四碳酸(C14∶0)、十五碳酸(C15∶0)、十七碳酸(C17∶0)、亚麻酸(C18∶3)、二十碳酸(C20∶0)和二十二碳酸(C22∶0)。真菌2.S33Y油脂中饱和脂肪酸和不饱和脂肪酸含量分别为61.52%和38.48%。

图4 真菌2.S33Y所产油脂的脂肪酸组成
3 结论
从南方红豆杉树组织中共分离筛选出18株内生真菌菌株,并经分子生物学鉴定,镰刀菌属(Fusarium)、毛色二孢属(Lasiodiplodia)和木霉属(Trichoderma)真菌各有2株,刺盘孢属(Colletotrichum)和甜樱间座壳属(Diaporthe)真菌各有3株,其他6株菌株包括拟盘多毛孢属(Pestalotiopsis)、青霉属(Penicillium)等。在相同培养条件下,筛选获得的18株菌株中,镰刀菌属(编码2.S33Y)菌株中油脂含量最高,达到细胞干重的27.60%,毛色二孢属(编码2.S31)真菌的油脂产量最大,为1.91 g/L。由于受生物量的影响,干细胞中油脂含量并不与油脂产量完全一致。
18种内生真菌油脂中主要含有甘油三酯、甘油二酯和游离脂肪酸,甘油三酯含量大于甘油二酯和游离脂肪酸含量,同时含有少量甘油一酯。来自甜樱间座壳属(编码S511)的油脂中有最高的甘油三酯含量,达到92.25%;镰刀菌属(编码2.S33Y)有最高的甘油二酯产量,达到335.22 mg/L;来自枝孢菌属(编码S431)的油脂中虽然甘油二酯含量最高,达到19.20%,但该菌株的甘油二酯产量只有102.91 mg/L;菌株2.S33Y最适合于用来生物合成功能性脂质甘油二酯。真菌2.S33Y油脂主要由棕榈酸、硬脂酸、油酸和亚油酸组成,含量分别达到29.79%、29.36%、11.07%和27.14%。
本研究成功筛选出了产富含甘油二酯的油脂的真菌菌株,为微生物发酵产富含甘油二酯的功能性脂质提供重要技术支持。但甘油二酯含量还不十分突出,今后需通过诱变、基因改造等方法进一步提高真菌油脂中的甘油二酯含量。
