斑褐孔菌子实体化学成分的分离鉴定及生物活性研究
2023-07-20吴晓鹏李冉马青云杨理谢晴宜戴好富赵友兴
吴晓鹏 李冉 马青云 杨理 谢晴宜 戴好富 赵友兴


关键词:斑褐孔菌;子实体;化学成分;分离鉴定;生物活性
中图分类号:R284.1 文献标识码:A
斑褐孔菌[Fuscoporia punctata (Fr.) Cunn]属于多孔菌科(Polyporaceae)褐孔菌属(Fuscoporia),常寄生在栎、槭及其他阔叶树的树皮和腐木上,可引起木材白色腐朽,主产于河北、吉林、江苏、陕西以及海南等地[1]。斑褐孔菌是海南重要的大型药用真菌资源,具有活血通经、祛瘀止痛的功效,民间用于治疗心绞痛、心律失常、月经不调和冠心病等,能起到降压和改善心功能的作用。现代药理研究表明,斑褐孔菌具有保护心律失常和抗肿瘤的作用[2-3]。但关于斑褐孔菌的药效物质基础尚无报道,其子实体的化学成分及其生物活性的研究鲜有报道,仅对发酵培养得到的斑褐孔菌菌丝体和野生斑褐孔菌子实体中的黄酮进行过含量测定[4]。
为了进一步明确斑褐孔菌子实体的药效物质基础和化学成分组成,本研究对斑褐孔菌子实体的乙醇提取物的活性物质进行分离纯化,采用活性追踪的方法对乙醇提取物采用多种色谱技术进行分离,通过NMR 和MS 等技术确定化合物成分,对7 个聚酮类成分(1~7)进行PTP1B 抑制活性测定、α-葡萄糖苷酶抑制活性測定和清除DPPH 自由基的测定。
1 材料与方法
1.1 材料
1.1.1 斑褐孔菌样品 斑褐孔菌子实体于2016年6 月采自海南省琼中县,由海南医学院曾念开教授鉴定为斑褐孔菌[Fuscoporia punctata (Fr.)Cunn],凭证标本(No. 2016ZBHKJ)存放于中国热带农业科学院热带生物技术研究所海口市热带天然产物研究与利用重点实验室。
1.1.2 仪器与试剂 化合物的核磁共振数据由Bruker DRX-500 核磁共振光谱仪测定,TMS 为内标;质谱由API Qster Pulsar 质谱仪测定;凝胶色谱采用GE Biosciences 公司的Sephadex LH-20;正相柱色谱用硅胶(200~300 目)和薄层色谱硅胶GF254均为青岛美高有限公司生产;反相硅胶ODS 为日本YMC 公司生产;Agilent 1260 分析型高效液相色谱仪购自Agilent 公司;半制备高效液相色谱仪(SUM-MITP680A,戴安,美国);甲醇(色谱纯)、乙腈(色谱纯)均为天津市康科德科技有限公司产品;氘代试剂(德国Merck 公司);Synergy H1 酶标仪(美国Bio-Tek 公司);薄层色谱TLC 显色剂为10% H2SO4乙醇显色剂,喷后70 ℃烘烤。
1.2 方法
1.2.1 化合物萃取、分离与纯化 斑褐孔菌干燥子实体3.5 kg 粉碎,用95%工业乙醇回流提取3次,每次4 h,过滤后滤液经浓缩加水混悬,用石油醚萃取脱脂,再用乙酸乙酯萃取,乙酸乙酯萃取液浓缩至浸膏得乙酸乙酯部分65.6 g。乙酸乙酯萃取部分经正相硅胶柱色谱[石油醚-乙酸乙酯(10∶1~0∶1, V/V)]梯度洗脱得到5 个馏分Fr1~Fr5。Fr.2(8.2 g)经减压硅胶柱色谱,以石油醚-乙酸乙酯(5∶1~0∶1, V/V)为洗脱剂,梯度洗脱,得到6 个组分(Fr.2.1~Fr.2.6)。Fr.2.2(1.6 g)通过Sephadex LH-20 ( 甲醇) 得到Fr.2.2.1~Fr.2.2.4。Fr.2.2.1(209 mg)通过半制备型高效液相色谱仪,经C18 半制备柱,以甲醇-水(55∶40,V/V)系统洗脱分离得到5(RT 9.9 min, 13.5 mg)。Fr.2.2.2(114 mg)通过反相硅胶柱色谱(甲醇-水系统,50∶50,V/V)洗脱后,得到化合物2(tR9.9 min,4.1 mg)。Fr.2.2.3(327 mg)通过半制备型高效液相色谱仪(乙腈-水系统,35∶65, V/V)分离制备得到化合物3(RT 9.2 min, 5.3 mg)、化合物6(RT 15.0 min, 7.2 mg)和化合物1(RT 11.0min, 10.8 mg)。Fr.2.2.4(89 mg)通过半制备型高效液相色谱仪(乙腈-水系统, 30∶70, V/V)分离制备得到化合物7(RT 18.8 min, 4.2 mg)。Fr.3(1.9 g)经减压C18 反相柱色谱,以甲醇-水(1∶5~1∶0, V/V)为洗脱剂,梯度洗脱,得到馏分再经半制备型高效液相色谱仪(乙腈-水系统, 40∶60, V/V)分离制备得到化合物4(RT 8.0 min,16.3 mg)和12(RT 12.8 min, 1. 8 mg)。Fr.4(3.2 g)经硅胶柱色谱[石油醚-乙酸乙酯(2∶1, V/V)]和Sephadex LH-20[氯仿-甲醇(1∶1, V/V)]得到化合物8(11.2 mg)和化合物9(2.2 mg)以及Fr.4.1。馏分Fr.4.1(65 mg)经半制备型高效液相色谱仪(甲醇-水系统,30∶70, V/V)分离制备得到化合物11(RT 14.2 min, 1.6 mg)和化合物10(RT10.8 min, 1.6 mg)。
1.2.2 生物活性测试 (1)蛋白酪氨酸磷酸酶1B(PTP1B)抑制活性测定。采用文献[5]报道的方法,对7 个聚酮类成分(1~7)进行PTP1B 抑制活性测定,以对硝基苯磷酸二钠(pNPP)作为反应底物,根据PTP1B 水解底物pNPP 得到的游离产物在405 nm 处有很强的光吸收,通过酶标仪在405 nm 处光吸收变化来观察酶的活性变化以及化合物对酶的抑制作用。以正矾酸钠作为阳性对照,不加蛋白稀释液和正矾酸钠作为空白对照。
用96 孔平板在酶标仪405 nm 测定吸光度,每个体系设置2 组重复, 每孔中依次加入50 μL2×reaction buffer、25.5 μL ddH2O 和10 μL 蛋白稀释液,置于酶标仪中37 ℃温育5 min,再分别在每孔中加入待测化合物(化合物用DMSO 溶解),置于酶标仪中37 ℃温育15 min,再分别加入12.5 μL pNPP 溶液,置于酶标仪中,在波长405 nm处每20 s 测1 次OD 值,测45 次。根据反应结果判断待测化合物的抑制活性,抑制率大于50%时,设置浓度梯度进行复筛,测其IC50 值。通过抑制率对抑制浓度的非线性关系,计算出半数抑制浓度IC50 值。
(2)α-葡萄糖苷酶抑制活性测定。采用PNPG法[6]测定化合物1~7 的α-葡萄糖苷酶抑制活性。化合物均用DMSO 溶解配制成待测化合物溶液(5 mg/mL)。取70 μL 磷酸盐缓冲液(0.1 mol/L,pH 6.8)于96 孔板中,再分别加入20 μL α-葡萄糖苷酶溶液(2 U/mL)和10 μL 待测样品溶液。37 ℃温育15 min 后加入20 μL pNPG 溶液(2.5 mmol/L),在37 ℃放置30 min 后加入80 μL Na2CO3终止液(0.2 mol/L)终止反应,反应总体系为200 μL。充分混匀后于405 nm 处用酶标仪检测各孔吸光值。以阿卡波糖(反应终浓度为0.25 mg/mL)为阳性对照,DMSO(反应终浓度为0.5%)为阴性对照,实验重复3 次。
按照公式计算化合物对α-葡萄糖苷酶的抑制率:抑制率=[(B-B0)-(A-A0)]/(B-B0)′100%,式中,A 为实验组平均吸光值,A0 为背景对照组平均吸光值,B 为阴性对照平均吸光值,B0 为空白对照平均吸光值。
(3)抗氧化清除自由基活性测定。采用1,1-二苯基-2-三硝基苯肼(DPPH)法测定化合物1~7的抗氧化清除自由基活性[7]。DPPH 是一种稳定的自由基,在乙醇溶剂中显紫色,清除自由基的清除剂可以使DPPH 的单电子被接受,使紫色变浅,从而在最大波长时吸光值下降,以代表抗氧化清除自由基能力增强。100 mL 无水乙醇将0.0256 gDPPH 溶解后,冷藏备用,使用时乙醇稀释10 倍。取50 mg/mL 的待测化合物10 μL 加到90 μL 无水乙醇中,在实验中抗坏血酸(VC)作为阳性对照药,以相同方法配制成5 mg/mL 的VC 溶液。分别取20 μL VC 溶液加入到阳性对照组和阳性背景组,20 μL 待测化合物溶液到空白组(A0)和实验组(A),20 μL 10% DMSO-乙醇溶液到阴性对照组(B),阳性背景组和空白组均加180 μL 无水乙醇,其他组均加180 μL DPPH 溶液到96 孔板中,避光反应30 min,處于25 ℃环境中,在515nm 波长下得出每孔的OD 值,计算抗氧化自由基清除力, 计算公式为: 自由基清除率=[1-(A-A0)/B]×100%,式中,A 为实验组平均吸光值,A0为背景对照组平均吸光值,B 为阴性对照平均吸光值。
2 结果与分析
2.1 化合物结构鉴定
化合物1:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+485,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C25H18O9,不饱和度为17。该化合物的1H-NMR谱有12 个信号,包括4 个单峰次甲基信号、5 个双峰的次甲基信号、1 个单峰甲基信号和2 个多重峰次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有25 个碳信号,包括1 个甲基信号,11个次甲基信号,13 个季碳(其中1 个酮羰基和1个酯羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz,DMSO-d6) δ: 1.93 (3H, s,CH3-1′), 5.63 (1H, s, H-5′), 5.66 (1H, s, H-2′), 6.52(1H, d, J=7.9 Hz, H-11′), 6.65 (1H, d, J=2.7 Hz,H-7′), 6.71 (1H, s, H-4), 6.73 (1H, d, J=2.7 Hz,H-10′), 6.78 (1H, m, H-12), 6.81 (1H, d, J=15.9 Hz,H-6), 7.01 (1H, m, H-13), 7.08 (1H, s, H-9), 7.32(1H, d, J=15.9 Hz, H-7);
13C-NMR (125 MHz, DMSO-d6) δ: 157.6 (s,C-1), 98.0 (s, C-2), 174.3 (s, C-3), 94.5 (d, C-4),165.0 (s, C-5), 115.9 (d, C-6), 137.6 (d, C-7),126.4(s, C-8), 114.3 (d, C-9), 145.8 (s, C-10), 148.3(s, C-11), 115.9 (d, C-12), 121.3 (d, C-13), 16.4 (q,CH3-1′), 189.9 (s, C-1′), 103.9 (d, C-2′), 199.7 (s,C-3′), 92.3 (s, C-4′), 93.6 (d, C-5′), 121.2 (s, C-6′),114.7 (d, C-7′), 145.0 (s, C-8′), 146.4 (s, C-9′),115.2 (d, C-10′), 118.8 (d, C-11′)。以上数据与文献[8]报道基本一致,鉴定该化合物为inoscavin A,结构式见图1。
化合物2:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+443,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C23H16O8,不饱和度为16。该化合物的1H-NMR谱有9 个信号,包括1 个单峰次甲基信号、1 个多重峰次甲基信号、6 个双峰的次甲基信号、1 个单峰甲基信号和;根据13C-NMR 和DEPT 谱分析,该化合物有23 个碳信号,包括1 个甲基信号,9个次甲基信号,13 个季碳(其中1 个酮羰基和1个酯羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, DMSO-d6) δ: 2.63 (3H, s,CH3-1′), 6.79 (1H, d, J=15.9 Hz, H-6), 6.84 (2H, m,H-12,9′), 6.98 (1H, d, J=8.0 Hz, H-13), 7.06 (1H, d,J=3.0 Hz, H-9), 7.09 (1H, m, H-10′), 7.10 (1H, s,H-4), 7.18 (1H, d, J=2.1 Hz, H-6′), 7.23 (1H, d,J=15.9 Hz, H-7);
13C-NMR (125 MHz, DMSO-d6) δ: 157.9 (s,C-1), 107.8 (s, C-2), 160.0 (s, C-3), 95.2 (d, C-4),157.4 (s, C-5), 116.2 (d, C-6), 134.4 (d, C-7), 126.9(s, C-8), 113.9 (d, C-9), 145.7 (s, C-10), 147.9 (s,C-11), 115.9 (d, C-12,9′), 120.5 (d, C-13), 32.0 (q,C-1′),196.6 (s, C-2′), 117.4 (s, C-3′), 153.7 (s, C-4′),119.0 (s, C-5′), 114.4 (d, C-6′), 145.4 (s, C-7′),147.5 (s, C-8′), 119.3 (d, C-10′)。以上數据与文献[9]报道基本一致,鉴定该化合物为inoscavin C,结构式见图1。
化合物3:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+375,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C19H12O7,不饱和度为14。该化合物的1H-NMR谱有8 个信号,包括3 个单峰次甲基信号、3 个双峰的次甲基信号和2 个多重峰次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有19 个碳信号,包括8 个次甲基信号,11 个季碳(其中1 个酯羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, DMSO-d6) δ: 6.77 (1H, d,J=8.1 Hz, H-12), 6.81 (1H, d, J=16.0 Hz, H-6), 6.97(1H, m, H-13), 7.05 (1H, m, H-9), 7.06 (1H, s, H-4),7.11 (1H, s, H-5′), 7.19 (1H, s, H-2′), 7.23 (1H, d,J=16.0 Hz, H-7);
13C-NMR (125 MHz, DMSO-d6) δ: 158.0 (s,C-1), 103.9 (s, C-2), 162.9 (s, C-3), 96.0 (d, C-4),158.2 (s, C-5), 116.6 (d, C-6), 134.2 (d, C-7), 127.1(s, C-8), 113.7 (d, C-9), 146.1 (s, C-10), 147.5 (s,C-11), 116.0 (d, C-12), 120.5 (d, C-13), 114.0 (s,C-1′), 104.7 (d, C-2′), 145.7 (s, C-3′), 144.6 (s,C-4′), 98.9 (d, C-5′), 149.1 (s, C-6′)。以上数据与文献[10]报道基本一致,鉴定该化合物为phellibauminA,结构式见图1。
化合物4:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+ 447,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C22H16O9,不饱和度为15。该化合物的1H-NMR谱有10 个信号,包括5 个单峰次甲基信号和5 个双峰的次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有22 个碳信号,包括10 个次甲基信号、12 个季碳(其中1 个酮羰基和1 个羧基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 6.18 (1H, s,H-4), 6.61 (1H, d, J=15.9 Hz, H-6), 6.68 (1H, d,J=8.3 Hz, H-12), 6.75 (1H, d, J=8.3 Hz, H-5′), 6.80(1H, d, J=8.3 Hz, H-6′), 6.94 (1H, s, H-2′), 6.92 (1H,m, H-13), 7.02 (1H, s, H-9), 7.32 (1H, d, J=15.9 Hz,H-7), 7.77 (1H, s, H-7′);
13C-NMR (125 MHz, CD3OD) δ: 166.0 (s, C-1),101.1 (s, C-2), 169.2 (s, C-3), 101.5 (d, C-4), 160.9(s, C-5), 116.8 (d, C-6), 137.2 (d, C-7), 128.3 (s,C-8), 114.8 (d, C-9), 146.2 (s, C-10), 148.6 (s,C-11), 116.1 (d, C-12), 122.0 (d, C-13), 128.9 (s,C-1′), 117.2 (d, C-2′), 146.7 (s, C-3′), 148.7 (s,C-4′), 116.6 (d, C-5′) 124.7 (d, C-6′), 145.6 (d, C-7′),120.0 (s, C-8′), 171.0 (s, C-9′)。以上数据与文献[11]报道基本一致,鉴定该化合物为phellibaumin D,结构式见图1。
化合物5:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+445,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C23H18O8,不饱和度为15。该化合物的1H-NMR谱有12 个信号,包括3 个单峰次甲基信号、4 个双峰的次甲基信号、2 个双双峰的次甲基信号、1个双双峰的亚甲基信号、1 个单峰甲基信号和1个多重峰次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有23 个碳信号,包括1 个甲基信号,1 个亚甲基信号,9 个次甲基信号,12 个季碳(其中1 个酮羰基和1 个酯羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, DMSO-d6) δ: 2.14 (3H, s,H-10′), 2.84 (1H, dd, J=16.5, 4.3 Hz, H-8′a), 3.07(1H, dd, J=16.5, 9.0 Hz, H-8′b), 5.75 (1H, m, H-7′),6.32 (1H, s, H-4), 6.58 (1H, s, H-5′), 6.69 (1H, d,J=16.0 Hz, H-7), 6.76 (1H, d, J=8.2 Hz, H-12), 6.95(1H, dd, J=8.2, 2.3 Hz, H-13), 7.03 (1H, d, J=2.3Hz, H-9), 7.89 (1H, s, H-2′), 7.22 (1H, d, J=16.0 Hz,H-6);
13C-NMR (125 MHz, DMSO-d6) δ: 160.0 (s,C-1), 99.8 (s, C-2), 162.3 (s, C-3), 100.5 (d, C-4),158.1 (s, C-5), 115.9 (d, C-6,12), 134.6 (d, C-7),126.9 (s, C-8), 114.0 (d, C-9), 145.1 (s, C-10),145.7 (s, C-11), 121.8 (d, C-13), 120.6 (s, C-1′),111.4 (d, C-2′), 145.4 (s, C-3′), 147.6 (s, C-4′),111.9 (d, C-5′), 116.6 (C-6′), 74.3 (d, C-7′), 48.4 (t,C-8′), 205.3 (s, C-9′), 30.3 (q, C-10′)。以上数据与文献[12]报道基本一致,鉴定该化合物为inonotusinB,结构式见图1。
化合物6:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+ 401,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C21H14O7,不饱和度为15。该化合物的1H-NMR谱有10 个信号,包括3 个单峰次甲基信号、4 个双峰的次甲基信号、2 个双双峰次甲基信号和1个多重峰次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有21 个碳信号,包括10 个次甲基信号,11 个季碳(其中1 个酮羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, DMSO-d6) δ: 6.76 (1H, d,J=16.0 Hz, H-1′), 6.78 (1H, d, J=8.3 Hz, H-7′), 6.83(1H, d, J=8.2 Hz, H-5′′), 6.95 (1H, dd, J=8.3, 1.9Hz, H-8′), 7.04 (1H, s, H-4′), 7.05 (1H, s, H-7), 7.15(1H, dd, J=8.2, 2.1 Hz, H-6′′), 7.17 (1H, d, J=16.0Hz, H-2′), 7.19 (1H, s, H-3), 7.20 (1H, m, H-2′′);
13C-NMR (125 MHz, DMSO-d6) δ: 155.9 (s,C-2), 100.1 (d, C-3), 158.1 (s, C-4), 156.5 (s, C-6),95.7 (d, C-7), 116.2 (d, C-1′), 133.3 (d, C-2′), 127.1(s, C-3′), 113.8 (d, C-4′), 145.7 (s, C-5′), 147.3 (s,C-6′), 115.9 (d, C-7′), 120.2 (d, C-8′), 120.2 (s,C-1′′), 111.7 (d, C-2′′), 145.8 (s, C-3′′), 146.8 (s,C-4′′), 116.4 (d, C-5′′), 116.5 (d, C-6′′), 110.8 (s,C-3a), 160.4 (s, C-7a)。以上數据与文献[13]报道基本一致,鉴定该化合物为phellifuropyranone A,结构式见图1。
化合物7:黄色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+403,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C20H12O8,不饱和度为15。该化合物的1H-NMR谱有12 个信号,包括3 个单峰次甲基信号和5 个双峰的次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有20 个碳信号,包括8 个次甲基信号,12 个季碳(其中2 个酯羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, DMSO-d6) δ: 10.82 (1H, s,HO-9), 10.22 (1H, s, HO-8), 9.66 (1H, s, HO-), 9.25(1H, s, HO-), 6.72 (1H, s, H-4), 6.78 (H, d, J=8.2Hz, H-,), 6.80 (1H, d, J=16.0 Hz, H-), 7.28 (1H, d,J=16.0 Hz, H-), 7.52 (1H, s, H-7), 7.53 (2H, d,J=8.2 Hz, H-4′,8'), 8.34 (1H, s , H-10);
13C-NMR (125 MHz, DMSO-d6) δ: 159.7 (s,C-1), 158.6 (s, C-3), 98.9 (d, C-4), 160.9 (s, C-4a),158.9 (s, C-6), 111.6 (s, C-6a), 114.6 (d, C-7), 147.1(s, C-8), 153.8 (s, C-9), 110.6 (d, C-10), 127.2 (s,C-10a), 99.2 (s, C-10b), 115.6 (d, C-1′), 136.0 (d,C-2′), 126.8 (s, C-3′), 114.2 (d, C-4′), 145.8 (s,C-5′), 148.0 (s, C-6′), 116.0 (d, 7′), 121.1 (d, C-8′)。
以上数据与文献[14]报道基本一致,鉴定该化合物为phelligridin D,结构式见图1。
化合物8:白色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+161,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C7H6O3,不饱和度为5。该化合物的1H-NMR 谱有4 个信号,包括1 个单峰醛基信号、2 个双峰的次甲基信号、1 个双双峰次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有7 个碳信号,包括3 个次甲基信号,4 个季碳(其中1 个醛羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 6.21 (1H, d,J=2.0 Hz, H-2), 6.42 (1H, dd, J=2.0, 8.8 Hz,H-6),7.42 (1H, d, J=8.8 Hz, H-5), 9.67 (1H, s,-CHO);
13C-NMR (125 MHz, CD3OD) δ: 194.5 (d,CHO), 135.4 (s, C-1), 102.5 (d, C-2), 146.2 (s, C-3),154.9 (s, C-4), 109.6 (d, C-5), 115.4 (d, C-6)。 以上数据与文献[15]报道基本一致,鉴定该化合物为原儿茶醛,结构式见图1。
化合物9:无色针状,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+ 133,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C6H6O2,不饱和度为4。该化合物的1H-NMR 谱有4 个次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有6 个碳信号,包括4 个次甲基信号,2 个季碳。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 6.67 (2H, d,J=8.2 Hz, H-3,6), 6.79 (2H, m, H-4,5);
13C-NMR (125 MHz, CD3OD ) δ: 146.2 (s,C-1,2), 116.2 (d, C-3,6), 120.9 (d, C-4,5)。以上數据与文献[16]报道基本一致,鉴定该化合物为儿茶酚,结构式见图1。
化合物10:白色针状,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+149,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C6H6O3,不饱和度为4。该化合物的1H-NMR 谱有3 个次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有6 个碳信号,包括3 个次甲基信号,3 个季碳。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 6.42 (1H, t,J=7.8 Hz, H-5), 6.31 (2H, d, J=8.1 Hz, H-4,6);
13C-NMR (125 MHz, CD3OD ) δ: 148.9 (s,C-1,3), 134.2 (s, C-2), 108.4 (d, C-4,6), 120.4 (d,C-5)。以上数据与文献[17]报道基本一致,鉴定化合物为没食子酚,结构式见图1。
化合物11:白色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+161,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C7H6O3,不饱和度为5。该化合物的1H-NMR 谱有4 个次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有7 个碳信号,包括4 个次甲基信号,3 个季碳(其中1 个酸羰基)。该化合物的H和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 7.77 (2H, d,J=8.4 Hz, H-2,6), 6.76 (2H, d, J=8.4 Hz, H-3,5);
13C-NMR (125 MHz, CD3OD ) δ: 169.7 (s,COOH),122.5 (s, C-1), 133.4 (d, C-2,6), 116.5 (d,C-3,5), 163.8 (s, C-4)。以上数据与文献[18]报道基本一致,鉴定该化合物为对羟基苯甲酸,结构式见图1。
化合物12:白色粉末,质谱的准分子离子峰ESI-MS positive m/z [M+Na]+ 185,结合1H-NMR、13C-NMR 和DEPT 谱信息可以确定其分子式为C10H10O2,不饱和度为6。该化合物的1H-NMR谱有7 个信号,包括1 个单峰甲基信号和6 个双峰的次甲基信号;根据13C-NMR 和DEPT 谱分析,该化合物有10 个碳信号,包括6 个次甲基信号,1 个甲基信号和3 个季碳(其中1 个酮羰基)。该化合物的H 和C 归属如下:
1H-NMR (500 MHz, CD3OD) δ: 2.29 (3H, s,H-4), 6.56 (1H, d, J=16.2 Hz, H-1), 6.76 (2H, d,J=8.2 Hz, H-3′,5′), 7.45 (2H, d, J=8.2 H-2′,6′), 7.54(1H, d, J=16.2 Hz, H-2);
13C-NMR (125 MHz, CD3OD) δ: 146.5 (d,C-1), 124.7 (d, C-2), 201.7 (s, C-3), 27.1 (q, C-4),131.6 (s, C-1′), 127.1 (d, C-2′,6′), 116.9 (d, C-3′,5′),151.6 (s, C-4′)。以上数据与文献[16]报道基本一致,鉴定该化合物为对羟基苄叉丙酮,结构式见图1。
2.2 化合物活性测定
2.2.1 PTP1B 抑制活性 研究表明,化合物1~7均具有PTP1B 抑制活性(表1),化合物2、3、4、5、7 的抑制率均大于60%,其中化合物4 的活性最高,化合物6 的活性最低。
2.2.2 α-葡萄糖苷酶抑制活性 α-葡萄糖苷酶抑制活性测定结果见表2,结果表明,化合物1、2、3、5、6、7 均具有抑制活性,其中化合物2 的活性最强。
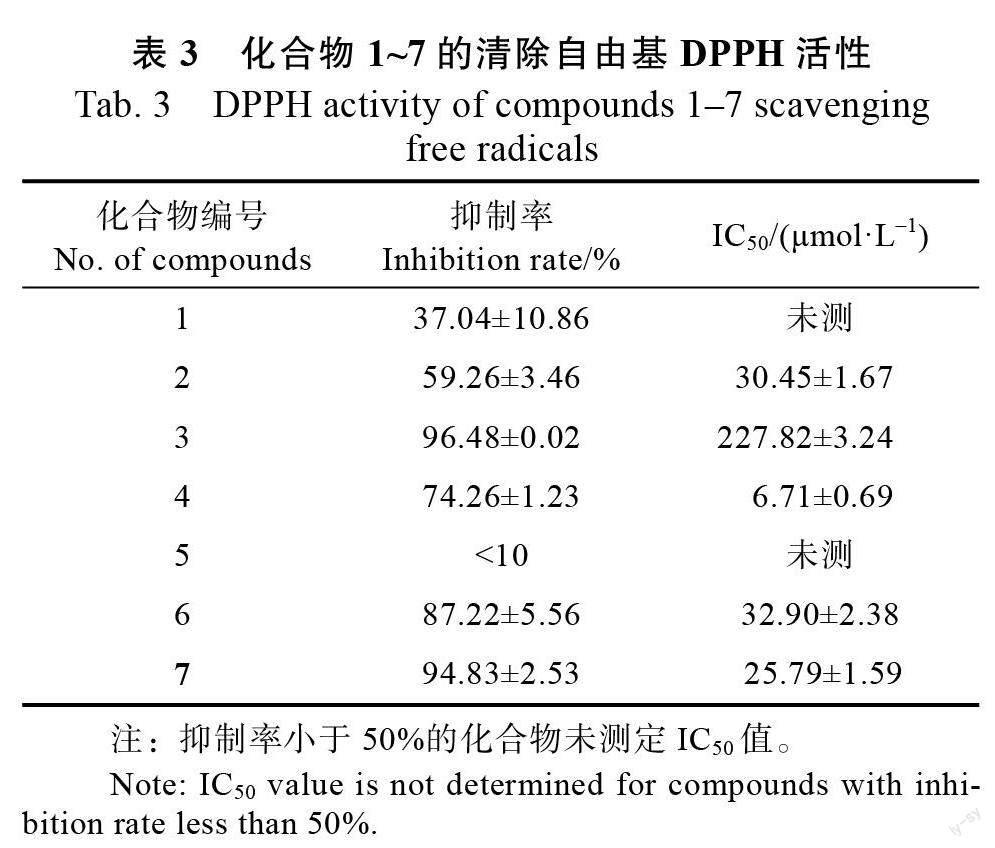
2.2.3 抗氧化清除自由基活性 化合物1~7 的抗氧化清除自由基活性测定结果见表3,研究结果显示,除化合物1 的清除率在10%以下,其他化合物均表现出一定的活性,其中化合物4 清除自由基的IC50 值为6.71 μmol/L,浓度最低。
3 讨论
3.1 斑褐孔菌子实体的化学成分
本研究综合利用多种色谱技术首次对斑褐孔菌(F. punctata)子实体的乙醇提取物进行分离纯化,通过质谱和核磁技术等对分离出的单体化合物进行结构鉴定,结果表明,从海南的斑褐孔菌子实体乙醇提取物中分离得到12 个化合物。分别鉴定为inoscavin A(1)、inoscavin C(2)、phellibaumin A(3)、phellibaumin D(4)、inonotusinB(5)、phellifuropyranone A(6)、phelligridin D(7)、原儿茶醛(8)、儿茶酚(9)、没食子酚(10)、对羟基苯甲酸(11)和对羟基苄叉丙酮(12),这些化合物均为首次从斑褐孔菌中分离得到。本研究鉴定的化合物结构类型主要为聚酮类和酚类成分,未发现前人测定的黄酮类成分[4],这可能是因为采用比色法测定的黄酮是一大类具有类似吸收的成分,可能包括本研究中发现的聚酮类成分,也可能是黄酮类成分含量低未分离得到单体成分。此外,化学成分的积累也与该真菌的生长期有关,这需要进一步研究分析。
3.2 斑褐孔菌子实体中活性成分构效关系分析
对于大型药用真菌的活性研究,大部分研究者都集中在抗肿瘤和提高免疫力的研究中,这可能与大型药用真菌普遍具有抗癌和提高免疫力的作用有关,其中的主要活性物质是多糖类、甾类和萜类化合物。由于本研究得到的化合物主要是聚酮类化合物,所以降血糖和抗氧化是本研究活性测试的重点。
化合物1~7 为聚酮类化合物,对PTP1B 均有抑制活性,活性由高到低依次为4、5、7、3、2、1、6。化合物4 的活性最高可能是因为3 位的羟基处于活性状态;化合物5 和7 的3 位羟基均参与成了六元环,且化合物5 的3 位羟基成了六元醚环,而化合物7 是六元酯环,这可能是影响活性的原因之一;化合物3、2、1 和6 的3 位羟基均成了五元醚环,且五元醚环上取代基越少活性越差,具体的作用机理有待进一步研究,后期可以根据聚酮类化合物的构效关系,对化合物结构进行针对性修饰,为开发治疗糖尿病的药物提供有价值的先导化合物。
在抑制α-葡萄糖苷酶活性方面,除了化合物4 的活性较低外,其他6 个化合物均表现出不同的抑制活性,这可能与化合物4 的3 位羟基未成环有关,而其他化合物的3 位羟基均成环,而且化合物2 和7 的3 位氧能与环上或附近的羰基形成电子共轭,这可能是化合物2 和7 的抑制活性较高,IC50 值较低的原因,如要验证此推论,还需要对化合物进行結构修饰,从而进一步明确构效关系。
在清除自由基DPPH 方面,大部分聚酮类化合物均表现出较强的活性,这可能与该类化合物均含有4 个酚羟基有关,而化合物4 比其他化合物多1 个羟基,促使其清除DPPH 的IC50 值最低,但化合物5 的DPPH 自由基清除率小于10%,不具有活性,而有研究[19-20]发现化合物5 和2 对ABTS 自由基具有清除活性,就目前的实验数据和构效关系还无法解释,还需进一步研究。
3.3 斑褐孔菌子实体中活性成分研究展望
通过本研究初步展现了海南斑褐孔菌的主要化学成分类型,挖掘了聚酮类化合物在抑制α-糖苷酶、PTP1B 和清除DPPH 自由基方面的药理活性[21],为后续研发治疗糖尿病等的药物提供先导化合物。但由于本研究得到的化合物的种类和数量较少,且生物活性测试模型有限,未进行更进一步的构效关系研究。斑褐孔菌是海南重要的大型药用真菌资源,在民间已作为健康食品广泛使用。为科学诠释斑褐孔菌的健康功效,后续应加大研究材料的量,分离鉴定微(痕)量或者新颖结构的化学成分,获得更多的化合物种类及数量,并采用高通量活性筛选评价化合物的多种生物功能,发现更多活性成分,对高含量的活性物质进行结构改造与修饰,阐明药理活性的物质基础及构效关系,为进一步深度开发利用海南斑褐孔菌提供理论依据。
