木薯品种华南12号(SC12)同源四倍体诱导及鉴定
2023-07-20曾文丹陆柳英施平丽肖亮尚小红曹升吴正丹严华兵
曾文丹 陆柳英 施平丽 肖亮 尚小红 曹升 吴正丹 严华兵


关键词:木薯;同源四倍体;鉴定;种质创新
中图分类号:S31 文献标识码:A
木薯(Manihot esculenta Crantz)是大戟科(Euphorbiaceae)木薯属(Manihot)植物,是一种富含淀粉的块根作物,有“淀粉之王”、“地下粮仓”等美称。木薯不仅是重要的非主粮生物质能源作物,也是重要的经济作物,用途广泛,可食用、饲用和加工成各种工业产品,如淀粉、酒精等[1-2]。然而,中国木薯产业目前存在种植品种单一、单产低、淀粉含量低和比较经济效益低等突出问题[3],多倍化可伴随产生一些优良的农艺性状,如抗逆性增强、器官体积变大、生物量增加等,被广泛应用于培育植物新品种[4-6]。如印度三倍体木薯品种Sree Harsha 在株型、块根产量、淀粉含量、抗性方面均优于二倍体亲本[7];在巴西,NASSAR 的研究团队通过秋水仙素诱导染色体加倍、远缘杂交等技术,获得了优良的木薯多倍体,如UnB201、UnB310 在长势、块根产量、蛋白质含量等方面表现出明显优势[8-9]。因此,多倍体育种为木薯品种培育提供了一个重要途径。
本研究以木薯品种SC12 为对象,探讨不同浓度秋水仙素对木薯组培苗诱导率的影响,并对二倍体与同源四倍体组培苗及大田材料进行形态学、解剖学和农艺性状比较。以期为提升木薯产量并创制新种质奠定基础。
1 材料与方法
1.1 材料
SC12 木薯组培苗来自广西壮族自治区农业科学院经济作物研究所。
1.2 方法
1.2.1 木薯同源四倍体离体诱导 以无菌水处理作为对照,将木薯组培苗的单芽茎段用0.03~0.20 g/L 的秋水仙素溶液,避光震荡培养48 h 后,用无菌水冲洗4 次,转接到MS+0.02 mg/L 6-BA+0.02 mg/L NAA+20 g/L 蔗糖+6.3 g/L 琼脂的继代培养基上。培养条件:培养温度(25±1)℃,光照强度为18.75~25.00 mol/(m·s),光照时间16 h/d。45 d 后,统计各浓度下的茎段成活率。各处理设3 个重复,每个重复接种10 瓶,每瓶接种3 株。
1.2.2 倍性鉴定 流式细胞仪鉴定:通过形态学初步观察,筛选叶色加深、叶片变宽等具有四倍体形态学特性的植株进行流式细胞仪倍性检测,检测方法参考ZHOU 等[10]的方法。染色体压片鉴定:检测方法参考周慧文[11]的压片方法,待组培苗根尖长至1~2 cm 时,取幼嫩生长旺盛的根尖,将其浸泡在0.002 mol/L 八羟基喹啉∶0.1%秋水仙素溶液1∶1 的溶液中,进行预处理。随后用卡诺固定液固定20 h。于高渗溶液(0.075 mol/LKCl)浸泡30 min 后用2.5%纤维素酶与2.5%果胶酶1∶1 混合酶液处理根尖8 h,蒸馏水洗净后用卡宝品红染色5 min。用光学显微镜观察根尖体细胞染色体数。
1.2.3 二倍体与同源四倍体离体观察比较 将鉴定为同源四倍体的木薯组培苗株系(SC12-4、SC12-11)与二倍体对照接种至MS+0.02 mg/LNAA+20 g/L 蔗糖+6.3 g/L 琼脂的生根培养基上。30 d 后统计组培苗的株高、茎粗、叶厚、裂叶长、裂叶宽、叶绿素SPAD 值等。各处理设3 个重复,每个重复接种15 瓶,每瓶接种6 株。
1.2.4 二倍体与同源四倍体形态观察比较 将鉴定为同源四倍体的木薯组培苗株系(SC12-4、SC12-11)与二倍体组培苗移栽大棚炼苗后移栽至大田,观察不同倍性植株移栽大田60 d(苗期)、120 d(块根形成期)、180 d(块根膨大期)、240 d(成熟期)的生长情况。统计不同时期植株的株高、茎粗、叶厚、裂叶长、裂叶宽、叶绿素SPAD值;成熟期的单株薯种、地上部重、收获指数。各处理设3 个重复,每个重复9 株。收获指数=单株薯种/(单株薯种+地上部重)。
1.2.5 二倍体与四倍体解剖学观察比较 保卫细胞观察:选取二倍体与四倍体木薯株系(SC12-4、SC12-11)成熟叶片,将叶片下表皮朝上放置。用镊子撕取叶片下表皮置于载玻片上,滴一滴0.5%的碘–碘化鉀溶液,染色30~60 s 后覆上盖玻片。使用光学显微镜Olympus BH-2 型40×物镜观察并拍照,测量保卫细胞长、宽,对保卫细胞内叶绿体数目进行计数,并对一个视野内保卫细胞个数进行计数。每个倍性统计5 株,每株观察测量30 个保卫细胞。
叶片横切面:采用番红固绿染色法观察木薯二倍体及同源四倍体的叶片横截面,用光学显微镜观察并拍照,测量叶片横截面、栅栏组织和海绵组织厚度。
叶片组织紧密度(CTR)=栅栏组织厚度(PPT)/叶片厚度
叶片组织疏松度(SR)=海绵组织厚度(SPT)/叶片厚度
1.3 数据处理
采用SPSS 18.0 和Excel 2010 软件对数据进行处理与统计分析。
2 结果与分析
2.1 木薯同源四倍体诱导
经秋水仙素浸泡处理的木薯单芽茎段15 d 左右开始萌发,随着秋水仙素浓度的升高,单芽茎段的存活率降低,0.03%的秋水仙素处理48 h 后,单芽茎段的成活率为42.2%;当秋水仙素浓度升至0.10 g/L 时,存活率仅为8.9%;浓度升至0.20 g/L 时,单芽茎段无一存活(表1)。
2.2 木薯诱变材料的倍性鉴定
共得到存活组培苗74 株,其中38 株存在叶片异形、黄化、颜色变深、叶尖钝化、叶片变宽等不同程度的形态变异。从中挑选疑似四倍体的组培苗进行继代增殖,每一株组培苗的继代植株作为一个株系,每次均挑选疑似四倍体的变异植株进行继代。继代4 次后,一共获得20 个株系进行流式细胞仪检测,在同一参数下,二倍体植株在荧光强度6750 处出现1 个主峰(图1A),四倍体植株在荧光强度13 500 处出现1 个主峰(图1B),四倍体植株的DNA 相对含量是二倍体的2倍。除二倍体植株和四倍体植株,通过流式细胞仪鉴定还检测到多种嵌合体植株(图1C、图1D)。其中,11 个株系为同源四倍体,5 个株系为嵌合体,4 个株系为二倍体。同源四倍体为检测株系的55%,为74 个存活株系的21.62%,即加倍率为21.62%。
根据流式细胞检测结果,将鉴定为四倍体的株系进行细胞学鉴定,结果表明二倍体植株的根尖细胞染色体数目均为2n=2x=36,而四倍体植株根尖细胞染色体数目为2n=4x=72。
2.3 二倍体与同源四倍体株系组培苗观察比较
继代培养30 d 后,二倍体与四倍体不同株系植株生长情况如表2 所示。二倍体组培苗的株高、裂叶长、裂叶长/裂叶宽显著高于四倍体组培苗,而裂叶宽、叶绿素SPAD 值、植株鲜重、干重显著低于四倍体,说明四倍体组培苗相比二倍体植株矮壮、叶片浓绿、干物质积累多,生长势较旺盛。
2.4 二倍体与同源四倍体大田植株形态观察比较
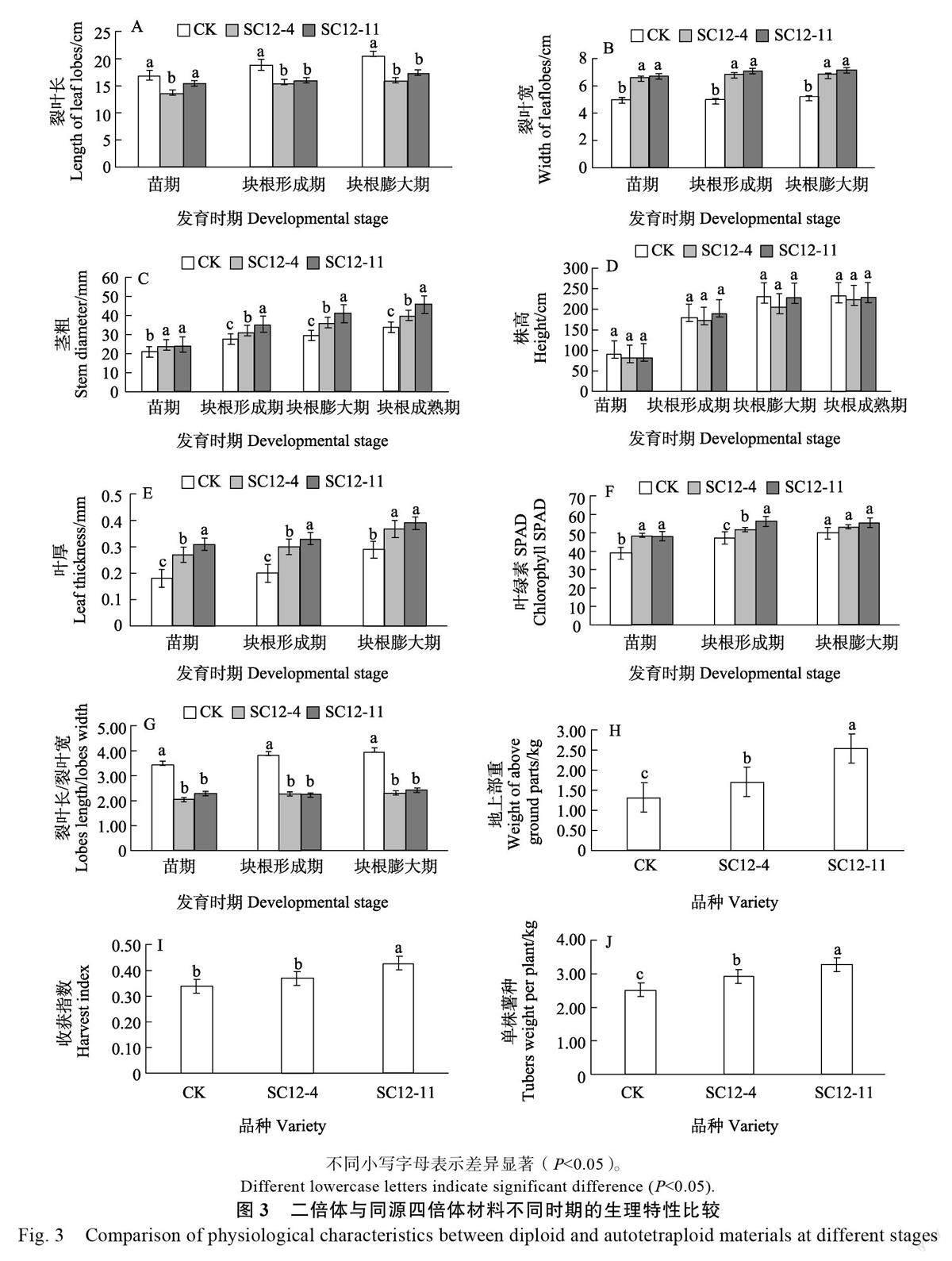
将鉴定为四倍体的木薯组培苗株系(SC12-4、SC12-11)与二倍体组培苗移栽至大田,并于植后60 d(苗期)、120 d(块根形成期)、180 d(块根膨大期)、240 d(成熟期)对生长情况进行调查。如图2 所示,不同时期的多倍体的株高低于二倍体,但差异不显著;多倍体的裂叶宽显著高于二倍体,裂叶长显著低于二倍体,裂叶长/裂叶宽显著降低,在叶片形态上表现为叶尖盾化,叶片由披针形向拱形过渡;大田生长的四倍体均呈现叶片厚、茎杆粗和叶色深等性状,与四倍体组培苗植株表现一致。四倍体株系SC12-11 的单株块根产量和收获指数较高,分别为3.30 kg 和0.43,显著高于二倍体株系(图3)。
2.5 二倍体与四倍体解剖学观察比较
与二倍体对照材料相比,变异四倍体叶片保卫细胞长、宽、叶绿体数目均显著增加,分别比二倍体增加2.33%、28.99%、117.79%;气孔数显著降低,比对照减少40.06%(表3);四倍体变异株保卫细胞呈椭圆形,二倍体保卫细胞趋近于圆柱形(图4)。叶片横截面观察结果表明(表4),四倍体叶片厚度和PPT 均显著高于二倍体,比对照分别增加24.41%、43.88%;SPT 比对照显著降低,降低了22.33%;PPT/SPT 是对照的1.9 倍。四倍体叶片的组织紧密度(CTR)为0.61 高于二倍体(0.52),叶片组[织疏松度(SR)为0.41 显著低于二倍体(0.25),说明四倍体叶片的栅栏组织排列紧密,但海绵组织不发达。
3 讨论
多倍体植物因其遗传物质倍增,从而表现出植株生长健壮、器官变大、抗逆性增强、营养物质和代谢物含量增多的特性,因此多倍体诱导在种质资源创新方面发挥着重要作用[12-13]。雷美艳等[14]经过3 a 的栽培试验均发现,百合多倍体株系JD-h-12 和JD-h-15 平均鳞茎重量优于对照;怀地黄同源四倍体的2 个株系分别比二倍体亲本增产26.6%和56.7%[15];紫雏菊四倍体株系不仅菊苣酸含量较二倍体亲本高,而且生物学产量也增加[16]。潞党参的多倍体株系LDSS-5 与二倍体相比,块根产量增加了76.0%,其叶、花、茎、种子及多糖含量均表现出巨大性或优异性[17]。但是,木薯品种新选048 和华南8 号的四倍体单株的淀粉含量及鲜薯产量均低于二倍体亲本[18]。本研究仅发现2 个四倍体株系的单株薯种比二倍体亲本显著增加。张晓霞等[19]对16 个白花除虫菊同源四倍体和二倍体的农艺性状进行比较分析,发现11个株系的总除虫菊酯含量高于二倍体株系,仅有7 个株系干花中的总除虫菊酯含量高于1.4%,研究结果与本研究结果一致。因此,考查四倍体的农艺性状需要对所获得的株系材料均进行鉴定评价,否则试验结果可能出现偏差。
只有在一定的处理浓度范围内,秋水仙素才能有效诱导多倍体发生。不同的基因型之间,适宜的诱变剂浓度和处理时间存在差异。聂杨眉[20]利用秋水仙素对5 个木薯品种的无菌腋芽进行诱导处理,0.5 g/L 的秋水仙素浓度处理SC5 6~9 h时,诱导率最高,可达66.67%,而0.1 g/L 的秋水仙素浓度处理6~9 h 为NZ199 最佳诱导浓度,但诱导率仅为16.67%;周慧文等[21]认为0.05~0.1 g/L 是诱导木薯组培苗单芽茎段获得四倍体的最宜浓度范围。本研究表明,木薯品种SC12 对秋水仙素较为敏感,当秋水仙素浓度为0.03 g/L时,成活率为42.4%,四倍體诱导率最高;当秋水仙素浓度提升到0.05 g/L 时, 成活率仅为19.4%。不同木薯品种最适宜的秋水仙素处理浓度范围差异显著。
CHEN 等[22]发现四倍体芦笋的气孔密度约为二倍体的一半,而叶绿体数量是二倍体的2 倍,以及气孔长度和宽度略大于二倍体植株。董一昕等[23]也发现四倍体艾纳香植株叶片保卫细胞长和宽,均较二倍体差异显著或极显著。草棉二倍体、三倍体以及四倍体通过细胞学鉴定发现,随着倍性的增加,气孔密度呈下降趋势,而气孔长度和叶绿体数均呈上升趋势[24]。本研究发现木薯变异四倍体叶片保卫细胞长、宽、叶绿体数目均显著增加,分别比二倍体增加2.33%、28.99%、117.79% ; 气孔密度显著降低, 比对照减少40.06%。本研究结果和前人[25-26]研究结果一致。所以气孔密度、保卫细胞的长度和叶绿体数目也是鉴定植株倍性的重要依据,该方法易取材,损伤小,操作简单。
叶片的组织结构在一定程度上反映植物响应外界环境的生理特性,可作为种质资源评价、育种和抗逆性研究的重要依据[27-29]。栅栏组织是光合作用特化而来的细胞群,PPT/SPT 越大,栅栏组织更发达,有利于光合作用和提高光合效能,并增加抗旱性。另外,叶片的CTR 越大,SR 越小说明栅栏组织排列紧密,海绵组织不发达,从而减少蒸腾作用,更有效地减少水分流失[30-31]。
本研究发现,木薯SC12 同源四倍体植株的PPT显著高于二倍体亲本,而SPT 显著低于亲本,四倍体PPT/SPT 是对照的1.9 倍,且紧密度高,进一步说明其抗旱性高。本研究以木薯品种SC12 离体单芽茎段为诱导材料,0.03 g/L 浓度的秋水仙素处理48 h 后,同源四倍体效率最高,为7.78%;经过流式细胞仪、染色体技术、细胞解剖学比较鉴定,获得了10 个同源四倍体和6 个嵌合体植株。二倍体和同源四倍体植株表现出显著的形态和生理差异,同源四倍体叶片变厚,裂叶长/裂叶宽显著降低,叶绿素含量显著增加;四倍体株系SC12-11 的单株薯重和收获指数分别为3.30 kg 和0.43,显著高于对照二倍体株系。
