新生SD 大鼠原代海马组织中神经干细胞的培养和鉴定
2023-07-18张玲娣杨振军
张玲娣, 赵 亮, 由 涌, 许 倩, 杨振军
(1.承德医学院人体解剖教研室,河北 承德 067000;2.承德医学院药理学教研室,河北 承德 067000;3.承德医学院免疫学教研室,河北 承德 067000;4.承德医学院基础医学研究所,河北 承德 067000)
神经干细胞(neural stem cells,NSCs)存在于神经系统中,其能够进行自我更新,具有分化为神经元、星形胶质细胞和少突胶质细胞潜能的原始未分化细胞的能力[1-2]。NSCs 不仅可以通过分化为神经元进行神经替代,还具有增加内源性神经营养因子释放、促进血管生成和突触重建及抑制免疫炎症等作用[3-7]。因此,NSCs 已经成为神经科学领域研究的热点。
研究[8-11]发现:哺乳动物胚胎时期在大脑皮质、嗅球、纹状体和海马区等不同脑区均存在NSCs。成年哺乳动物脑组织中NSCs 存在于侧脑室的脑室下区及海马区的齿状回颗粒下层[12-13]。本研究对既往方法[14-16]进行改良,体外分离培养新生SD 大鼠海马组织中NSCs,鉴定NSCs 纯度并观察培养过程中NSCs 形态表现和生长规律变化,为原代海马组织中NSCs 提取及培养提供参考,并为相关实验提供可靠细胞来源。
1 材料与方法
1.1 实验动物、主要试剂和仪器新生24 h 内SD大鼠由北京华阜康生物科技股份有限公司提供,动物生产许可证编号:SCXK (京)2019-0008。DMEM/F12 基础培养基、B-27、L-谷氨酰胺(L-glutamine)、表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自美国Thermo Fisher 公司,青-链霉素混合液和细胞增殖与活性检测试剂盒购自上海索宝生物科技有限公司,Nestin多克隆一抗、AF-488 标记的羊抗兔二抗、流式抗体标记液和抗体封闭液购自北京博奥森生物技术有限公司,EdU-555 细胞增殖检测试剂盒和DAPI 染色液购自上海碧云天生物技术有限公司。眼科手术器械经高压灭菌烘干后使用;超净台(上海博迅医疗生物仪器股份有限公司),CO2恒温培养箱(日本普和希公司),倒置生物显微镜、流式细胞仪和激光共聚焦显微镜(日本Olympus 公司),台式高速冷冻型微量离心机(北京大龙兴创实验仪器股份公司)。
1.2 新生大鼠海马组织分离和处理取新生24 h内SD 新生大鼠,异氟烷气雾麻醉,75%乙醇浸泡消毒5 min,断颈取头部,移入超净台。剥离皮肤和颅骨,暴露皮质下海马组织(图1)。取新生大鼠海马组织置入预冷PBS 缓冲液中洗净血液,加入Accutase 1.5~2.0 mL 置于培养箱中,37 ℃、5%CO2混匀消化10 min,轻柔吹打至无肉眼可见组织团块,1 000 r·5 min-1高速离心,加入培养基重悬细胞,按照(1~10)×105mL-1的密度接种于T25 培养瓶中[16],置于37 ℃、5%CO2培养箱中悬浮培养。
1.3 原代海马组织中NSCs 培养、传代和形态表现观察取海马组织中NSCs,对培养第2 天获得的原代细胞进行纯化,采用半量换液的方法去除培养基上层漂浮的死细胞和细胞碎片,细胞吹散过200 目细胞筛(孔径75 μm)进一步去除脑膜组织和血管,纯化后细胞按照(1~10)×105mL-1的密度接种于T25 培养瓶中,置于37 ℃、5%CO2培养箱悬浮培养。自培养第2 天开始,每日观察细胞生长状态并采集图像,每2 天半量更换上层培养基。
原代取材的海马组织中NSCs 通常2~3 d 传代1 次,传代时主要采用机械吹打法结合酶消化法进行。海马组织中NSCs 以神经球的形式悬浮生长,随着培养时间延长,神经球体积逐渐增大,当观察到神经球的中心部分折光性变差时,即可进行传代。第1 和2 代神经球结构松散,离心后直接用200 μL 枪头轻柔吹打,即可将神经球吹散成单细胞悬液状态;至第3 代以后细胞之间黏附紧密,神经球的结构致密,需离心后加入细胞消化液消化,再用200 μL枪头轻柔吹散成单细胞悬液,1 000 r·5 min-1高速离心去除细胞消化液,加入培养基重悬细胞,按照(1~10)×105mL-1的密度接种于T25 培养瓶中,置于37 ℃、5%CO2培养箱悬浮培养。
1.4 流式细胞术检测原代海马组织中NSCs纯度
细胞培养至第8 天时倒置显微镜下观察可见,视野内杂质和死细胞数明显减少。以取材当天海马组织提取细胞,即原代海马组织NSCs 第0 天作为对照组,对培养第8 天NSCs 进行纯度鉴定,绘制流式单参数直方图。分别取培养第0 天和培养第8 天NSCs,吹散神经球制成单细胞悬液,4%多聚甲醛固定,0.3%Triton 透膜,3%BSA 封闭,1∶100 Nestin 一抗孵育,AF-488 标记二抗,以每管8×105mL-1的密度转移至流式管中,检测NSCs 纯度,实验重复3 次。
1.5 免疫荧光法检测NSCs 中Nestin 和EdU 蛋白表达分别取培养第2 和8 天的细胞,置于层黏连蛋白处理过的24 孔细胞培养板中,加入1∶500 的含EdU 的培养基,置于37 ℃、5%CO2培养箱中贴壁培养48 h,采用EdU 标记细胞并使细胞贴壁。4% 多聚甲醛固定,0.3% Triton 透膜,3%BSA 封闭。1∶400 Nestin 一抗4 ℃孵育过夜,AF-488 标记二抗,100 μL DAPI 标记细胞核。激光共聚焦显微镜下观察并采集图像。
1.6 细胞计数法检测NSCs 增殖活性取培养第2 天过滤后细胞制成单细胞悬液,调整细胞密度为1.5×105mL-1,接种于96 孔细胞培养板,每孔200 μL,置于37 ℃、5%CO2培养箱中悬浮培养。分别于培养第2、5、8、11、14 和17 天采用细胞计数板进行细胞计数,每次取5 个复孔,共6 次。依据细胞计数结果绘制细胞生长曲线。
1.7 CCK-8 法检测NSCs 增殖活性取培养第2 天过滤后细胞制成单细胞悬液,调整细胞密度为1.5×105mL-1,接种于96 孔细胞培养板,每孔200 μL,置于37 ℃、5%CO2培养箱中悬浮培养。分别于培养第2、5、8、11、14 和17 天检测,共计6 次。加入20 μL CCK-8 溶液,每次测量5 个复孔,培养箱孵育6 h,采用酶标仪于波长450 nm 处检测各孔吸光度(A)值,绘制细胞增殖活性曲线。
1.8 统计学分析采用SPSS 24.0 统计软件进行统计学分析。各时间点细胞计数值和A 值均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 培养不同时间海马组织中NSCs 形态表现
培养第0 天,海马组织中NSCs 以单细胞形式悬浮于培养基中。培养第2 天,海马组织中NSCs开始聚集为大小不等和形态不规则的细胞团块,悬浮生长。此后以细胞团块为中心开始增殖,形成悬浮生长的神经细胞球,随时间的延长神经球体积逐渐增大。培养第8 天,可见神经球大小不一,呈圆形或椭圆形桑葚状,边界清晰,折光度高,无明显突起,神经球中心部位细胞密集,折光性差,颜色暗黑。见图2。
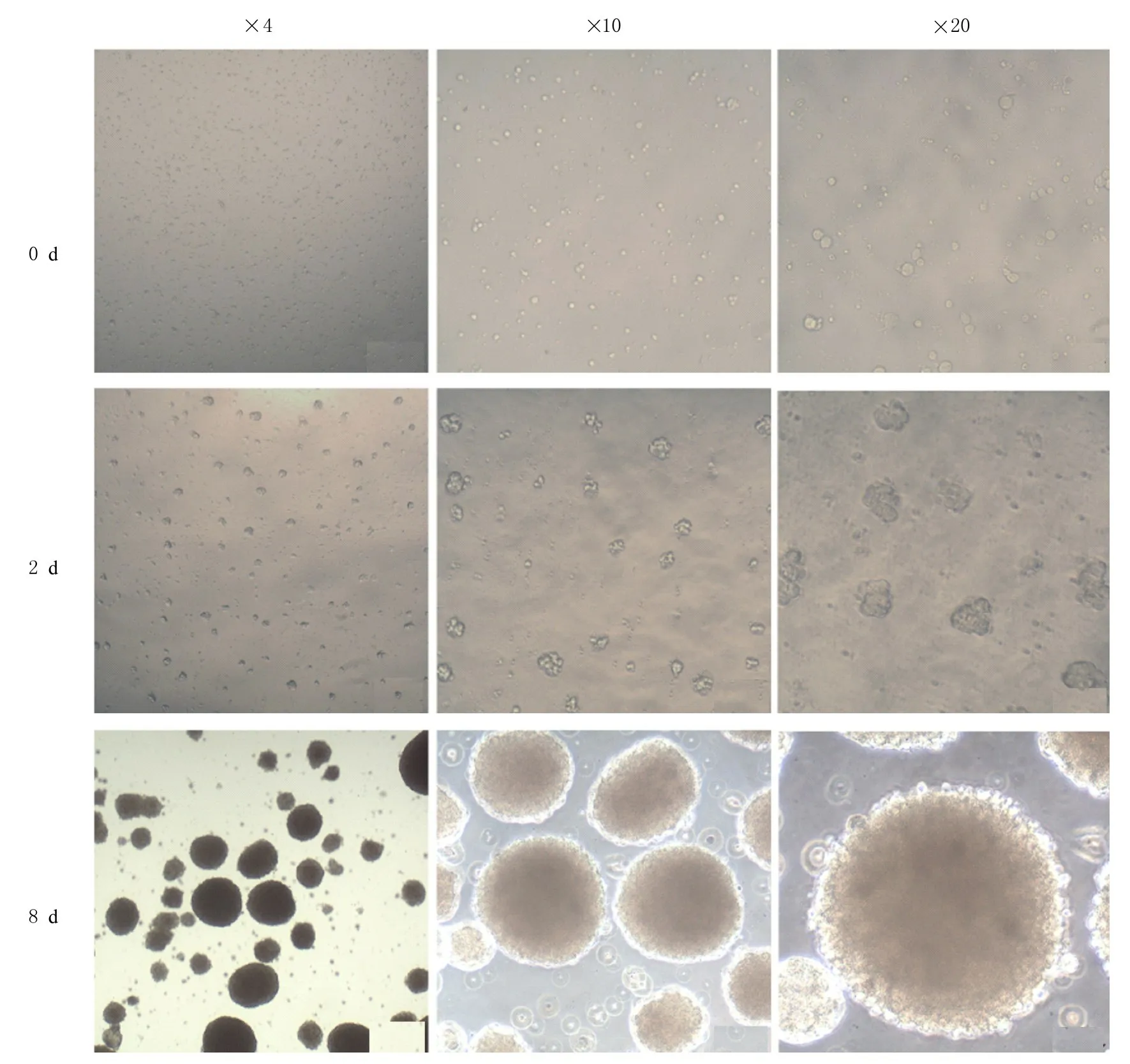
图2 培养不同时间海马组织中NSCs 形态表现Fig.2 Morphology of NSCs in hippocampus tissue after cultured for different time
2.2 海马组织中NSCs 的纯度鉴定原代培养第0 天,海马组织中NSCs 纯度为5.78%。原代培养第8 天,海马组织中NSCs 纯度可达76.50%~85.40%,可满足实验需要。见图3。
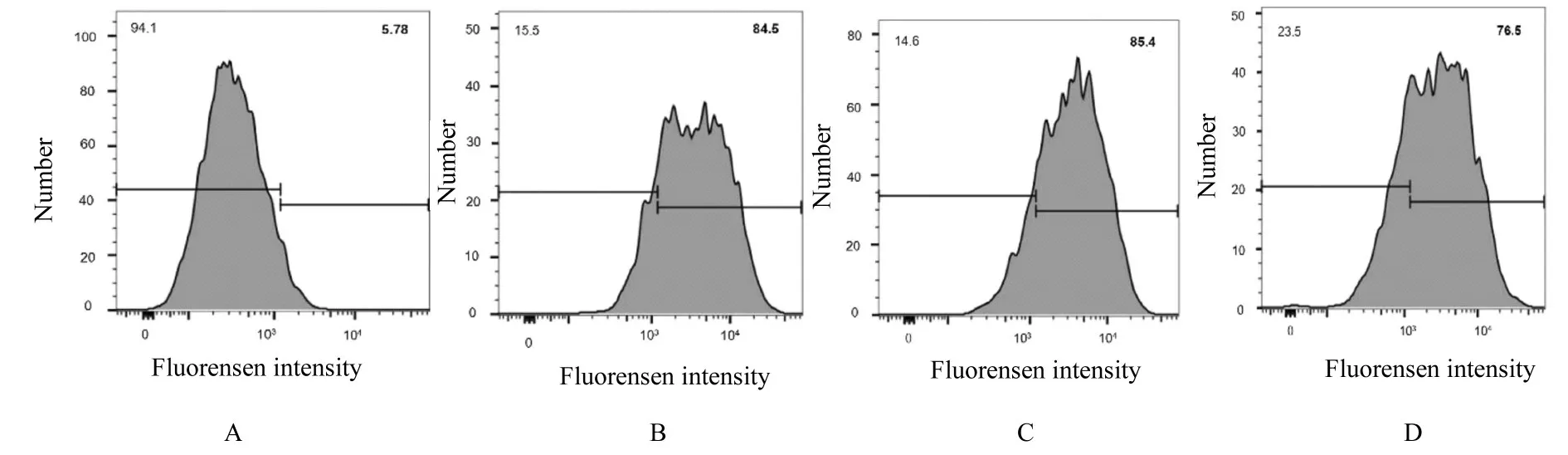
图3 流式细胞术检测不同培养时间海马组织中NSCs 纯度Fig.3 Purities of NSCs in hippocampus tissue after cultured for different time detected by flow cytometry
激光共聚焦显微镜下可见,NSCS 中特异性标记蛋白Nestin 在细胞质中呈阳性表达(绿色),细胞增殖标记物EdU 在细胞核中呈阳性表达(红色),DAPI 标记细胞核为蓝色。培养第2 天海马组织中NSCs 聚集为大小不等和形态不规则的细胞团块,培养第8 天时海马组织中NSCs 聚集为个体较大的神经球。视野内可见神经球为Nestin 与EdU共染细胞构成,提示本研究提取的细胞为具有分裂和增殖能力的NSCs,神经球由具有增殖能力的NSCs 聚集而成。见图4。
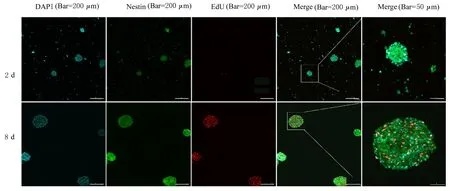
图4 免疫荧光法检测培养不同时间海马组织中Nestin 和EdU 表达情况Fig.4 Expressions of Nestin and EdU in hippocampus tissue after cultured for different time detected by immunofluorescence
2.3 原代海马组织中NSCs 增殖活性细胞增殖标记物EdU 在细胞核呈阳性表达(红色),与培养第2 天比较,培养第8 天时海马组织中NSCs 中EdU 表达明显增加,NSCs 增殖活性明显增强。见图4。结合细胞计数法绘制的细胞生长曲线和CCK-8 法绘制的细胞增殖活性曲线分析,培养5~11 d,NSCs 处于对数生长期,增殖速度快,细胞增殖活性较高,从培养第14 天开始,NSCs 增殖进入平台期,增殖速度减缓。见图5。
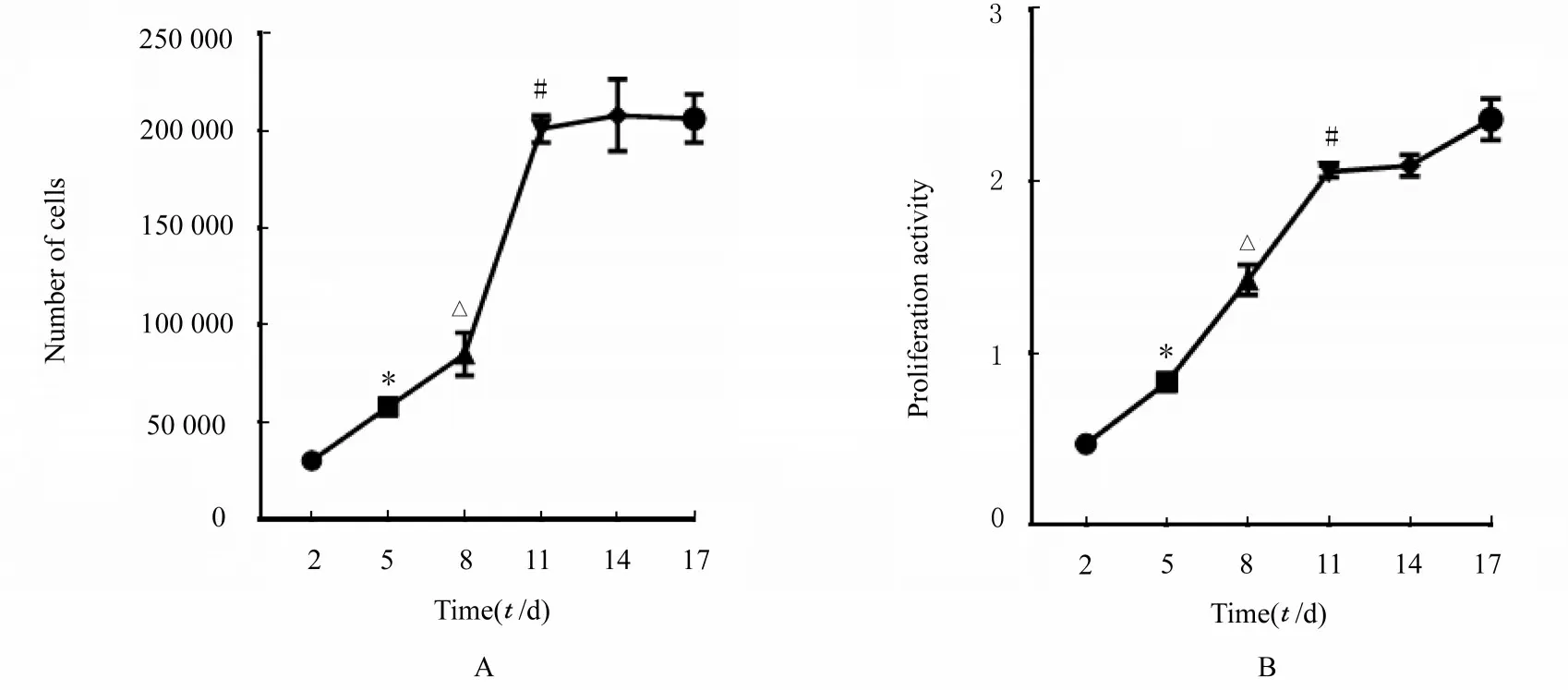
图5 各组大鼠海马组织中NSCs 生长曲线(A)和细胞增殖活性曲线(B)Fig.5 Growth curve(A) and proliferation activity curve(B) of NSCs in hippocampus tissue of rats in various groups
3 讨 论
NSCs 具有增殖和分化能力,可以分化为神经元,参与神经修复,且其免疫原性极低,是理想的细胞治疗材料[17]。与永生化细胞系比较,原代培养NSCs 直接取自活体组织,离体时间短且体外培养代次少,能更好地反映细胞在体内的生长状态。因此,采用原代培养NSCs 可以更好地建立细胞疾病模型,高效率稳定地获得NSCs,并进行体外培养和扩增。
研究[18]采用孕14.5 d 胎鼠大脑半球作为取材部位提取NSCs,取材过程繁琐且时间较长,细胞死亡率较高。本研究以新生大鼠海马组织作为取材对象,取材部位更接近成年大鼠NSCs 存在部位,细胞相似度高;肉眼直视下即可完整分离海马组织,取材难度低,减少了污染风险;取材速度快,可以减少缺血所导致的脑细胞损伤。与大脑半球比较,海马组织结构完整易于分离,脑膜和血管组织相对较少,取材过程中无需剥离脑膜组织,培养第2 天经细胞筛过滤即可完全去除脑膜和血管组织,减少了由于机械分离和操作时间过长导致的细胞损伤[19]。
原代取材的细胞中有脑膜组织、血管组织、神经元、胶质细胞和死亡细胞混入,因此取材后需进一步纯化,以获得高纯度高一致性的NSCs。本研究采用3 步法进行细胞纯化。取材后采用细胞筛过滤去除脑膜和血管组织。神经元和胶质细胞贴壁生长,死亡细胞及细胞崩解产物漂浮于培养基上层,NSCs 以神经球形态悬浮生长。根据上述特性,在培养过程中通过丢弃贴壁细胞以去除神经元和胶质细胞;通过半量换液去除上层培养基中漂浮的死亡细胞及细胞崩解产物;根据NSCs 聚集成的神经球体积偏大且低速离心即可使神经球沉积的特点,在传代过程中通过低速离心换液,进一步去除漂浮于培养基中的杂质,从而达到NSCs 纯化。本研究结果显示:NSCs 纯度可达76.50%~85.40%,能够满足实验需要。
Nestin 蛋白是NSCs 最具代表性的标志物[20],在中枢神经系统发育早期阶段的神经上皮干细胞中表达,随着神经细胞的迁移,Nestin 蛋白表达水平降低,当神经细胞完成分化时,Nestin 蛋白停止表达,因此被广泛地应用于鉴定NSCs。EdU 是一种胸腺嘧啶核苷类似物,能够在细胞增殖过程中代替胸腺嘧啶掺入正在复制的DNA 分子中,可以快速和准确地反映细胞增殖能力[21]。本研究采用Nestin和EdU 对NSCs 进行免疫共标记染色,结果显示:海马组织提取的细胞为具有增殖能力的NSCs。且随着培养时间的延长,NSCs 分裂和增殖增多,NSCs 形成的神经球体积逐渐增大,Nestin 与EdU共染阳性细胞数逐渐增多,神经球外周光滑,无明显突起,表明在一定的体外培养时间内,NSCs 能很好地保持干性潜能。
来源于新生SD 大鼠海马组织的NSCs 在体外培养过程中不能长期保持高度增殖能力和增殖活性,随培养时间的延长和培养代次的增加,细胞活性和增殖能力明显降低。本研究结果显示:培养0~3 d,NSCs 增殖活性较低,生长较缓慢,神经球形成速度较慢;培养5~11 d 时NSCs 处于对数生长期,细胞状态最好,可以保持较高的细胞增殖活性和增殖能力,神经球形成速度较快;培养第14 天开始,细胞生长进入平台期,细胞增殖活性和增殖能力开始降低。因此,相关实验尽量选用培养5~11 d 的NSCs。
综上所述,本研究探讨了NSCs 原代培养的提取和纯化方法,对NSCs 进行纯度鉴定,观察培养过程中NSCs 增殖活性变化,为相关研究提供参考。
