双能CT腰椎定量测量预测骨质疏松的临床研究
2023-07-18姜咏水通信作者
熊 跃,姜咏水,韩 丹(通信作者)
(1昆明医科大学 云南 昆明 650100)
(2云南省第一人民医院 云南 昆明 650100)
(3昆明医科大学第一附属医院影像科 云南 昆明 650100)
骨质疏松症(osteoporosis,OP)是一种以骨量减低及骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性疾病[1-2]。骨质疏松性骨折(脆性骨折)是其严重并发症,可以发生在全身各个部位,最常见的部位是脊柱、髋部、前臂远端和肱骨近端等[3]。随着我国人口老龄化加剧,骨质疏松症及其并发症带来的老年化社会问题将更加严峻[4],因此早期诊断和预防骨质疏松至关重要。临床主要根据骨密度(bone mineral density,BMD)诊断骨质疏松症。常用的检查方法有双能X线吸收法(dual-energy X-ray absorptiometry,DXA)和定量CT(quantitative CT,QCT)。双能CT(dual-energy CT,DECT)作为一种新成像技术,利用不同物质在X线下特征性衰减规律从而分离、鉴别不同组织成分,为疾病的诊断提供多参数依据。本研究通过比较DECT测量参数与BMD的相关性,探讨DECT诊断骨质疏松的临床价值。
1 资料与方法
1.1 一般资料
本研究采用前瞻性设计,在每位参与者的知情同意下于2021年12月—2022年12月收集腰部双能CT扫描患者共128例,其中男性患者49例,女性患者79 例,男女比约1:1.61;患者年龄为39~84岁,平均年龄(64.61±10.01)岁;平均体质量指数(body mass index,BMI)为(23.62±3.37)kg/m2。
纳入标准:①年龄大于20岁,随机选择非外伤腰痛就诊,临床建议行腰椎CT扫描患者;②志愿参加腰椎DECT定量检查者;③腰椎体检者;④行全腹部DECT扫描的患者。排除标准:①腰椎椎体骨折患者;②腰椎或椎间盘内固定器植入术后患者;③椎体成形术后患者;④骨肿瘤含骨转移患者;⑤近期服用影响骨代谢药物患者。
1.2 方法
1.2.1 扫描设备及参数 腰椎CT扫描采用德国西门子公司SOMATOM Force第三代双能量开源CT扫描仪,检查同时将校准体膜(Pro v5.0;Mindways,Tex)放置在患者腰椎下方。患者取仰卧位,双手上举,头足方向扫描,扫描范围自胸12椎体上缘至骶1椎体下缘。扫描时两个X射线管的设置是恒定的(管A:电压90 kV,电流220 mAs;管B:电压150 kV,带Sn过滤器,电流138 mAs)。使用自动管电流调制技术,准直128×0.6 mm,螺距0.6。采用高级模拟迭代重组技术(advanced modeled iterative reconstruction,ADMIRE),强度为3进行图像重组,卷积核Qr 40,A、B X射线管图像层厚均为1.0 mm,层间隔均为0.7 mm。
1.2.2 后处理工作软件 将所得图像传入Syngo Via Dual Energy后处理工作站,以0.5为线性融合系数的混合能量图像(等效120 keV)传入美国Mindways公司的QCT分析软件测量BMD值。
1.2.3 辐射剂量 扫描完成后记录DECT扫描的容积剂量指数(volume computed tomography dose index,CTDIvol)和剂量长度乘积(dose length product,DLP),CTDIvol和DLP均由机器自动给出。
1.2.4 分组方法 骨质疏松组(A组):BMD<80 mg/cm3;骨量减低组(B组):80≤BMD≤120 mg/cm3;骨量正常组(C组):BMD>120 mg/cm3。
1.3 图像后处理及分析
1.3.1 DECT测量参数及方法 使用Syngo Via VB10 CT后处理工作站Dual-Energy选项卡中的虚拟平扫(virtual non-contrast,VNC)软件对图像进行处理分析。参照Luo等[5]定量测量肝组织中铁含量的方法,对VNC中脂肪、软组织的CT值和碘的斜率进行修正:按Dual-Energy选项卡中Bone Marrow软件推荐的90 kV、Sn 150 kV管电压下红骨髓、黄骨髓的CT值和钙的斜率,以钙的斜率1.65替换碘的斜率3.01。在椎体中心层面轴位图像上对腰1~5椎体进行测量,手工沿椎体前部的三分之二处勾勒感兴趣区(ROI),避开骨皮质及椎静脉沟,记录软件自动给出的椎体各测量值:钙的CT值(CM)、混合能量图像(混合比0.5)的CT值(rCT)、钙浓度(CaD)和脂肪含量百分比(FF)。
由1名具有10年骨骼肌肉系统影像诊断经验的影像科主治医师和2年工作经验的住院医师在后处理工作站完成测量,测量者对测量对象的BMD骨密度结果并不知情。采用组内相关系数(intraclass correlation coefficient,ICC)评价两名医师测量结果的一致性。
1.3.2 QCT测量的BMD CT设备和QCT分析Mindways软件使用质量控制模型提前校准。将混合比0.5的CT扫描数据导入QCT分析软件应用程序。每个椎体的BMD在包含前椎体三分之二的ROI内测量(与DECT的ROI尽可能相同)。每个椎体测量两次取平均值。
1.4 统计学方法
采用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,采用t检验;不符合正态分布的计量资料采用中位数及四分位距[M(Q1,Q2)]表示,采用Mann-WhitneyU检验。使用Pearson检验和线性回归分析各测量参数与BMD间的一致性及相关性。使用受试者操作特征(receiver operating characteristic,ROC)曲线分析各测量参数对骨质疏松的诊断效能,进一步的两两比较采用U检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本情况统计分析
患者一般资料见表1。
2.2 DECT腰椎测量结果
比较骨质疏松和非骨质疏松、骨量减低和骨量正常椎体各测值间的差异,结果显示除FF外,各组椎体的测量参数间差异均显著(P<0.01)。见表2。
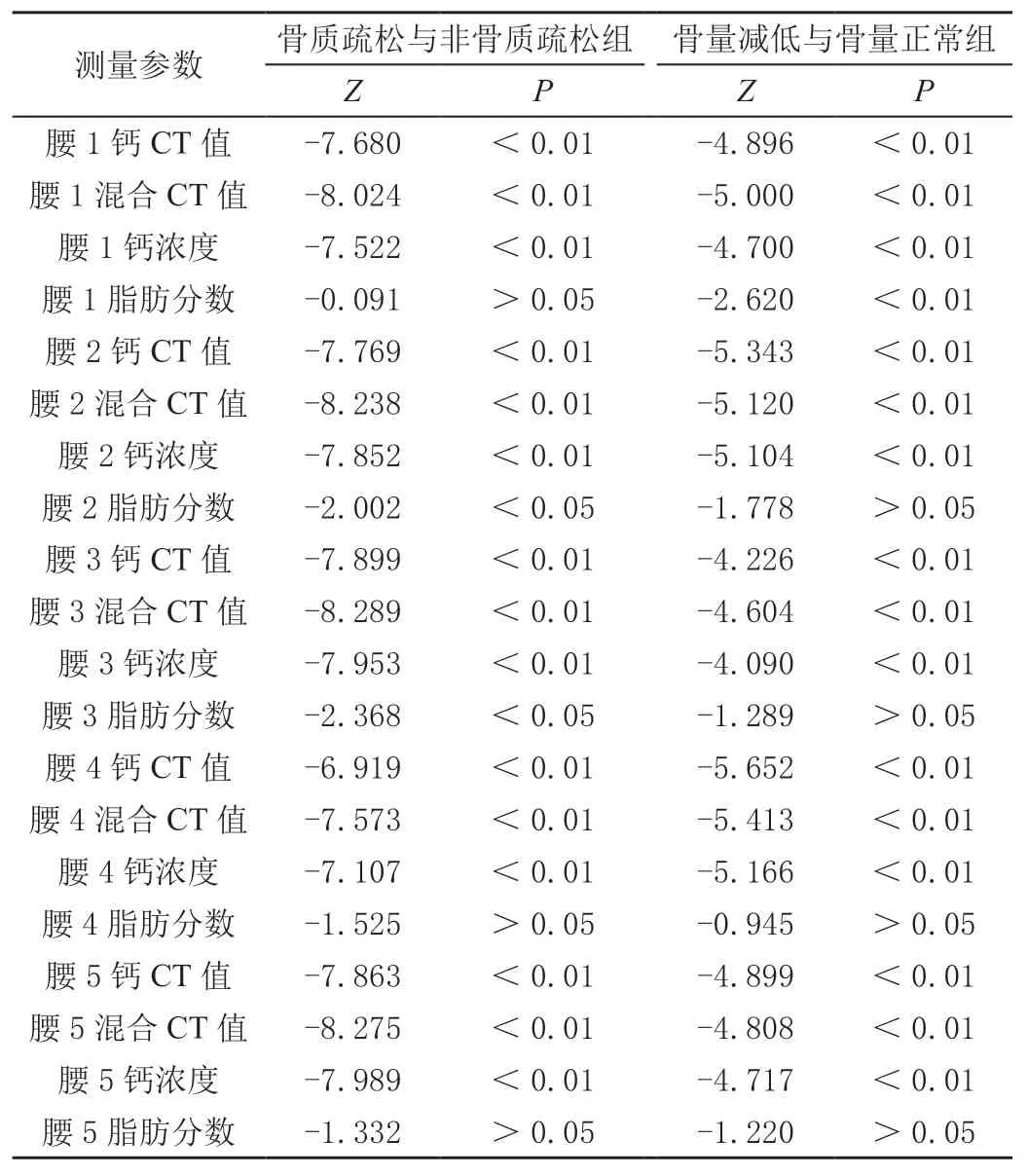
表2 DECT测值的差异性
观察性别对各测量值的影响,除FF外,男性CM、rCT、CaD值均大于女性,差异均有统计学意义(P<0.05)。见表3。
表3 性别在双能CT各测值的差异性()
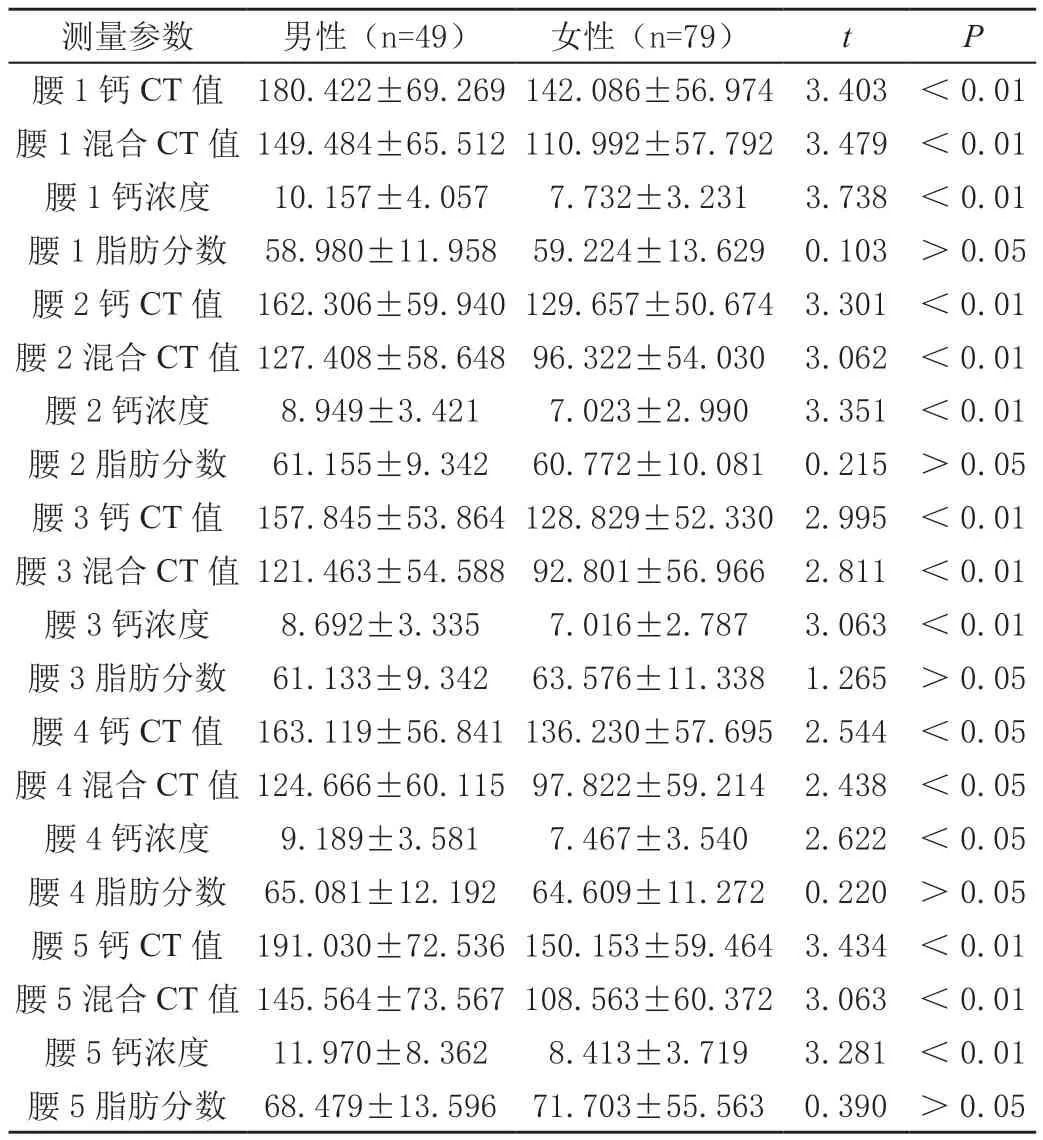
表3 性别在双能CT各测值的差异性()
测量参数男性(n=49)女性(n=79)tP腰1钙CT值180.422±69.269142.086±56.9743.403<0.01腰1混合CT值149.484±65.512110.992±57.7923.479<0.01腰1钙浓度10.157±4.0577.732±3.2313.738<0.01腰1脂肪分数58.980±11.95859.224±13.6290.103>0.05腰2钙CT值162.306±59.940129.657±50.6743.301<0.01腰2混合CT值127.408±58.64896.322±54.0303.062<0.01腰2钙浓度8.949±3.4217.023±2.9903.351<0.01腰2脂肪分数61.155±9.34260.772±10.0810.215>0.05腰3钙CT值157.845±53.864128.829±52.3302.995<0.01腰3混合CT值121.463±54.58892.801±56.9662.811<0.01腰3钙浓度8.692±3.3357.016±2.7873.063<0.01腰3脂肪分数61.133±9.34263.576±11.3381.265>0.05腰4钙CT值163.119±56.841136.230±57.6952.544<0.05腰4混合CT值124.666±60.11597.822±59.2142.438<0.05腰4钙浓度9.189±3.5817.467±3.5402.622<0.05腰4脂肪分数65.081±12.19264.609±11.2720.220>0.05腰5钙CT值191.030±72.536150.153±59.4643.434<0.01腰5混合CT值145.564±73.567108.563±60.3723.063<0.01腰5钙浓度11.970±8.3628.413±3.7193.281<0.01腰5脂肪分数68.479±13.59671.703±55.5630.390>0.05
2.3 DECT椎体各测量参数与BMD值的相关性
腰1~5椎体DECT扫描后测得的CM、rCT、CaD值校正年龄、BMI因素后,与BMD值呈显著正相关(r均>0.7,P均<0.01)。见图1。
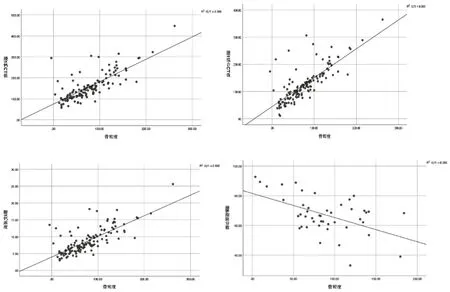
图1 总体DECT测量参数CM、rCT、CaD及FF与BMD相关性分析散点图(校正年龄和BMI后)
2.4 DECT椎体各测量参数对骨质疏松的诊断价值
腰1~5各椎体层面DECT参数ROC曲线下面积(AUC)见表4和图2。各层面椎体rCT的曲线下面积最大,表明腰1~5各椎体层面DECT测得的CM、rCT、CaD值中,rCT值对骨质疏松具有更好的诊断效能。男性以腰3椎体层面rCT值诊断准确性最高(AUC=0.979,P<0.01)。女性以腰5椎体层面rCT值诊断准确性最高(AUC=0.959,P<0.01)。
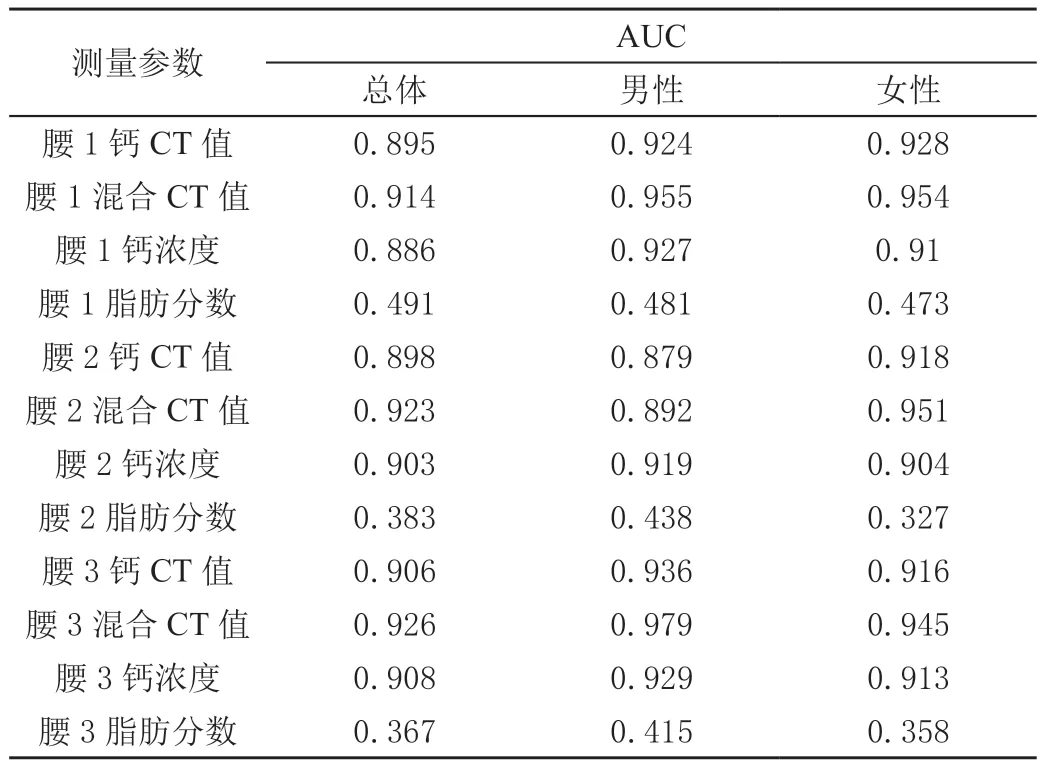
表4 双能CT各测量参数ROC曲线下面积
3 讨论
双能X线吸收测定仪(DXA)骨密度(BMD)测量是目前临床应用最广泛、认可度最高的方法,也是诊断OP的金标准[6],相较于其他成像技术辐射剂量相对较低、简便易用;但不足的是,因其是二维平面投影,易受重叠、肥胖、主动脉壁钙化、脊柱退行性改变等影响,不能真实反映骨密度。由于DXA测量的面积BMD是骨皮质和骨松质的综合值,所以,发生在松质骨的早期OP并不能被及早发现[7]。定量CT(QCT)利用临床CT扫描图像,经过校准,精准测量骨密度及体成分[8]。QCT测量的体积骨密度可以区分骨皮质和骨小梁,在早期骨质疏松诊断及骨折预测方面优于DXA。近年来,QCT测量腹腔游离脂肪面积和肝脏脂肪含量广泛应用于评价肥胖和脂肪肝,但目前诊断标准尚未建立,尚需要多中心、大队列的数据[8]。
BMD只能反映骨质量的一部分,不能反映骨髓性质及有机物质等成分。研究表明随着骨量的降低,骨髓内脂肪组织不同程度增加,骨髓脂肪沉积是骨质疏松重要发病机制之一。研究椎体内骨髓脂肪组织的含量对评估骨质疏松及其并发症具有重要意义。双能CT是利用组织和材料在不同能量X射线下的不同衰减特异性,从而实现物质鉴别、量化组织类型的检查方法。最早临床多应用在痛风、肾结石等物质定量及鉴别。随着技术的发展、软件及后处理重建算法改进,DECT扫描保持图像质量的同时减少了辐射剂量。据报道可准确回顾性地预测有风险的患者维持骨质疏松症相关骨折的2年风险。同时DECT虚拟非钙(VNCa)图可以改善对细微和隐匿性骨折的检测,并评估算骨折的愈合情况。虚拟非对比增强(VNC)图可以测量椎体钙浓度及骨髓脂肪含量,在骨质疏松的诊断和预防方面提供新的生物靶向指标。
本研究结果表明,DECT腰椎定量测量可以有效诊断骨质疏松症,并且可以获得椎体骨折及骨髓水肿等信息,优化了检查流程。与传统的BMD测量相比,DECT腰椎定量测量具有更高的灵敏度和特异度,可以更准确地诊断骨质疏松症。此外,DECT腰椎定量测量还可以提供更多的信息,如骨折和骨髓水肿等,有助于更全面地评估患者的骨骼健康状况。本研究还发现,除FF外,骨质疏松组椎体CM、CaD及rCT值均小于非骨质疏松组椎体值,骨量减低组椎体CM、CaD及rCT值均小于骨量正常组椎体值,差异均有统计学意义。这表明,DECT腰椎定量测量可以对不同骨质疏松程度的患者进行分类诊断,有助于更准确地评估患者的骨骼健康状况。此外,我们还发现,性别在各测量参数间有显著差异,男性CM、rCT、CaD值均大于女性。这可能与男性骨骼密度较高有关。在校正年龄和BMI因素后,CM、CaD及rCT值均与BMD显著正相关,这表明DECT腰椎定量测量可以作为一种有效的骨密度评估方法。
骨质疏松症是影响全世界的骨骼最常见疾病,该病的影像诊断不能仅由一个参数来表征。当前的成像技术与模式跟新模型和先进处理相结合,有可能全面了解骨质疏松症中骨组织发生的病理变化,并为诊断和监测骨质疏松症的新成像方法铺平道路,从而更好地为临床预防和治疗骨质疏松提供选择。
