子宫主动脉结扎大鼠缺氧缺血脑病模型的声辐射力脉冲弹性成像结果与神经细胞凋亡率的相关性研究
2023-07-18孙凤兰付晓庆刘玮玮
赵 晶,孙凤兰,王 红,付晓庆,刘玮玮
(德州市妇幼保健院特检科 山东 德州 253011)
新生儿缺氧缺血性脑病(hypoxie-ischemic encephalopathy,HIE)是指新生儿在围产期因窒息导致的缺氧缺血性脑损伤,其极易引起新生儿出现各类脑损伤后遗症,严重的可危及生命[1]。因此,对新生儿缺氧缺血性脑病的临床早期诊断和及时干预治疗尤为重要。普通的超声检测虽然已经广泛用于新生儿颅脑损伤的诊断,但因其技术局限性,导致灵敏度较低,需要极具经验的医师才能准确判断。有研究表明声辐射力脉冲弹性成像技术(ARFI)在组织硬度检测中具有较高的灵敏度,因此在颅脑损伤的早期精确诊断应用中具有巨大潜力[2-3]。尽管如此,基于安全性考虑,当前关于颅脑损伤的相关研究主要集中于各类动物模型[4-5]。因此,本研究首先通过孕鼠子宫体动脉结扎的方法构建大鼠缺氧缺血性脑病模型,随后分别利用多普勒超声检测模型鼠大脑的MCA血流参数和利用ARFI弹性成像技术检测新生大鼠模型的脑组织硬度。两种超声检测方法得到的数据分别与模型鼠脑组织的病理染色、神经细胞凋亡统计以及凋亡相关蛋白的WB结果进行比较,对ARFI弹性成像应用于缺氧缺血性脑损伤检测的可行性进行深入研究,为今后该技术应用于临床提供参考依据。
1 资料与方法
1.1 一般资料
选取济南金丰实验动物有限公司提供的30只孕晚期Wistar大鼠作为实验对象。参考颜淑芹等[5]的造模方法,将所有实验对象无麻醉仰卧固定在手术台上,手术暴露子宫后用止血钳将双侧子宫角及子宫体动脉结扎。根据结扎时间不同分为对照组、10分钟组、20分钟组三组,每组10只。其中,对照组仅暴露子宫而不结扎,随后缝合伤口,继续饲养,自然分娩。模型组结扎完成后,剖宫产取出胎鼠,使其尽快恢复自主呼吸,交给代乳妈妈鼠喂养。动物实验获得德州市妇幼保健院医学伦理委员会批准(批号YXLL-202004)。
1.2 方法
超声检查使用含内置ARFI技术的Simens公司的ACUSON S2000彩色多普勒超声诊断仪。探头9L4,频率(7 ~9)MHz。荧光显微镜使用日本奥林巴斯CKX53荧光显微镜。蛋白质免疫印迹实验使用美国伯乐公司的Mini-PROTEAN® Tetra电泳槽以及ChemiDoc化学发光成像系统。
三个实验组存活的模型幼鼠分别于出生后6天、8天、10天、12天进行超声检查。将幼鼠头颅固定在检查台上,探头置于其头部顶骨中线,先应用多普勒彩超和脉冲多普勒测定双侧大脑中的收缩期最大血流速度(Vs)、舒张期末最大血流速度(Vd)以及阻力指数(RI)。随后使用ARFI弹性成像技术测量脑实质的声触诊量化(VTQ)值。所有测量值连续测定3次取平均值作为最终结果。
1.3 动物模型病理学检测
在所有超声检查结束后,对每个实验组的所有模型幼鼠进行病理检测。具体方法:首先,将实验对象麻醉后固定于解剖台上,用PBS生理盐水进行心脏和大脑灌注。随后,取完整一侧大脑经4%多聚甲醛固定、脱水、石蜡包埋等处理。另一侧完整大脑冷冻于超低温冰箱用于后续实验。大脑组织蜡块在石蜡切片机上切片5 μm后行苏木素-伊红染色(HE染色),封片后显微镜观察。
1.4 TUNEL组织细胞凋亡检测
大脑组织石蜡切片经二甲苯脱蜡、梯度乙醇水化后20 μg/mL的蛋白酶K室温处理20 min,PBS漂洗三次彻底去除残留的蛋白酶K。按照TUNEL试剂盒(碧云天)说明书的要求配制荧光标记反应液,37°避光孵育样本60 min后洗去反应液,DAPI复染后封片,于荧光显微镜下观察并拍照。
1.5 统计学方法
采用GraphPad 8.0软件进行数据分析,符合正态分布的计量资料以均数±标准差()表示,多组间采用方差分析(ANOVA),以秩和检验分析非正态分布的资料。各指标间相关性采用Pearson相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 各实验组模型在不同时间点检测的Vs值
子宫动脉结扎20分钟和10分钟组出生的幼鼠模型大脑Vs值在各检测时间点内均低于对照组(P<0.05),但随着生长时间延长并未出现进一步的降低。结扎20分钟组与10分钟组在各时间点的Vs值差异均无统计学意义(P>0.05)。详见表1。
表1 各实验组模型不同时间点大脑Vs值测量结果(,cm/s)

表1 各实验组模型不同时间点大脑Vs值测量结果(,cm/s)
注:①表示与对照组相比,P<0.05;②表示与10分钟组相比,P>0.05。
组别6 d8 d 20分钟组(n=5)6.86±0.62①②6.94±0.84①②10分钟组(n=7)7.27±0.57①6.81±0.67①对照组(n=10)11.57±0.5511.14±0.89组别10 d12 d 20分钟组(n=5)6.41±0.64①②6.41±0.47①②10分钟组(n=7)6.91±0.76①6.64±0.94①对照组(n=10)11.24±0.5911.04±0.86
2.2 各实验组模型在不同时间点检测的Vd值
子宫动脉结扎20分钟组和10分钟组中大脑Vd值在幼鼠出生后各时间点与对照组均无显著差异;结扎20分钟组与10分钟组在各时间点的Vd值差异均无统计学意义(P>0.05)。详见表2。
表2 各实验组模型不同时间点大脑Vd值测量结果(,cm/s)
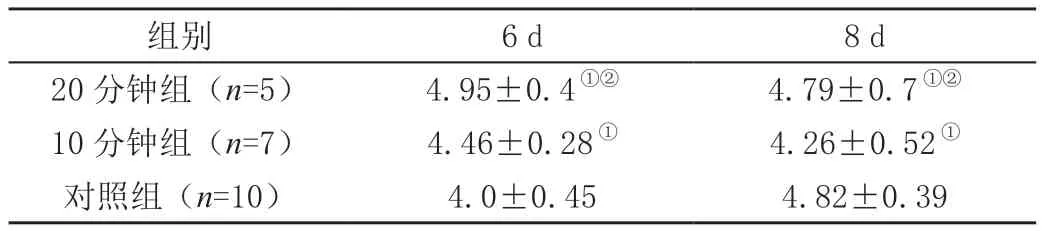
表2 各实验组模型不同时间点大脑Vd值测量结果(,cm/s)
组别6 d8 d 20分钟组(n=5)4.95±0.4①②4.79±0.7①②10分钟组(n=7)4.46±0.28①4.26±0.52①对照组(n=10)4.0±0.454.82±0.39
表2(续)
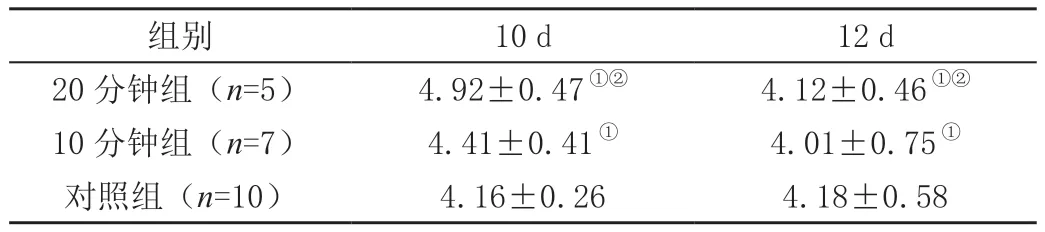
表2 各实验组模型不同时间点大脑Vd值测量结果(,cm/s)
注:①表示与对照组相比,P>0.05;②表示与10分钟组相比,P>0.05。
组别10 d12 d 20分钟组(n=5)4.92±0.47①②4.12±0.46①②10分钟组(n=7)4.41±0.41①4.01±0.75①对照组(n=10)4.16±0.264.18±0.58
2.3 各实验组模型在不同时间点检测的RI值
子宫动脉结扎20分钟组和10分钟组中模型幼鼠大脑RI值在出生后6~12天各时间点内均低于对照组(P<0.05),但数值并未随着生长时间的延长而发生明显变化。结扎20分钟组与10分钟组在各时间点的RI值差异均无统计学意义(P>0.05)。详见表3。
表3 各实验组模型不同时间点大脑RI值测量结果()

表3 各实验组模型不同时间点大脑RI值测量结果()
注:①表示与对照组相比,P<0.05;②表示与10分钟组相比,P>0.05。
组别6 d8 d 20分钟组(n=5)0.45±0.01①②0.39±0.02①②10分钟组(n=7)0.42±0.02①0.45±0.04①对照组(n=10)0.57±0.030.59±0.03组别10 d12 d 20分钟组(n=5)0.35±0.04①②0.42±0.03①②10分钟组(n=7)0.42±0.03①0.47±0.01①对照组(n=10)0.55±0.030.57±0.03
2.4 各实验组模型在不同时间点检测的声触诊量化(VTQ)值
子宫动脉结扎20分钟组和10分钟组中模型幼鼠大脑VTQ值在出生后6到12天各时间点内均高于对照组(P<0.05),但数值并未随着生长时间的增加而发生明显变化。结扎20分钟组在各时间点的VTQ值均显著高于10分钟组(P<0.05)。详见表4。
表4 各实验组模型不同时间点大脑VTQ值测量结果(,m/s)

表4 各实验组模型不同时间点大脑VTQ值测量结果(,m/s)
注:①表示与对照组相比,P<0.05;②表示与10分钟组比较,P<0.05。
组别6 d8 d 20分钟组(n=5)1.86±0.17①②1.80±.0.11①②10分钟组(n=7)1.34±0.07①1.39±0.10①对照组(n=10)0.83±0.090.86±0.09组别10 d12 d 20分钟组(n=5)1.85±0.14①②1.85±0.18①②10分钟组(n=7)144±0.13①1.43±0.11①对照组(n=10)0.96±0.070.86±0.07
2.5 各实验组模型大脑切片HE染色观察结果
对照组中神经细胞排列紧密、整齐,细胞形态正常。结扎10分钟组和结扎20分钟组中脑组织神经细胞数目减少,细胞形态改变,细胞间隙增大,出现很多大的空泡。结果详见图1。
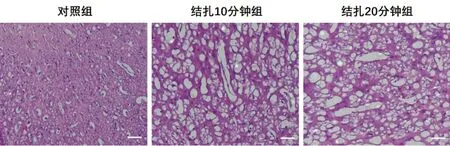
图1 三组模型脑组织HE染色结果
2.6 TUNEL染色观察各实验组模型大脑中神经细胞凋亡情况
结扎10分钟组和结扎20分钟组中神经细胞数目显著少于对照组,而细胞凋亡率却明显高于对照组。结扎20分钟组中的神经细胞数目显著少于结扎10分钟组,细胞凋亡率显著上升。模型组中的一些神经细胞细胞核形态较正常神经细胞核发生变型。结果详见图2、表5。
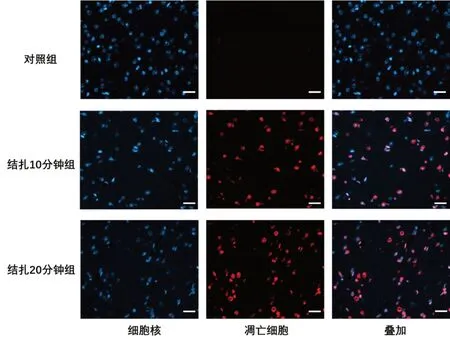
图2 各实验组脑组织TUNEL染色结果
表5 各实验组大鼠脑组织中神经细胞凋亡率统计结果()

表5 各实验组大鼠脑组织中神经细胞凋亡率统计结果()
注:①表示与对照组相比,P<0.05;②表示与10分钟组相比,P<0.05。
组别单视野细胞数凋亡细胞数凋亡率/%结扎10分钟组95.28±7.16①45.43±4.37①45.61±4.54①结扎20分钟组88.4±4.88①54.7±6.01①61.89±6.03①②对照组102.6±8.043.6±1.353.47±1.18
2.7 计算各参数之间的相关性系数
结果显示只有VTQ值和细胞凋亡率成高相关性且有显著差异(r=0.9974,P=0.046)。见表6。
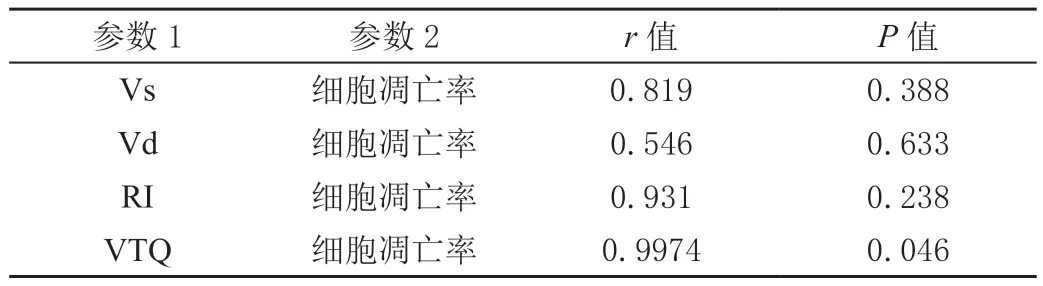
表6 动物模型大脑血流动力学参数、VTQ值与细胞凋亡率的相关性
3 讨论
新生儿大脑组织对能量和氧气的需求非常旺盛,一旦发生缺氧缺血会极大影响神经系统的正常发育和功能,造成脑损伤[1]。因此对新生儿缺氧缺血性脑病的早期诊断和治疗至关重要。目前对HIE的临床诊断主要依赖于影像学检查,其包括磁共振成像(MRI)和超声检查[6-8]。MRI是鉴别HIE特异性和敏感性最高的检查方式[9]。然而,不能进行床旁操作,费用昂贵且通常需要镇静麻醉限制了其在新生儿颅脑损伤检查中的应用。因此,越来越多的临床医生开始首选超声这种可以在床边进行的低成本、无辐射损害的检查方式来诊断新生儿脑损伤[10]。彩色多普勒超声可以测量出新生儿颅脑中的血流动力学参数,而这些参数的改变与HIE的发生和发展密切相关[11-12]。随着超声技术的进一步发展,超声检查的敏感度也在逐步提高,其中超声弹性成像技术就是一种很有潜力并且非常适合检测脑损伤的超声成像技术[2-3]。
弹性成像是一种用来确定组织硬度的方法,相较于传统的灰度超声,其产生定量或半定量的测量组织形态,可以显著提高诊断和预后的敏感性。弹性成像还可以用来检测那些仅通过MRI或普通超声无法定量地观察这些病变的进展和演变,深化人们对新生儿脑损伤的认识[13]。ARFI弹性成像是一种新兴的弹性成像技术,其包括声触诊成像(virtual touch tissue imaging,VTI)和声触诊组织定量(virtual touch tissue quantification,VTQ),并已经应用于颅脑超声检查[14]。尽管如此,国内关于ARFI弹性成像技术应用于新生儿脑损伤检查的研究较少。因此,本研究利用彩色多普勒超声技术结合ARFI弹性成像检测缺氧缺血性脑损伤动物模型中测量值的变化,以期有新的发现。
制作大鼠缺氧缺血性脑损伤模型技术已经得到多方面的研究,其中应用较多的方法是将出生一周的幼鼠通过手术结扎一侧颈总动脉后低氧处理而成[15]。然而,人类缺氧缺血性脑病的发生是妊娠期间或分娩过程中缺氧导致的。为了更接近于真实的情况,本实验采用了结扎孕晚期大鼠双侧子宫动脉的方法制作动物模型。为了保证模型组新生乳鼠成活率,将模型组分为结扎时间10分钟组和20分钟组,分别进行观察和研究。通过不断摸索,本实验成功构建了子宫动脉结扎诱发的新生缺氧缺血大鼠模型,并在适当的时间点进行了颅脑超声评价以及病理检测、Tunel细胞凋亡检测等。
实验结果说明,子宫动脉结扎20分钟和10分钟组的新生大鼠,在各检测时间点其大脑血流动力学参数Vd值变化不明显,而Vs和RI值较对照组均发生显著变化。尽管如此,结扎20分钟组和10分钟组之间的Vs和RI值在各时间点均未检测到明显差异,这说明缺氧缺血性脑损伤形成后很难自行修复。利用ARFI技术检测的脑实质VTQ值随着子宫动脉结扎时间的延长而显著提高,而且两个不同时间组之间也存在明显差异。HE染色结果表明,子宫动脉结扎后,新生大鼠脑组织中神经细胞数量减少,细胞形态改变,细胞间出现很多空泡。而TUNEL染色也从单个细胞层面揭示了对照组、结扎10分钟、结扎20分钟组之间,活的神经细胞数量递减而细胞凋亡率递增。王超等[16]的研究也得到了类似的结果。那么,大脑血流动力学参数和VTQ值分别与神经细胞凋亡水平的相关性如何呢?通过计算发现,ARFI弹性成像的VTQ值与细胞凋亡率的相关性比彩色多普勒超声检测血流参数更强,且具有显著相关性。这也说明ARFI弹性成像更能反映模型鼠大脑的缺氧缺血性脑损伤的真实情况,灵敏度更高。因此,ARFI弹性成像检测新生大鼠脑组织弹性变化值对新生大鼠缺氧缺血性脑损伤的早期诊断和损伤程度分级的评价可能具有重要的参考价值。尽管如此,由于本项目得到的动物模型数量还不够多,导致最终得到的数据还不够完善,这也是今后的研究需要改进的地方。
综上所述,该项研究结果为今后ARFI弹性成像技术能在新生儿颅脑损伤临床诊断领域的安全、广泛应用提供了一定的理论依据。
