不同抗结核药物致肝损伤小鼠模型的特征指标分析
2023-07-17陆霓虹刘洪璐陈杨君刘梅艳杨永锐杜映荣
陆霓虹,刘洪璐,陈杨君,刘梅艳,杨永锐,杜映荣
(昆明市第三人民医院,云南省传染性疾病临床医学中心,云南 昆明 650041)
抗结核药物导致的肝损伤发病率逐年上升,严重影响结核病患者的治疗效果,延长患者治疗时间,导致耐药结核病的发生[1]。抗结核药物性肝损伤(anti-tuberculosis drug-induced liver injury,ATB-DILI)的发生机制不明,目前有炎症机制、免疫机制等理论学说,但均未得到研究证实[2]。国内研究有异烟肼(INH)、利福平(RIF)单药导致的肝损伤小鼠模型,INH 联合RIF 的肝损伤小鼠模型报道[3],但未见四联抗结核药物(异烟肼+利福平+乙胺丁醇+吡嗪酰胺,INH+RIF+EB+PZA)的肝损伤小鼠模型,尤其是经牛分枝杆菌减毒株卡介苗(bacillus Calmette-Guérin,BCG)滴鼻建立结核分枝杆菌(mycobacterium tuberculosis,MTB)感染的ATB-DILI 小鼠模型。本研究通过建立单药、四联抗结核药物导致的感染MTB 肝损伤小鼠模型,分析其不同病理表现及原因,进一步探讨ATBDILI 发生机制,为防治ATB-DILI、避免耐药结核病发生打下前期研究基础。
1 材料与方法
1.1 实验材料
药物与试剂:药物选择:异烟肼片(isoniazid,INH,每片0.1 g,批号:H51020788)、利福平胶囊(rifampicin,RIF,每粒0.15 g,批号:H51020786)、盐酸乙胺丁醇片(ethambutol hydrochloride,EB,每片0.25 g,批号:H51020917)、吡嗪酰胺片(pyrazinamide,PZA,每片0.25 g,批号H51020877)均为成都锦华药业有限公司生产。根据动物与人体的每公斤体重剂量折算系数,查60 kg 成人与2 g小鼠折算系数为9.01,得出小鼠药物给药剂量为:异烟肼45 mg/(kg·d)(INH)、利福平90 mg/(kg·d)(RIF)、乙胺丁醇135 mg/kg·d(EB),吡嗪酰胺180 mg/(kg·d)(PZA)[4]。临用前,用0.5% CMC配成所需浓度的混悬液备用。
试剂选择:谷氨酰转移酶(Glutamyltransferase,GGT,试剂号:CH01070011)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT,试剂号:CH01070012)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST,试剂号:CH01070022)、总胆红素(total bilirubin,TBIL,试剂号:CH0107003)、(alkaline phosphatase,ALP,试剂号:CH0107001),测定试剂盒均购自广东省西陇化工科学股份有限公司。牛分枝杆菌减毒株卡介苗(Bacillus Calmette-Guérin,BCG,试剂号:S20123007,成都生物制品研究所)。
1.2 实验动物
动物类型:昆明种(KM)小鼠,SPF 级,♂,体质量(18~24)g,由中国科学院昆明动物所实验动物中心提供,合格证号:YNXY(滇)-2019-22。小鼠饲养于中国科学院昆明动物所实验动物中心屏障系统,合格证号:(昆)-2019-103,室温(21~26)℃,湿度(55~65)%,明暗各12 h。
1.3 实验仪器
LST-008 型全自动生化分析仪(日本日立株式会社),Leica RM2135,Germany 石蜡切片机,Leica EG1160,Germany 石蜡包埋机,Leica CM 1900,Germany 冰冻切片机、阔海科技KH-TK 组织脱水机、青岛海尔电冰箱股份有限公司4℃/-20℃电冰箱等。
1.4 实验方法
1.4.1 分组与指标检测感染BCG 实验步骤:150 只小鼠分为2 组,25 只设为对照组,125 只设为BCG 感染组。BCG 组每只小鼠经鼻腔滴入1×107CFU 的BCG,4 周后随机抽取5 只BCG 感染的小鼠,及5 只对照组小鼠取样检测。肺组织病理切片及菌落计数证实BCG 组小鼠感染结核分枝杆菌(mycobacterium tuberculosis,MTB),对照组未发现感染MTB,证实感染MTB 小鼠模型建立成功。
抗结核药物性肝损伤小鼠模型建立步骤:100 只感染MTB 小鼠随机分为5 组,每组20 只。每组抽取5 只,按照用药设为INH 组、RIF 组、EB 组、PZA 组、四联组。5 组分别单次灌胃给药INH、RIF、EB、PZA 及四联抗结核药物12 h 后,称体重,断头取血,全自动生化仪检查ALT、AST、ALP、TBIL、GGT。取肝脏,计算肝指数及分析肝脏病理改变。剩余每组15 只小鼠同样按照用药分为3 个亚组,每组5 只,分别给予INH、RIF、EB、PZA 及四联抗结核药物后1 周取样、2 周取样、3 周取样及检测。感染MTB 小鼠20 只设为MTB 感染组,未感染MTB 小鼠20 只设为对照组,2 组按照实验时间分为4 组,每组5 只,跟随实验组时间进行喂养及取样对比。本研究经昆明市第三人民医院伦理委员会审批同意(201902313)。
肝脏病理制片:取小鼠肝脏称湿重,计算其脏器指数,肝指数(Live index)=肝湿质量/小鼠体质量×100%。取5 g 小鼠肝脏4 ℃冰浴灭菌生理盐水冲洗,常规脱水,石蜡包埋后采用石蜡切片机进行连续切片,厚度约为4 µm,HE 染色后用中性树胶50 µL 进行封片。每张切片均用显微镜进行20 倍镜下观察病变范围,40 倍镜下观察病变组织形态,并留存图片。由病理学专家在显微镜下根据标准进行盲法评分(评分标准参照表1)。

表1 病理观察结果分级(%)Tab.1 Classification of pathological observation results(%)
1.5 统计学处理
数据均用SPSS26.0 统计软件进行分析,符合正态分布采用单因素方差分析,数据均用表示,组间差异采用SNK-q检验。偏态分布的计量资料以“中位数(四分位数)[M(Q1,Q3)]” 描述,组间差异的比较采用Kruskal-WallisH秩和检验,总体差异的比较选用Kruskal-wallis 单因素ANOVA(k样本)检验。相关性分析采用spearman相关性分析,P< 0.05 为差异具有统计学意义。
2 结果
2.1 小鼠模型的肝脏表观特征和病理改变
比较小鼠肝脏平铺面积发现,感染MTB 前后小鼠肝脏体积无明显改变(P> 0.05),灌胃药物2周后,除EB 组外,小鼠肝脏平铺面积较MTB 感染组、对照组均明显增大(P< 0.05),见图1。
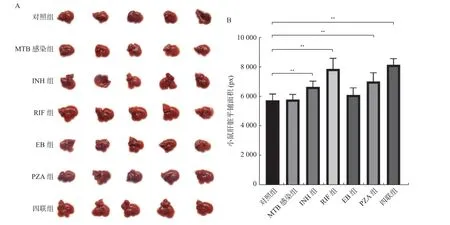
图1 不同抗结核药物灌胃2 周小鼠肝脏表观特征Fig.1 Apparent characteristics of liver in mice treated with different antituberculosis drugs for 2 weeks
病理分析发现,抗结核药物性肝损伤后,肝细胞水肿、变形,胞浆有空泡,核浆比增加,核膜深染,可见部分细胞坏死、凋亡。MTB 感染组可见核大深染;INH 组可见毛细血管增多,细胞增大核深染,RIF 可见条索样改变,细胞水肿,核增大;其余3 组改变同MTB 感染组表现(图2)。
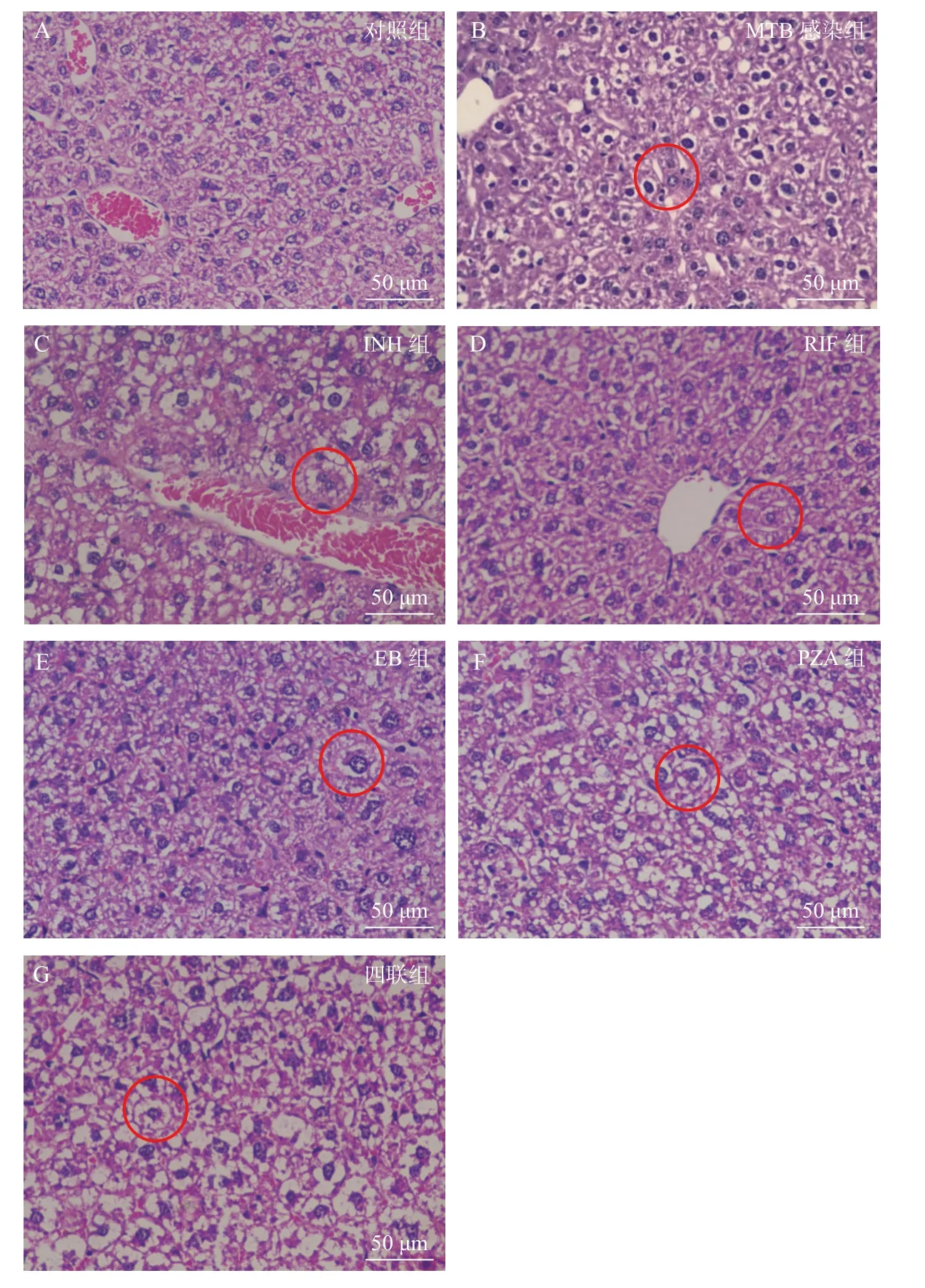
图2 不同抗结核药物灌胃2 周导致的小鼠肝损伤病理变化(40×)Fig.2 Pathological changes of liver injury in mice caused by intragastric administration of different antituberculosis drugs for 2 weeks(40×)
2.2 单次INH、RIF、EB、PZA 及四联抗结核药物灌胃12 h 后对小鼠肝脏指标的影响
单次灌胃小鼠INH、RIF、EB、PZA、四联抗结核药物12h 后,INH 组、RIF 组、四联组小鼠血清AST、ALT 升高,与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05,表2),两两对比后,RIF 组、四联组与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05)。用药5 组ALP、GGT、TBIL、肝指数无明显改变,与MTB感染组、对照组比较,差异无统计学意义(P>0.05)。
表2 不同抗结核药物灌胃12 h 后的小鼠肝脏指标变化()Tab.2 Changes in liver indicators of mice after 12 hours of intragastric administration of different anti-tuberculosis drugs()
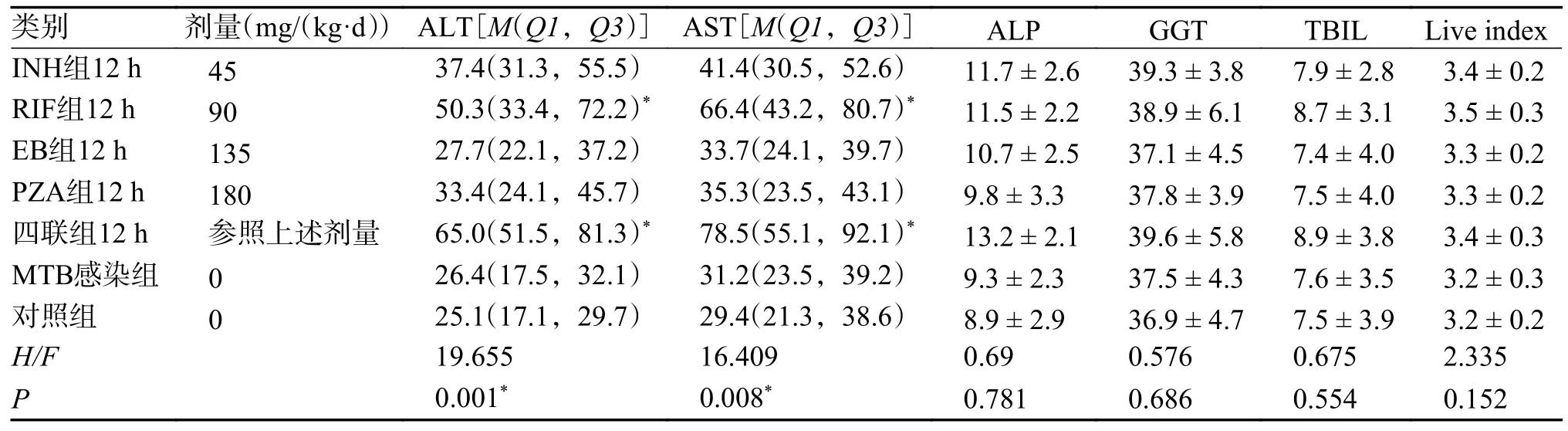
表2 不同抗结核药物灌胃12 h 后的小鼠肝脏指标变化()Tab.2 Changes in liver indicators of mice after 12 hours of intragastric administration of different anti-tuberculosis drugs()
不同组别中该组与MTB感染组比较,*P < 0.05。
2.3 连续INH、RIF、EB、PZA 及四联抗结核药物灌胃1 周对小鼠肝脏相关指标的影响
连续INH、RIF、EB、PZA 及四联抗结核药物灌胃小鼠1 周,INH 组、RIF 组、四联组小鼠AST、ALT、TBIL 升高,与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05)。INH 组及RIF 组、四联组小鼠肝脏组织有不同程度损伤,3 组肝指数与病理改变范围与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05)。EB 组、PZA 组所有指标轻度升高,与MTB 感染组、对照组比较,差异无统计学意义(P> 0.05),见图1、图2、表3。
表3 不同抗结核药物灌胃1 周的小鼠肝脏指标变化()Tab.3 Changes in liver indicators of mice after 1 week of intragastric administration of different anti-tuberculosis drugs()
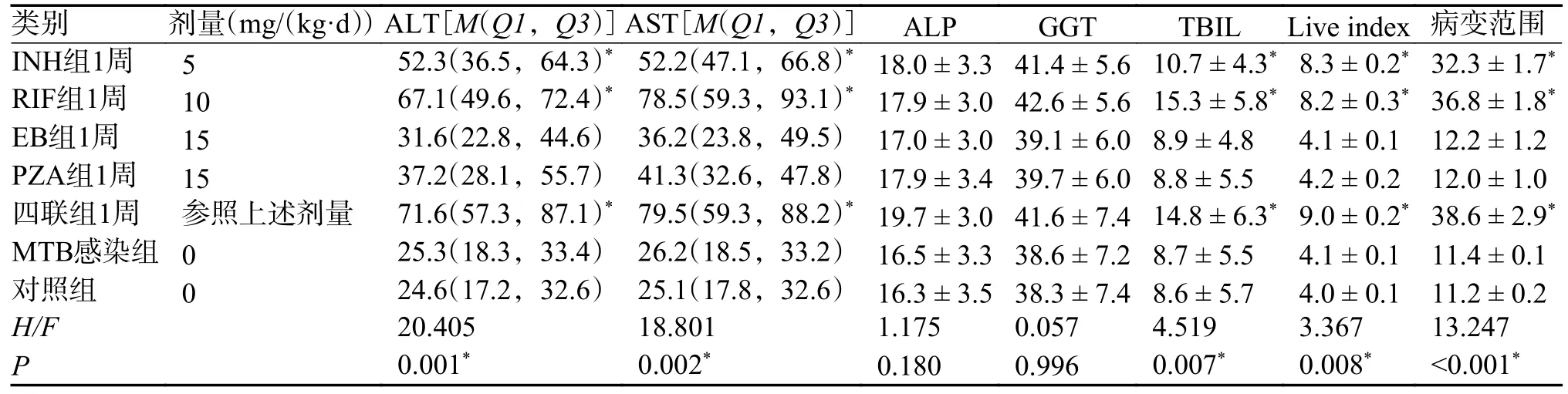
表3 不同抗结核药物灌胃1 周的小鼠肝脏指标变化()Tab.3 Changes in liver indicators of mice after 1 week of intragastric administration of different anti-tuberculosis drugs()
不同组别中该组与MTB感染组比较,*P < 0.05。
2.4 连续INH、RIF、EB、PZA 及四联抗结核药物灌胃2 周对小鼠肝脏相关指标的影响
表4 结果显示,连续INH、RIF、EB、PZA及四联抗结核药物灌胃2 周,INH 组、RIF 组、四联组小鼠肝脏组织进行性损伤,INH 组及RIF组损伤程度达到重度,3 组AST、ALT、TBIL、肝脏指数及病变范围与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05)。EB 组、PZA 组肝脏血清学指标及肝脏指数、病变范围轻度升高,但与MTB 感染组、对照组比较,差异无统计学意义(P> 0.05)。
表4 不同抗结核药物灌胃2 周的小鼠肝脏指标变化()Tab.4 Changes in liver indicators of mice after 2 weeks of intragastric administration of different anti-tuberculosis drugs()

表4 不同抗结核药物灌胃2 周的小鼠肝脏指标变化()Tab.4 Changes in liver indicators of mice after 2 weeks of intragastric administration of different anti-tuberculosis drugs()
不同组别中该组与MTB感染组比较,*P < 0.05。
2.5 连续INH、RIF、EB、PZA 及四联抗结核药物灌胃3 周对小鼠肝脏相关指标的影响
连续INH、RIF、EB、PZA 及四联抗结核药物灌胃3 周,INH 组、RIF 组、四联组AST、ALT、GGT、TBIL 继续升高,与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05)。INH 与RIF 组小鼠肝组织重度损伤,部分极重度损伤,肝脏指数与病变范围与MTB 感染组、对照组比较,差异具有统计学意义(P< 0.05),四联组肝组织损伤缓慢进展,未达重度,肝脏指数与病理改变范围与MTB 感染组、对照组比较,差异仍有统计学意义(P< 0.05)。其余各组指标与MTB 感染组、对照组比较,差异无统计学意义(P> 0.05),见表5。
表5 不同抗结核药物灌胃3 周的小鼠肝脏指标变化()Tab.5 Changes in liver indicators of mice after 3 weeks of intragastric administration of different anti-tuberculosis drugs()
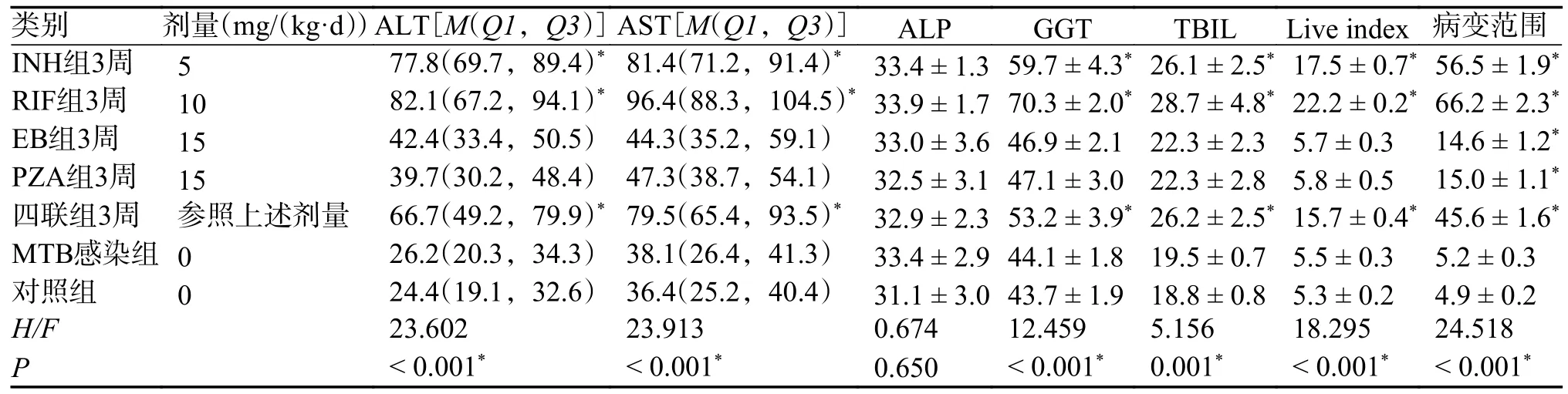
表5 不同抗结核药物灌胃3 周的小鼠肝脏指标变化()Tab.5 Changes in liver indicators of mice after 3 weeks of intragastric administration of different anti-tuberculosis drugs()
不同组别中该组与MTB感染组比较,*P < 0.05。
2.6 小鼠肝损伤指标随用药时间的变化趋势
所有用药组均按照用药时间进行相关性分析,EB 组、PZA 组、四联组肝损伤血清学指标、肝脏指数、病变范围与用药时间无明显相关性(P值均 > 0.05)。INH 组、RIF 组ALT 及AST、ALP、GGT、TBIL 水平升高、肝脏指数增加、病变范围增加,与用药时间有明显相关性(P< 0.05),提示INH、RIF 在抗结核药物性肝损伤中起到主要作用,对小鼠肝脏损伤具有明显时间累积效应,见表6、表7,图3、图4。
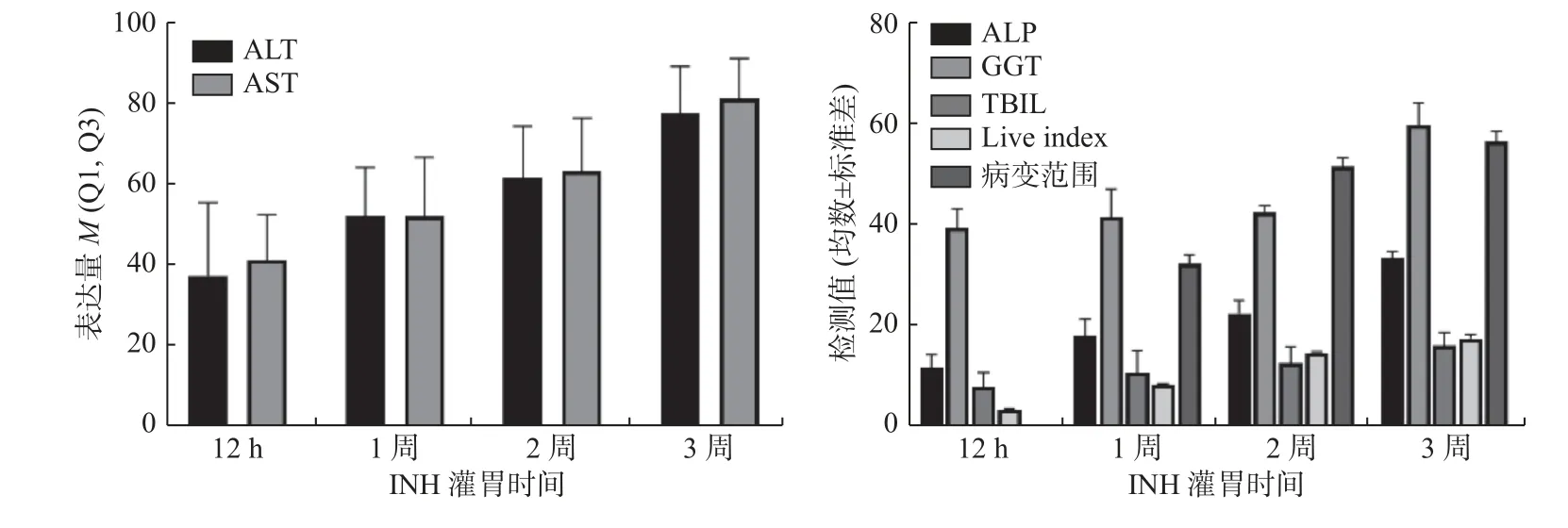
图3 INH 组不同灌胃时间肝损伤指标变化Fig.3 Changes in liver injury indicators in the INH group at different gastric lavage times
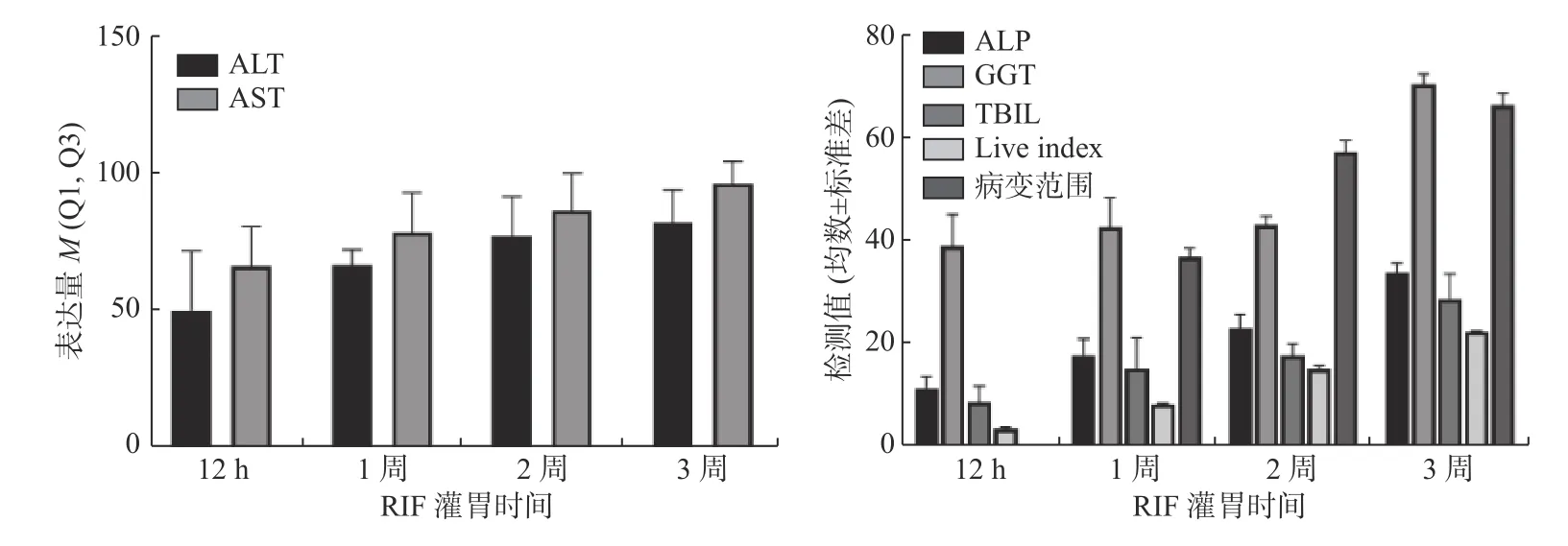
图4 RIF 组不同灌胃时间肝损伤指标变化Fig.4 Changes in liver injury indicators in the RIF group at different gastric lavage times
表6 INH 组小鼠肝损伤指标与用药时间的相关性分析()Tab.6 Correlation analysis between liver injury indicators and medication time in INH group mice()
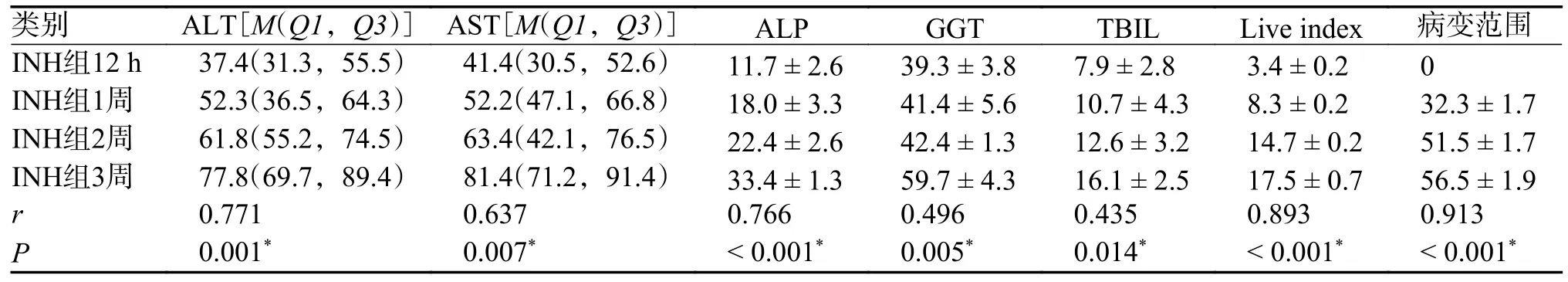
表6 INH 组小鼠肝损伤指标与用药时间的相关性分析()Tab.6 Correlation analysis between liver injury indicators and medication time in INH group mice()
*P < 0.05 。
表7 RIF 组小鼠肝损伤指标与用药时间的相关性分析()Tab.7 Correlation analysis between liver injury indicators and medication time in RIF group mice()
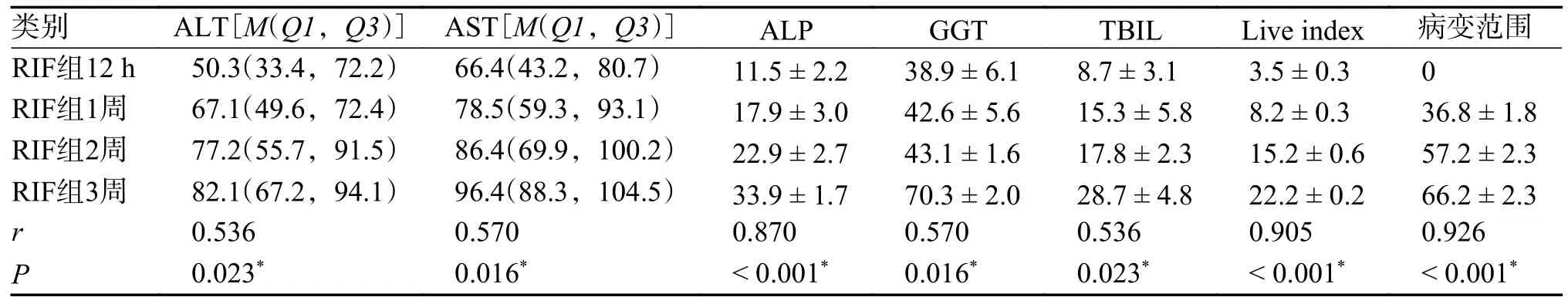
表7 RIF 组小鼠肝损伤指标与用药时间的相关性分析()Tab.7 Correlation analysis between liver injury indicators and medication time in RIF group mice()
*P < 0.05。
3 讨论
目前国内外研究已经有ATB-DILI 的小鼠模型建立研究,但是多为单药如INH、RIF 或INH联合RIF 的肝损伤小鼠模型[5],未见EB、PZA 及四联抗结核药物导致感染MTB 小鼠模型肝损伤的研究报道。通过建立感染MTB 的ATB-DILI 小鼠模型,进一步发现ATB-DILI 发病机制,是目前防治肺结核,尤其是防治耐药肺结核发生发展的方向及热点[6]。
本研究结果证实,INH 致肝损伤小鼠组(简称INH 组)、RIF 致肝损伤小鼠组(简称RIF 组)、EB 致小鼠肝损伤组(简称EB 组)、PZA 致小鼠肝损伤组(简称PZA 组)以及四联抗结核药物导致小鼠肝损伤组(简称四联组)在给药12 h 后,RIF、四联抗结核药物可以导致小鼠ALT、AST 升高(P< 0.05),提示急性肝损伤主要与RIF 及RIF 联合其他抗结核药物相关,与EB 及PZA 无明显相关性。给药1~2 周后,RIF 组、INH 组及四联组病理改变明显,主要表现为肝细胞增大变形,部分细胞坏死凋亡(P< 0.05),提示INH、RIF 主要导致肝细胞坏死,对肝血管等组织影响较小。通过药物减少INH、RIF 对肝细胞的损伤,可以降低ATB-DILI 发病率[7]。
本研究结果证实,连续灌胃3 周后,各组损伤程度均有上升,其中INH 组、RIF 组、四联组血清学指标AST、ALT、GGT、TBIL 与MTB 感染组、对照组相比均具有明显统计学意义(P< 0.05)。四联抗结核药物使用后,肝脏指标升高程度与病理改变范围均低于单药INH、RIF,考虑为4 种抗结核药物同时使用,药物效应可以互相拮抗,从而导致肝损伤程度较轻,与目前研究报道相符[8]。
本研究结果显示,RIF 组、INH 组、四联组在1 周给药时,肝脏病理改变程度均比血清学肝功能指标改变程度严重,且肝细胞坏死出现较早,用药1 周时已经出现中度肝损伤,而血清学指标仅为轻度。给药2 周后,INH 组及RIF 组血清学肝功能指标未达重度,但肝脏病理表现已经出现重度或极重度改变,尤其是RIF 组改变更为明显。本研究这一病理改变与目前文献结果不完全相符[9-10],考虑入组研究的小鼠均为感染MTB 的小鼠,而其他研究为未感染MTB 的小鼠。感染MTB 小鼠的炎症反应更重,肝损伤进展更快,所以病理改变更严重、病变范围扩大更快。本研究结果也显示,MTB 感染组小鼠与对照组小鼠在伴随试验中,肝脏指标无明显统计学差异(P> 0.05),但MTB 感染组小鼠肝脏异常指标仍略高于对照组,提示MTB 感染也可以导致部分肝脏指标异常,可能与MTB 感染导致的炎症反应相关[11-12]。
本研究结果显示,INH、RIF 均有时间累积效应的肝损伤,多项肝脏血清学指标及病理改变、肝脏指数与INH、RIF 的时间累积效应具有明显相关性(P< 0.05),提示INH、RIF 的用药时间越长,药物累积效应越明显,从而导致损伤程度加重,该研究结论与目前研究报道相符[13]。ATBDILI 的结核病患者调整治疗时,应重点关注INH、RIF 的用药时间与疾病严重程度,对ATB-DILI患者用药选择进行规范、科学的指导,可以防止因反复停药导致耐药肺结核的发生。
综上所述,ATB-DILI 发生发展与INH、RIF密切相关,两种药物主要损伤肝细胞,并以细胞坏死水肿为主要病理表现[14]。INH 与RIF 对肝脏损伤具有时间累积效应,同时ATB-DILI 的病理损伤程度重于及早于血清学检测指标。ATBDILI 小鼠血清学指标显示轻度异常的时候,肝脏的病理性损伤已经达到中度或重度。及早应用保护肝细胞损伤的药物,可能对ATB-DILI 的发生发展具有一定防治作用。本研究为基础实验研究,是否与临床表现相符合,仍需要更多研究来进行证实。
