DDAH1 基因836A/T 多态性与云南地区汉族2 型糖尿病肾脏疾病的相关性分析
2023-07-17殷和佳任遵丹
谭 洪 ,殷和佳 ,李 妍 ,胡 琴 ,李 斓 ,任遵丹 ,石 柔
(1)昆明医科大学第一附属医院内分泌二科,云南 昆明 650032;2)昆明医科大学第一临床医学院,云南 昆明 650500)
据国际糖尿病联盟估计,2021 年全球有5.37亿人患有糖尿病(diabetes mellitus,DM),预计到2045 年将增加到7.84 亿[1]。DM 会导致多种慢性并发症,其中糖尿病肾脏疾病(diabetic kidney disease,DKD)是最严重的并发症之一,其发病率约20%~40%[2]。氧化应激是内皮功能障碍的重要发病机制之一,是DKD 的标志性特征[3]。在DKD 患者中发现到与氧化应激密切相关的高水平的非对称性二甲基精氨酸(asymmetric dimethylarginine ADMA)[4]。二甲基精氨酸二甲胺水解酶1(dimethyl arginine dimethylamine hydrolase 1 DDAH1)是ADMA 代谢的关键酶,其基因多态性与ADMA水平及氧化应激相关[5],但与DKD 的关系尚不明确。本研究的目的为探讨DDAH1 基因836A/T 多态性与云南地区汉族2 型糖尿病肾脏疾病的相关性。
1 资料与方法
1.1 研究对象
均符合1999 T2DM 诊断标准[6]。纳入标准:民族为汉族,籍贯为云南省,在云南居住10 a 以上,相互间无亲缘关系。排除标准:其它疾病引起的蛋白尿及肾功能不全、合并严重肝功能不全、糖尿病酮症、感染性疾病、妊娠者。选取2017年5 月至2019 年2 月期间到昆明医科大学第一附属医院就诊的T2DM 患者共660 例,男334 例,女326 例,平均年龄(55.87±11.45)岁。根据随机尿尿白蛋白/肌酐比值(UACR)分为单纯2 型糖尿病组(DN0 组,UACR ≤ 30 µg/mg),合并早期肾病组(DN1 组,UACR 30~299 µg/mg),合并临床期肾病组(DN2 组UACR ≥ 300 µg/mg),合并肾病组(DN1+DN2 组)。同时纳入同期昆明医科大学第一附属医院体检中心的健康人群(NC 组),共304 例,男154 例,女150 例,年龄(54.62±10.58)岁。无糖尿病、高血压家族史,且经糖耐量试验排外糖尿病。所有研究对象均为云南区域无亲缘关系的汉族。研究方案经昆明医科大学第一附属医院伦理委员会审核批准,所有样本采集均需知情同意。
1.2 研究方法
1.2.1 DDAH1基因836A/T 多态性分析方法研究对象外周静脉血中DNA 的抽提采用全血基因DNA 提取试剂盒提取。之后以特定的引物(通用生物系统有限公司合成)进行聚合酶链反应(PCR)[7],引物序列见表1。将纯化后的PCR 产物在3730xl 型测序仪上进行DNA 测序,得到3种基因型(图1~图3)。
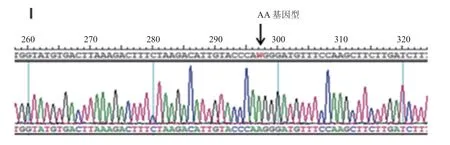
图1 DDAH1 基因836AA 基因型对应的测序图Fig.1 DDAH1 gene 836AA genotype sequencing
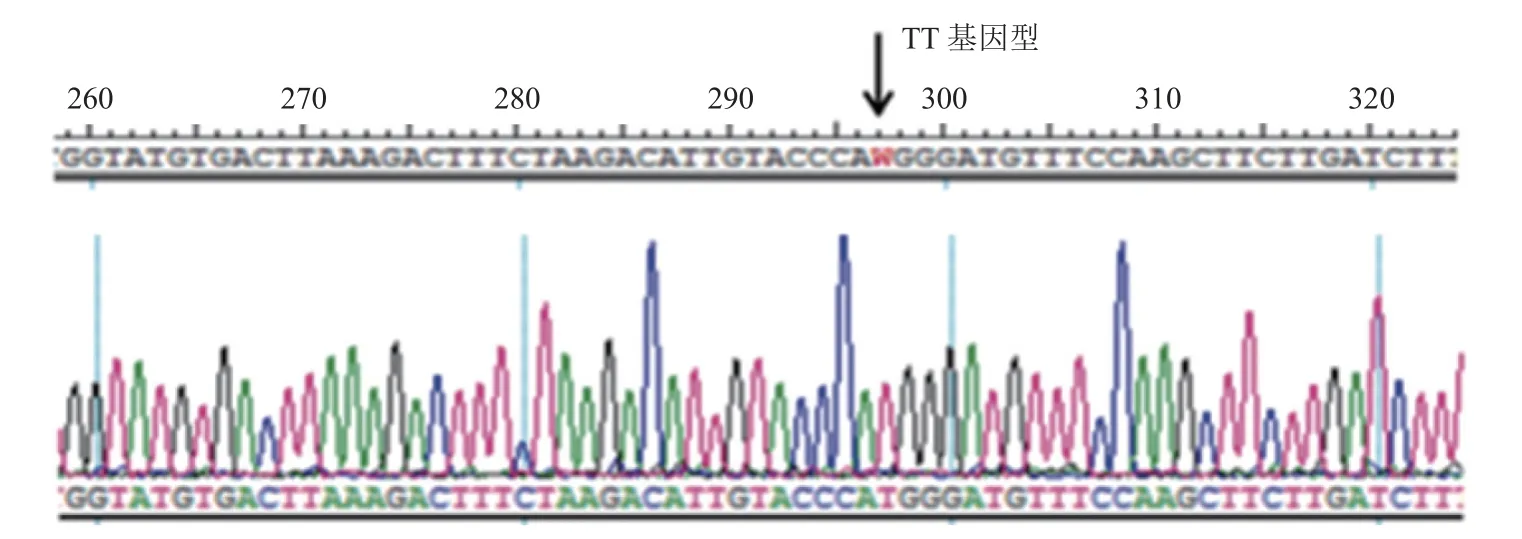
图2 DDAH1 基因836TT 基因型对应的测序图Fig.2 DDAH1 gene 836TT genotype sequencing

图3 DDAH1 基因836AT 基因型对应的测序图Fig.3 DDAH1 gene 836AT genotype sequencing

表1 PCR 引物序列Tab.1 PCR primer sequences
1.2.2 临床及生化指标检测检测血肌酐、尿酸、血脂、UACR(均采用贝克曼库尔特AU5800 全自动生化分析仪),用高效液相法测定糖化血红蛋白(HBA1C)含量,用双抗体夹心酶联免疫吸附(ELISA)试剂盒(美国 RD)测定血浆ADMA 水平。测量血压。
1.3 统计学处理
数据分析选择SPSS19.0 软件。用哈迪-温伯格遗传平衡定律检验样本的人群代表性。计量资料以表示,各组间采用单因素方差分析进行比较。计数资料以n(%)描述,各组间等位基因和基因型频率的差异采用χ2检验分析。采用Logistic 回归分析T2DM 发生DKD 的危险因素。P< 0.05 为差异有统计学意义。
2 结果
2.1 各组间临床资料比较
病程、SBP、LDL-C、ADMA 在DN1+DN2 组高于DN0 组。为排除混杂因素对结果的干扰,进一步行协方差分析,两组间病程、ADMA 差异仍有统计学意义(P< 0.05)。病程、SBP、血肌酐、尿酸在DN2 组高于DN1 组、为排除混杂因素对结果的干扰,进一步行协方差分析,病程、SBP在两组间的差异仍有统计学意义(P< 0.05),见表2。
表2 各组间临床资料比较()Tab.2 Comparison of clinical data of each group()

表2 各组间临床资料比较()Tab.2 Comparison of clinical data of each group()
与NC组比较,* P < 0.05;与DN0组比较,△P < 0.05;与DN1组比较,#P < 0.05;协方差分析,▲P < 0.05。
2.2 各组间DDAH1 基因836A/T 多态性比较
AA 基因型频率:DN1+DN2 组高于DN0 组,差异显著(P< 0.05)。A 等位基因频率:DN1 +DN2 组高于DN0 组,差异显著(P< 0.05)。但AA、AT+TT 基因型频率、A 等位基因频率在DN1 和DN2 组间无显著性差异(P> 0.05),见表3。

表3 各组间基因型频率和等位基因频率[n(%)](1)Tab.3 The genotype and allele frequencies in each group [n(%)](1)
2.3 T2DM 患者中不同基因型间临床资料比较
在T2DM 患者中,DDAH1 基因836AA 基因型携带者较AT+TT 基因型个体具有更高的ADMA水平(P< 0.05),见表4。
表4 T2DM 患者中不同基因型间临床资料比较( )(1)Tab.4 Comparison of clinical data of DDAH1 genotype of T2DM patients()(1)

表4 T2DM 患者中不同基因型间临床资料比较( )(1)Tab.4 Comparison of clinical data of DDAH1 genotype of T2DM patients()(1)
表4 T2DM 患者中不同基因型间临床资料比较( )(2)Tab.4 Comparison of clinical data of DDAH1 genotype of T2DM patients()(2)

表4 T2DM 患者中不同基因型间临床资料比较( )(1)Tab.4 Comparison of clinical data of DDAH1 genotype of T2DM patients()(1)
2组间比较,*P < 0.05。
2.4 T2DM 患者发生DKD 的危险因素分析
以2 型糖尿病患者发生DKD 与否(发生=1,不发生=0)作为因变量,将单因素分析中有统计学意义的变量(基因型、收缩压、血肌酐、尿酸、甘油三酯、低密度脂蛋白、糖化血红蛋白、ADMA 水平、病程)为自变量,进行二元Logistic回归分析,结果显示,在2 型糖尿病患者中病程、ADMA、DDAH1 基因836 位点AA 基因型是DKD发生的危险因素(表5)。以2 型糖尿病患者DKD发展与否(发展=1,不发展=0)作为因变量,选择上述各项指标作为自变量,进行二元Logistic回归分析,结果显示,在2 型糖尿病患者中病程、SBP 是DKD 发展的危险因素,DDAH1 基因836位点基因多态性不是DKD 发展的危险因素(表6)。

表5 T2DM-DKD 发生的危险因素的Logistic 分析Tab.5 Logistic regression analysis of T2DM-DKD occurence

表6 T2DM-DKD 发展的危险因素的Logistic 分析Tab.6 Logistic regression analysis of T2DM-DKD development
3 讨论
DKD 是T2DM 微血管病变的致命表现之一,同时也是全球范围内导致终末期肾脏疾病发生及死亡的主要原因[8]。以一氧化氮(NO)生物利用度降低和氧化应激升高为特征的内皮功能障碍是糖尿病和DKD 的显著特征[9]。ADMA 是一种内源性一氧化氮合酶抑制剂,影响NO 的水平,参与氧化应激及内皮功能障碍。近期研究发现,糖尿病前期和T2DM 患者的ADMA 浓度均显著升高[10]。蛋白尿是DKD 最重要的临床标记物之一,动物实验和临床研究均表明,ADMA 升高与重度蛋白尿相关[11]。与此同时在动物模型和糖尿病微血管病变(如视网膜病变、肾病和神经病变)患者中也检测到ADMA 升高[12]。一项meta 分析也提示,DM合并蛋白尿患者ADMA 明显升高,ADMA 可能在包括DKD 在内的糖尿病微血管并发症的病理生理学过程中发挥重要作用[13]。来自印度的一项临床研究结果表明,ADMA 有可能成为DKD 的预测因子[14]。本研究发现在云南地区汉族2 型糖尿病患者中,合并DKD 患者较未合并DKD 患者ADMA水平升高,但在DKD 亚组(DN1、DN2)间ADMA浓度无差异。行相关危险因素分析后,提示ADMA 是DKD 发生的危险因素。提示ADMA 作为氧化应激的重要刺激因子,对DKD 的发生可能起重要作用,但对DKD 病情进展可能不是主要的促进因素。
DDAH 通过降解ADMA 来维持NO 的生物利用度。DDAH 的两种亚型(DDAH-1 和DDAH-2)由两种不同的基因编码,具有不同的组织分布。尽管2 者都在肾脏中表达,主要在肾小球内皮细胞、致密斑和小管细胞中[15],但DDAH-1 是降解ADMA 的关键同工酶[3]。在健康和糖尿病小鼠中发现缺乏DDAH1 导致血浆ADMA 水平显著升高[16]。DDAH1 缺乏可促进肾近端小管上皮细胞向间充质细胞转变,并在糖尿病肾脏中引起纤维化和氧化应激[17]。而纤维化和氧化应激都是DKD 的显著病理生理特征。Michael DW 等[3]报道,DKD 与肾脏中ADMA 增加和DDAH 活性及DDAH1 表达降低相关,使用腺病毒载体在肾内过表达DDAH1 可显著减少肾损伤。上述研究结果提示,DDAH1 可能通过对ADMA 的调节影响DKD 的发生。DDAH1 基因序列变异与血清ADMA浓度密切相关[18-19]。国外学者研究了编码ADMA代谢相关酶DDAH1 的基因多态性,发现DDAH1 rs233112,rs669173、rs7521189、rs2474123 和rs13373844 几个单核苷酸多态性与ADMA 水平密切相关[18,20]。还有一些报道提示DDAH1 基因变异与糖尿病及其并发症有关。例如:DDAH1 启动子-396_-395插入等位基因(GCGT)增加男性T2DM 患病风险[21]。DDAH1 rs233109 CC 纯合子的患者比携带TT 纯合子的患者更容易发生糖尿病大血管病变[22]。但目前有关DDAH1 基因多态性与DKD 关系的研究报道罕见。本研究通过对云南地区汉族T2DM 患者DDAH1 基因836 多态性研究,发现携带AA 基因型的患者更容易发生DKD,并且该基因型携带者ADMA 水平升高。但在DKD 亚组(DN1、DN2)间没有发现该基因位点的遗传差异。相关危险因素分析显示DDAH1 基因836 位点AA 基因型是T2DM 发生DKD 的危险因素。
综上所述,在云南地区汉族2 型糖尿病患者中,ADMA 水平升高可能增加DKD 发生的风险。DDAH1 基因836 多态性与DKD 的发生相关,AA基因型可能通过调控DDAH1 的表达和活性,增加ADMA 的浓度,从而促进DKD 的发生。然而在DKD 患者中ADMA 升高的确切机制尚不完全清楚。未来应对ADMA 进行连续测定的前瞻性研究以进一步证实ADMA 作为DKD 的生物标志物及致病因素的因果关系。另一方面,本研究样本量有限,而且影响DDHA1 基因表达的位点不止1个,当其它位点变异时可能增强或减弱836 位点变异的作用。因此,今后还应进一步增加样本量,同时联合DDHA1 基因其他位点进行系统研究,并结合动物模型及体外实验辅以功能实验,进一步揭示DDHA1 基因遗传多态性与DKD 的内在关系。
