中药调控铁死亡抑制肝纤维化的研究进展
2023-07-17李浩吴勉华马艳霞李文婷李沐涵
李浩,吴勉华,马艳霞,李文婷,李沐涵
(1.南京中医药大学第一临床医学院,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023;3.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023)
肝纤维化是在肝脏长期损伤的过程中,多种致病因素导致的细胞因子分泌以及内环境紊乱,引起肝脏过度修复而出现纤维瘢痕的一种病理组织学变化。细胞外基质(Extracellular matrix, ECM)是形成肝纤维化的物质基础,其主要来源于肝星状细胞(Hepatic stellate cells,HSCs)活化后的肌成纤维化细胞[1]。目前临床治疗肝纤维化尚停留在针对病因层面,仍缺乏有效的抗纤维化药物。因此,抑制HSCs的活化或诱导其死亡是阻止肝纤维化向肝硬化甚至肝癌转变的关键研究方向。
铁死亡(Ferroptosis)是2018年正式定义的一种新型程序性细胞死亡方式,其特点是铁依赖性的氧化还原失衡,导致细胞膜磷脂过氧化损伤[2]。研究表明,肝纤维化过程中的HSCs活化、氧化应激、炎症反应等与铁死亡密切相关。铁死亡或成为抑制肝纤维化,治疗慢性肝病新的靶点[3]。中医学认为,肝纤维化属于“积聚”“胁痛”范畴,病机可归纳为“虚损生积”[4]。此外,亦有运用阴阳理论和“取象比类”法探究铁死亡与肝纤维化的报道[5-6]。大量研究证明,中药及其活性成分可以靶向肝纤维化过程中多种信号通路,是当前抗纤维化药物的重要来源。目前,运用中药调控铁死亡治疗疾病的研究大多集中在心脑血管疾病及肿瘤,对于干预铁死亡治疗肝纤维化的中药及其活性成分缺乏归纳总结。现就铁死亡途径调控肝纤维化的作用机制及中药干预的研究现状进行综述,为深入研究中药调控铁死亡发挥抗肝纤维化作用,以及为找到可靠的抗纤维化药物提供新的思路。
1 铁死亡的发生机制
铁死亡机制主要归纳为铁代谢、GSH/GPX4抗氧化体系、脂质过氧化。见图1。
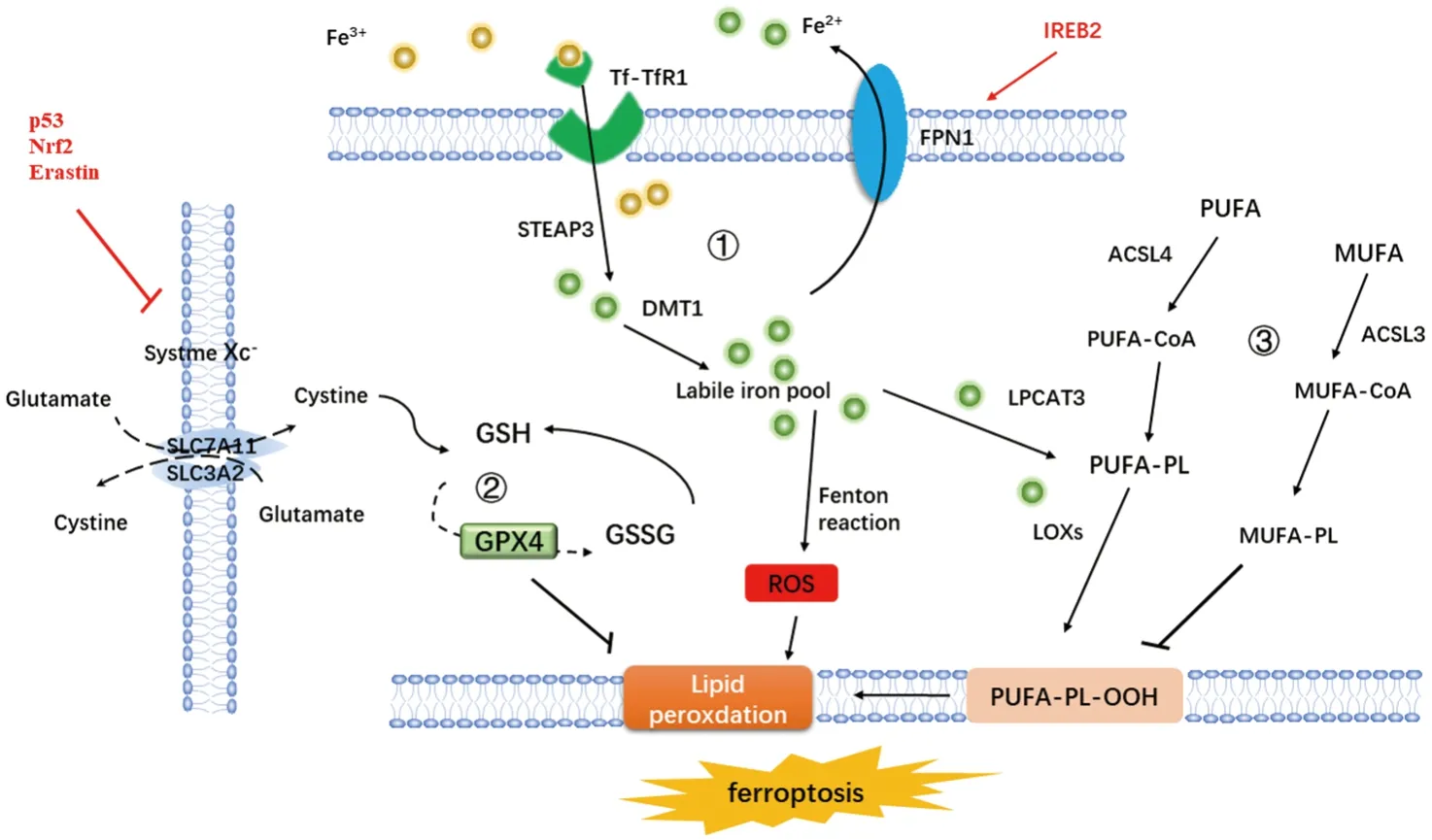
图1 铁死亡发生的主要机制Fig.1 The main mechanism of ferroptosis
1.1 铁代谢
生理状态下,Fe3+经由转铁蛋白/转铁蛋白受体1(Trf/TfR1)途径进入细胞内,并被前列腺上皮跨膜蛋白3(STEAP3)还原成Fe2+。Fe2+由二价金属离子转运体1(DMT1)转运储存在铁蛋白(FT)和不稳定铁池(LIP)中[7]。膜铁转运蛋白(FPN)将多余的Fe2+运出细胞,整个过程在铁反应蛋白2(IREB2)及核转录E2相关因子2(Nrf2)的调控下维持平衡[8-9]。当铁过载时,高浓度的Fe2+发生芬顿反应,产生ROS并激活脂氧合酶(LOXs)造成细胞膜氧化损伤[10]。在铁摄取不足时,机体通过铁自噬将FT降解,释放游离铁增加LIP,诱导铁死亡的发生[11]。因此,铁代谢紊乱在铁死亡过程中扮演至关重要的角色。通过调控铁代谢过程中的相关靶基因,或使用铁螯合剂、铁抑制剂等减少细胞内游离铁的浓度,可影响细胞对铁死亡的敏感性进而调控铁死亡[12]。
1.2 GSH/GPX4抗氧化体系
GSH/GPX4是针对脂质过氧化物蓄积的抗氧化系统,抑制GSH/GPX4系统会导致细胞膜过氧化损伤和铁死亡。GPX4是唯一已知可以将脂质过氧化物还原成醇的GPXs同工酶,并减少ROS的积累,抑制铁死亡的发生。GSH是GPX4发挥抗氧化性必要的辅助因子,GSH缺乏将导致GPX4失活,其合成受到半胱氨酸的限速控制。敲除GPX4相关基因或使用GPX4抑制剂如RSL3将会诱导细胞铁死亡,其与细胞内GPX4失活导致的脂质过氧化直接相关[13-14]。System Xc-是一种特异性氨基酸转运体,由溶质载体家族7成员11(SLC7A11)和溶质载体家族3成员2(SLC3A2)构成,通过对细胞内外谷氨酸/胱氨酸的转运影响GSH的合成,被认为是调控铁死亡的关键中枢。p53、Nrf2、erastin可直接或间接地抑制System Xc-的活性,诱导铁死亡[12,15-16]。因此,System Xc-/GSH/GPX4是调控细胞铁死亡的关键靶点,通过调控相关氨基酸转运及GPX4的活性可以实现对铁死亡的诱导和抑制。
1.3 脂质过氧化
铁代谢紊乱及GPX4失活导致的脂质过氧化是造成细胞膜损伤的核心事件,主要是由含有多不饱和脂肪酸(PUFA)的磷脂膜过氧化引起的。PUFA极易在LOXs催化下生成脂质过氧化物,是铁死亡发生的核心脂质。在酰基辅酶A合成酶长链家族成员4(ACSL4)的催化下,PUFA进入细胞膜并在Fe2+的介导下被LOXs酶解生成脂质过氧化物,此过程需要溶血磷脂酰胆碱酰基转移酶3(LPCAT3)的帮助。ACSL4和LPCAT3会加速PUFA过氧化,抑制GPX4的活性,导致脂质过氧化物大量生成,导致铁死亡[17]。
此外,辅酶Q10在铁死亡抑制蛋白-1(FSP1)及NADPH的催化下抑制脂质及ROS的产生,阻止了脂质过氧化,在此过程中不需要GSH[18]。因此,通过对PUFA的调控及对脂质过氧化物的醇转化,可以调控铁死亡在细胞中的发生。
2 铁死亡在肝纤维化中的作用及干预策略
肝纤维化会伴有与铁死亡相关的铁代谢紊乱、细胞抗氧化系统失衡及脂质过氧化等特征。因此,通过探究铁死亡在肝纤维化过程中所扮演的角色,可明确调控细胞铁死亡对肝纤维化促进和抑制的作用靶点,为肝纤维化以及其他慢性肝病的研究提供思路和治疗策略。
2.1 HSCs活化与铁死亡
HSCs活化是肝纤维化的核心事件,活化的HSCs分泌的Ⅰ型和Ⅲ型胶原纤维,是造成肝脏内ECM堆积的主要驱动力。活化的HSCs会出现铁代谢紊乱和脂质过氧化物堆积,提示铁死亡参与HSCs的活化。肝脏是机体储存铁和调节铁代谢的重要器官,过量的铁会引起肝细胞持续损伤,诱导肝细胞铁死亡,进而分泌大量细胞因子如IL-13、TGF-β等诱导HSCs活化,促进肝纤维化[19]。
在高铁饮食小鼠肝纤维化模型中,敲除肝脏Trf基因加重了肝细胞铁超载,而进一步敲除SLC7A14可改善小鼠肝纤维化,这表明Trf通过抑制肝细胞铁死亡发挥对肝脏的保护作用[20]。使用铁死亡抑制剂可以减轻肝损伤、减少炎性因子的分泌进而抑制HSCs活化[21]。索拉菲尼可通过调控ZFP36/TTP和ELAVL1/HuR影响下游mRNA,进而使HSCs发生铁自噬,诱导HSCs发生铁死亡[22]。因此,通过减少肝细胞的铁死亡或诱导活化HSCs铁死亡是治疗肝纤维化的有效治疗策略。
2.2 肝脏炎症反应与铁死亡
炎症反应是肝脏损伤后机体对肝组织进行修复、保护的病理反应,但长期持续的炎性浸润和促炎因子的释放会导致肝脏组织的坏死,HSCs活化与肝纤维化。IL-6、IL-13、TNF-α、TGF-β等炎性因子能够诱导肝纤维化的发生,而IL-10、IL-22可以发挥抗炎的作用,抑制HSCs的活化,从而降低肝纤维化程度[19]。
在CCl4诱导的大鼠肝纤维化模型中,高表达的Nrf2和HO-1通过介导铁死亡减轻肝脏炎症反应,抑制了肝脏α-SMA和mRNA的含量,发挥抗纤维化作用[23]。在NASH小鼠模型中,使用铁死亡抑制剂可以减轻肝脏炎症反应,进而抑制NASH和肝纤维化[24]。临床实验中,黄芩苷胶囊联合异甘草酸镁可以通过抑制肝细胞铁死亡,减轻炎症反应、抑制肝纤维化[25]。上述研究表明,铁死亡可以影响肝纤维化过程中的炎症反应,抑制铁死亡可以发挥抗炎作用从而影响肝纤维化。因此,抑制肝脏炎症反应是调控铁死亡治疗肝纤维化的重要研究方向。
2.3 氧化应激与铁死亡
氧化应激是由于机体抗氧化系统失衡造成过氧化物积累至毒性的过程,是引起肝损伤的重要病理过程。ROS是肝纤维化过程中造成肝脏损伤最主要的毒性物质,一方面通过自身的氧化毒性对肝细胞造成持续损伤,另一方面可以通过激活Nrf2、TGF-β等靶点参与HSCs活化,从而促进肝纤维化的进展[26]。在肝纤维化早期,ROS刺激肝脏微环境,促进HSCs活化及肝纤维化的形成;随着肝纤维化的进展,活化的HSCs会表达NOX,引起肝脏持续的氧化应激,进一步刺激HSCs活化。
维生素E、GSH/GPX4等抗氧化剂可以清除肝纤维化和铁死亡过程中产生的ROS,ferrostatin-1可以抑制高铁饮食下小鼠的铁死亡,减少ROS,减轻肝脏氧化应激及肝纤维化程度[27]。Keap1/Nrf2通路不仅可以调控铁死亡的过氧化,还可以调控肝脏氧化应激减轻肝纤维化程度,多与其调控铁死亡及氧化应激众多靶基因有关,如GSH/GPX4、HO-1、FSP1/NADPH、SLC7A11[28]。因此,调控铁死亡减轻肝脏氧化应激,是临床研究抗肝纤维化药物的一个方向。
3 中药调控铁死亡防治肝纤维化
在中医理论的指导下,中药调控铁死亡在治疗肿瘤、心血管疾病、中枢神经系统病变等领域取得显著的进展[29-33]。近年来大多研究表明中药及其活性成分通过诱导活化的HSCs铁死亡以达到缓解和治疗肝纤维化的目的,也有中药复方通过调控铁死亡减缓肝纤维化前期的肝脏损伤与肝细胞死亡,从而防治肝纤维化。总结近五年内调控铁死亡治疗肝纤维化的中药单体及其活性成分相关研究如下(表1)。

表1 调控铁死亡治疗肝纤维化的相关中药及其有效成分Table 1 Related traditional Chinese medicine and its effective components for regulating ferroptosis in the treatment of liver fibrosis
3.1 青蒿
青蒿素衍生物可以抑制肝细胞铁死亡或诱导活化的HSCs铁死亡,以此抑制肝纤维化。在体外培养HSCs实验中,双氢青蒿素通过降低TfR1与TGF-β1的表达,使HSCs活化及CollagenⅠ的分泌被抑制,从而抑制铁死亡发挥抗肝纤维化的作用[34]。在CCl4诱导大鼠肝纤维化模型及体外HSCs培养实验中,青蒿琥酯可以降低CollagenⅠ、α-SMA和Fibronectin表达,增加p53 mRNA表达,促进HSCs铁死亡,改善肝纤维化的病理损伤[35]。在CCl4诱导大鼠肝纤维化模型实验中,蒿甲醚可以上调HSCs中SLC2A11和铁离子水平,通过BRD7-P53-SLC7A11通路介导HSCs铁死亡发挥抗肝纤维化的作用[36]。
双氢青蒿素、青蒿琥酯与蒿甲醚对调控铁死亡治疗肝纤维化有着不同的作用靶点与途径:双氢青蒿素靶向TfR1、TGF-β1,通过铁代谢、LD代谢影响肝细胞和活化的HSCs铁死亡;青蒿琥酯靶向p53和FT相关基因,通过p53与铁蛋白自噬途径,增加HSCs铁超载,引起HSCs铁死亡;蒿甲醚靶向SLC2A11、p53及IRP2,通过BRD7-P53-SLC7A11通路和IRP2-Iron-ROS轴,诱导HSCs铁死亡[34-41]。
3.2 黄芩
黄芩素和黄芩苷作为新型HSCs铁死亡调节剂,在治疗肝纤维化方面具有巨大潜力。在CCl4诱导小鼠肝纤维化模型中,黄芩素干预下的小鼠有SLC7A11、p53水平上调,GPX4和GSH消耗,电镜下观察到HSCs线粒体脊断裂,这提示黄芩素通过SOCS11/P53/SLC7A11途径诱导活化的HSCs铁死亡,从而缓解肝纤维化[42]。在血小板衍生因子诱导HSCs培养中,黄芩苷增加了miR-3595的表达,降低了ACSL4的水平,这提示黄芩苷通过miR-3595/ACSL4轴抑制肝细胞铁死亡从而抗肝纤维化[43]。
上述研究表明,黄芩及其活性成分可以靶向SLC7A11、ACSL4,从铁代谢、脂质过氧化方面调控铁死亡,发挥抗纤维化作用。其中,黄芩素从铁代谢途径靶向SLC7A11引起HSCs铁死亡,而黄芩苷从脂质过氧化方面,靶向ACSL4减少脂质过氧化,抑制肝细胞铁死亡,从而减少HSCs的活化。
3.3 黄连
黄连活性成分小檗碱可以通过调节脂质代谢和ROS积累介导活化的HSCs铁死亡来缓解肝纤维化。在硫代乙酰胺和CCl4诱导的小鼠肝纤维化模型中,小檗碱损害了自噬-溶酶体途径(ALP)并增加了HSCs中ROS产生,加速了铁蛋白的分解并加速了铁释放,从而导致HSCs铁死亡,这提示小檗碱通过诱导铁蛋白自噬,加速ROS介导的HSCs铁死亡,从而治疗肝纤维化[44]。在研究小檗碱治疗小鼠肝纤维化实验中,实验组小鼠的脂质合成相关基因DGAT1表达下调,脂质降解基因HSL表达上调,病理切片观察肝纤维化程度降低,这提示小檗碱能通过降低肝脏脂质合成以及增加脂质降解抑制肝细胞铁死亡,进而缓解肝纤维化的进展[45]。
因此,小檗碱既靶向铁蛋白自噬基因通过铁蛋白自噬引起的铁超载,诱导HSCs铁死亡,也靶向DGAT1、HSL,抑制脂质的过度积累,减少肝细胞铁死亡。
3.4 雷公藤
雷公藤红素可以通过抗氧化途径诱导活化的HSCs发生铁死亡,在多种肝脏疾病中显示出有效的抗纤维化和抗炎活性。有实验指出,雷公藤红素通过活性半胱氨酸位点直接与过氧化物还原蛋白(PRDXs)结合,包括PRDX1、PRDX2、PRDX4和PRDX6,并抑制其抗氧化活性;靶向HO-1并上调其在活化的HSCs中的表达[46]。
3.5 前胡
紫花前胡素具有缓解TGF-β诱导的HSCs活化的抗肝纤维化作用,可以防止CCl4诱导的肝毒性,发挥抗氧化作用。研究表明,紫花前胡素可以明显降低α-SMA和CollagenⅠ表达,并引起HSCs中Fe2+、脂质过氧化物的升高及GPX4/GSH水平降低,而铁死亡抑制剂破坏了紫花前胡素对HSCs铁死亡及抗纤维化作用,这说明紫花前胡素可以通过增加Fe2+、脂质过氧化物水平诱导HSCs铁死亡,发挥抗肝纤维化的作用[47]。
3.6 甘草
甘草的活性成分如异甘草素和异甘草酸镁在治疗肝纤维化上效果显著,通过干预肝细胞和HSCs的铁死亡的发生,以达到抗纤维化的作用。在异甘草酸镁对肝纤维化大鼠的作用研究中,异甘草酸镁显著降低了CollagenⅠ的表达,并且出现了Fe2+升高,HO-1水平升高,提示HSCs铁死亡的发生,这说明异甘草酸镁通过HO-1介导HSCs铁死亡是其发挥抗肝纤维化作用所必需的[48]。在斑马鱼及小鼠的体内外实验中,ROS、TfR、DMT1的水平升高,GPX4水平降低,其机制在于异甘草酸通过抑制GPX4表达和增加TfR和DMT1的表达诱导HSCs铁死亡来缓解肝纤维化,Cav-1在这个过程中起到促进作用。这提示我们Cav-1介导的HSCs铁死亡是异甘草酸在体外和体内发挥抗肝纤维化作用所必需的[49]。
3.7 其他
除上述传统中药及其衍生物,尚有从水果蔬菜中提取出的天然化合物。鞣花酸(EA)通过干扰SNARE复合物的形成来诱导HSCs的FPN依赖性铁死亡,从而发挥其抗纤维化作用[50]。根皮苷通过铁死亡、碳代谢等途径抑制C57/BL6N小鼠模型中的肝纤维化[51]。野苦瓜提取物可以诱导结缔组织生长因子(CTGF)、α-SMA、整合素-β1、磷酸化-JNK(p-JNK)、GPX4和SLC7A11下调,提示野苦瓜提取物可能通过调控铁死亡发挥抗肝纤维化的作用[52]。
3.8 中药复方
中药复方调控铁死亡治疗肝纤维化的研究尚处于探索阶段,多从肝损伤的角度研究中药复方调控铁死亡防治肝纤维化。中药复方调控铁死亡改善肝损伤是在中医“治未病”理论指导下有效防治肝纤维化的初步探索。
中药复方多通过抑制肝细胞铁死亡减轻肝损伤过程中炎症反应、氧化应激,从而改善肝脏损伤。近五年的研究表明,参苓白术散能够通过上调Nrf2信号通路改善氧化应激的途径抑制肝细胞内铁死亡,进而减少酒精性肝损伤,发挥抗氧化与抗炎作用[53];化脂复肝颗粒可以通过TLR4/NF-κB通路调控铁死亡发挥显著的降脂、抗炎、抗氧化损伤及保肝作用[54];泽泻汤可以上调Nrf2信号通路抑制肝细胞铁死亡,从而改善非酒精性脂肪性肝病[55];蒙药德都红花-7味散通过抑制肝细胞铁死亡,从而减轻CCl4所致慢性肝损伤[56];扶正养肝合剂通过抑制铁死亡,减轻药物性肝损伤[57]。因此,运用中药复方调控铁死亡改善肝损伤是中医药防治肝纤维化的重要一环。
4 小结与展望
肝纤维化作为慢性肝病发展过程中的持续存在的病理改变,已成为临床治疗慢性肝病、预防肝硬化及肝癌的一个突破点。肝纤维化的发生发展伴随着HSCs的活化、炎症反应、氧化应激等病理变化。铁死亡作为新型的细胞死亡方式,已被证实参与肝纤维化的进程,对肝纤维化的发展具有双面影响:一方面,铁死亡过程中铁代谢紊乱、脂质代谢及过氧化都会改变肝脏内环境,损伤肝细胞,诱导HSCs活化,最终促进肝纤维化;另一方面,铁死亡可以作为一种减少HSCs活化及其数量的治疗措施,抑制肝纤维化。通过促进HSCs铁死亡、抑制肝细胞铁死亡,是目前治疗肝纤维化的可行措施。最新研究表明,通过铁代谢、脂质代谢及过氧化、GSH/GPX4等调控途径可以防治肝纤维化。中药及其活性成分抗肝纤维化作用具有多靶点、多途径、个体化优势明显等特点,铁死亡是预防和治疗肝纤维化的潜在靶向,因此通过中药及其活性成分干预铁死亡治疗肝纤维化是未来研究的重点方向。
然而,目前中药及其活性成分调控铁死亡防治肝纤维化的研究仍处于探索阶段,仅限于已知的具有抗纤维化作用的中药及其活性成分。如何发现和验证更多临床尚未使用过的中药及其活性成分通过铁死亡治疗肝纤维化,值得我们思考。同时,现阶段关于铁死亡与中药复方的研究多局限于心脑血管病变,尚缺乏中药复方包括经方、验方和时方在肝纤维化方面的研究。因此,这提示我们未来在调控铁死亡抗纤维化的中药研究中,有三个方向:利用FerrDb数据库,发掘中药中作为天然铁螯合剂或抗氧化剂以此抑制正常肝细胞的铁死亡;调节正常细胞对铁死亡的敏感性,提高中药活性成分对HSCs的靶向性,以期更好地阐释中药防治肝纤维化的作用机制,指导临床用药;从已知有效的中药及活性成分入手,探索相关经方或验方是否可以调控铁死亡治疗肝纤维化,以期未来可以有更多抗纤维化相关的中药复方或中成药。
