重症监护病房耐碳青霉烯类肺炎克雷伯菌的耐药基因型及系统进化分析
2023-07-16胡小骞王琴
胡小骞,王琴
作者单位:安徽医科大学第二附属医院医院感染管理办公室,安徽 合肥 230601
肺炎克雷伯菌(Klebsiella pneumoniae,KP)约占医院重症监护病房(intensive care unit, ICU)革兰阴性杆菌感染的15%[1],是人体内呼吸道和肠道的常见定植菌,易引起免疫力低下病人呼吸道、血液、消化道等部位的感染。耐碳青霉烯类肺炎克雷伯菌(Carbapenem-resistant Klebsiella pneumoniae,CRKP)最初于1996 年在美国的北卡罗来州被Yigit 等[2]发现,随后传播至全球各大洲国家。由于碳青霉烯类抗生素的抗菌活性强、抗菌谱广,近年来临床治疗重症感染病人时广泛应用碳青霉烯类药物,致使CRKP逐年增加,而治疗CRKP的抗菌药物的选择有限,感染病人的死亡率较高[3],国内文献报道为29.53%~76.19%[4],国外文献报道为42.14%[5],给临床抗感染工作带来了艰巨的挑战。近年,我国CRKP 的耐药形势逐渐严峻,全国细菌耐药监测网(China antimicrobial resistance surveillance system,CARSS)“2013—2017 年的全国细菌耐药监测报告”分析显示,5年期间CRKP检出率与其他常见耐药菌的检出率相比仍处于持续上升的状态。CHINET(China antimicrobial surveillance network)统计2005—2019年15年的监测数据显示KP对亚胺培南和美罗培南的耐药率呈持续上升趋势(3.0%、2.9%对25.3%、26.8%)[6]。本研究对某三甲医院ICU 的19株CRKP 进行全基因组测序(whole genome sequenc⁃ing, WGS),通过分析其耐药基因型、多位点序列分型(multilocus sequence typing,MLST)、核心基因组多位点序列分型(core genome multilocus sequence typing,cgMLST)、荚膜型,以及构建最小生成树(minimum spanning tree,MST)、最大似然树(maxi⁃mum likelihood tree,MLT),研究该院ICU内CRKP菌株的分子生物流行病学特点,旨在指导临床合理使用抗生素,为医院感染防控措施的落实提供参考依据,遏制多重耐药菌在院内的播散。
1 材料与方法
1.1 菌株来源及药敏鉴定收集安徽医科大学第二附属医院2018 年3—7 月ICU 分离的19 株CRKP,排除同一病人的重复菌株。应用法国VITEK-2 Compat 全自动细菌分析系统和配套试剂GN/GN13,进行革兰阴性菌的鉴定及药敏试验。以大肠埃希菌ATCC 25922,肺炎克雷伯菌ATCC 700603,铜绿假单胞菌ATCC 27853,阴沟肠杆菌ATCC 700323 为质控菌株,质控菌株购自国家卫健委临床检验中心。
1.2 仪器与试剂仪器主要为法国生物梅里埃VI⁃TEK-2 Compat 全自动细菌分析系统,英国Biochrom超微量分光光度计,上海一恒科学仪器有限公司恒温培养摇床,美国Bio-Rad 电泳仪,美国Bio-Rad 凝胶成像系统。试剂主要为Oxoid 公司的药敏纸片、M-H 培养基,DNA Marker D、上海生工生物工程股份有限公司的4S Red plus 核酸染色剂、上样缓冲液,天根生化科技有限公司的细菌DNA 提取试剂盒。
1.3 菌株DNA 提取挑取CRKP 菌株接种于LB固体培养基上,37 ℃复苏24 h 后,挑取单克隆菌落于LB 液体培养基中,于37 ℃摇菌过夜。取1 mL 细菌培养液,10 000 r/min 离心1 min,弃上清液,并用DNA提取试剂盒提取细菌DNA。
1.4 基因组DNA 提取物质量控制标准取适量DNA 提取产物进行琼脂糖凝胶电泳,并用超微量分光光度计检测纯度和浓度。纯度要求OD260∶OD280 值于1.8~2.0 范围内,以避免RNA 干扰;DNA浓度要求数值≥20 µg/L,并且电泳条带清晰无杂带,总量于1.0~2.0 µg范围内。
1.5 细菌全基因组测序运用Illumina Hiseq 2500第二代高通量测序平台进行2×100 bp Paired-End测序,主要步骤包括对细菌DNA 样本进行建库、扩增测序及质控。
1.6 测序结果组装在Linux 系统中运行SPAdes-2.0 软件将测序原始FASTQ 结果拼接为FASTA 文件,运行命令参考SPAdes-2.0 软件网址https://github.com/ablab/spades。
1.7 耐药基因型检测应用staramr 软件的Res⁃Finder, PointFinder 和PlasmidFinder 数据库,通过与数据库的耐药基因进行比对,预测菌株携带的耐药基因[7]。
1.8 MLST 分型、荚膜型、cgMLST 分型及MST 构建、最大似然树构建应用MLST软件对CRKP基因组的7 个管家基因:gapA、infB、mdh、pgi、phoE、rpoB、tonB进行比对,以检测CRKP 的ST 型[8],CRAB 菌株的荚膜型鉴定应用Linux 系统运行Kaptive 软件检测。应用Ridom SeqSphere+软件进行cgMLST 分型及MST 构建,其通过将菌株基因组与www.cgMLST.org 网站上的4 647 个参考核心基因组进行比对,扫描基因序列间的差异,将特定等位基因类型的菌株定义为相应的CT 型(complex type)编号。菌株间的比对结果被可视化以构建MST,相同CT型编号的菌株聚拢为一簇,并对每个菌株的差异等位基因数进行计数,同簇菌株间等位基因差异的阈值为15,差异的等位基因数越少表示亲缘性关系越近[9]。
同时,依据全基因组序列的单核苷酸多态性(single-nucleotide polymorphism,SNP)分析,以AY7001 号菌株序列作为参考,应用CGE 的CSI Phy⁃logeny1.4 工具(网址:https://cge.cbs.dtu.dk/services/CSIPhylogeny/)及FigTree v1.4.4 软件构建19 株CRKP 的最大似然树,按亲缘性远近分组,分析其系统进化关系。
1.9 统计学方法采用WHONET 5.6 软件对数据进行分析处理,计数资料以率和例数进行描述。
2 结果
2.1 CRKP 的临床资料19 株CRKP 菌株标本来源分别为痰(16 株84.21%)、腹水(1 株5.26%)、血(1株5.26%)、静脉导管尖端(1 株5.25%),病人性别分别为男性(14 例73.68%)、女性(5 例26.32%)。见表1。

表1 19株耐碳青霉烯类肺炎克雷伯菌的分布情况
2.2 CRKP 的药敏试验结果19 株CRKP 对头孢菌素类、青霉素类、碳青霉烯类、氨基糖苷类、氟喹诺酮类、磺胺类等抗菌药物的耐药率均为100%,而对替加环素均敏感,耐药率为0%。见表2。
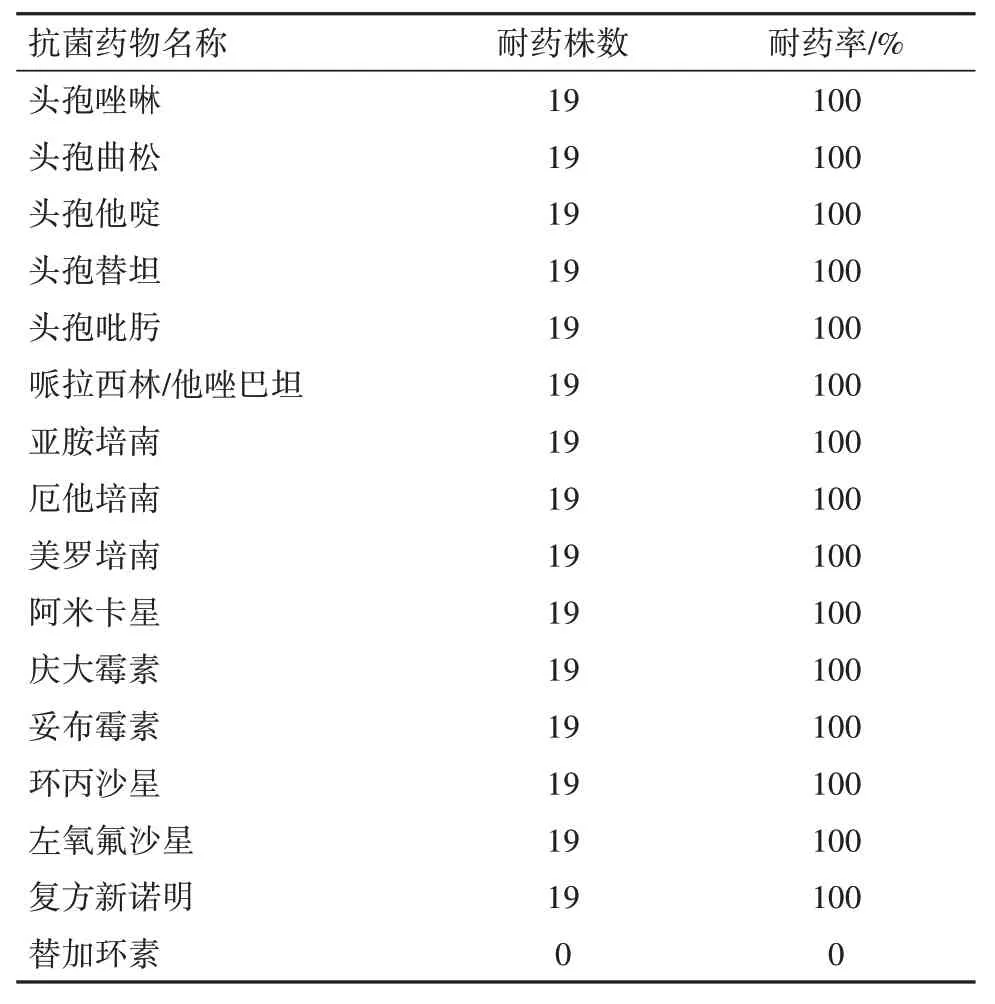
表2 耐碳青霉烯类肺炎克雷伯菌对常用抗菌药物的耐药情况
2.3 耐药基因分析结果19 株CRKP 的WGS 结果显示,其共携带11种耐药基因和4种质粒,包括3种β-内酰胺酶,19 株(100%)携带blaKPC-2、blaTEM-1B,15 株(78.95%)携带blaSHV-66;2 种氨基糖苷类中,19 株(100%)携带rmtB,17 株(89.47%)携带aa⁃dA2;喹诺酮类耐药基因只有1 种为qnrS1,19 株(100%)均携带该基因;磺胺类耐药基因有2 种,分别为19 株(100%)携带的sul2,17 株(89.47 %)携带的sul1;19 株(100%)均携带磷霉素耐药基因fosA6、四环素耐药基因tet(A)。另外,19 株(100%)CRKP均携带四种不同的质粒,包括ColRNAI、IncFII、In⁃cHI1B、IncR。见图1。
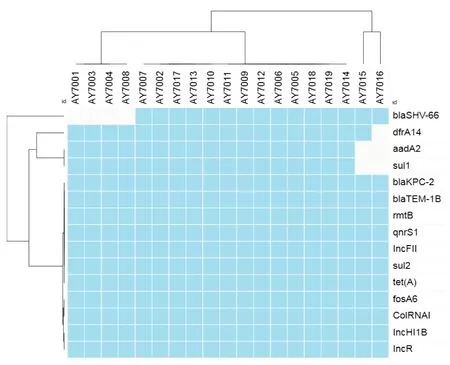
图1 19株CRKP的耐药基因分布
2.4 MLST 分型、荚膜型、cgMLST 分型及系统进化分析结果19 株CRKP 的MLST 分型结果均为ST11 型,其荚膜型结果均为KL64 型,初步结果显示19株CRKP具有较高亲缘性。
通过cgMLST 分型,19 株CRKP 为一个谱型:CT1774 型,同一谱型聚集为一簇,簇中心菌株与周围菌株具有1~15个等位基因的差异,本研究的中心菌株与周围菌株具有较近的亲缘性关系。MST 图显示中心菌株AY7007 与AY7002、AY7005、AY7008、AY7009、AY7010、AY7012、AY7013、AY7014、AY7016、AY7017、AY7018、AY7019 的等位基因差异数为6个以内,亲缘性关系较近;中心菌株AY7003 与AY7001、AY7004、AY7010、AY7011 的等位基因差异数为2 个以内,亲缘性关系相近;同时,AY7006 与AY7009 的等位基因差异数为5,AY7015与AY7016 的等位基因差异数为2,其亲缘性关系相近。见图2。

图2 19株CRKP的最小生成树
19 株CRKP 的MLT 结果显示,AY7007 位于进化树的根部,以AY7007 为进化祖先向周围进化出分支菌株,19 株菌株的进化关系较近。根据分支节点上Bootstrap 值越大该节点置信度越高的判断标准分为四组克隆型,Ⅰ组为AY7001、AY7003、AY7004、AY7011,Ⅱ组为AY7006、AY7009,Ⅲ组为AY7012、AY7018,Ⅳ 组 为 AY7015、AY7016。见图3。

图3 19株CRKP的最大似然树
3 讨论
CRKP 的耐药机制较为复杂,主要包括产碳青霉烯酶、高产AmpC酶、膜孔蛋白的缺失、主动外排泵过度表达等。其中,产碳青霉烯酶为其主要的耐药机制,本研究中19 株CRKP 均携带β-内酰胺类耐药基因肺炎克雷伯菌碳青霉烯酶2 型(β-lactamase Klebsiella pneumonia carbapenemase,blaKPC-2),与碳青霉烯类抗生素亚胺培南、厄他培南、美罗培南(耐药率均为100%)的药敏结果相一致,blaKPC-2是一种常见的碳青霉烯类药物的耐药基因,于2007年首次在中国一家医院被发现[10],KPCs酶通常由质粒编码,产酶菌株仅对少数抗菌药物敏感,感染病人的死亡率较高[11-12]。氨基糖苷类耐药基因中,rm⁃tB检出率为100%,aadA2检出率为89.47%,aadA2检出率小于阿米卡星、庆大霉素、妥布霉素的药敏结果(耐药率100%),说明aadA2并非引起氨基糖苷类耐药的主要原因。喹诺酮类耐药基因qnrS1检出率100%与环丙沙星、左氧氟沙星的药敏结果(耐药率100%)相一致。19株CRKP均携带四环素类耐药基因tet(A)与替加环素耐药表型(耐药率0%)并不一致,说明tet(A)不是替加环素的耐药基因。tet(A)属于MFS 外排泵,而RND 型外排泵、AcrAB 型外排泵和核糖体蛋白的突变才是导致替加环素耐药的主要机制[13-14]。同时,质粒在传播细菌的耐药性和毒力方面也起着关键作用[15],本研究筛选出四种质粒如ColRNAI、IncFII、IncR、IncHI1B,其中,ColRNAI、IncFII、IncR为耐药性质粒,19 株CRKP 均携带此三种质粒,并同时存在于产KPC-2的ST11型菌株,与Yu 等[16]的研究相符,此三种质粒可能与携带blaK⁃PC-2耐药基因相关。IncHI1B是一种可携带耐药基因和毒力基因的结合性质粒,国外一家医院曾报道阴沟肠杆菌、肺炎克雷伯菌、大肠埃希菌和弗劳地氏杆菌的IncHI1B质粒中均携带blaNDM[2],该质粒可在不同菌种间进行碳青霉烯类耐药基因的水平传播[17]。如此严峻的耐药情况和复杂多样的耐药基因给临床抗感染治疗带来了困难,当耐药菌防控措施落实不当、医务人员手卫生依从性低、抗生素的使用不合理等情况发生时,耐药菌将在医院内、科室间进行传播流行,将会给病人带来健康和经济损失,给社会造成一定的危害。因此,有效的防控措施至关重要。
本研究的19 株CRKP 均为ST11-KL64 型,均携带blaKPC-2耐药基因。ST11 已成为我国CRKP 的优势克隆型,约占60%百分比[18]。国内有研究曾报道某院的ST11-KL47型CRKP自2016年后发生亚克隆转移为ST11-KL64 型,系统进化树显示ST11-KL64 型由ST11-KL47 型祖系重组所产生。ST11-KL64 型CRKP 感染病人的30 d 病死率高于其他型别CRKP 感染病人,其高毒力表型与生物膜产生较多相关,致使该型抵抗人中性粒细胞的杀灭能力、对大蜡螟幼虫感染模型的杀灭作用均高于ST11-KL47 型,并且调控黏液表型基因(regulator of mu⁃coid phenotype gene A,rmpA)的rmpA-rmpA2共同存在于ST11-KL64 型菌株亦使其毒力增强,rmpA-rm⁃pA2基因通过毒力质粒进行亚克隆转移,而该型对于干燥环境的抵抗力较强,进一步促进其在医院内的传播[19]。blaKPC-2耐药基因的保守移动元件在质粒上的传播致使我国CRKP 菌株的广泛流行[18]。因此,对于携带blaKPC-2耐药基因的ST11-KL64 型CRKP 进行前瞻性主动筛查,提前对感染病人进行主动干预的意义十分重要。
传统的病原菌分型与溯源方法包括聚合酶链式反应(polymerase chain reaction,PCR)、脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)[20-21]等,其中PFGE被视为同源性分析的“金标准”, 但亦具有耗时长、操作难度大、批次间差异性大的缺点[22]。随着全基因组测序(whole genome sequenc⁃ing,WGS)技术的迅速发展,及测序成本的降低,WGS 结合生物信息学分析的方法已经广泛应用于分子生物流行病学研究中,技术方法包括MLST 分型、cgMLST 分型、SNP 等,cgMLST 分型和SNP 具有较好的分辨率、准确性、可比性、可操作性,有利于实验室间的标准化[23-24]。本研究同时应用cgMLST分型和SNP 两种方法对19 株CRKP 的亲缘性关系进行溯源。其中,基于cgMLST 的Ridom SeqSphere+软件根据核心基因组等位基因的差异数目生成MST,亲缘性关系越近距离越近,并聚集为一簇。本研究MST 图显示19 株CRKP 聚集为一簇CT1774型,以AY7007、AY7003 菌株为中心,向周围菌株进化播散,周围菌株与中心菌株的等位基因差异数目阈值为15 以内,说明19 株CRKP 的亲缘性关系相近。同时,应用FigTree v1.4.4 软件基于最大似然法的单核苷酸多态性构建MLT图[25],结果显示19株菌株以AY7007 为进化祖先向周围进化分支,Ⅰ组克隆型的4 株菌株(AY7001、AY7003、AY7004、AY7011)分离自2018 年3 月10 日至4 月11 日,Ⅱ组克隆型的2 株菌株(AY7006、AY7009)分离于2018年5 月2 日、5 月4 日,Ⅳ组克隆型的2 株菌株(AY7015、AY7016)分离于2018 年5 月28 日、6 月6日,这三组组间采样时间间隔较远,但组内采样时间间隔较近。Ⅰ组、Ⅳ组克隆型组内病人床位相邻,且两组病人均接受过床旁共用的纤维支气管镜检测,推测可能由于床旁物体表面、纤维支气管镜或医务人员的手等引起病人间的交叉传播。虽然,Ⅱ组克隆型中病人床位不相邻;Ⅲ组克隆型的2 株菌株(AY7012、AY7018)分离于2018 年5 月21 日、6月24 日,组内采样时间间隔较远,且床位不相邻或相同,由于CRKP 产生生物膜,生物膜可在医院的各类导管及医疗设备内、外表面长期存活,能保护病原菌抵抗外界环境变化[26-27],故Ⅱ组、Ⅲ组克隆型仍不能排除医务人员的手或共用检查设备表面引起CRKP的传播。
由于本研究是针对ICU的医院感染病例高发情况的调查,因而在菌株收集数目和标本来源方面具有一定的局限性。另外,由于目前缺乏国际通用的细菌基因组数据分析标准化流程,对于判断暴发克隆的SNP 阈值缺乏统一标准,致使系统进化分析结果难以实现标准化。后续笔者将对以上不足之处进行深入研究,优化病原菌溯源分析策略,完善菌株数目及标本来源,为多重耐药菌防控工作提供更科学的数据支持。
综上所述,该院ICU 的CRKP 主要耐药机制为携带blaKPC-2并产KPC 酶;CRKP 分型为ST11-KL64-CT1774型,同源相关性高,存在科内克隆性传播的风险。
(本文图3见封三)
