间变性淋巴瘤激酶阴性系统性间变性大细胞淋巴瘤穿刺活检病理诊断分析
2023-07-16李印张子杰师晨阳
李印,张子杰,师晨阳
作者单位:南阳市中心医院病理科,河南 南阳 473000
间变性大细胞淋巴瘤(anaplastic large cell lym⁃phoma,ALCL)属外周成熟T 细胞淋巴瘤亚型,免疫组化瘤细胞强表达CD30,分为间变性淋巴瘤激酶(anaplasticlymphoma kinase,ALK)阳性和ALK 阴性两个独立的疾病实体[1-3]。肿瘤累及淋巴结和(或)结外器官常伴有系统性症状则为系统性ALCL(sys⁃temic ALCL,SALCL)[1-3]。ALK 阳性ALCL 和ALK 阴性ALCL细胞形态学无法区分[1],但二者临床特征和预后显著不同。ALK 阳性系统性间变性大细胞淋巴瘤(ALK-systemic anaplastic large cell lymphoma,ALK-SALCL)相比于其他ALCL,包含有与预后相关的特殊细胞遗传学改变,其特征性瘤细胞同ALK 阳性SALCL 一样细胞核具有多形性,常胞质丰富伴有上皮样形态,在淋巴结或器官内侵犯时瘤细胞聚集成团似转移癌[1,3],粗细针穿刺活检标本病理诊断容易误诊[3-5]。现对临床病理资料完整的2 例ALK 阴性SALCL进行分析并文献复习如下。
1 资料与方法
1.1 一般资料收集南阳市中心医院2019 年1 月至2022 年1 月行粗针穿刺活检确诊恶性淋巴瘤41例(其中包括弥漫大B 细胞淋巴瘤28例),根据2017年WHO 淋巴瘤分类诊断标准,4 例明确为SALCL:男性和女性各2例,年龄63.5岁,首发颈部淋巴结肿块2 例,腹膜后1 例,腹股沟淋巴结肿块1 例,均为ALK 阴性,其中2例临床病理资料完整,病人皆伴有长期慢性病史。病人或其近亲属知情同意。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 标本获取和处理病例均行粗针穿刺活检,由临床医师和超声科医师协作施行, 常规消毒铺巾,2%利多卡因麻醉,在彩超引导下,用一次性16 G 枪用活检针沿穿刺线进针到达肿块边缘,扣动扳机反复取样3~4 次,取材满意,10%甲醛固定后送病检。病例1 粗针穿刺前先行细针穿刺吸取细胞学检查,其吸取标本收集按细针穿刺细胞块制作流程[6-7]。所有穿刺标本均用擦镜纸包裹放入至少两个包埋盒经常规脱水石蜡切片并苏木精-伊红(HE)染色。
1.3 免疫组化免疫组化采用MicroStackerTM法,所有CK、P63、P40、GATA3、LCA、CD20、CD79a、CD10、PAX5 、CD45R0、CD3、 CD5、CD43、 CD30、CK8/18、P53、KI-67、Vimentin、Syn、TIA-1、MUM1、C-myc、CD117、D2-40、PLAP、CK7、CK20、 CDX2、 TTF-1、PSA、Villin、HMB45 、S-100、PSA 等一抗及试剂盒均购自河南赛诺特生物技术有限公司。
1.4 分子遗传学分析2例石蜡组织送广州金域医学检验中心协助基因重排检测:TCR 基因重排检测采用PCR 法结合荧光片段分析;DUSP22-IRF4 和TP63基因重排检测采用FISH法。
2 结果
2.1 临床资料病例1,女,69 岁。无明显原因口腔反复溃疡10余年,伴发热,曾间断服药,查体口腔黏膜有溃疡,左颈部水肿。彩超示左颈部多发异常肿大淋巴结,最大约2.0 cm×0.7 cm,,胸部CT示双肺多发小结节,纵隔淋巴结不大。细针穿刺细胞块和粗针穿刺标本常规切片诊断低分化鳞癌、未分化癌等。病例2,男,72 岁。患高血压20 余年,近4 年来多次住院治疗高血压及脑梗死,最近一次以“右下肢肿胀1 个月,记忆力下降1 周”入院。病人行正电子发射计算机断层显像(PET-CT)检查示双腹股沟淋巴结增大,左侧最大径约4.0 cm。双肺炎症改变,其余各器官未见特殊。粗针穿刺标本常规切片诊断尿路上皮癌、低分化腺癌、生殖细胞肿瘤等。
2.2 病理检查
2.2.1 大体所见2 例粗针穿刺标本均为细条状灰白灰褐色组织,长0.8~1.2 cm,宽约0.1 cm。例1 粗针穿刺前行细针穿刺长径约0.5 cm的细胞凝块。
2.2.2 镜检病例1见大量多形性肿瘤细胞片状分布,细胞质丰富淡染,核呈卵圆形、肾形、分叶状、马蹄形等,可见一至多个核仁,并见一些花环状多核细胞,核分裂象多见,局部见明显坏死。其细针穿刺细胞块细胞量偏少,但形态易于分辨。病例2 低倍镜下见纤维化间质内见单行性上皮样瘤组织成片巢状生长,癌细胞具有黏附性,部分瘤细胞呈小巢团状浸润 ,形态类似尿路上皮癌等; 高倍镜下见癌细胞具有卵圆形、肾形、分叶状、“面包圈”核等,胞质丰富淡染,核分裂象多见。其镜下所见见图1。
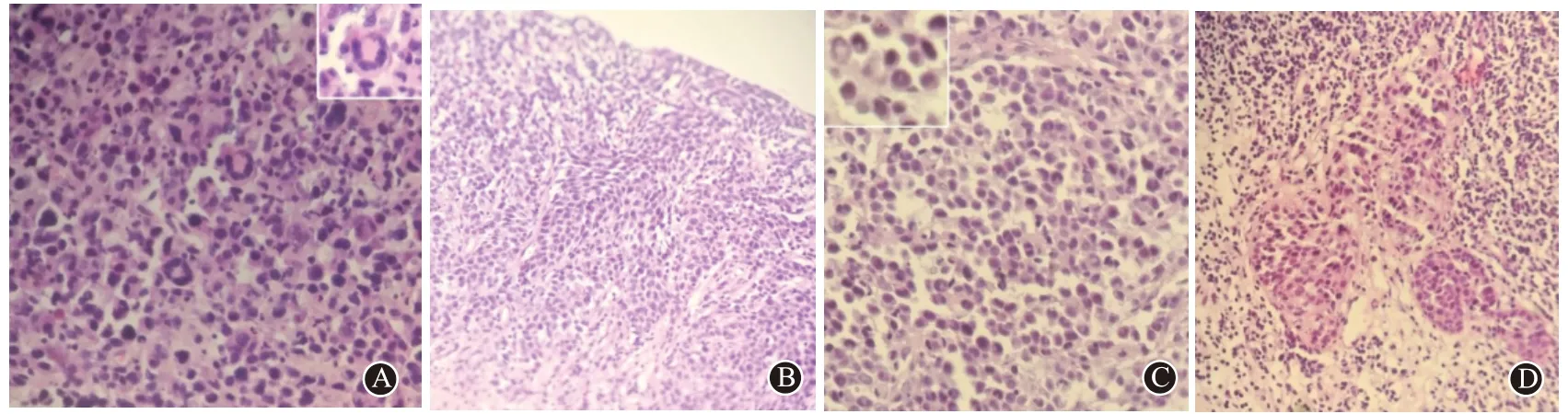
图1 间变性淋巴瘤激酶阴性系统性间变性大细胞淋巴瘤:A为病例1肿瘤细胞图,右上方为典型花环状核(HE染色×400);B为病例2肿瘤细胞图,纤维化间质内见单行性上皮样瘤组织成片巢状生长,癌细胞具有黏附性,该视野形态类似尿路上皮癌(HE染色×200);C为病例2肿瘤标志性细胞高倍放大,左上方为明显肾形核和“面包圈”核(HE染色×400);D为病例2部分瘤细胞呈小巢团状浸润 ,似上皮性癌(HE染色×200)
2.2.3 免疫组织化学染色2 例瘤细胞均CD30(阳性)(强表达于胞膜和核旁高尔基区),ALK(阴性),LCA(阳性),CD43(阳性),CD5(阳性),MUM1(阳性), CD30(阳性),CK(阴性),Vimentin(阳性),CD23(阴性),CD56(阴性),PAX5(阴性),KI-67(>80%阳性),P40(阴性),CD20(阴性),CD79a(阴性),Syn(阴性),CD45RO(阴性),CD34(阴性)。其他标志物,病例1:TIA-1(阳性),P63(80%阳性),CD3(阴性),GATA-3(阴性),HMB45(阴性),S-100(阴性),C-myc(阳性)。病例2:GATA-3(阳性),P53(阳性),CK7(阴性),P63(70%阳性),CK20(阴性),CDX2(阴性),Villin(阴性),TIA-1(阴性),TTF-1(阴性),CD10(阴性),CK8/18(阴性),D2-40(阴性),PSA(阴性),CD117(阴性),PLAP(阴性)。免疫组化表达见图2。
2.2.4 分子遗传学2 例经PCR 法分析均存在TCRB 和TCRG 克隆性基因重排。FISH 检测:病例1检测到TP63 基因重排,病例2 有DUSP22-IRF4 位点基因重排。结果见图3。
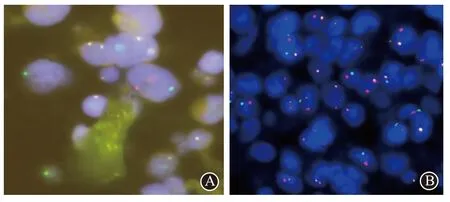
图3 间变性淋巴瘤激酶阴性系统性间变性大细胞淋巴瘤:A为例1病人瘤细胞荧光原位杂交(FISH)检测,采用TP63(3q28)基因断裂双显色分离探针,检测到TP63基因重排,可见分离信号(×1000);B为例2病人瘤细胞荧光原位杂交检测(FISH)检测,采用DUSP22-IRF4双色分离探针,检测到6p25.3的DUSP22-IRF4位点基因易位,肿瘤细胞可见典型的红色和绿色分离信号(×600)
2.3 诊疗经过病例 1 常规HE 切片诊断先后考虑低分化癌、未分化癌、恶性黑色素瘤等,经多轮免疫组化染色病理确诊ALK 阴性SALCL 后行CHOP 方案全身化疗6 周期,期间复查颈部彩超示淋巴结肿块消退。6 个月后病人胸部增强CT 示左肺门占位约4.5 cm×4.4 cm,左纵隔淋巴结增多增大局部融合成团,双肺多发小结节,经肺穿刺取样病理诊断为ALK 阴性SALCL 累及肺部。行CHOEP 方案化疗及卡瑞丽珠单抗免疫治疗2周期病情好转。后再次行全身化疗,12个月后病人复查CT左肺门病灶较6个月前缩小,范围约0.8 cm×0.7 cm,右肺下叶及肺门见团块状高密度影,最大者3.7 cm×3.8 cm,双肺多发结节样高密度影较前增多增大,调整方案再次化疗效果不佳,病人距最初诊断16个月后病故。病例2常规HE 切片诊断先后考虑尿路上皮癌、低分化腺癌等,确诊ALK 阴性SALCL 后行CHOP 方案化疗1个周期效果不佳,后改用吉西他滨+顺铂化疗4个周期,肿块明显缩小。随访6个月,身体状况可。
3 讨论
SALCL 既可累及淋巴结,也可累及结外部位如肝、骨、肺、胃肠道及皮肤(继发性皮肤受累)等[1]。ALK 阳性SALCL 多发生于儿童和年轻成人;ALK 阴性SALCL 可发生于各年龄段,尤其是老年人,常出现B 症状预后差[3]。显微镜下ALK 阴性和ALK 阳性 SALCL 两者均可出现”标志性细胞”(Hall mark cells)即细胞富含淡嗜酸或嗜碱性胞质,核呈肾形、马蹄形、分叶状、环形多核细胞、“面包圈”细胞核等多种形态,可见明显核仁,核分裂象多见。肿瘤细胞具有黏附性,常呈片巢状排列,有时在淋巴窦内侵犯特征显著,易误诊为转移癌或恶性组织细胞疾病等[1-5]。该瘤其组织学形态还可类似肉瘤、生殖细胞肿瘤、恶性黑色素瘤等多种变形[3],出现标志性瘤细胞是其共同特征。免疫组化除ALK 外,肿瘤细胞胞膜和核旁高尔基体区强表达CD30,不同程度表达T 细胞标志物但不表达B 淋巴细胞标志物是诊断该肿瘤的关键。本组2 例首发于淋巴结的ALK 阴性SALCL临床病理特点与文献报道符合。
淋巴结肿块多采用手术切除行组织学诊断,尤其淋巴瘤的诊断按WHO 的建议尽可能切除完整淋巴结送检,粗针穿刺适用于无法有效及安全获得切除或切取组织的病人。少数体质差高危病人、淋巴结融合不易与血管分离的病人、体腔深部不易获取完整淋巴结肿块病人等,实践中均不适合完整切除淋巴结[7-11]。细针穿刺细胞学辅以细胞块制作对转移癌诊断价值高[1,7],在淋巴瘤则适于疑似病例的初筛以及部分确诊病例复发病灶的确认[9]。近年来随着超声诊断水平的提高,淋巴结粗针穿刺活检日益增多[1],成为确诊不易完整切除淋巴结病人的重要手段,多数能满足诊断需要[9-11]。文献报道,淋巴结肿大在2 cm以上,粗针穿刺活检标本在3条以上,穿刺活检与淋巴结完整切除标本一致性高,其在大细胞高级别淋巴瘤准确性最高,滤泡性淋巴瘤等则不易通过穿刺方法确诊[1,10]。ALK 阴性SALCL 因细胞异型性大,通过穿刺获得恶性诊断并不困难,其难点在于肿瘤的分类[3,5]。本文2 例均为体质较差的老年病人且皮肤水肿,属超声引导粗针穿刺活检的适应证,标本穿刺均在3 条以上,穿刺获取标本满意,常规石蜡切片结合免疫组化染色最终明确诊断。
ALK 阴性SALCL 临床少见,淋巴结穿刺活检组织诊断陷阱在于该瘤细胞具有上皮样形态,且具黏附性生长特点,常聚集成实性腺癌或鳞癌样的片巢或小团簇状结构[3,12],常规切片镜下观察常疏于考虑,如不熟悉其病理特征,极难作出淋巴瘤的诊断。如本组2 例ALK 阴性,首轮免疫组化均未选用LCA和CD30抗体,致漏诊该肿瘤。病例1因病人有口腔长期溃疡,因其细胞显著多形性,分化差,第一次病理诊断考虑为来源于口腔的低分化鳞癌或未分化癌。病例2因肿瘤细胞低倍镜下细胞似单行性黏附性生长,并有片状甚至小簇状及巢状生长方式,曾考虑为尿路上皮癌、腺癌或恶性生殖细胞肿瘤等疾病,且其免疫组化和尿路上皮癌均表达GATA3 和P63 造成诊断困难,后经PET-CT 检查后调整诊断思路应用LCA 和CD30 抗体得以确诊。复习文献病例,首次多诊断考虑为非淋巴瘤疾病,选用了较多的免疫组化抗体,最多甚至40余种抗体标记才得以确诊[3-5,13]。有研究认为对于具有上皮样或梭形形态的低分化恶性肿瘤(在CK 和S-100、CD45 均阴性情况下),强烈推荐CD43、CD30 和ALK 联合应用以防漏掉ALK 阴性SALCL[3]。对于T 细胞系列裸细胞表型等疑难病例,则需TCR 克隆性基因重排分析协助诊断[1-3]。
穿刺活检标本因组织局限,ALK 阴性SALCL 需与以下肿瘤免疫组化鉴别:(1)转移癌:ALK 阴性SALCL 多不表达CK 系列标志物,而表达LCA、CD30及不同程度表达T 淋巴细胞系列标志物,可与低分化鳞癌、腺癌、尿路上皮癌等鉴别。(2)弥漫大B细胞瘤伴间变:弥漫大B 细胞瘤强和弥漫表达CD20、PAX5 和B 细胞相关转录因子而不表达T 细胞系列标志物等可与ALK 阴性SALCL 鉴别[3]。(3)恶性黑色素瘤及生殖细胞肿瘤、组织细胞肿瘤等:ALK 阴性SALCL 表达LCA、CD30及T淋巴细胞系列标志物而不表达HMB45、S-100、CD1a、CD117、PLAP、OCT3等可与以上肿瘤鉴别。(4)霍奇金淋巴瘤:ALK 阴性SALCL 偶尔可表达CD15 和PAX5[3],免疫组化应同时选用T 细胞系列标志物及EBER 等,必要时IGH和TCR 克隆性基因重排分析与之鉴别。(5)CD30 阳性的非特指外周T 细胞淋巴瘤:其与ALK 阴性SAL⁃CL相比缺乏间变特征和标志性瘤细胞,无淋巴窦片巢状分布特征,CD30表达不强[3,13]。(6)肉瘤样癌:本文例1继发肺部占位需和肉瘤样癌鉴别。肉瘤样癌表达CK 和VIMENTIN,ALK 阴性SALCL 表达VI⁃MENTIN和淋巴细胞标志物,不表达CK[3,14]。
ALK 阴性SALCL 在生物学行为等方面与原发皮肤性ALK阴性ALCL及乳腺植体相关性ALK阴性ALCL 不同,后两者分别表现为局限性病变、临床惰性[1-3]。ALK 阴性SALCL 包括两个特殊的基因易位[15-18]:其中最常见的易位(约占30%)是位于6p25.3的DUSP22-IRF4位点的基因重排(即DUSP22基因重排),其多数病例瘤细胞形态相对单一,片状黏附性生长方式,缺乏多形性细胞,预后同ALK 阳性病人;另一重现性易位为位于3q23 位点的TP63基因重排,见于约8%的病人,其预后较差。文献报道TP63 基因重排也不倾向发生于多形性瘤细胞的病例[16],本文例1 瘤细胞多形性则存在TP63 基因重排。ALK、DUSP22 和TP63 均阴性(三阴性)的病人预后介于前两者之间。有DUSP22基因重排和TP63基因重排病人其在组织形态学、生物学行为及预后方面均不同[15-18],本组细胞多形性病例1和单行性病例2 在组织形态及分子遗传学方面显著不同,其对化疗药物有不同的敏感性,病例1 治疗后短时间又出现纵隔和肺部进展,其临床病理特点与分子改变一致。根据CSCO2020 淋巴瘤诊疗指南要求对ALK阴性SALCL 应进行DUSP22/IRF4 或TP63 基因重排检测以指导治疗[9]。有研究[3]建议对免疫组化P63在瘤细胞表达>30%的病人应行TP63 基因重排检测。ALK 阴性SALCL 穿刺活检组织诊断常困难,因免疫组化损耗较多,建议穿刺疑为淋巴瘤的标本应制作至少2 个蜡块,除满足常规HE 切片外,一个用于免疫组化检测,一个备用基因检测。本组2 例免疫组化和分子检测均获满意结果。
(本文图1~3见封三)
