形觉剥夺性弱视儿童脑灰质的变化:基于体素的形态测量研究
2023-07-14李亚东郑广瑛迟英杰文宝红张晓盼
李亚东 郑广瑛 骆 瑶 迟英杰 文宝红 张晓盼
弱视是常见的儿童视觉发育障碍性疾病,我国儿童弱视的患病率为 0.81%~2.80%[1-2]。弱视可引起视力下降、敏感度下降、立体视觉障碍、视觉运动觉障碍等[3],影响儿童的学习、成长和就业。不同类型的弱视患者大脑结构改变不同[4-5]。既往研究多集中在斜视性、屈光参差性和屈光不正性弱视,关于形觉剥夺性弱视皮层的研究却多采取黑暗环境或眼睑缝合方式建立动物模型[6-7],因此目前仍缺少着重于人类形觉剥夺性弱视大脑皮层结构改变的研究。基于体素的形态测量学(VBM)方法是一种全面、客观的脑结构影像分析技术,已广泛应用于眼科疾病的研究中[8-9]。因此,本研究采用VBM技术对先天性白内障所致单眼、双眼形觉剥夺性弱视儿童的结构像磁共振成像(MRI)进行灰质体积(GMV)的定量分析和对比,探索形觉剥夺性弱视大脑结构的变化和潜在的病理机制。
1 资料与方法
1.1 一般资料
收集2020年8月至2022年1月于本院眼科中心就诊的形觉剥夺性弱视儿童25例35眼。单眼形觉剥夺性弱视组15例15眼,其中男7例,女8例,年龄5~13(8.93±2.50)岁;双眼形觉剥夺性弱视组10例20眼,其中男4例,女6例,年龄6~10(7.80±1.32)岁。纳入标准:(1)单眼或双眼先天性白内障;(2)符合中华医学会眼科学分会斜视与小儿眼科学组2011年制定的弱视诊断标准[10];(3)眼位、眼球运动及眼底检查无异常;(4)未行弱视治疗;(5)右利手。排除标准:(1)眼部其他疾病、外伤及手术史;(2)神经精神系统疾病、外伤及手术史;(3)MRI检查禁忌证(如金属植入物、幽闭恐惧症等)。同期门诊招募正常对照组受检者11名22眼,其中男4名,女7名,年龄6~13(9.55±2.42)岁。纳入标准:(1)双眼裸眼视力或最佳矫正视力(BCVA)≥1.0;(2)右利手。排除标准:(1)眼部或神经精神系统疾病、手术史、外伤史;(2)MRI检查禁忌证(如金属植入物、幽闭恐惧症等)。本研究符合《赫尔辛基宣言》,经本院伦理委员会批准(批文号:2022-KY-0394-002),所有受试者及其监护人均被告知研究目的、过程及意义,并签署知情同意书。
1.2 方法
1.2.1 MRI数据采集
经眼科首诊后,所有受检者使用德国西门子MAGNETOM Prisma 3.0T MRI扫描仪,采用64通道头部线圈进行MRI扫描。扫描时用海绵垫固定受试者头部两侧,戴耳塞,嘱其保持清醒、闭眼、安静平卧。结构像MRI采用磁化制备快速梯度回波获取三维T1加权图像,具体参数如下:脉冲重复时间为2 300 ms,回波时间为2.32 ms,层厚为0.9 mm,翻转角为8°,矩阵为256×256,视野为240 mm×240 mm。历时5 min 21 s,获得高分辨率结构像MRI图。
1.2.2 MRI数据处理
在Matlab 2018b平台上采用VBM软件来处理MRI数据。方法如下:(1)空间标准化。将所有受试者的结构像MRI标准化到蒙特利尔神经研究所(MNI)模板上;(2)组织分割。将配准后的图像分割成灰质、白质、脑脊液及非脑像素,并对分割后的图像进行调制;(3)平滑处理。采用半高全宽为8 mm的高斯核对图像进行空间平滑处理。
1.2.3 数据分析与观察指标
经数据提取可获得每个受试者的总颅内容积(TIV)、白质体积和GMV,其中GMV为主要观察指标。应用脑成像数据处理和分析软件对三组受检者GMV进行分析比较,并以年龄、TIV作为协变量导入分析,经高斯随机场校正,阈值设定为体素水平P<0.001且团块水平P<0.05。记录有统计学意义的脑区的MNI坐标、团簇体素数量及相应LSD-t值。
1.3 统计学分析
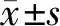
2 结果
2.1 一般资料比较
2.2 三组受检者VBM比较
单眼形觉剥夺性弱视组、双眼形觉剥夺性弱视组及正常对照组受检者的TIV分别为(1 460.68±156.66)mL、(1 403.17±91.18)mL和(1 403.20±77.23)mL,三组受检者之间TIV的差异无统计学意义(F=0.998,P=0.379)。单眼形觉剥夺性弱视组、双眼形觉剥夺性弱视组及正常对照组受检者的GMV分别为(793.30±76.66)mL、(809.35±139.19)mL和(908.38±48.93)mL,三组受检者之间GMV的差异有统计学意义(F=5.395,P=0.009);其中单眼形觉剥夺性弱视组、双眼形觉剥夺性弱视组与正常对照组受检者之间GMV的差异均有统计学意义(P=0.004、0.019),而单眼形觉剥夺性弱视组、双眼形觉剥夺性弱视组患者之间GMV的差异无统计学意义(P=0.673)。
与正常对照组相比,单眼形觉剥夺性弱视组患者在左侧颞中回、左侧楔叶和左侧额中回的GMV均减少(均为P<0.05)(图1中蓝色部分和表1),在左侧额上回、左侧额下回岛盖部、左侧顶上小叶、右侧颞下回和右侧小脑前叶的GMV均增加(均为P<0.05)(图1中红色部分和表1)。
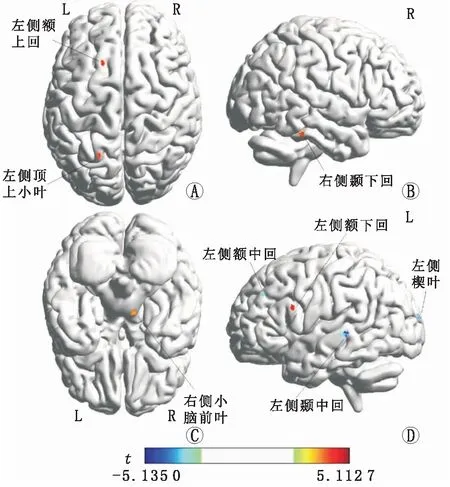
A:顶面观;B、D:外侧面观;C:底面观。红色区域代表单眼形觉剥夺性弱视组GMV增加的脑区,蓝色区域代表其GMV减少的脑区。t为统计学t值。图1 单眼形觉剥夺性弱视组与正常对照组之间GMV有显著差异的脑区分布图
与正常对照组相比,双眼形觉剥夺性弱视组患者在右侧额叶、双侧小脑后叶、双侧小脑前叶和双侧海马旁回GMV均减少(均为P<0.05)(表2和图2中蓝色部分);在左侧颞上回和右侧顶上小叶GMV均增加(均为P<0.05)(表2和图2中红色部分)。
与双眼形觉剥夺性弱视组相比,单眼形觉剥夺性弱视组患者分布在右侧楔前叶、右侧颞中回、右侧中央后回及辅助运动区、左侧额中回、左侧前扣带回、左侧中央前回、左侧中央后回、双侧中扣带回、双侧岛叶的GMV均增加(均为P<0.05)(图3中红色部分和表3),未见GMV显著减少的脑区(P>0.05)。
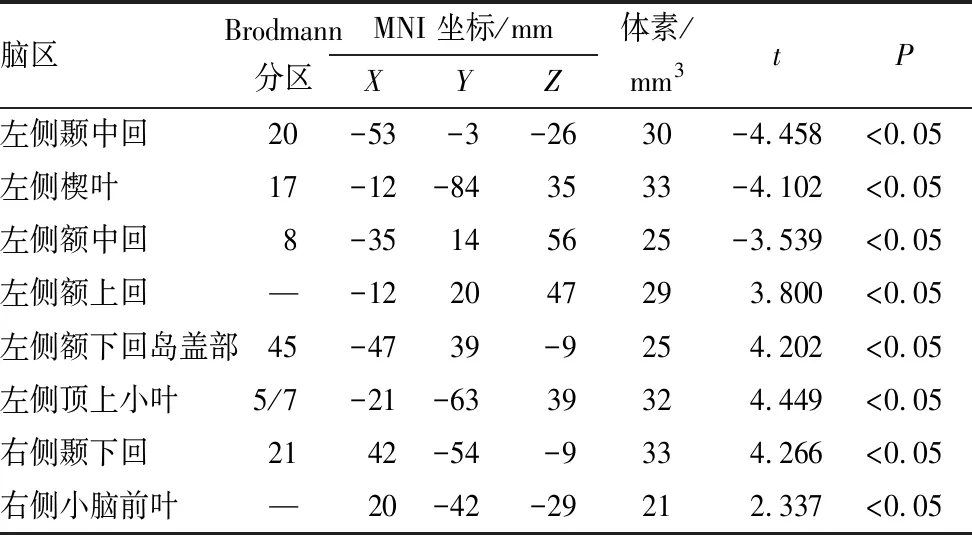
表1 单眼形觉剥夺性弱视组与正常对照组受检者相比GMV有显著变化的脑区
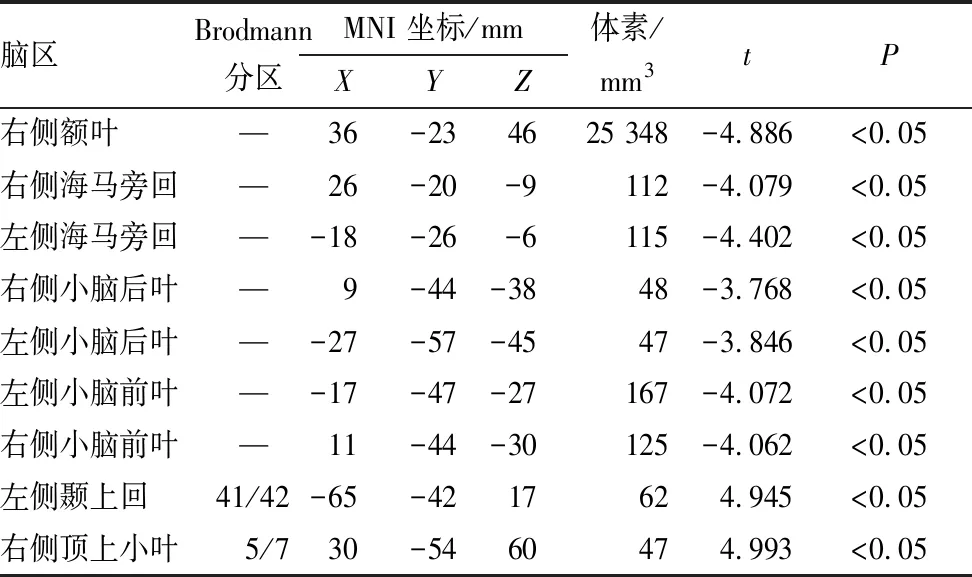
表2 双眼形觉剥夺性弱视组与正常对照组受检者相比GMV有显著变化的脑区

A、D:外侧面观;B:顶面观;C、F:内侧面观;E:底面观。红色区域代表双眼形觉剥夺性弱视组GMV增加的脑区,蓝色区域代表其GMV减少的脑区。t为统计学t值。图2 双眼形觉剥夺性弱视组与正常对照组受检者之间GMV有显著差异的脑区分布图
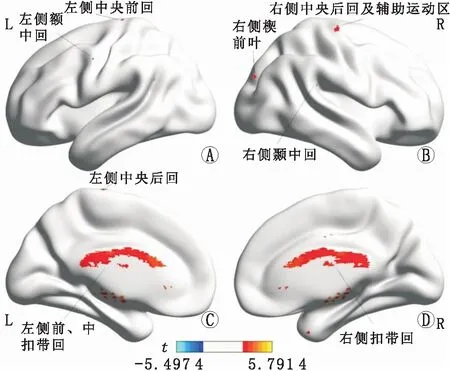
A、B:外侧面观;C、D:内侧面观。红色区域代表单眼形觉剥夺性弱视组GMV增加的脑区。t为统计学t值。图3 单、双眼形觉剥夺性弱视组患者之间GMV有显著差异的脑区分布图
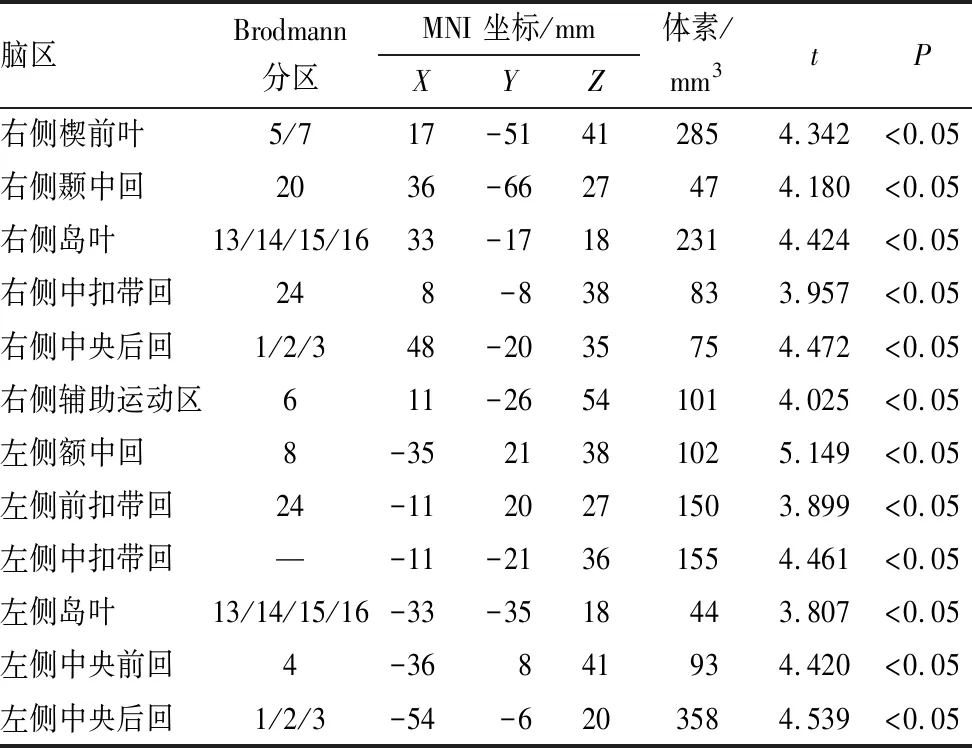
表3 单、双眼形觉剥夺性弱视组患者之间GMV有显著变化的脑区
3 讨论
非侵入性、高分辨率的结构像MRI使得活体研究大脑结构变化成为可能,VBM技术实现了对视觉系统相关疾病脑组织的形态学及病理学改变的直观显示和定量分析,为弱视发病机制的研究提供了新的方法。本研究是较早应用VBM技术来分析形觉剥夺性弱视儿童大脑GMV并进行单、双眼对比的研究,结果表明,形觉剥夺性弱视存在视觉皮层和其他高级皮层结构的改变,且单、双眼形觉剥夺性弱视的灰质变化具有差异性。
楔叶属于初级视觉皮层(V1区),是视觉信息加工的初步场所。本研究中单眼形觉剥夺性弱视儿童在左侧楔叶的GMV减少,表明单眼形觉剥夺性弱视存在V1区的损害,这与既往研究结果一致[11-12]。然而,本研究未发现双眼形觉剥夺性弱视组患者V1区GMV的减少,原因可能是该组儿童双眼视力接近,因此双眼发育不平衡和中枢抑制的情况较弱,与竞争机制引起的弱视改变不同。
视觉系统有两条独立的信息处理通路:背侧流起始于V1区,经过次级视皮层(V2区),进入背内侧区和中颞区(V5),抵达后顶叶皮质;腹侧流起始于V1区,经过V2区和视皮层第4区(V4区),进入下颞叶。颞中回是视觉背侧流的高级功能区,在视觉运动分析、空间位置、行为预测与执行中起着关键作用[13]。下颞叶是腹侧流的关键脑区,涉及物体、面孔和场景感知[14]。后顶叶皮层是处理多种感觉、运动信息的整合脑区,在视觉空间工作记忆中起着特殊作用,顶上小叶侧重注意力部署,顶下小叶侧重时空整合[15]。越来越多的研究发现弱视患者这些脑区功能的减弱[9,16]。本研究中,单眼形觉剥夺性弱视组患者在左侧颞中回的GMV减少,在右侧颞下回和左侧顶上小叶的GMV增加,双眼形觉剥夺性弱视在右侧顶上小叶的GMV增加,这些改变提示:(1)形觉剥夺性弱视的结构异常并不局限于V1区,也累及高级视觉皮层以及相连的视觉通路;(2)形觉剥夺性弱视的视觉功能障碍有其解剖学基础。
额上回参与高级信息处理,包括视觉引导的扫视序列、手眼协调和认知控制等相关过程。刘圣源等[8]和本研究均发现弱视在左侧额上回的GMV增加。额叶眼区位于额中回后部,控制眼球随意运动、眼跳和视觉注意[17]。本研究中双眼形觉剥夺性弱视组患者的右侧额叶存在广泛的GMV减少,单眼形觉剥夺性弱视组患者在左侧额中回的GMV减少,后者与谢晟等[11]和Xiao等[5]的研究结果一致。优势半球(左侧)额下回岛盖部包括运动性语言中枢(Broca区),与语音处理和复杂句法密切相关,优势半球(左侧)颞上回为听觉性言语中枢(Wernicke区),二者有双向神经活动[18],且听觉功能区中存在视觉-听觉交互作用[19],因此,我们推测单眼形觉剥夺性弱视在左侧额下回岛盖部、双眼形觉剥夺性弱视在左侧颞上回的GMV增加,可能是听觉和语言区域因视觉缺陷而出现代偿性增加。海马旁回位于枕叶和颞叶下方的内侧,是边缘系统的一部分,与认知、记忆、情绪和视觉空间处理有着重要的联系[20]。本研究中双眼形觉剥夺性弱视在双侧海马旁回的GMV增加,与Li等[12]的研究结果相反,差异的原因可能是后者未细分弱视类型。
小脑参与运动平衡和眼动控制,包括持续的追求眼球运动、注视和扫视,这种视觉运动的协调和控制有赖于脑-小脑网络连接及多个脑区间的功能连接[21]。本研究中,双眼形觉剥夺性弱视组患者在双侧小脑前叶、后叶的GMV减少,单眼形觉剥夺性弱视组患者在右侧小脑前叶的GMV增加,表明形觉剥夺性弱视组患者存在小脑结构的损害和代偿,且单、双眼形觉剥夺性弱视组患者的小脑变化不同。有研究发现屈光参差性弱视患者右侧小脑半球GMV增加[8],与本研究结果不尽相同,可能的原因是弱视类型不同,且前者未对小脑进行分区。
大脑皮层具有大量相互连接、相互作用的神经元,构成了区域间的大范围网络。已有研究发现除了视觉网络异常[22],弱视还存在默认网络、额顶控制网络及背侧注意网络等多个网络功能的异常[23]。后扣带回与楔前叶是默认模式网络的重要组成脑区,突显网络由前扣带皮层、双侧岛叶和前辅助运动区组成,感觉运动网络包括初级运动皮层、扣带皮层、前运动皮层和辅助运动区,还包括顶叶的初级感觉皮层。本研究中,与双眼形觉剥夺性弱视组患者相比,单眼形觉剥夺性弱视组患者在右侧楔前叶、右侧颞中回、右侧辅助运动区、左侧额中回、左侧前扣带回、左侧中央前回、双侧中扣带回、双侧岛叶和双侧中央后回的GMV增加。结果表明,与单眼形觉剥夺性弱视组患者相比,双眼形觉剥夺性弱视组患者在这些脑网络的皮质缺陷更重。
本研究还存在以下局限性:(1)由于儿童在检查过程中依从性差,每组的样本量并不大,未来需要扩大样本量来完善结果;(2)这是针对大脑结构变化的研究,尚未对应功能变化,应综合多模态MRI成像进行多角度的探索。这些局限性也是我们在今后研究中需要改进的方向。
4 结论
综上,本研究通过对形觉剥夺性弱视患者全脑灰质进行VBM分析,发现形觉剥夺性弱视患者脑皮层结构的改变不仅局限于V1区、高级视皮层,也涉及其他功能皮层及联络通路,且单、双侧弱视变化存在差异。本研究结果提示不同类型弱视的视功能障碍具有其解剖学基础,且应重视皮层间复杂的网络关系在弱视研究中的重要性。
