新疆部分地区环形泰勒虫Tams1基因型及遗传多样性分析
2023-07-14葛晓敏温丽翠缪荣浩李才善刘凯强陈宋琴郑会珍巴音查汗郭庆勇
葛晓敏 温丽翠 缪荣浩 李才善 刘凯强 陈宋琴 郑会珍 巴音查汗 郭庆勇
(新疆农业大学 动物医学学院,乌鲁木齐 830052)
环形泰勒虫(Theileriaannulata)是由璃眼蜱属传播的顶复门专性细胞内寄生虫,经蜱吸血时释放子孢子入侵并感染宿主白细胞,发育为裂殖体,成熟后由白细胞释放裂殖子感染红细胞形成梨形虫体[1]。环形泰勒虫在国内外分布广泛;其感染牛单核细胞/巨噬细胞、B淋巴细胞和红细胞,导致淋巴结肿大、体温升高、贫血和消瘦等,是造成致命性淋巴组织增生疾病的主要病原[2-3]。由于治疗成本高、抗蜱控制策略不完善和动物死亡率高等,环形泰勒虫病对养牛业造成较大的经济影响[4-5]。环形泰勒虫生命周期涉及宿主体内无性繁殖和媒介蜱体内有性繁殖阶段[1,6]。Tams1蛋白作为免疫显性主要裂殖子表面抗原能引发针对环形泰勒虫的保护性反应,并且Tams1编码基因已开发用于PCR检测[7]。Tams1多样性由无性繁殖时核苷酸的随机突变和生物学优势的变化而产生,且未表现出地理特异性,因此被用于ELISA检测等[8]。Tams1是由寄生虫单倍体基因组中的单个拷贝基因编码的,目前,尚无证据表明Tams1的多样性是由于基因家族成员的差异表达所致[9]。印度、伊朗和突尼斯先前也报道了基于环形泰勒虫Tams1基因的序列和系统发育分析[10]。研究Tams1的系统发育变异性和分子遗传特性有助于了解环形泰勒虫的分子进化史与新环形泰勒虫的出现、爆发与传播之间的关系。新疆环形泰勒虫病在多个地区发生不同程度的流行[11],本研究团队前期研究发现,近几年吐鲁番和阿勒泰等地区发病率持续增多,且夏季多发[12-13]。目前,新疆地区环形泰勒虫Tams1基因多应用于PCR检测及抗原制备阶段,尚未对其分型情况进行研究。
为初步了解新疆地区环形泰勒虫Tams1基因型及遗传多样性,本研究基于Tams1基因的检测方法对新疆4个地区的牛血DNA进行PCR检测,克隆测序获得环形泰勒虫Tams1序列,通过比对Tams1核苷酸和氨基酸序列,对环形泰勒虫Tams1基因型和遗传多样性进行分析。本研究有助于了解新疆地区不同环形泰勒虫种群的分布情况,并采取不同措施来防控环形泰勒虫病,为制定有效诊断方法分析提供理论依据。
1 材料与方法
1.1 血液DNA样品的采集和分离
2022年4~6月在新疆艾丁湖(吐鲁番)地区采集具有发热、体表淋巴结肿大、结膜黄染、贫血、呼吸衰竭及虚弱等临床症状的奶牛全血,将其置于含乙二胺四乙酸(EDTA)的5 mL抗凝管内,按照全式金基因组DNA提取试剂盒说明书提取牛全血基因组DNA,存于-20 ℃冰箱备用。此外,新疆农业大学动物医学学院寄生虫实验室保存了托克逊(吐鲁番)、青河(阿勒泰)、伊吾(哈密)地区的少量牛血DNA。
1.2 试剂及仪器
2×EcoTaq PCR Super Mix、DL-2000 Marker购自天根生化科技(北京)有限公司;血液DNA提取试剂盒购自北京全式金生物技术股份有限公司;PMD19-T、DH5α感受态细胞购自宝日医生物技术(北京)有限公司;PCR引物由生工生物工程(上海)股份有限公司合成。
PCR仪、紫外凝胶成像仪(型号为 Gel Doc2000)购自伯乐生命医学产品(上海)公司;
1.3 Tams1基因PCR扩增及测序
参考文献[10]中合成环形泰勒虫Tams1引物(F:5′-CCGTTAATGCTGCAAATGAGGAGG-3′;R:5′-GAGGCGAAGACTGCAAGGGGAG-3′)进行Tams1基因序列扩增,片段大小751 bp。PCR扩增体系为:2×EcoTaq PCR SuperMix 25 μL,上、下游引物(10 μmol/L)各2 μL,模板DNA 2 μL,加ddH2O至50 μL。PCR扩增程序为:95 ℃ 5 min,95 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,35个循环,72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,紫外凝胶仪下观察。选取不同地区阳性样品的Tams1产物克隆到PMD19-T载体并转化至感受态DH5α细胞,涂板选阳性单菌落培养并进行菌液PCR验证,每个样品选取PCR检测条带最亮的2管菌液提取质粒,送至生工生物工程(上海)股份有限公司测序。
1.4 Tams1基因序列的系统进化分析
将测序正确的新疆地区23条序列进行比对,从目的片段两端截短以获得同源核苷酸数据集[14],截短依据分别对应于环形泰勒虫(MF346014,India)基因序列的第13位和第745位。同时,在GenBank中下载别国已上传的Tams1序列,并根据文献[10]筛选印度地区已证实的不同基因型(G1~G3型)的9条序列共同构建系统进化树。
用MEGA7.0软件中Clustal W算法,设置基本参数:最大似然法(ML),Bootstrap值为1 000,Tamura-Nei(T92+G+I)模型(+G=0.297 6;+I=34.69%位点)对序列进行比对,将莱氏泰勒虫(LC430946,Iran)的MS-1基因序列作为外群。该分析涉及到47条核苷酸序列,最终数据集共有722个比对位置。
1.5 序列分析
为分析序列的变异,对新疆地区23条环形泰勒虫的Tams1基因序列比对分析。使用BioEdit7.0程序计算多序列比对及核苷酸和氨基酸同一性百分比。使用DnaSP6.0估计种群多样性指数和中性检验[15]。使用Network 10构建中值连接树来进行单倍型网络分析。本研究所有46条序列详细信息见表1。
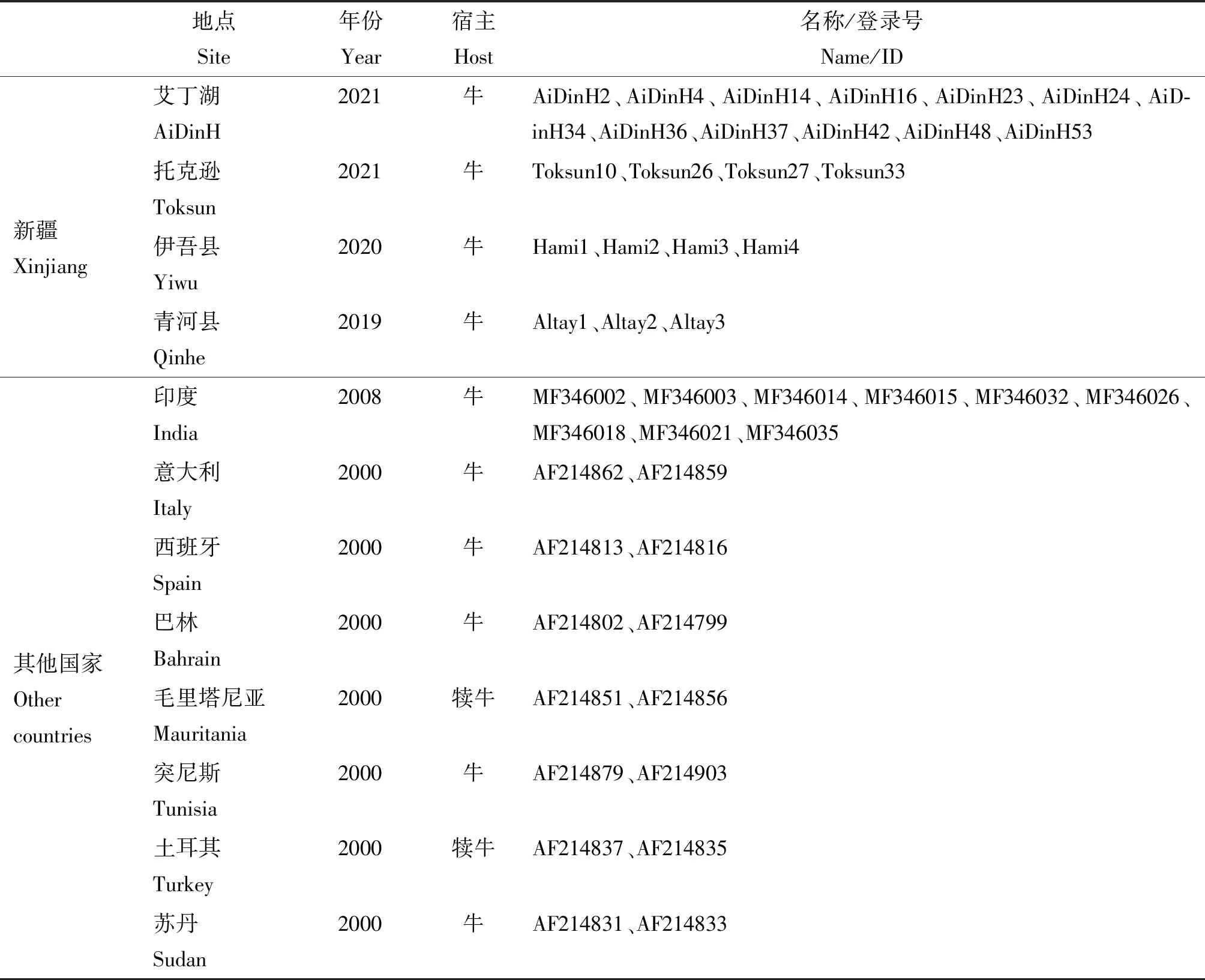
表1 Tams1分离株序列信息Table 1 Tams1 isolate sequences information
1.6 N-糖基化位点预测
糖蛋白的基本结构蛋白链与糖链通过共价键相连,蛋白链上连接糖链的位点称为糖基化位点(Glycosylation sites)。糖基化位点在确定相关蛋白质的特性方面具有重要作用,比如抗原特性等[11]。由于糖基化属于一种蛋白质翻译后修饰,因此本研究仅在氨基酸水平上预测潜在的糖基化位点。使用NetNGlyc Server在线网站将蛋白质氨基酸序列上传并预测序列中N-糖基化位点。
1.7 二级结构、同源性建模与抗原表位预测
使用几种蛋白质预测程序,即SOPMA、ExPASy、SignalP 5.1、EzMol等,预测环形泰勒虫Tams1基因序列的二级结构与抗原表位。使用SWISS-MODEL预测Tams1蛋白三级结构并自动同源模型。
2 结果与分析
2.1 Tams1基因PCR扩增
对环形泰勒虫Tams1基因扩增产物进行电泳,出现约751 bp的特异性条带且与预期片段大小一致(图1)。
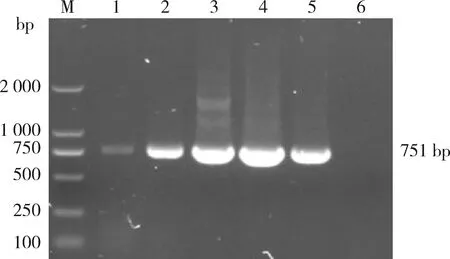
M:DNA标志物;1~5:扩增产物;6:阴性对照M:DNA Marker;1-5:Amplification products;6:Negative control
2.2 基于Tams1基因的多序列比对和系统发育分析
经测序证实后,通过最大似然法(ML)对Tams1基因核苷酸序列构建系统发育树(图2)。所有序列被分为两大支,在第一支中发现多系聚类,而第二支中仅包含2个聚类且与已报道的两类分型对应[10];可能由于所选择的建树参数有差异,因此第二支以92%相似性聚在一起;根据已报道的分型命名,G1、G2和G3基因型分别由40、3和3条序列组成,因此G1为主要基因型。新疆地区的23条序列,除伊吾地区2号样品序列被归为G3型,其余均属于G1型,因此本次采集的样本中环形泰勒虫Tams1基因G1型为主要基因型。所有3种基因型中未观察到地理从属关系。
2.3 环形泰勒虫Tams1基因序列分析
对新疆地区Tams1序列进行分析,在核苷酸与氨基酸水平上分别具有90.1%~100%(左下方)和83.9%~100%(右上方)的相似性,为方便呈现,表格仅展示部分序列(表2)。同时,发现整个共有序列中存在序列变异,尤其在核苷酸的168~217和479~528位置之间检测到广泛序列变异(图3),其中G2和G3在168~217位置序列一致性较高(橘色虚线框区域),而在479~528位置序列差异较显著(蓝色虚线框区域);该数据结果与系统进化树结果相对应。
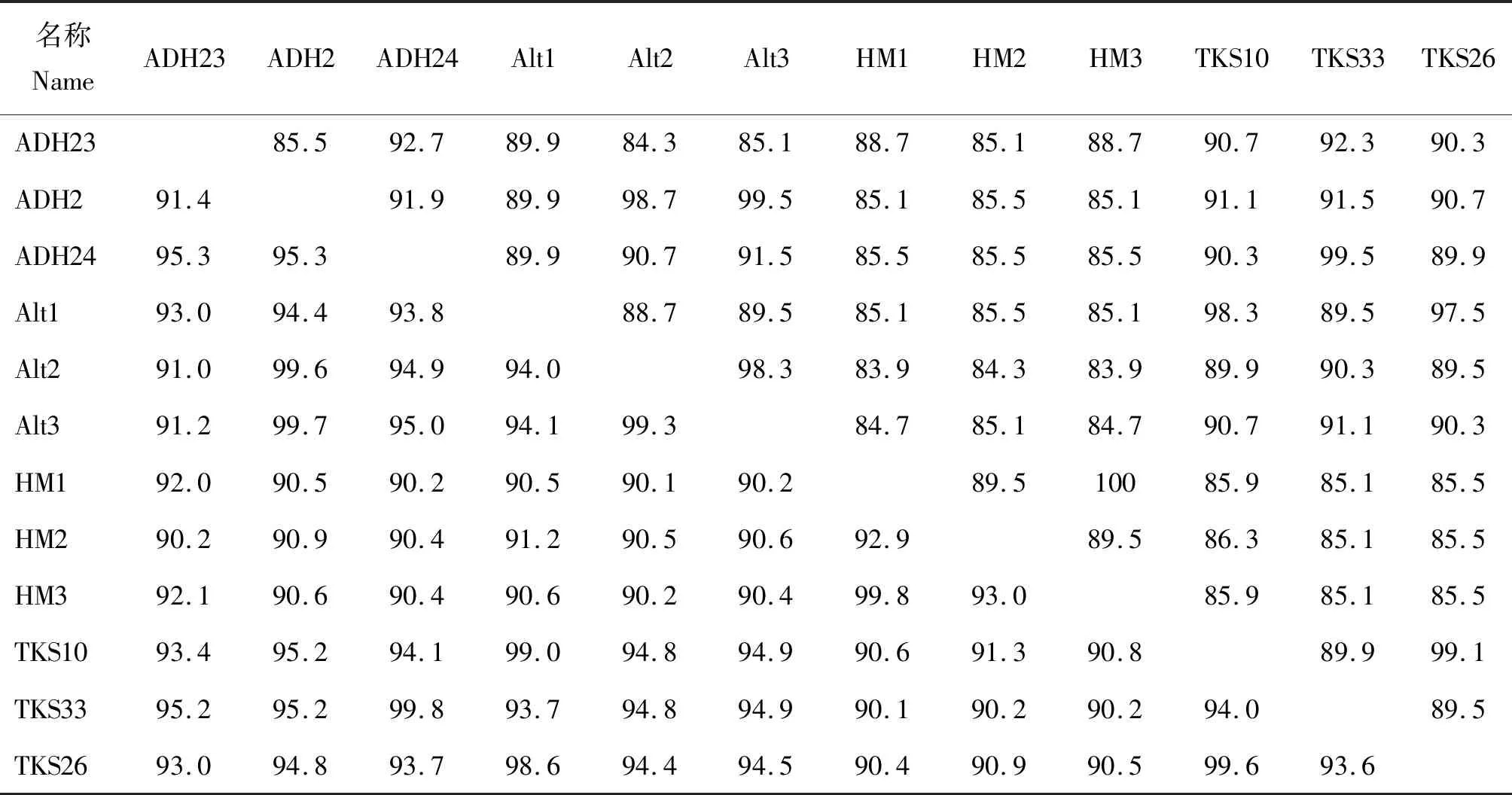
表2 环形泰勒虫新疆地方Tams1核苷酸和氨基酸序列的相似性Table 2 The similarity of nucleotide and amino acid sequences of Tams1 isolated from Xinjiang of T.annulata %
据上述分析发现新疆地区序列多属于G1型,因此,选取本研究所有序列共46条进行序列变异及中性测试指标分析,结果见表3。检测到高单倍型多样性(Hd)和低核苷酸多样性(π)。本研究的46条Tams1基因序列的总单倍型(Hd)和核苷酸多样性(π)分别为0.994±0.006和0.071±0.002。序列组合数据集的Hd>0.5,反映了较高的遗传多样性。任意2个序列之间的平均核苷酸差异数非常高(k=52.32)。在3种基因型中观察到了38个单倍型(h)。中值连接的单倍型网络共显示38种单倍型,其中一些单倍型由多个序列组成(圆圈大小)。与基因型1的单倍型相比,基因型2和3的单倍型彼此之间的关系更密切(图4)。此外,Tajima’s D和Fu-Li’s F检验总体数值大于零,表明该基因单倍型数大于多态位点个数,呈现平衡选择。
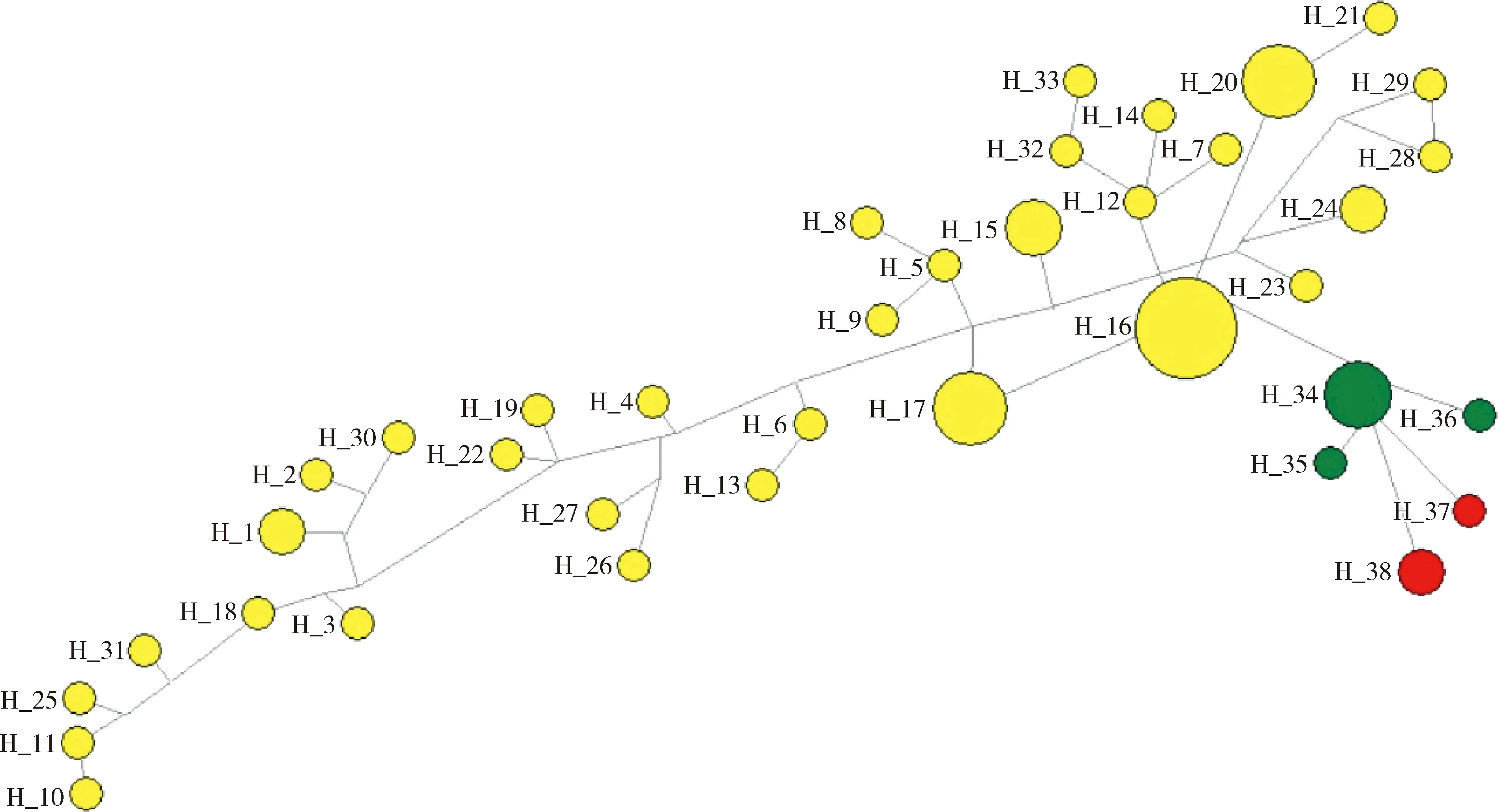
G1型:黄色圆圈;G2型:绿色圆圈;G3型:红色圆圈;圆圈大小:分离株的数量(成正比)。G1:Yellow circle;G2:Green circle;G3:Red circle;Circle size:Number of isolates (proportional).
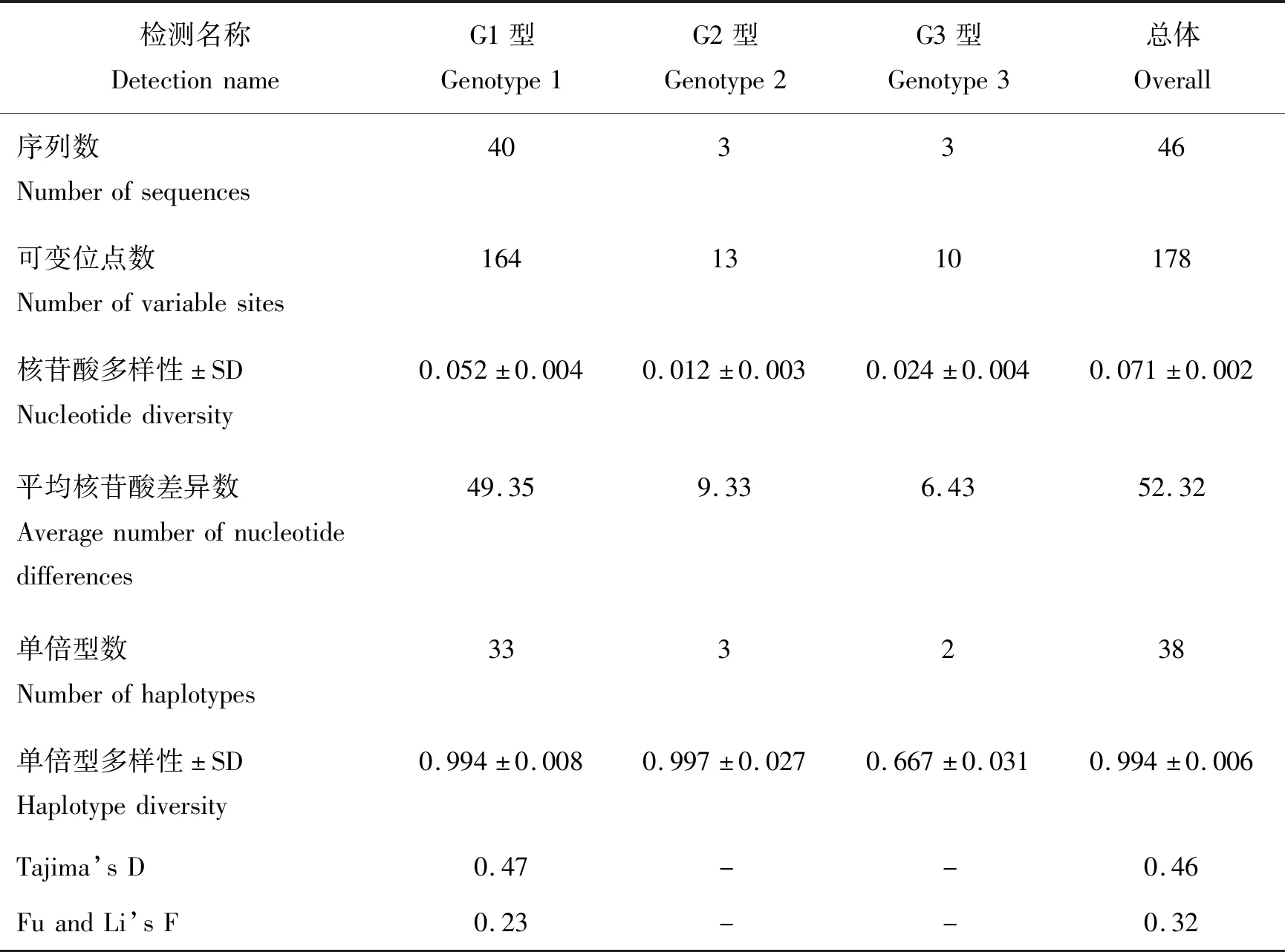
表3 Tams1基因型G1~G3的单倍型、核苷酸多样性和中性测试Table 3 Haplotype/nucleotide diversity and neutrality tests of genotypes G1-G3 based on the Tams1 gene
2.3.1环形泰勒虫Tams1基因型1(G1)
由新疆地区22条序列组成,且序列在核苷酸和氨基酸上相似性为97.6%~100%和96.3%~100%。该基因型的单倍型(Hd=0.994±0.008)和核苷酸(π=0.052±0.004)多样性最高;此外,具有最多的多态性位点(S=164)、单倍型数(h=33)及核苷酸差异数(k=49.35)。证实了G1基因型中存在最高的遗传多样性水平。Tajima’s D和Fu-Li’s F检验值大于零,表明是平衡选择(表3)。
2.3.2环形泰勒虫Tams1基因型2(G2)
本研究在新疆未检测到该型。由印度2条和意大利1条分离株组成,序列在核苷酸和氨基酸水平分别表现出98.0%~100%和86.1%~100%的相似性。G2型的Hd和π分别为0.997±0.027和0.012±0.003。S=13、h=3和k=9.33的数量表明该基因型存在中等水平的遗传多样性(表3)。
2.3.3环形泰勒虫Tams1基因型3(G3)
新疆伊吾地区2号样本序列为该型,同时还有印度2条分离株共同组成。G3型核苷酸和氨基酸水平分别表现出94.3%~100%和83.7%~100%的相似性。该型的Hd和π分别为0.667±0.031和0.024±0.004;S=10、h=2和k=6.43(表3)。
在线软件对N-糖基化位点预测结果显示新疆氨基酸序列含有潜在糖基化位点,但不包含信号肽,因此在体内糖基化可能不会被激活。
2.4 Tams1基因型分布情况
本研究发现环形泰勒虫最常见G1基因型在新疆多个地区存在,其中包括托克逊地区4条、艾丁湖地区12条、青河地区3条及伊吾地区3条序列;此外在国外各地区也分布广泛。G2型分布于意大利和印度不同地区。G3型分布有限,本研究仅发现伊吾地区1条序列和印度2株存在于该型(图2)。
2.5 Tams1蛋白特征分析和同源性建模
本研究翻译得到Tams1蛋白约为27.39 ku蛋白,含有249个氨基酸。由于不同位置的替换、添加和缺失,不同株氨基酸序列在整个序列比对中表现出较大的差异。在每个基因型内相互比对筛选遗传差异性较典型的序列,之后对所选的3个基因型间的序列进行比对(图5)。结果显示,在氨基酸N端位置27~52、138~175和180~196这3个区域存在广泛变异,基因型间鉴定出52个出现变异的特征碱基。Tams1蛋白二级结构分析预计存在7个α螺旋和17个β折叠(图6(a)),该蛋白不存在跨膜区和信号肽。使用IEDB Analysis Resource在线网站预测Tams1蛋白B细胞抗原表位,结果显示抗原性较好,根据预测结果,以Mycoplasmapneumoniae粘附素1为模板对Tams1蛋白3D结构同源建模(图6(b)),并使用EzMol网站对Tams1蛋白同源3D模型进行抗原表位标记(图7)。
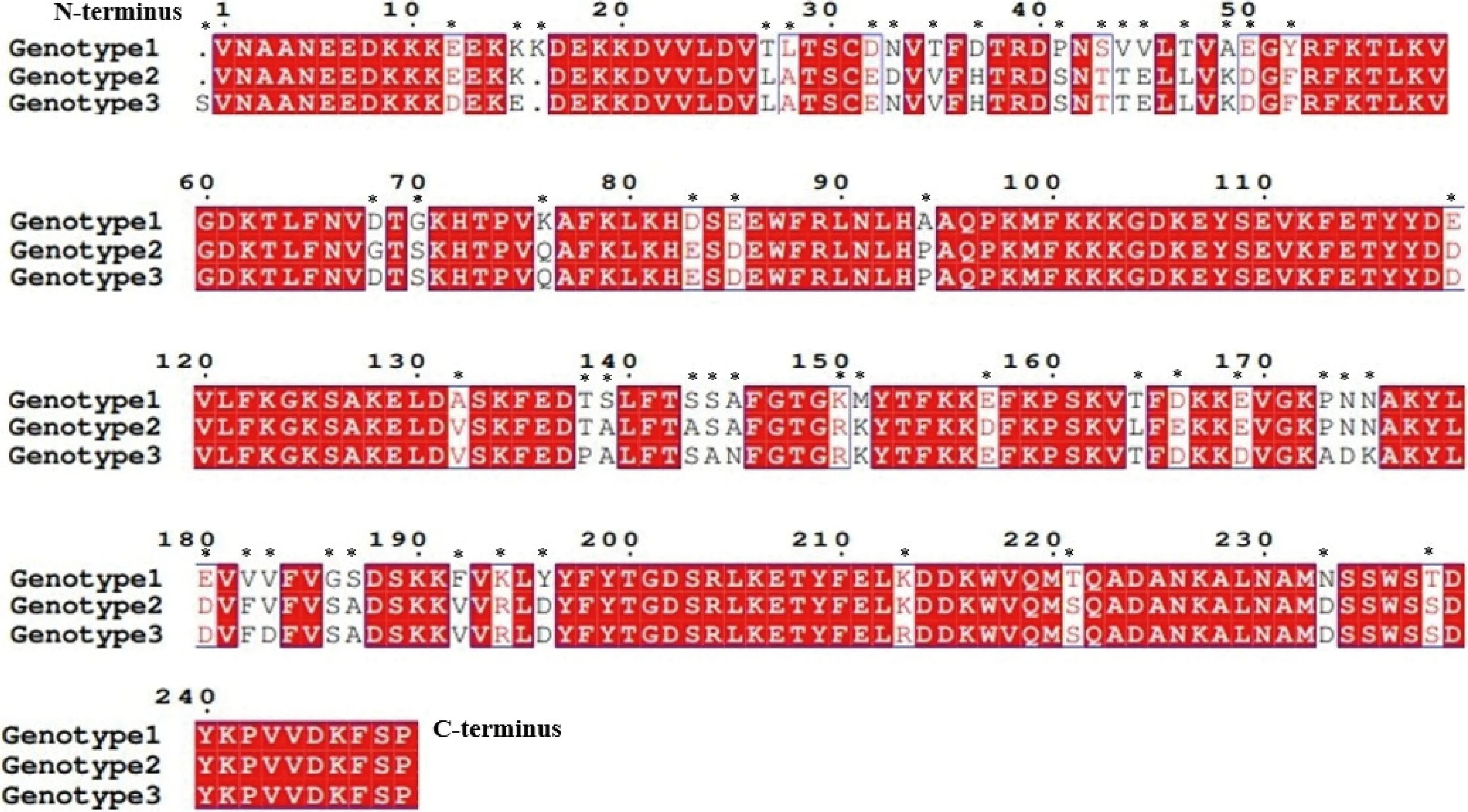
*表示出现变异的氨基酸。* Indicates the mutated amino acid.
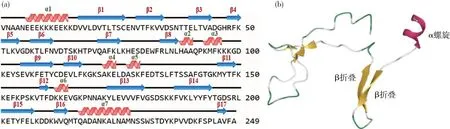
图6 Tams1蛋白质二级结构(a)及同源模型(b)Fig.6 Secondary structure (a) and homology model (b) of Tams1 protein
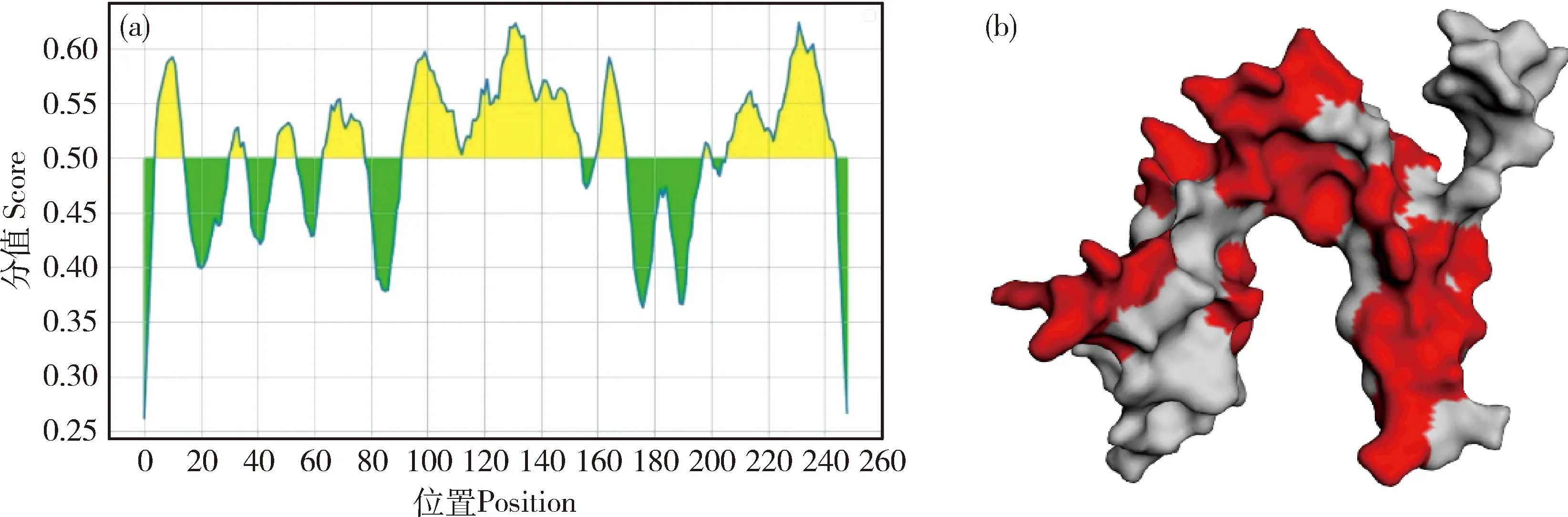
(a)B细胞抗原表位预测;(b)Tams1蛋白3D模型:抗原位点标记(红色区域)(a) B cell epitope prediction;(b) Tams1 protein 3D model:antigen site marker (red areas)
3 讨 论
环形泰勒虫感染会造成牛较高的发病率和死亡率,导致重大经济损失,是影响新疆牛养殖业发展的原因之一。轻微感染时一般染虫率较低且无明显临床症状,常规检查难于发现,通常采用核酸检测技术。然而,近几年有学者猜测针对环形泰勒虫特定地方株的基于Tams1基因诊断工具可能无法准确检测到其他分离株[16]。研究顶复门寄生虫如何通过适应新的宿主物种而进化,并确定此类进化是否以低频率或高频率发生很有意义。为了建立新型的控制措施并评估其有效性,需要有关环形泰勒虫的遗传多样性和种群结构的信息。因此,本研究分析新疆部分地区环形泰勒虫的遗传多样性。
研究表明,Tams1基因为高度多态性,是用于环形泰勒虫抗原多样性研究的候选基因[17-18],该基因作为一种免疫显性表面抗原[8],已被报道用于疫苗研发[19]、ELISA诊断[20-21]及PCR分子诊断[22-23]等方面。尽管国外有针对环形泰勒虫研发的疫苗[24-27],但在印度近几年也常有报道环形泰勒虫病,其中患病率最高的地区可达66.67%,此外秋季发病率占53%[28-30]。环形泰勒虫株间的遗传多样性可能是未能控制该疾病的原因之一[18]。有报道病毒、细菌、立克次体和原生动物抗原基因通过正向选择氨基酸取代和基因内重组来产生多样性[9,31-32]。
本研究检测新疆地区23条环形泰勒虫序列,除伊吾地区2号样品序列被归为G3型,其余均为G1型。根据系统发育分析,所选环形泰勒虫序列存在3种不同基因型。此外,之前有基于Tams1基因报道在印度存在1种或2种分型情况[8,18]。本研究也展示了Tams1多样性的存在,Tams1基因型的遗传多样性指数,即S、π、k、h和Hd以及Tajima’s D和Fu-Li’s F进一步证实了这一点。G1、G2和G3基因型以及总体数据的Hd值均大于0.5,反映了较高的遗传多样性。G1型Tajima’s D和Fu-Li’s F的正值表明种群规模减少和/或高频的几个等位基因平衡选择,这意味着高核苷酸变异。此外,单倍型网络分析产生38个单倍型,G1、G2和G3型分别由33、3和2个单倍型组成;其中G1型与其他型相比具有更丰富的多样性及异质性。未检测到基因型的地理特异性,且在不同的地理区域中存在几乎相同的序列;造成这种情况的原因可能与不同国家之间的动物进出口贸易有关,此外,新疆地区主要为G1型为主,推测可能与采样地大多为本地养殖有关。环形泰勒虫是通过璃眼蜱属传播后等位基因的随机分配、基因间和基因内的重组、交叉及生物学优先级选择而发生变异[33]。在其他密切相关的寄生虫中也提出了类似机制,即恶性疟原虫[34]和肉孢子虫[35]。鉴于基因的遗传多样性有助于寄生虫逃避宿主免疫反应,因此通常认为这种现象是积极选择的结果[36]。
本研究Tams1蛋白大小约27.39 ku,含有249个氨基酸;二级结构分析预计存在7个α螺旋和17个β折叠,不存在跨膜区和信号肽,含有可能不会被激活的潜在糖基化位点;经预测该蛋白具有良好的抗原性,且抗原位点多位于表面,利于宿主免疫系统识别与捕捉,然而,本研究证实了Tams1基因存在多样性,其抗原位点可能会发生改变,推测环形泰勒虫可能会因此逃避宿主免疫。尽管Tams1序列高度可变,但典型泰勒虫物种的Tams1和mMPSA[37]氨基酸序列似乎是保守的,因此,猜测保守区发挥功能/结构作用,而可变区暴露于免疫反应[9]。针对可变结构域(V4)开发的抗体可以阻断针对参与加工和入侵的保守结构域的抗体的保护作用[9]。目前,通过使用活疫苗可以有效控制和预防由环状泰勒虫和小泰勒虫引起的热带泰勒虫病。Muguga cocktail疫苗被称为活子孢子疫苗,许多非洲国家已用于控制由泰勒虫引起的牛的东海岸发热病[38]。此外,摩洛哥,以色列,伊朗,印度和突尼斯已有效地使用针对环形泰勒虫病基于裂殖体的减毒活疫苗[39]。由于采样数量及地区有限,不能对其遗传多样性进行全面的概述,未来可能需要对新疆更多地区环形泰勒虫进行大规模的遗传多样性研究,以采取有效措施控制该疾病,同时检测环形泰勒虫Tams1是否存在其他新基因型;此外,不同基因型和遗传多样性是否与致病特性存在相关性,还需要进一步研究。
4 结 论
通过对新疆部分地区环形泰勒虫Tams1存在的基因型及遗传多样性进行初步研究,发现所选采样地区环形泰勒虫存在基因分型情况,其中以G1型为主,仅发现一条G3型序列;根据S、π、k、h、Hd以及Tajima’s D和Fu-Li’s F等指数进一步证实Tams1基因有较高的遗传多样性,本研究为后续研究环形泰勒虫基因型及如何逃避宿主免疫提供基础方法与理论。
