长期不同种植制度下植烟土壤细菌群落特征差异分析
2023-07-14方远鹏白羽祥徐照丽邓小鹏
方远鹏 王 娜 白羽祥 王 戈 徐照丽 邓小鹏 杜 宇 周 鹏*
(1.云南农业大学 烟草学院,昆明 650201;2.云南省烟草农业科学研究院 烟草农艺研究中心,昆明 650021)
云南省是我国烟叶主产区,部分地区由于种植制度不合理(如长期连作),导致烤烟土壤理化性状恶化、养分比例失调、微生物群落特征明显改变[1-2];同时这些环境因子相互作用对土壤环境产生综合影响,造成烤烟连作障碍,导致病虫害加剧和植株的减产降质,严重影响了烤烟生产的可持续发展[3]。轮作是缓解连作障碍,提高经济和生态效益的重要方法。玉米与烤烟轮作可以提高土壤中酸性细菌和放线菌的丰富度,从而控制烟草枯萎病的发作[4];大蒜与烤烟轮作可以降低烟草黑胫病的发生和危害程度[5];烤烟-苕子-水稻的轮作模式可以促进微生物繁衍,改善土壤生态环境,从而减轻土壤病虫害的发生[6]。由此可见,合理的种植制度可以有效地改善土壤环境,控制病虫害的发生,有助于烤烟生产的可持续发展。
土壤是作物生长发育的基本条件,其中土壤养分可为植物生长提供所需的营养元素,其速效养分含量的高低是土壤肥力供给的衡量标准之一[7]。土壤酶是土壤的一个重要组分,参与包括土壤生物化学过程在内的自然界物质循环,对土壤肥力的形成过程具有重要作用[8]。大量研究表明,土壤中的酶活性和速效养分含量受种植制度的影响较大[9-10],例如烤烟连作5年后土壤碱解氮和速效磷含量呈不同程度的增加,同时还降低了土壤过氧化氢酶和蔗糖酶的活性[11];烤烟长期连作或轮作后,土壤速效养分含量存在明显差异,其中轮作降低了土壤的速效磷、速效钾含量,与连作相比,烤烟轮作提高了土壤脲酶和蔗糖酶活性,同时轮作还增加了土壤中有益细菌类群数量,尤其是杆菌类细菌[12]。此外,土壤理化性质和酶活性的变化也受根系分泌物以及土壤微生物群落的影响[13-14]。
土壤微生物是生态系统中最重要的生物群落之一,在促进土壤物质循环、维持土壤生态系统稳定性及可持续性方面发挥着重要的作用[15],而土壤细菌在土壤微生物类群中占主要部分,它在植物根系的微生态环境中对物质和能量的转化起着重要作用[16]。不同的种植模式对土壤微环境的影响不同,进而改变了土壤细菌群落结构[17]。目前,短期连作或轮作对植烟土壤细菌群落影响的研究较多[18-19],而长期定位试验研究相对较少,针对植烟土壤细菌群落与微生态环境因子间的内在联系的研究尚未见报道。本试验在长期定位试验点分别收集不同种植制度土壤样品,通过16S rRNA高通量测序技术测定分析土壤细菌群落的组成、结构、多样性等,旨在探讨长期不同烟草种植制度对土壤微生态环境的影响特征及其各因子间的内在联系,以期为优化烤烟种植制度提供参考。
1 材料与方法
1.1 试验概况
试验地点位于云南省烟草科学研究院玉溪研和基地(24°23′63″ N,102°49′98″ E),海拔1 635 m,土壤类型为红壤,气候条件为亚热带湿润季风气候,年平均气温17.4~23.8 ℃,年平均降水量670.80~1 500.20 mm,年平均无霜期146.2~168.3 d,其土壤基础肥力为pH 6.72、有机质16.24 g/kg、全氮0.97 g/kg、全磷0.79 g/kg、全钾4.96 g/kg、碱解氮67.53 mg/kg、速效磷48.37 mg/kg、速效钾175.01 mg/kg。2011年在基地选取0.2 hm2地块,均分,分别进行长期不同种植制度定点试验,主要包括撂荒地(Abandoned Land,AL)、烤烟连作(Continuous cropping of flue-cured tobacco,CC)、烤烟-玉米轮作(Flue-cured tobacco-Corn rotation,CR)。2021年8月15日在长期定位试验点的3种不同种植制度地块进行土壤取样,该区域土地由云南省烟草农业科学研究院负责管理,各地块作物种植及施肥详细信息见表1,试验地所施肥料由管理单位提供,其他栽培管理措施统一按照当地常规生产技术进行。
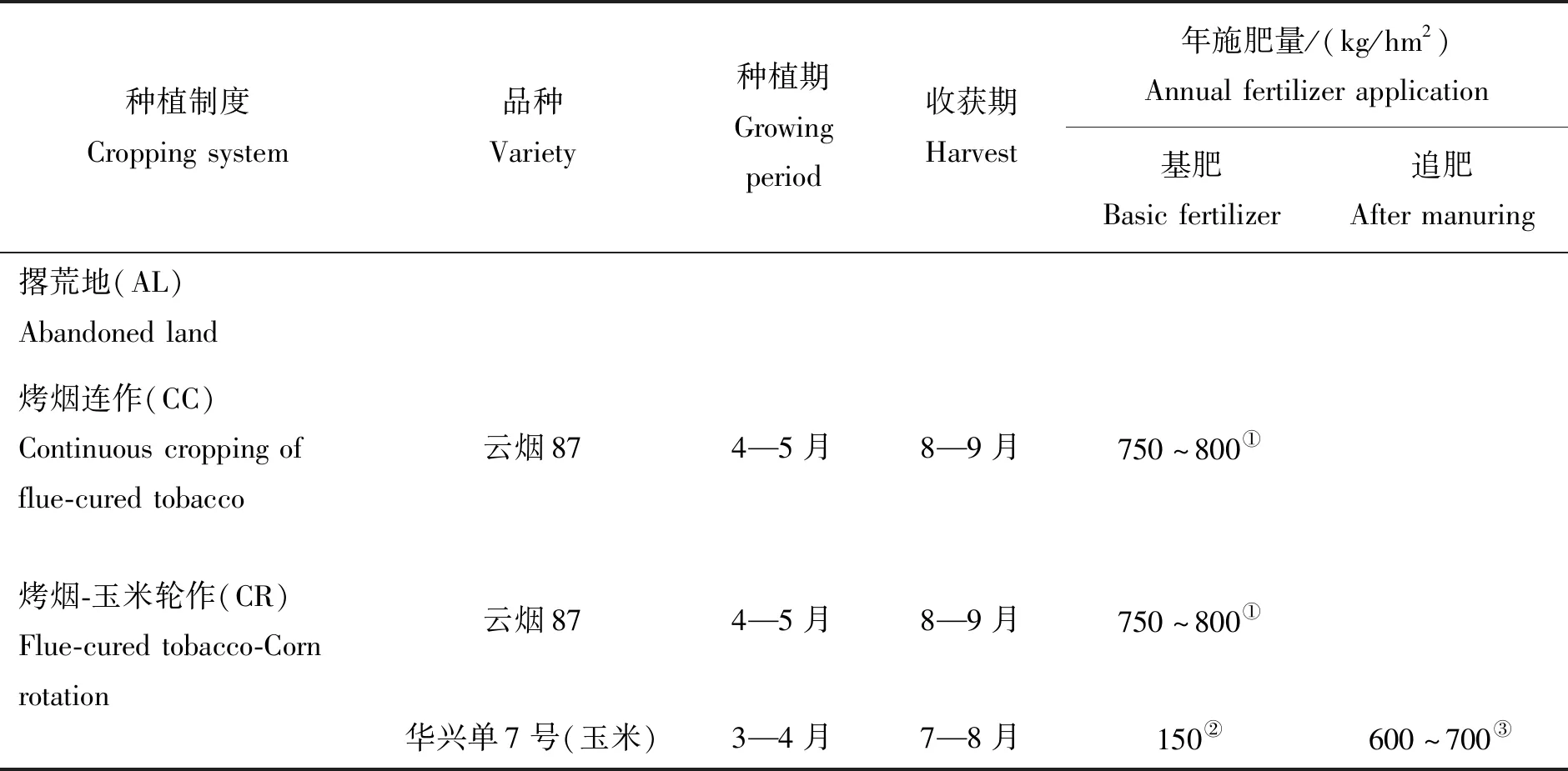
表1 2011—2021年取样地基本信息Table 1 Basic information of sampling sites from 2011 to 2021
1.2 土样采集
于2021年8月15日(烤烟成熟期)在每个地块随机选取3个点,采用抖根法采集根际土样,样品去除植物残体及其他杂质后,将同一地块的多点取样土壤样本按照四分法混合均匀后分为2份,一份放入无菌冻存管中,置于液氮内速冻,然后置于-80 ℃超低温冰箱中保存,用于土壤细菌群落测定;另一份放入自封袋中,取回待风干后过2 mm筛,用于土壤理化性状和酶活性的测定。
1.3 测定项目及方法
1.3.1土壤化学指标测定
土壤化学指标的测定方法,pH测定采用美国SPECTRUM公司的IQ150 pH仪,有机质、全氮、全磷、全钾、碱解氮、速效磷、速效钾含量的测定参考《土壤农化分析》[20]。每个测定指标均设置3次重复。
1.3.2土壤酶活性测定
过氧化氢酶活性(CAT)、蔗糖酶活性、脲酶活性和磷酸酶活性的测定参考梅守荣等[21]方法,试剂盒购买于深圳市华夏准测检测技术有限公司。每个指标测定均设置3次重复。
1.3.3土壤细菌群落结构和多样性测定
使用Power Soil DNA提取试剂盒(型号D3142,广州美基生物科技有限公司),从1.0 g土壤样本中提取基因组DNA;用Nanorop微量分光光度计(型号DYY-6C,北京六一仪器公司)检测DNA浓度和纯度;用0.8%琼脂糖凝胶电泳检测DNA样品是否降解及有无杂质。经DNA浓度和纯度检测后(DNA浓度≥20 ng/μL,总量≥500 ng,A260/280为1.8~2.0,基因组DNA经凝胶电泳后呈单一条带),利用PCR仪(型号ETC811,东胜兴业科学仪器有限公司)对细菌16S rRNA基因进行PCR引物扩增,扩增引物为515F(5′-GTGYCAGCMGCCG-CGGTAA-3′)和806R(5′-GGACTACNVGGGT-WTCTAAT-3′)。每个样本3次重复,获得扩增产物后,进一步通过AMPure XP Beads(型号A63880,美国贝克曼库尔特公司)进行PCR产物纯化,用ABI Stepone Plus Real-Time PCR System(型号ABI7900,美国应用生物系统公司)进行定量,根据Novaseq 6000的PE250模式pooling上机测序。使用SILVA 16S数据库作为细菌参考数据库,将过滤后的Tags进行拼接,以97%的相似度为界,聚类成可操作分类单元(Operational Taxonomic Units,OTUs),并对OTUs代表性序列进行注释[22]。
1.4 数据处理及统计分析
试验数据初步处理采用Microsoft Excel 2010 软件进行;利用IBM SPSS Statistics 24.0软件对土壤理化性质、酶活性及细菌群落进行单因素方差分析(One-way ANOVA)、Duncan法多重比较分析以及Pearson相关性分析;在Omicshare平台(https:∥www.omicshare.com/tools/home/task/index.html)和Galaxy(http:∥huttenhower.sph.harvard.edu/galaxy/root?tool_id=PICRUSt_normalize)平台分别对土壤细菌数据进行韦恩图分析(Venn diagram)、主成分分析(Principal Component Analysis,PCA)和线性判别分析(Linear discriminant analysis Effect Size,LEfSe);利用Canoco 5.0软件进行冗余分析(Redundancy Analysis,RDA)。
2 结果分析
2.1 不同种植制度下土壤理化性状
由表2可知,各种植制度土壤的pH和有机质、碱解氮含量无显著差异(P>0.05)。相较AL土壤,CC、CR土壤的全氮、全磷、全钾、速效磷、速效钾含量均有一定升幅,其中CC土壤中的速效钾含量显著升高108.06 mg/kg(P<0.05),而轮作仅升高3.25 mg/kg(P>0.05)。综上,耕作条件(CC和CR)下土壤养分含量均升高,其中连作条件(CC)下土壤速效钾含量显著富集。

表2 不同种植制度土壤理化性质Table 2 Physical and chemical properties of soil under different cropping systems
2.2 不同种植制度下土壤酶活性差异
由表3可知,各种植制度土壤中的脲酶、蔗糖酶活性均无显著差异(P>0.05),而磷酸酶、过氧化氢酶活性差异显著(P<0.05)。相较AL土壤,磷酸酶活性在CC、CR土壤中分别增加64.34%和51.24%;过氧化氢酶活性在CC土壤中增加50.06%,而在CR土壤中降低39.84%。说明不同种植制度对土壤酶活性影响存在差异,其中过氧化氢酶表现最为敏感。

表3 不同种植制度土壤酶活性变化Table 3 Changes of soil enzyme activities in different cropping systems
2.3 不同种植制度下土壤细菌DNA测序结果分析
由图1可知,不同种植制度土壤样品中,共得到有效序列921 534条,质控过滤和去除嵌合体后得到691 734条优质序列。依据物种Venn图分析所有样品测得总的OTU(Operational Taxonomic Unit)数目为12 958个,其中共有的OTU数为3 966个,约占总数的30.61%。AL土壤中特有的OTU数目为889个,约占6.86%;CC土壤中特有OTU数目为1 208个,约占9.32%;CR土壤中特有OTU数目为1 772个,约占13.67%(图1(a))。从图1(b)可以看出,各种植制度下土壤中OTU分布数目由大到小为:CR>CC>AL。

图1 不同种植制度下土壤细菌OTU数量比较Fig.1 Comparison of OTU quantity of soil bacteria under different cropping systems
2.4 细菌群落结构与多样性变化特征分析
2.4.1细菌门水平结构变化
由图2可知,3种种植制度土壤样品共检测出50个菌门,其中AL土壤45个,CC土壤43个,CR土壤49个。将相对丰度最大的前10种进行比较分析发现,它们共有的相对丰度最大的前5个优势菌门均为:变形菌门(Proteobacteria,占总量的30.35%~35.20%),放线菌门(Actinobacteria,占总量的13.33%~21.82%),酸杆菌门(Acidobacteria,占总量的11.23%~13.93%),拟杆菌门(Bacteroidetes,占总量的6.44%~8.41%),绿弯菌门(Chloroflexi,占总量的4.53%~8.93%),5个菌门共占总量的65.88%~88.29%。其中放线菌门(Actinobacteria)的相对丰度在CC土壤中最高,绿弯菌门(Chloroflexi)的相对丰度在CR土壤中最高。总体来看,不同种植制度下土壤细菌群落在门水平组成上相似,但少数菌门相对丰度存在差异。

图2 门水平细菌的相对丰度分析Fig.2 Analysis of relative abundance of phylum level bacteria
2.4.2细菌属水平结构变化
由表4可知,各种植制度下土壤样品在属水平上共检出733个菌属,其中AL土壤469个属,CC土壤509个属,CR土壤547个属。部分细菌属的相对丰度在各土壤中存在显著差异(P<0.05),其中,CC和CR土壤中的鞘脂单胞菌属(Sphingomonas)、苔藓杆菌属(Bryobacter)相对丰度均显著高于AL土壤;CC土壤中的假节杆菌属(Pseudarthrobacter)、链霉菌属(Streptomyces)、类诺卡氏菌属(Nocardioides)、阿尔达杆菌属(Adhaeribacter)相对丰度显著高于AL和CR土壤,而CR土壤中的赭黄嗜盐囊属(Haliangium)相对丰度显著高于AL和CC土壤。AL、CC和CR土壤中最丰富的细菌属分别为Sphingomonas、Pseudarthrobacter和Haliangium,相对丰度分别为1.28%、4.19%和2.45%。土壤细菌群落结构热图分析表明(图3),土壤细菌群落共被划分为3大类,分别为AL、CC、CR土壤,相较AL土壤,CC与CR土壤细菌群落结构具有一定相似性,但在优势细菌属组成上存在较大差别。AL土壤优势菌属为黄杆菌属(Flavobacterium)、H16属、土微菌属(Pedomicrobium)、胸腺杆菌属(Steroidobacter)等,CC土壤优势菌属为Pseudarthrobacter、芽孢八叠球菌属(Sporosarcina)、Nocardioide等,CR土壤优势菌属为Haliangium、Flavisolibacter、地杆菌属(Geobacter)、芽单胞菌属(Gemmatimonas)等。

1、2、3代表每个种植制度下土壤的3个平行样。1,2 and 3 represent 3 parallel samples of soil under each cropping system,respectively.

表4 不同种制度下土壤主要细菌属相对丰度差异Table 4 Differences in the relative abundance of main bacterial genera in soil under different species systems %
2.4.3细菌Alpha多样性变化
由图4可知,16S rRNA 扩增子测序的覆盖率(Goods coverage)均在97%以上,表明测序结果符合所取土壤样本中微生物的实际情况,且测序的长度符合后续分析要求。相较AL土壤,CC、CR土壤细菌的Chao1、ACE、Observed species及Shannon均表现出显著升高的趋势(P<0.05),且以CR土壤变化更为显著。综上,CC、CR土壤细菌群落多样性和丰富度均显著高于AL,CR土壤细菌群落多样性和丰富度最高。

不同小写字母表示各种植制度间差异显著(P<0.05)。Different lowercase letters indicate significant differences between cropping systems (P<0.05).
2.4.4细菌Beta多样性变化
由图5可知,对不同种植制度土壤细菌进行PCA分析,PC1和PC2分别解释了细菌总变异数的53.87%和29.21%,共计83.08%,说明上述2个主成分可反映各处理土壤样品细菌群落结构信息。3种种植制度下土壤细菌群落分别置于3个不同的区间,说明不同种植制度下土壤细菌群落结构存在明显差异,但CC和CR处在PC1的正半轴,CC和AL处在PC2的负半轴,这又说明其存在一定的相似性。综上,相较AL,其他2种种植制度对土壤细菌群落结构影响存在差异,且CR较CC影响更大。

图5 细菌群落结构的PCA分析Fig.5 PCA analysis of bacterial community structure
2.5 不同种植制度下土壤细菌群落物种差异分析
由图6可知,通过LEfSe分析确定各分类水平上具有显著差异的物种及其效益大小。3种种植制度土壤中共有18个细菌分支的相对丰度表现出显著差异(P<0.05)。其中,AL土壤存在5个相对丰度差异显著的细菌分支,主要包括互营杆菌目(Syntrophobacterales)、微杆菌科(Microbacteriaceae)、互营菌科(Syntrophaceae)、壤霉菌属(Agromyces)、unidentified_Syntrophaceae;CC土壤中存在2个相对丰度差异显著的细菌分支,主要包括Micrococcaceae和Pseudarthrobacter;CR土壤存在11个相对丰度差异显著的细菌分支,主要包括噬几丁质科(Chitinophagaceae)、黏球菌目(Myxococcales)、Flavisolibacter、Haliangium、Haliangiaceae科等。AL、CC、CR土壤中相对丰度差异最显著的细菌分支分别为互营杆菌纲(Syntrophobacterales)、Pseudarthrobacter、Haliangium。

o、f、g分别代表目、科、属;5个大圆圈由内至外依次为门、纲、目、科、属,小圆圈大小代表该分类水平下该物种相对丰度大小;无显著差异物种标记为黄色,有显著差异物种以着色标记。o,f and g represent order,family and genus,respectively.The five large circles are phylum,class,order,family and genus from the inside out,and the small circle size represents the relative abundance of the species at the taxonomic level.Species with no significant difference are marked in yellow,while species with significant difference are marked in color.
2.6 土壤细菌群落与环境因子间相关性分析
2.6.1土壤主要细菌属和环境因子RDA分析
由图7可知,3种种植制度土壤中共发现4个理化指标差异显著和2个酶活性差异显著,将其与土壤细菌属水平主要物种作RDA分析。环境因子对细菌群落结构的解释量为77.13%,其中,第一排序轴的解释变量为43.47%,第二排序轴的解释变量为33.65%,表明环境因子在较大程度上可以解释土壤细菌群落的差异。第一轴上,土壤速效钾(AK)、速效磷(AP)、全磷(TP)含量及其磷酸酶活性(ACP)是主要的影响因子,第二轴上,土壤全钾(TK)含量及其CAT活性是主要的影响因子。综合来看,对土壤细菌群落分布具显著影响的因子为土壤AK含量及CAT、磷酸酶(ACP)(P<0.05),其R2分别为0.83、0.90、0.92。

蓝线表示土壤主要细菌属,红线表示土壤主要环境因子。TP,全磷;TK,全钾;AP,有效磷;AK,速效钾;ACP,磷酸酶;CAT,过氧化氢酶。下同。The blue line represents the major soil bacteria genera,and the red line represents the major soil environmental factors.TP,total phosphorus;TK,total potassium;AP,available phosphorus;AK,available potassium;ACP,phosphatase;CAT,catalase.The same below.
2.6.2土壤环境因子与优势菌属的相关性分析
由表5可知,全磷(TP)、全钾(TK)含量与Flavisolibacter、Gemmatimonas的相对丰度呈极显著正相关,与Agromyces的相对丰度呈极显著负相关(P<0.01);AK含量与Pseudarthrobacter的相对丰度呈极显著正相关(P<0.01),与Haliangium的相对丰度呈显著负相关(P<0.05);AP含量与Pseudarthrobacter、Gemmatimonas的相对丰度呈显著正相关(P<0.05),与unidentified_Syntrophaceae的相对丰度呈极显著负相关(P<0.01);CAT活性与Pseudarthrobacter的相对丰度呈极显著正相关,与Haliangium、Geobacter的相对丰度呈极显著负相关(P<0.01);ACP活性与Pseudarthrobacter的相对丰度呈显著正相关(P<0.05)。结合RDA分析结果,土壤中主要环境因子与优势菌属的相对丰度间存在较强相关性,其中以AK、CAT活性对土壤细菌群落分布影响较大。

表5 优势菌属与环境因子间的Pearson相关性Table 5 Pearson correlation between dominant bacteria and environmental factors
3 讨 论
连作、轮作能够改变土壤微环境,对土壤养分产生一定的影响[23]。本研究中,烤烟连作(CC)、轮作(CR)条件下,土壤养分含量均升高,而魏全全等[24]研究发现烤烟轮作能有效促进土壤养分含量升高,而连作则会显著降低土壤养分含量,与本研究结果不完全一致。本研究中,连作(CC)土壤养分含量的升高,可能是由于烤烟在长期连作条件下,当施入土壤的养分持续不变时,烟株吸收的养分量在不断减少,从而出现土壤养分含量随着连作年限的增加而增加的现象[11]。此外,本研究还发现连作(CC)土壤中的速效钾含量高出撂荒地(AL)与轮作(CR)土壤约2倍,主要由于烤烟作为喜钾作物,在栽培过程中钾肥施用量较高,长期大量钾肥投入导致土壤对钾的特殊吸附位点增加,从而增加了土壤对钾的固定[25],这与王棋等[26]的研究结果相类似,即烤烟在连作3年时即可引起土壤钾积累。烤烟是忌连作的作物,长期连作中施肥成分及烤烟对养分吸收的相对固定,导致土壤中某些营养元素长期亏缺或累积,从而造成土壤养分比例失衡,严重威胁土壤生态环境[27-28]。
土壤酶活性可以揭示土壤中生物代谢作用强度以及对外界环境的适应能力[29]。磷酸酶主要来源于真菌和植物根系[30],其作用是促进磷素的循环和转化,表征土壤磷素的水平[31];过氧化氢酶是微生物或者植物产生的一类氧化还原酶[32],能促使土壤中的过氧化氢(H2O2)分解为水和氧气,从而减轻或消除过氧化氢对生物体的危害[33]。在本研究中,连作(CC)、轮作(CR)均导致了土壤磷酸酶活性的显著升高,这可能与烤烟长期轮作过程中大量氮肥的施入有关[13]。高量氮肥施用下,植物地上生物量和叶片磷含量显著增加,从而促进植物根系分泌磷酸酶的活性增强[34]。而连作土壤中的磷酸酶活性升高可能与根系分泌物增多有关[35],根系分泌物中的低分子量化合物可作为土壤微生物的碳源和能源物质,有利于土壤中某些细菌、真菌和放线菌的繁殖和生长,从而增加了土壤酶的来源[36];同时,根系分泌物还具遗留效应,尤其是连作体系会反复将相同的根系分泌物释放到土壤中,从而使根系分泌物增多[37]。不同种植制度对过氧化氢酶活性的影响有很大差异[38]。本研究中连作(CC)导致土壤中过氧化氢酶活性显著升高,这主要由于长期连作条件下根际病原菌的活动会影响宿主植株的代谢过程,刺激根系分泌过氧化氢等物质[39-40],促进过氧化氢酶对过氧化氢的降解反应,导致土壤中过氧化氢酶活性升高[41-42]。土壤中酶活性的变化受诸多因素影响,如根际分泌物、土壤养分、土壤微生物等,已有大量研究表明,不同作物甚至同一作物连作后土壤酶活性变化并不一致[43-46];因此,不能单独用酶活性来解释连作障碍,应将土壤中各种因素结合起来分析。
根际微生物是土壤和根系间养分转化和运输的调节器,根际土壤细菌数量巨大,不仅参与土壤养分的转化,同时还参与土壤团粒结构的形成和变化,因此细菌对土壤可持续利用是至关重要的[47],种植制度的改变会直接或间接地影响土壤微生物群落多样性[12]。本研究中,连作(CC)、轮作(CR)土壤在细菌群落门水平上组成基本相同,优势菌群主要为放线菌门、变形菌门、酸杆菌门、绿弯菌门等,但连作(CC)土壤细菌群落丰度和多样性明显低于轮作(CR)土壤。这是因为烟草在连作条件下,根系分泌物中化感物质的积累可使根系受害,影响根际微生物的数量、种群和土壤微生物的代谢、生长和发育,同时烤烟连作破坏了烟草根际土壤细菌群落的平衡,使烟草的生存微环境不断恶化;而轮作方式可以提高植烟土壤中细菌群落的多样性,并且随轮作年限的增加,轮作处理根际土壤细菌含量高于烤烟单作的趋势越来越明显[48-50]。本研究中PCA(图5)和LefSe分析(图6)表明,连作(CC)土壤优势菌群明显低于轮作(CR)和撂荒地(AL)土壤,各土壤优势菌群组成不同,结构差异显著,可能是由于连作障碍因子的存在,限制了土壤某些细菌的生长,使得土壤细菌种类较少[51-52]。Hu等[53]研究发现连作马铃薯根际土壤中,非有益细菌显著增多,从而影响土壤细菌群落结构以及重要土壤理化因子。在本研究中,RDA分析(图7)和相关性分析(表5)表明,土壤过氧化氢酶活性、速效钾含量是影响细菌群落分布的主要环境因子,且均与连作(CC)土壤主要优势细菌假节杆菌属(Pseudarthrobacter)的相对丰度呈显著正相关,与轮作(CR)土壤主要优势细菌赭黄嗜盐囊属(Haliangium)的相对丰度呈显著负相关。假节杆菌属(Pseudarthrobacter)具有好氧特性[54],且大多数假节杆菌属的代谢物主要含有甲萘醌[55],具有很强的氧化还原活性,它可以通过相应的半醌自由基进行酶促反应,产生超氧阴离子自由基,对一些生物大分子,如DNA、脂质、蛋白质等产生损伤[56]。而赭黄嗜盐囊属(Haliangium)是一种耐盐粘土细菌[57],其产生的次生代谢产物参与非核糖体肽合成酶生物合成中关键酶基因的编码[58],非核糖体肽合成酶基因对过氧化氢具较强的耐受性,同时该基因还能在一定程度上抑制嗜水气单胞菌的致病性[59]。因此,本研究推测假节杆菌属(Pseudarthrobacter)可能是植烟土壤中的有害菌,赭黄嗜盐囊属(Haliangium)可能是植烟土壤中的益生菌,但其对环境因子的具体响应机制尚未明确,有待进一步研究。
4 结 论
针对长期不同种植制度下植烟土壤细菌群落变化特征研究发现,烤烟长期连作导致植烟土壤速效钾含量富集,磷酸酶和过氧化氢酶活性显著升高,而轮作导致土壤中过氧化氢酶活性显著降低。相较撂荒地,连作、轮作均能显著提高土壤细菌群落的多样性和丰富度,其根际土壤细菌群落在门水平组成上相似,优势菌群均为变形菌门、蓝细菌门、酸杆菌门、绿弯菌门和拟杆菌门,但在属水平上差异显著,优势细菌在组成及数量上均不同。不同种植制度土壤优势菌群数从高到低为轮作>撂荒地>连作,其中连作、轮作土壤中相对丰度差异最显著的细菌分别为假节杆菌属(Pseudarthrobacter)和赭黄嗜盐囊属(Haliangium)。土壤微环境因子与优势菌属间存在较强的相关性,其中土壤过氧化氢酶活性、速效钾含量是影响细菌群落分布的主要环境因子,且均与假节杆菌属(Pseudarthrobacter)的相对丰度呈显著正相关,但与赭黄嗜盐囊属(Haliangium)的相对丰度呈显著负相关。综上,长期连作会导致土壤养分失衡,有益细菌相对丰度减少,致病细菌相对丰度增加,破坏土壤细菌群落结构,进而影响土壤微生态环境的平衡,而轮作则能均衡土壤养分,改善土壤酶活性状况,并且显著提高土壤细菌群落的丰富度和多样性。
