多金属氧酸盐类α-葡萄糖苷酶抑制剂的研究进展
2023-07-13王瑞芳帅蝶孙乐常谢远红
王瑞芳,帅蝶,孙乐常,谢远红
(集美大学海洋食品与生物工程学院,福建 厦门 361021)
0 引言
糖尿病是21世纪威胁全球人类健康的主要疾病之一,也是世界范围内最严重的慢性病之一。糖尿病主要是由葡萄糖吸收和胰岛素分泌的不平衡引起的,长期高血糖会对神经和代谢系统造成严重损害,常引起眼睛、肾脏、脑血管和神经等重要人体器官组织的功能障碍。目前,市面上有几种抗糖尿病药物,如阿卡波糖、西他列汀和格列齐特等,它们通过干扰糖类消化酶的活性来延缓葡萄糖在小肠内的吸收,减轻糖尿病的症状。但是,长期较高剂量地服用这些药物也会产生副作用,如引起胃肠道疾病、肾功能衰竭等[1]。
α-葡萄糖苷酶广泛分布在机体小肠绒毛粘膜细胞刷状缘中,参与人体对碳水化合物、淀粉、糖蛋白的消化和吸收[2]。淀粉在α-淀粉酶的作用下被消化为麦芽糖和糊精,随后由α-葡萄糖苷酶将其转化为葡萄糖,从而提高血糖水平[3]。因此,抑制α-葡萄糖苷酶是控制餐后血糖升高的有效途径[4]。α-葡萄糖苷酶抑制剂能够可逆性竞争小肠绒毛粘膜细胞刷状缘的α-葡萄糖苷酶,抑制糖类化合物的分解,减少葡萄糖的生成和吸收。因此,α-葡萄糖苷酶抑制剂被视为减少餐后高血糖的有价值的工具[5],已被认为是2型糖尿病的主要治疗药物。开发新型的α-葡萄糖苷酶抑制剂替代传统抗糖尿病药物也成为国内外学者的研究热点。
多金属氧酸盐(polyoxometalates,POMs)是一类具有高水溶性和高结构选择性的金属-氧化物簇阴离子,在材料[6]、纳米材料[7]、电化学[8]、医学[9]、催化[10]、超分子材料[11]等领域得到了广泛的研究。又由于其结构多样性、功能特性和多方面的生物活性,POMs在抗癌[12]、抗病毒[13]、抗阿尔茨海默病[14]和酶抑制[15]等领域显示出良好的医学应用前景,近年来已成为无机药物的研究热点。
本文综述了近年来α-葡萄萄糖苷酶抑制剂的研究进展,以及POMs作为α-葡萄糖苷酶抑制剂的研究概况,并对其发展前景进行了展望。
1 抑制剂对α-葡萄糖苷酶的抑制机理
抑制剂与α-葡萄糖苷酶的作用机理研究有利于后期研究和开发新药物,多种光谱技术已用于活性成分对酶抑制机理的研究。紫外分光光谱可用于研究活性成分对酶的抑制动力学和抑制类型,活性成分与酶结合会使酶发生荧光猝灭,故荧光光谱可研究活性成分和酶的相互作用[16]。圆二色谱法可用于分析酶与活性成分结合前后的构象变化。应用计算机技术分子对接模拟配体和酶之间结合位点和作用力,研究分子间的亲和力和结合模式[17]。α-葡萄糖苷酶抑制剂能可逆性抑制α-葡萄糖苷酶,可逆性抑制又可分为竞争型抑制、非竞争型抑制和混合型抑制3种,3种抑制类型中所涉及的分子间作用机制如图1所示。
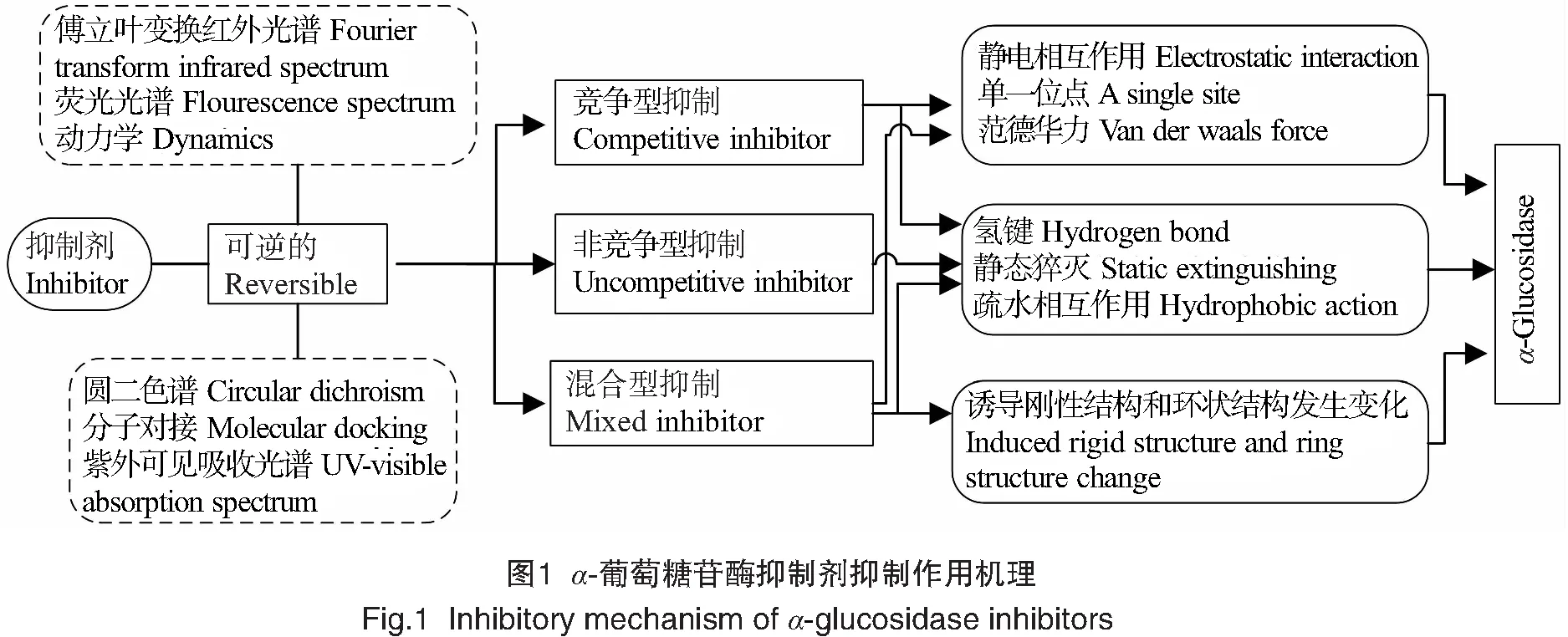
3种抑制类型的抑制剂通过与α-葡萄糖苷酶的结合改变酶的二级结构来抑制酶的活性[3],同时抑制剂在疏水作用和氢键驱动下,与酶周围的氨基酸残基相互作用,干扰酶的构象动力学[18]。在疏水力的驱动下,α-葡萄糖苷酶内源荧光静态猝灭,从而导致蛋白质多肽链部分延伸,引起α-螺旋含量下降。在这一过程中,抑制剂与α-葡萄糖苷酶活性中心的入口处结合,与氨基酸残基相互作用,阻碍底物和催化反应产物的释放,最终抑制α-葡萄糖苷酶的催化活性[19]。某些物质能诱导α-葡萄糖苷酶的刚性结构和环结构发生变化,从而引起与α-葡萄糖苷酶活性密切相关的酶结构变化[20]。同时,这些物质还可抑制葡萄糖与酶底物的结合,降低α-葡萄糖苷酶的活性。抑制剂还会受氢键和范德华力驱动,引起酶的构象变化,同时与α-葡萄糖苷酶活性部位的一些氨基酸残基相互作用,占据酶的催化中心,最终抑制酶的活性[21]。总之,抑制剂对α-葡萄糖苷酶的抑制作用大多和疏水作用、范德华力、静电作用、氢键形成等有关。
2 α-葡萄糖苷酶抑制剂的种类及来源
早期对α-葡萄糖苷酶抑制剂的研究主要是开发传统药物,如:1970年发现米格列醇对α-葡萄糖苷酶有强烈的抑制作用;1977年,德国拜尔公司首次提取到能抑制α-葡萄糖苷酶的活性成分,于1990年将其研制成药物并命名为阿卡波糖。阿卡波糖、米格列醇是目前使用的降糖药,通过抑制α-淀粉酶和α-葡萄糖苷酶的活性,减少了糖的水解,延缓了葡萄糖的吸收。然而,阿卡波糖和类似的药物也有副作用,如腹胀、腹泻、腹部和肝脏疾病等。因此,寻找具有轻微或无不良影响的新型α-葡萄糖苷酶抑制剂显得尤为重要。目前,可从天然物质中提取α-葡萄糖苷酶抑制剂,也可利用微生物发酵来合成。随着研究的深入,国内外学者也通过化学手段合成了部分化合物以抑制α-葡萄糖苷酶的活性。α-葡萄糖苷酶抑制剂的研究历程如图2所示。

2.1 天然提取物中的α-葡萄糖苷酶抑制剂
迄今为止,已报道的天然α-葡萄糖苷酶抑制剂主要是药用植物中的有效成分,如糖类、黄酮类、酚类化合物、萜烯、醌类和有机酸类等。除此之外,还可以从微生物次级代谢产物中提取纯化出具有降血糖的单体活性成分。
基于国内外学者近年来的研究成果,天然提取物中的α-葡萄糖苷酶抑制剂糖类的主要来源有网地藻多糖[22]、蛹虫草子实体纯多糖和菌丝体纯多糖[23]、五加仑葡萄糖[24]、大黄中的褐藻多糖[2]、菊芋中的果聚糖[25]等。多酚类化合物也是一种有效的α-葡萄糖苷酶抑制剂[26],主要包括从咖啡豆、山楂等各种植物的种子中提取的阿魏酸、绿原酸[3],茶叶中的表没食子儿茶素没食子酸酯[4],青苹果多酚[1],山奈酚[21],迷迭香的正丁醇提取物和二乙醚提取物[27],原花青素[28],苹果/甘蓝中提取的根皮苷和类黄酮[29]等。其中,Imane等[30]首次揭示了单宁酸是α-葡萄糖苷酶的功能性抑制剂。多糖类和多酚类物质对α-葡萄糖苷酶的具体抑制效果见表1~表2。

表1 多糖类物质对α-葡萄糖苷酶的抑制效果Tab.1 Inhibitory effect of polysaccharides on α-glucosidase
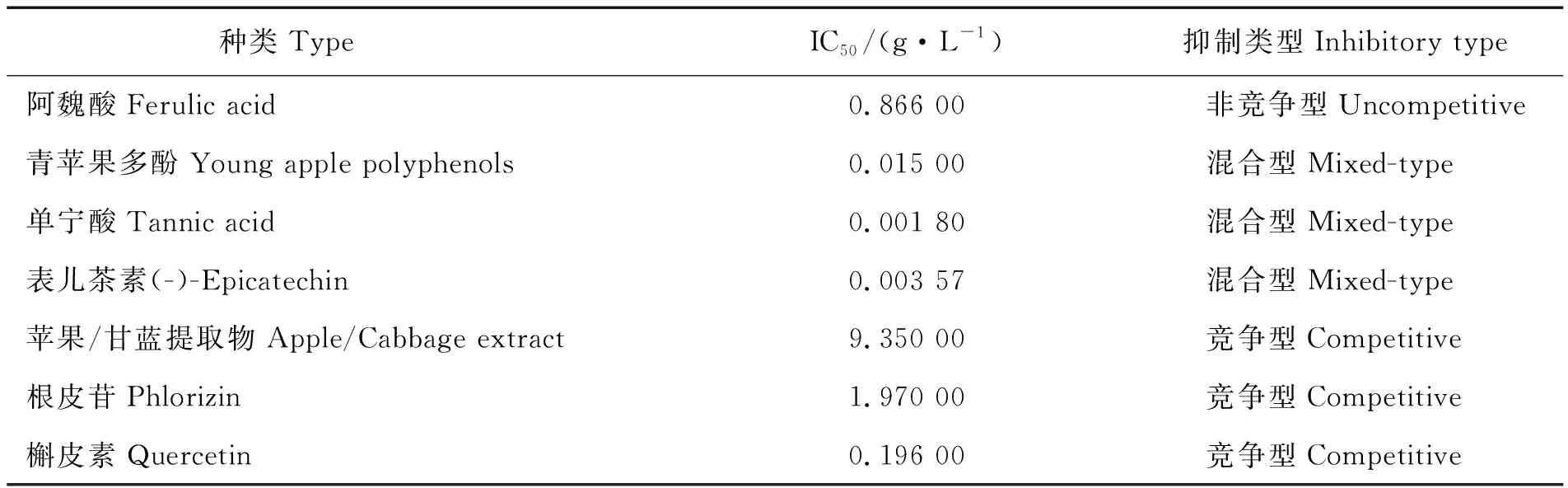
表2 多酚类物质对α-葡萄糖苷酶的抑制效果Tab.2 Inhibitory effect of polyphenols on α-glucosidase
天然提取物中的α-葡萄糖苷酶抑制剂除上述多糖、多酚类化合物之外,还包括从植物中分离得到的具有新的结构的化合物,如具有2,6-环氧骨架的二芳基庚烷类化合物、异香豆素、苯并呋喃、香豆素类似物等。He等[31]从草果干果中分离出13个新的和4个已知的具有2,6-环氧骨架的二芳基庚烷类化合物,其中化合物5、8~11具有明显的α-葡萄糖苷酶抑制活性。Chen等[32]从红树林内生真菌桃金娘科YX1获得了6种新的异香豆素(化合物1~4和14~15)、2个新的苯并呋喃16~17以及9种已知的异香豆素类似物5~13。化合物2、6、8和10表现出α-葡萄糖苷酶抑制活性。Milella等[33]从牛蒡的地上部分分离得到3种新的香豆素类化合物(1~3)、1种预酰化黄烷酮(4)、2种环烯醚萜类化合物(5和6)、17种已知的次生代谢产物,衍生物4对α-葡萄糖苷酶作用最强,IC50值为(28.1±2.6) μmol/L,比作为阳性对照的阿卡波糖更为有效。Ye等[34]对山茱萸进行了系统的植物化学研究,以寻找抗糖尿病的成分,分离出10种未报道的环烯醚萜苷、山茱萸苷A~J(1~8、9a/9b和10a/10b),所有化合物均表现出α-葡萄糖苷酶抑制活性。
除此之外,还有一些植物粗提物对α-葡萄糖苷酶也表现出抑制作用。将西番莲用二苯乙烯进行提取,可分离得到对α-葡萄糖苷酶有抑制作用的苦皮藤醇衍生物[35]。蛹虫草水提物可诱导HepG2细胞摄取葡萄糖,并诱导葡萄糖代谢,其对α-葡萄糖苷酶抑制活性高于阿卡波糖,是糖尿病防治的候选药物或潜在药物[36]。Ayusman等[37]对美人蕉根茎进行了研究,结果表明,美人蕉根茎的水提取物和丙酮提取物均显著抑制α-葡萄糖苷酶活性。Park等[38]以80%乙醇为提取剂,对冻干的马尾藻进行提取和浓缩,马尾藻提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用强于阳性对照阿卡波糖。与链脲佐菌素诱导的糖尿病小鼠对照组相比,马尾藻提取物组餐后血糖升高明显减轻。
2.2 化学合成的α-葡萄糖苷酶抑制剂
由于α-葡萄糖苷酶抑制剂结构复杂,单独合成难度较大,故大多是在天然产物的结构基础上加以修饰改良的。化学合成的α-葡萄糖苷酶抑制剂主要包括糖衍生物或类似物、咪唑类、大环化合物等一系列有机合成物。临床应用的阿卡波糖、伏格列波糖和米格列醇都是葡萄糖的结构类似物,Adib等[39]设计合成的咔唑-咪唑、Ajish等[40]合成的花姜酮衍生物、闫晶晶[41]合成的菲类化合物2,4-二甲氧基-7-羟基菲都具有α-葡萄糖苷酶抑制作用。
2.3 微生物发酵提取的α-葡萄糖苷酶抑制剂
目前,已获得临床应用的3种α-葡萄糖苷酶抑制剂(阿卡波糖、伏格列波糖和米格列醇)均来自于微生物的代谢产物。1977 年,阿卡波糖从游动放线菌 SE50 的代谢产物中被提取发现[42];1982年,米格列醇从Streptomyceslavendulae发酵液中被提取发现[43]。Lee等[44]从链霉菌的代谢产物中分离出的染料木素,王欣荣等[45]在淡紫链霉菌发酵液中分离得到的化合物 HW110,郎国竣等[46]从506157菌中分离出的代谢产物4’,7-二羟基异黄酮均对α-葡萄糖苷酶有明显抑制活性。
3 POMs对α-葡萄糖苷酶的抑制
从药用植物中提取α-葡萄糖苷酶抑制剂存在提取量低、纯度低且结构相对复杂等问题;微生物的不稳定性及可重复性不高,发酵过程关键控制点难以掌握,很难进入到工业化生产阶段;化合物合成过程相对繁琐,且有一定毒副作用,限制了临床的应用。因此,研究新型的α-葡萄糖苷酶抑制剂就显得尤为重要。王力等[47-50]合成了2种不同系列的POMs(Keggin型和Dawson型),并且对化合物与α-葡萄糖苷酶进行了分子对接研究,结果证实,2种不同系列的POMs均对α-葡萄糖苷酶表现出显著的抑制效果(见表3)。
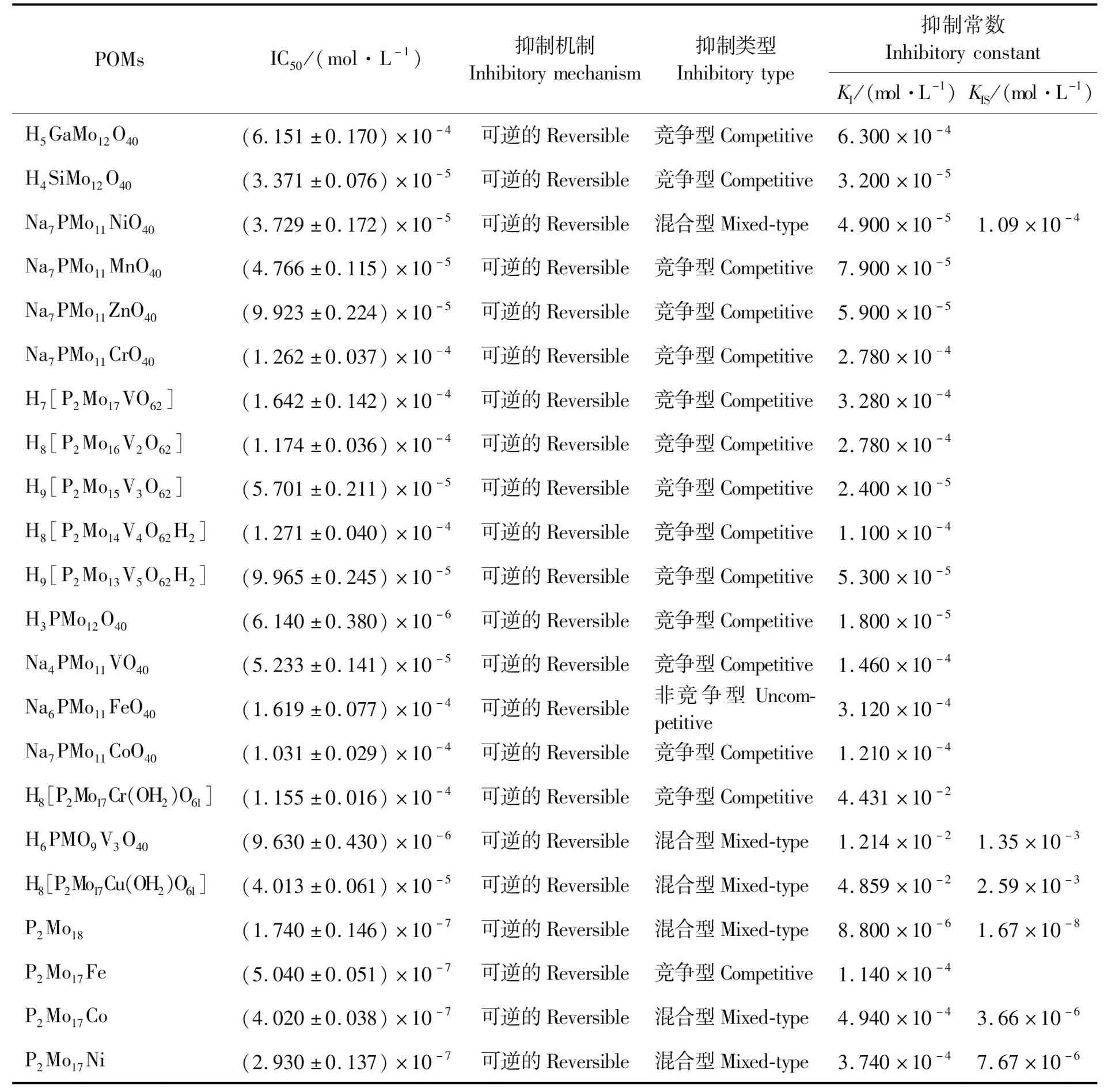
表3 合成POMs化合物对α-葡萄糖苷酶的抑制效果Tab.3 Inhibitory effects of synthetic polyoxometalate compounds on α-glucosidase
3.1 Keggin型POMs对α-葡萄糖苷酶的抑制作用
Chi等[48]合成H3PMo12O40、Na4PMo11VO40、Na6PMo11FeO40和Na7PMo11CoO40(PMo12、PMo11V、PMo11Fe和PMo11Co),并研究了它们对α-葡萄糖苷酶的抑制作用。PMo12和3种过渡金属取代的Keggin型磷钼酸(PMo11V、PMo11Fe和PMo11Co)可以有效地抑制α-葡萄糖苷酶的活性,PMo12的抑制作用大约是标准阿卡波糖的117倍。分子对接模拟表明,所有化合物通过多种范德华力和氢键相互作用结合到α-葡萄糖苷酶的活性位点。抑制剂PMo12主要通过氢键和范德华力相互作用与α-葡萄糖苷酶活性位点的氨基酸分子结合,如图3所示。PMO12准确地嵌入活性部位的深凹处,并且大部分被多肽包围,如图4所示,化合物PMo12与活性区域中的氨基酸残基(Tyr158、Ser240、Asp242、His280、Ser311和Arg315)启动了7次氢键相互作用。其中PMo12骨架中的5个O原子与氨基酸残基中的H原子形成7个氢键。此外,该化合物以氢键形式与酶结合,还与活性区周围的氨基酸残基(Lys156、Ser157、Leu246、Gln279、Asp307、Thr310、Pro312、Leu313和Phe314)形成范德华相互作用。Chi等[47]合成的其他化合物也得出:化合物主要是通过范德华力和氢键相互作用与α-葡萄糖苷酶活性位点竞争性结合,同时,很多极性氨基酸残基也参与了POMs与α-葡萄糖苷酶的强结合。

Chi等[47]研究了Ni、Mn、Zn、Cr 4种过渡金属取代的Keggin型POMs 对α-葡萄糖苷酶的抑制作用。与先前研究的抑制剂(PMo11V、PMo11Co和PMo11Fe)相比,7种Keggin型POMs对α-葡萄糖苷酶的抑制作用为:PMo11Fe Hu等[49]合成了H4PMo11VO40、H5PMo10V2O40、H6PMo9V3O40、H7PMo8V4O40、H8PMo7V5O40,分别简称为 PMo11V、PMo10V2、PMo9V3、PMo8V4、PMo7V5,抑制效果较好的是PMo9V3。研究发现,这5种Keggin型POMs对α-葡萄糖苷酶的抑制类型均为可逆混合抑制。对接结果表明,氢键和范德华力是配体化合物与酶蛋白结合的关键力。Keggin型配体化合物PMo9V3与α-葡萄糖苷酶活性囊周围的氨基酸残基(Arg442、Glu411、Asn350、Arg315、Tyr72、Glu277、Arg213)形成氢键,与氨基酸残基(His351、Thr306、Tyr347、Gln279、Tyr158、Asp352、Phe159、Phe178、Leu219、Val216、Phe303)形成范德华力(见图5a)。 以上研究结果表明,Keggin型POMs对α-葡萄糖苷酶的可逆抑制类型有3种类型,即竞争型、非竞争型及混合型,PMo12对α-葡萄糖苷酶的抑制能力约是阿卡波糖的117倍,PMo11Ni的抑制能力约为阿卡波糖的20倍,配体化合物与酶蛋白结合的关键力是氢键和范德华力。 Chi等[47]合成了一系列钒取代的Dawson型POMs,发现5种Dawson型POMs对α-葡萄糖苷酶的抑制作用为:P2Mo17V Hu等[49]合成了4种化合物H8[P2Mo17Cr(OH2)O61]、H8[P2Mo17Mn(OH2)O61]、H8[P2Mo17Cu(OH2)O61]、 H8[P2Mo17Zn(OH2) O61],分别简写为 P2Mo17Cr、 P2Mo17Mn、 P2Mo17Cu、P2Mo17Zn。 其中,P2Mo17Cu对α-葡萄糖苷酶的抑制作用最强,其IC50=(40.13±0.61) μmol/L。2种Dawson型化合物P2Mo17Cr、P2Mo17Cu与α-葡萄糖苷酶活性囊周围的重要氨基酸相互作用形成范德华力,其中疏水性氨基酸Phe159、Phe178、Leu219、Val216、Phe303参与了与配体的相互作用(见图5b、图5c)。极性氨基酸会增强多酸与α-葡萄糖苷酶的相互稳定性,活性位点周围的疏水氨基酸是配体化合物进入活性囊的关键。 Hu等[50]还合成了Dawson型磷钼酸H6(P2Mo18O62)、H8[P2Mo17Fe(OH2)O61]、H8[P2Mo17Co(OH2)O61]和H8[P2Mo17Ni(OH2)O61],分别简称为P2Mo18、P2Mo17Fe、P2Mo17Co和P2Mo17Ni。其中P2Mo18、P2Mo17Co和P2Mo17Ni对α-葡萄糖苷酶具有可逆的混合抑制作用,P2Mo17Fe对α-葡萄糖苷酶具有可逆的竞争抑制作用。另外,这4种化合物能分别与酶分子形成非共价相互作用,包括氢键形成、范德华相互作用。 Dawson型多金属氧酸盐对α-葡萄糖苷酶亦表现出显著的抑制效果,P2Mo15V3和P2Mo17Cu对α-葡萄糖苷酶的抑制能力分别约为阿卡波糖的13倍和18倍,其抑制类型既有可逆竞争型抑制,也有可逆混合型抑制。综上所述,POMs在开发和研究α-葡萄糖苷酶新型抑制剂方面展现出广阔的应用前景。 目前,在临床上应用的α-葡萄糖苷酶抑制剂大多来自微生物代谢产物或天然产物,通过化学合成来获得活性更强的抑制剂已成为发现高效α-葡萄糖苷酶抑制剂的一种趋势,而POMs在开发有临床价值的α-葡萄糖苷酶抑制剂方面具有相当大的潜力。但POMs对α-葡萄糖苷酶的作用机理复杂,分子对接仅了解构建的α-葡萄糖苷酶活性囊周围化合物与氨基酸的相互作用,而化合物与酶蛋白的对接机理尚不清楚,这也对POMs在开发有临床价值的α-葡萄糖苷酶抑制剂方面的后续研究提供了以下方向: 1)进一步合成POMs,并采用定点突变和比较模拟的方法确定α-葡萄糖苷酶的活性位点和底物结合方式,并通过与人α-葡萄糖苷酶和模型酶异麦芽糖酶的类似抑制研究来扩大研究范围。 2)研究抗衡阳离子与结晶水等因素对多酸构效关系的影响,并进一步扩展对人体的α-葡萄糖苷酶和同源模型酶的研究。 3)解析α-葡萄糖苷酶-多酸复合物的X射线晶体结构,比较和评估建模数据的准确性,对酶-多酸复合物的X射线晶体结构和结构-活性关系进行的分析,能在结构层面上更好地理解多酸与酶的相互作用。 4)开展动物实验、毒理学研究,了解多酸的药物作用机理,深入研究毒副作用,助力医学上研究低毒、低成本、高效的α-葡萄糖苷酶抑制剂,以期更好地治疗糖尿病,为POMs化学的生物医学应用提供新思路。
3.2 Dawson型POMs对α-葡萄糖苷酶的抑制作用
4 结论
