大黄鱼TLR25的分子结构及表达特征分析
2023-07-13李永健姚翠鸾
李永健,姚翠鸾
(集美大学水产学院,福建 厦门 361021)
0 引言
大黄鱼(Larimichthyscrocea)主要分布于我国东南沿海,是我国海水网箱养殖量最大的经济鱼类。然而,病害频发已经成为制约大黄鱼养殖业健康发展的主要瓶颈之一[1-2]。
Toll样受体(Toll-like receptors,TLRs)是一类重要的先天性模式识别受体(pattern-recognition receptors,PRRs),通过识别包括来自细菌、真菌及病毒等病原体中的脂多糖(lipopolysaccharide,LPS)、肽聚糖(peptidoglycan,PGN)、鞭毛蛋白(flagellin)、多聚核苷酸(Poly I:C,CpG-DNA)等共有的病原相关分子模式(pathogen associated molecular pattern,PAMPs),激活宿主下游免疫信号传导通路及炎症反应[3]。典型TLR家族成员的蛋白质结构包括胞外富含亮氨酸(leucine rich repeats,LRR)的结构域(主要识别不同病原的PAMPs)、一个跨膜区(transmembrane region,TM),以及一个胞内的Toll/白细胞介素-1受体(Toll/Il-1Receptor,TIR)结构域。TLRs激活后可招募胞内的接头蛋白及信号分子,通过MyD88(myeloid differentiation primary response gene 88)依赖或MyD88非依赖途径,向下游进行免疫信号传递[4]。
迄今为止,已经在人类体内发现了10种不同的TLR,在小鼠中发现了13种[5]。根据其结构特点、进化关系及它们识别的PAMPs配体,将TLR分为TLR1、TLR3、TLR4、TLR5、TLR7和TLR11等6个亚家族[6]。其中TLR1、TLR4、TLR5亚家族成员主要分布在细胞膜上,主要识别细菌、真菌产生的脂肽、脂多糖、肽聚糖等PAMPs[7-9]。TLR3、TLR7、TLR11亚家族成员主要存在于内体膜上[10],通过识别病毒、细菌等病原体的双链及单链RNA或CpG DNA激活免疫[11]。目前,已经发现鱼类存在20余种TLRs,虽然其多样性远远多于哺乳动物,但是对其序列及结构分析表明,它们也分属于哺乳动物的6个TLR亚家族[12]。
TLR1亚家族主要识别细菌细胞壁中的肽聚糖和脂肽,在抗细菌免疫中发挥重要作用。哺乳动物TLR1亚家族的主要成员包括TLR1、TLR2、TLR6和TLR10[13]。但是,鱼类TLR1亚家族包括TLR1、TLR2、TLR14、TLR18、TLR25[14]和TLR28[15],提示来自鱼类的TLR可能与哺乳动物存在较大差异。
TLR25是近年来在鱼类中发现的TLR1亚家族的新成员,目前,已经在达氏鲟(Acipenserdabryanus)[16]、齐口裂腹鱼(Schizothoraxprenanti)[17]、尼罗罗非鱼(Oreochromisniloticus)[18]中得到鉴定。研究表明,这些鱼类的TLR25均具有典型TLR分子的三个保守结构域。在免疫反应中,达氏鲟的TLR25可以被LPS、Poly I:C刺激所诱导[16];齐口裂腹鱼的TLR25主要存在于细胞质,可能参与识别LPS与Poly I:C[18];而脂多糖(Lipopolysaccharide,LPS)、脂磷壁酸质(Lipoteichoic acid,LTA)和酵母聚糖能够显著诱导尼罗罗非鱼TLR25的表达上调[17]。在尼罗罗非鱼中发现两种类型的TLR25,其中截短的TLR25可以诱导多种促炎细胞因子和I型干扰素(IFN-I)的表达[18],提示不同鱼类的TLR25可能存在较大差异,它们在鱼类的免疫反应中可能发挥重要作用。但是,作为一种重要的经济鱼类,大黄鱼TLR25的序列尚未得到鉴定,它在大黄鱼免疫反应中的功能,也尚未见报道。
本研究拟克隆一个大黄鱼TLR25的cDNA,对其进行结构分析,构建系统进化树,并在此基础上,研究其在大黄鱼不同组织及免疫刺激后在大黄鱼肾细胞(LCK)中的时空表达特征,为深入了解大黄鱼TLR25在免疫反应中的作用提供科学依据。
1 材料与方法
1.1 实验用鱼、细胞系及免疫刺激
大黄鱼(体重(300±25.6)g,体长(24±3)cm)购自福建宁德,取样前驯养1周。取4尾大黄鱼,解剖取出肌肉、脾脏、胃、肠、血液、头肾、鳃、肝脏、肾脏、皮肤、心脏和大脑等12种组织或器官(n= 4),迅速置于液氮中冻存,并保存于-80 °C超低温冰箱中,用于总RNA提取。
大黄鱼LCK细胞系为本实验室保存。采用含有10%(质量分数)胎牛血清及1%(质量分数)双抗的MEM培养基,在28 ℃下培养,待细胞长满培养瓶后,用胰酶将其消化并传代至6孔板,细胞量约为2×106ind/孔,待细胞贴壁程度达到80 %以上后,分别用溶于PBS的LPS(50 μg/mL)与Poly I:C(20 μg/mL)进行刺激,刺激后6、12、24、48 h分别取样。对照组细胞内加入等体积PBS(0.01 mol/L,pH=6.8)。每个样本设置3次独立生物学重复及3个平行重复(n=3)。取样前先使用灭菌PBS洗涤细胞1~2次,洗涤后于冰上加入RNA裂解液裂解,吹匀后吸出,用于RNA提取。
1.2 RNA提取及cDNA合成
从-80 °C保存的大黄鱼12种组织及收集的LCK细胞中提取总RNA,具体操作参照厂家说明书(Eastep© Super Total RNA,Promega)。
分别以上述总RNA为模板,采用反转录试剂盒(HiScript©II 1st Strand cDNA,诺唯赞)制备cDNA模板,每个反应使用1 μg总RNA,所制备的cDNA用于后续的LcTLR25 cDNA的克隆与荧光定量PCR(qPCR)分析。
1.3 LcTLR25基因的克隆
根据GenBank数据库中预测的TLR25(XM_010729650.3)序列信息,设计大黄鱼TLR25特异性引物LcTLR25-F、LcTLR25-R(见表1)。以健康大黄鱼各个组织混合的cDNA为模板扩增LcTLR25编码区序列。PCR体系为:ddH2O 12.2 μL、5×PCR buffer 4 μL、dNTP mix 1.6 μL、LcTLR25-F 0.5 μL、LcTLR25-R 0.5 μL、各组织混合的cDNA模板1 μL、高保真Taq酶0.2 μL。PCR反应程序为:变性98 ℃ 3 min;98 ℃ 10 s,58 ℃ 10 s,72 ℃ 90 s(55个循环);72 ℃ 10 min。琼脂糖凝胶电泳检测PCR产物条带。
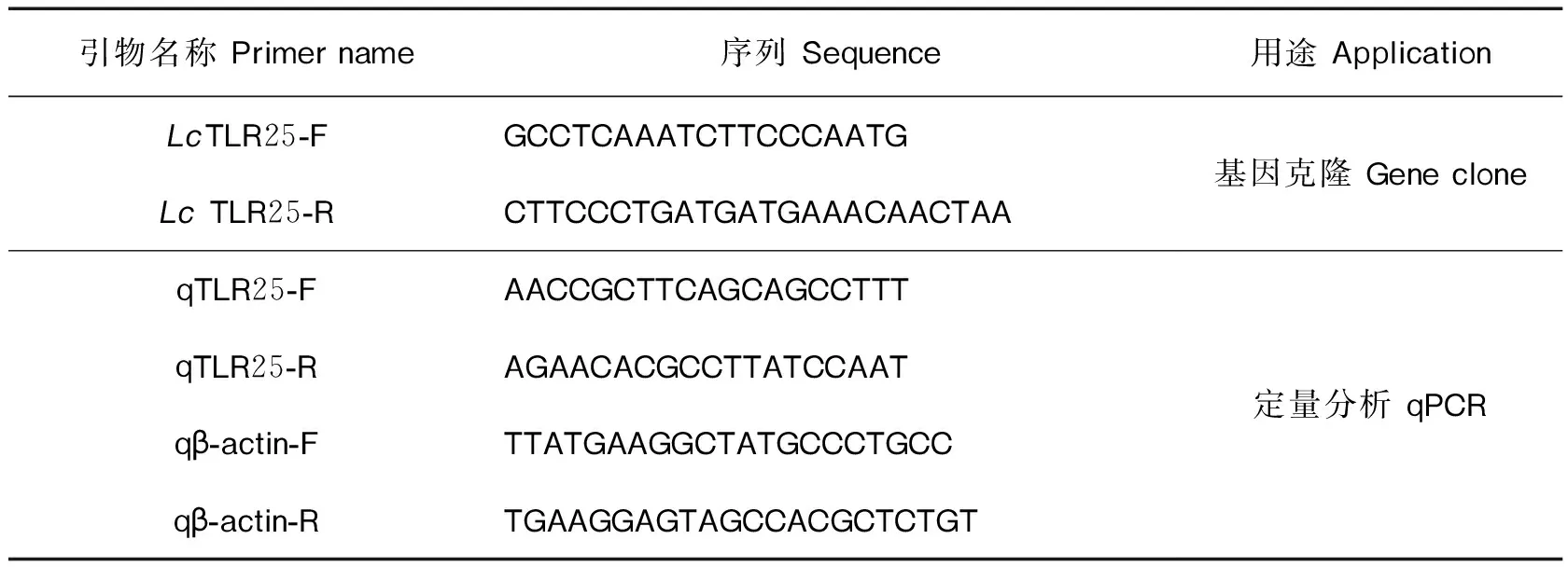
表1 实验中所用引物Tab.1 The primers used in this study
使用胶回收试剂盒(Gel Extraction Kit,OMEGA)对PCR产物进行胶回收。回收产物用于连接至pMD19-T线性载体(Promega),连接体系为:纯化后PCR产物4.5 μL、Solution I 5 μL、PMD-19-T线性载体0.5 μL。连接条件为16 ℃水浴12 h。连接后载体经转化Top10感受态细胞后,挑单克隆培养及菌液PCR检测,检测出的阳性菌液送至厦门铂瑞测序公司测序。
1.4 序列及结构分析
使用NCBI网站中BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源比对、相似性分析及氨基酸序列预测;氨基酸序列的多重比对使用Clustomega(http://www.clustal.org/omega/)进行;分子量、等电点等使用EXPASY(https://web.expasy.org/protparam/)预测;保守的结构域及其功能在SMART网站(http://smart.embl-heidelberg.de)进行分析;亚细胞定位在BUSCA(http://busca.biocomp.unibo.it/)网站进行在线分析。
1.5 进化树的构建
在NCBI数据库中选择来自其他物种TLR1亚家族成员TLR1、TLR2、TLR18、TLR14、TLR25的氨基酸序列及部分其他TLR家族成员的氨基酸序列。使用MEGA X软件(https://www.megasoftware.net/)对相关基因序列进行邻位相接法(NJ method)构建系统进化树,用Bootstrap法评估1000次。
1.6 定量PCR检测LcTLR25转录水平的表达变化
采用qPCR检测LcTLR25在肌肉、脾脏、胃、肠、血液、头肾、鳃、肝脏、肾脏、皮肤、心脏和大脑等组织中的转录表达水平,以及LPS或Poly I:C刺激后LcTLR25在LCK细胞系中的表达变化。用LcTLR25的特异性引物qTLR25-F和qTLR25-R,并以β-actin为内参,扩增目的基因。qPCR反应体系为:2 × ChamQ Universal SYBR qPCR Master Mix 10 μL,正反向特异性引物各0.4 μL,模板2 μL,ddH2O补齐20 μL。qRT-PCR程序反应程序为:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 10 s(40个循环);60 ℃ 1 min,95 ℃ 15 s。实验方法参照诺唯赞ChamQTM Universal SYBR© qPCR Master Mix 说明书。目的基因表达的相对定量参照2-ΔΔCT方法确定[19]。
1.7 数据分析
使用软件GraphPad Prism 8对数据进行样本差异显著性分析(Student’sttest),并做图。差异显著性水平为P<0.05,差异极显著性水平为P<0.01。
2 结果与分析
2.1 LcTLR25基因的cDNA序列
利用基因特异性引物LcTLR25-F和LcTLR25-R扩增后获得约2868 bp特异性单一条带,测序后对序列进行BLASTX分析。结果显示该序列与尼罗罗非鱼的TLR25同源性最高(80.43%),与其他鱼类TLR25同源性约64.09%~67.66%,推测本研究所获得的为大黄鱼TLR25基因序列。
通过SMART在线分析推测大黄鱼及其他硬骨鱼TLR25的保守功能域,结果见表2。预测的LcTLR25蛋白质包括5个胞外的LRR,分别位于82—105 aa、111—133 aa、205—228 aa、229—250 aa、262—313 aa(LRR CT);一个跨膜区,位于315—337 aa;一个典型的胞内TIR同源域,位于371—521 aa(见图1,表2)。与其他鱼类的TLR25相比,大黄鱼LRR数量较少,其TLR25氨基酸起始序列对应其他硬骨鱼TLR25序列约278—291 aa处(表2中虚线表示)。

注:ATG为起始密码子,TAG为终止密码子;首尾大写斜体部分表示序列克隆所用引物位置;灰色底纹部分氨基酸序列分别表示5个LRR,其中前4个灰色底纹部分表示LRR(82—105 aa、111—133 aa、205—228 aa及229—250 aa),灰色底纹加下划线为LRR_CT(262—313 aa);下划线部分表示跨膜结构域(315—337 aa);方框及灰色底纹序列为TIR结构域(371—521 aa)。Notes:The start codon (ATG) and the stop codon(TAG) are capitalized,capital italic section indicate the position of primers used for sequence cloning,the amino acid sequence in gray shadows indicate the LRRs(82—105 aa,111—133 aa,205—228aa,229—250 aa and 262—313 aa) and the underlined sequence is emphasized as LRR_CT,transmembrane domain (315—337 aa) is underlined,sequence in gray box is the TIR domain (371—521 aa).图1 大黄鱼TLR25基因的编码区Fig.1 The cDNA sequences and deduced amino acid sequences of LcTLR25

表2 与不同硬骨鱼TLR25结构域的比较Tab.2 Comparison of the predicted conserved domains of TLR25 from different teleost
序列分析表明,该序列包含699 bp的5’非翻译区(UTR)、564 bp的3’ UTR、1605 bp的完整开放读码框(ORF),起始密码子为“ATG”,终止密码子为“TAG”,编码534个氨基酸(见图1)。Expasy预测其分子质量为61.09 kD,理论等电点(pI)为8.35;亚细胞定位预测LcTLR25定位于细胞膜。
2.2 序列一致性分析

2.3 进化树分析
系统进化树结果表明(见图2),从大黄鱼中扩增得到的LcTLR25与来自其他鱼类的TLR25聚为一支,其中与同样来自鲈形目(Perciformes)的尼罗罗非鱼的TLR25显示出较近的亲缘关系;TLR1亚家族的其他成员分别聚类到其相应的分支;而其他TLRs亚家族成员也分别聚类到其相应的分支。
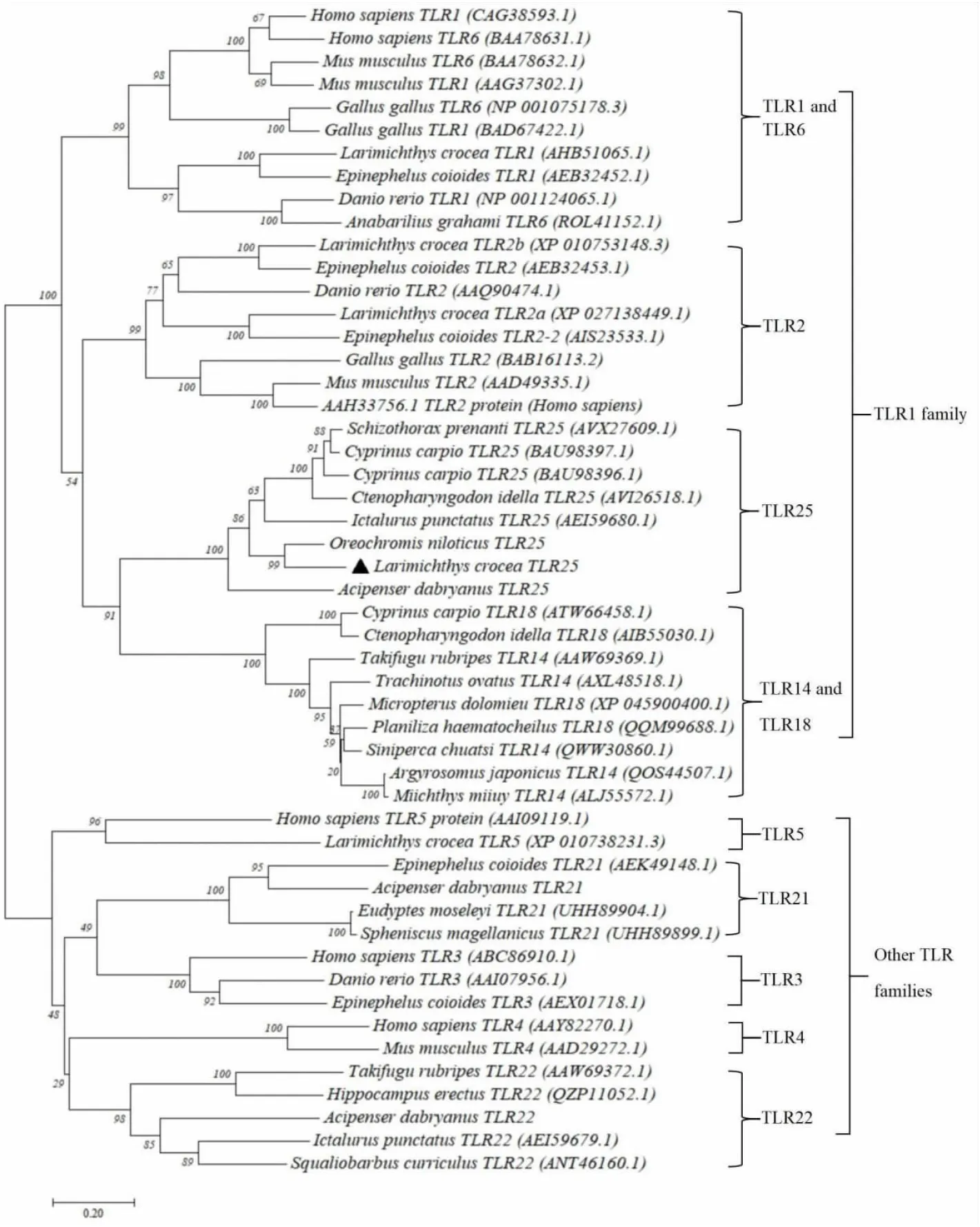
注:达氏鲟(Acipenser dabryanus)TLR21、TLR22和TLR25引自文献[16],尼罗罗非鱼(Oreochromis niloticus)TLR25引自文献[18])。Notes:The TLR21,TLR22,and TLR25 sequence of Dabry’s Sturgeon was from reference [16],and the TLR25 sequence of Nile tilapia (Oreochromis niloticus) was from reference [18]).图2 大黄鱼TLR25基因的系统进化树Fig.2 Phylogenetic tree produced using the neighbor-joining algorithm
2.4 大黄鱼TLR25的组织表达谱
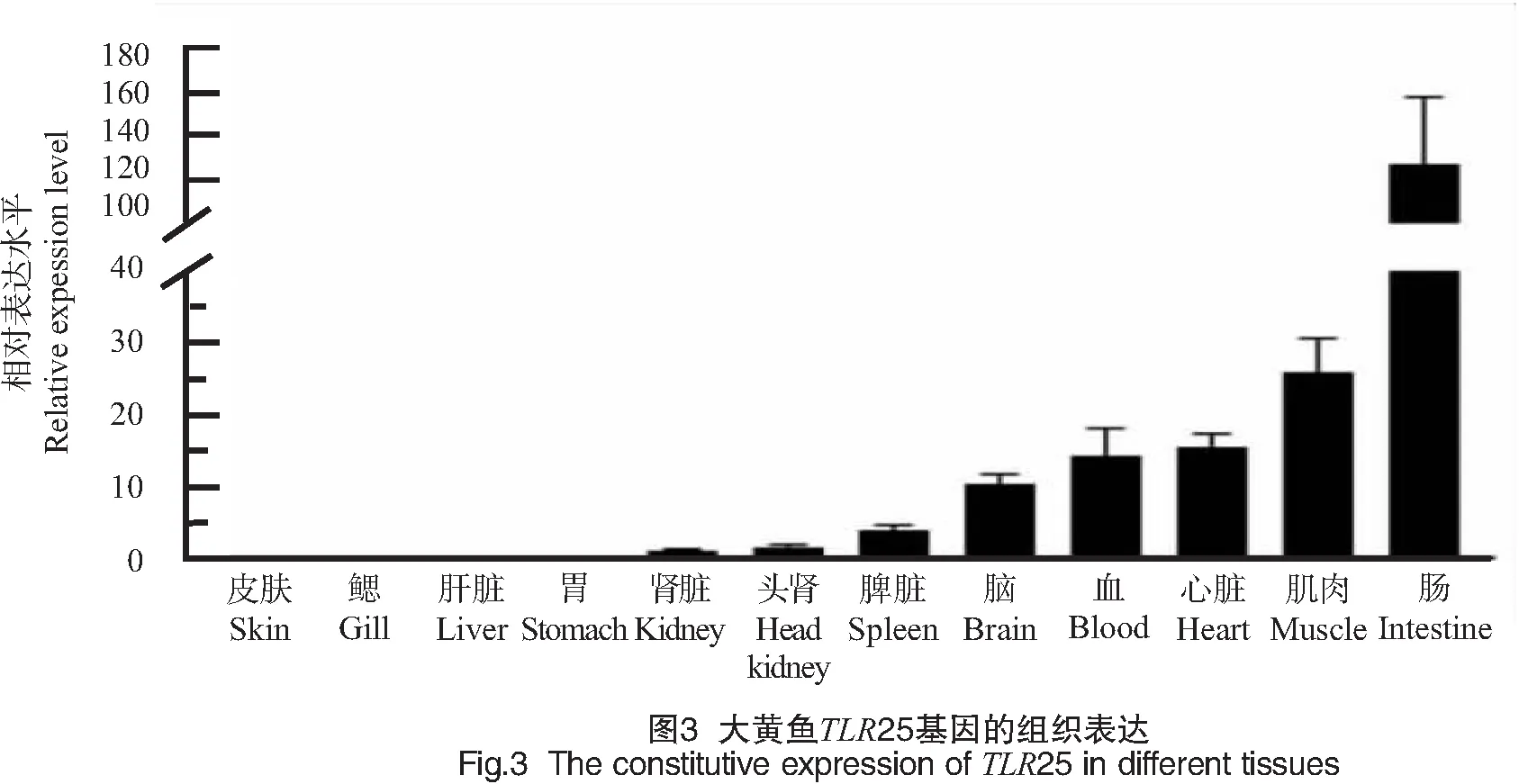
通过qPCR方法在大黄鱼12个组织(脑、鳃、心脏、头肾、肾脏、胃、肠、肝脏、脾脏、皮、肌肉、血液)中检测了LcTLR25基因的转录表达水平。结果表明,LcTLR25在肠、肌肉、心脏、血液、脑、脾脏、肾脏及头肾中均有表达。其中:在肠组织中的表达量最高;其次为肌肉、心脏、血细胞和脑组织;在头肾及肾脏组织中的表达量较低;而在胃、肝脏、鳃及皮肤中未检测到其表达(CT值>35)(结果见图3)。
2.5 大黄鱼TLR25的刺激表达谱
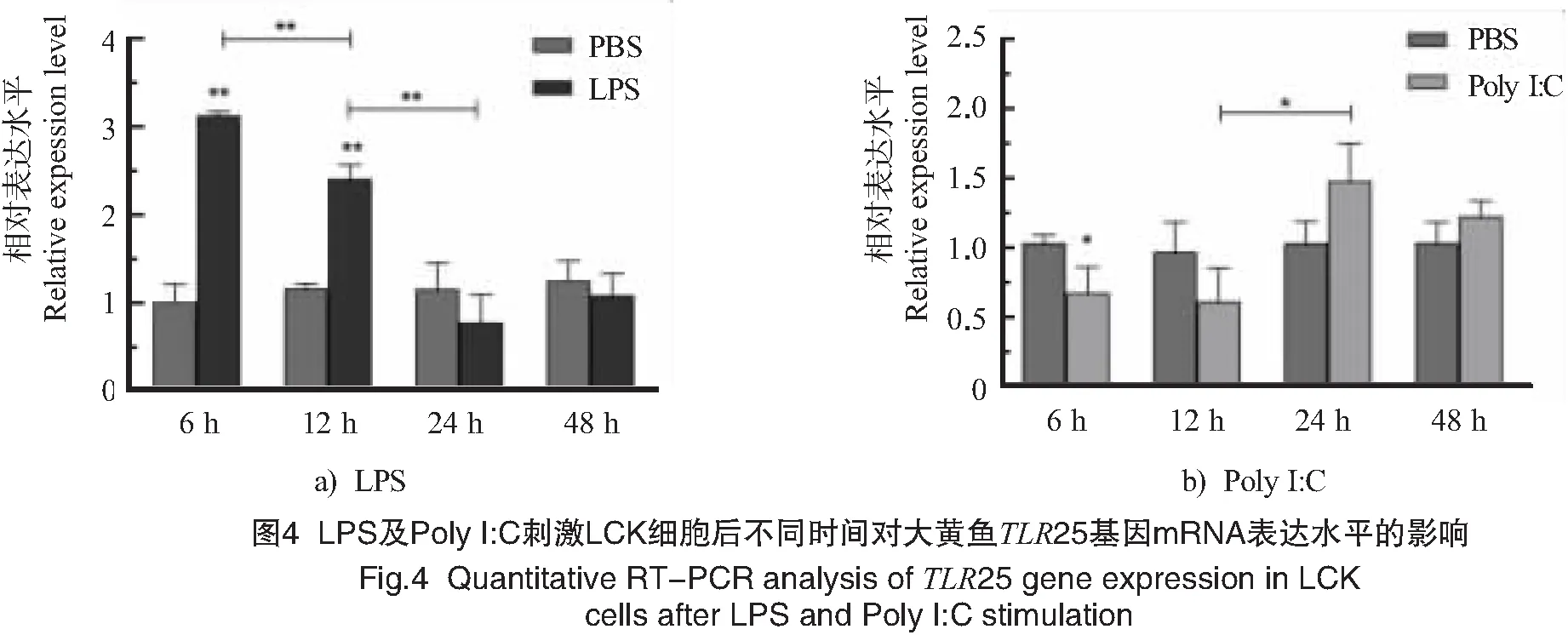
LCK细胞经LPS、Poly I:C刺激后,qPCR检测结果表明:LcTLR25基因表达水平在LPS刺激后6 h时极显著上调(P<0.01)并达到最大值,约为对照组表达水平的3.1倍;随后逐渐下降,但是在刺激后12 h时LcTLR25表达水平仍然显著高于对照组(P<0.01),约为对照组的2.3倍;但刺激后24 h及48 h时恢复至对照组水平。
在Poly I:C刺激后6 h时,LcTLR25表达水平显著下调(P<0.05),大约为对照组的70 %;随后逐渐增加,在刺激后24 h时显著高于对照组(P<0.05),约为对照组的1.5倍;但是在刺激后48 h时,恢复至对照组水平。
3 讨论
本研究克隆到2868 bp的大黄鱼TLR25基因cDNA序列,其开放阅读框1605 bp,编码534个氨基酸。BLASTN及多重比对结果显示大黄鱼TLR25碱基序列与尼罗罗非鱼TLR25具有最高的序列同源性。氨基酸序列分析及蛋白跨膜区预测显示LcTLR25具有5个典型的亮氨酸重复LRRs,1个跨膜结构域,并具有1个典型的TIR结构域(见图1),提示其属于典型的TLR家族。大黄鱼TLR25与鱼类TLR25分子氨基酸序列一致性约64%~77%。来自尼罗罗非鱼、达氏鲟、草鱼等的TLR25大多包含815~852个氨基酸,具有6~9个LRR结构域(见表2)。
LcTLR25包含较短的ORF,仅编码534个氨基酸,与其他鱼类TLR25相比,LcTLR25缺少了N端2~3个LRR结构域(见表2)。这是由于本实验克隆到的LcTLR25 cDNA在697—699 bp处由大多数鱼类TLR25中的“TGG”突变为 “TGA”,造成翻译终止,下一个密码子700—702 bp处的“AAA”变为“ATG”,造成了翻译起始位点后移,因此导致大黄鱼的TLR25编码区较短。在鱼类的进化过程中,由于基因组倍增及演化,导致了其基因型的多样性。目前,已经发现鱼类的许多功能基因存在不同基因型或者多种剪接体[21]。与其他物种相比,这种较短的LcTLR25基因可能是选择及进化的结果[22-23],这也可能导致了鱼类TLR比哺乳动物更为丰富多样。进化分析表明,LcTLR25与其他鱼类的TLR25聚为一支,并与其他成员一起聚为硬骨鱼的TLR1家族(见图2),说明本研究获得的序列可能为鱼类保守的TLR25,也分属于TLR1亚家族。
组织表达分析显示,大黄鱼TLR25在肠组织中表达量最高,其次是肌肉和脑(见图3)。齐口裂腹鱼TLR25在脑中表达量最高[16],鲤鱼TLR25在肌肉中表达量最高[24],与本研究结果相似。但是尼罗罗非鱼TLR25在脾脏组织中表达量较高[17],说明不同鱼类TLR25的组织表达水平可能存在差异,也有可能与鱼的生理状态有关。推测大黄鱼TLR25基因可能在肠道内具有重要功能。
大黄鱼肾脏细胞中的LcTLR25能够被LPS显著诱导(见图4)。Qi等[16]研究发现,尼罗罗非鱼TLR25的转录表达水平可以被LPS、LTA和酵母聚糖显著诱导[17];另外达氏鲟、齐口裂腹鱼的TLR25也表现出相似的研究结果[16-17]。TLR1亚家族主要识别来自细菌的PAMPs[25],LPS作为一种内毒素,能够诱导多种TLR及其下游关键因子的表达增加[26],提示LcTLR25可能参与LPS诱导的免疫反应。经Poly I:C刺激后,LcTLR25在刺激早期表达下调;然而在达氏鲟、齐口裂腹鱼及尼罗罗非鱼中,Poly I:C刺激均可诱导TLR25的表达上调[16-18]。这有可能与LcTLR25包含较少的LRR有关,也有可能是由于不同类型的细胞导致,详细机制还有待于深入研究。
综上所述;本实验克隆获得的大黄鱼TLR25基因,包含典型的TLRs家族结构域,为硬骨鱼类特有的TLR1家族成员;LcTLR25在大黄鱼肠组织中表达量最高;LPS可显著诱导LcTLR25表达上调,但是Poly I:C不能诱导其表达上调,提示LcTLR25可能更多参与LPS诱导的免疫反应。
