载脂蛋白A-I对基质金属蛋白酶-2的抑制作用机理
2023-07-13王钰佳李婉玉蔡雨晨张凌晶翁凌孙乐常曹敏杰
王钰佳,李婉玉,蔡雨晨,张凌晶,翁凌,孙乐常,曹敏杰
(集美大学海洋食品与生物工程学院,福建 厦门 361021)
0 引言
鲢鱼(Hypophthalmichthysmolitrix)是淡水鱼中的代表性鱼类,由于其生命力强,分布地域广,是常用的研究对象[1-2]。鱼死后的生化变化直接影响鱼肉的品质和价值,而由内源酶引起的鱼肉蛋白质降解是导致鱼肉质构软化的主要原因[3]。特别是基质金属蛋白酶(matrix metalloproteases,MMP)由于可以降解胶原蛋白,对肌肉软化起着重要的作用。因此,研究其内源性抑制剂对于揭示鱼死后肌肉质构变化规律有重要意义[4]。
MMP是一种含锌、钙依赖性的内肽酶,它负责细胞外基质的降解,参与胚胎发育、器官形态发生、骨重塑等许多生物学过程。在鱼类中,MMP在胚胎发育、组织修复中发挥重要作用。在MMP中,MMP-2(EC 3.4.24.24)和MMP-9(EC 3.4.24.35)因与明胶降解有关,被归类为明胶酶[5-6]。在不同鱼类中已经检测到明胶酶的存在,如太平洋岩鱼(Sebastessp.)[7]、鱼(Seriolaquinqueradiata)[8]、大西洋鳕鱼(Gadusmorhua)、花狼鱼(Anarhichasminor)和大西洋鲑鱼(Salmosalar)等[9]。明胶酶被认为参与了胶原蛋白的代谢,使肌肉纤维蛋白降解,导致鱼体软化[10]。在生物体内,MMP的活性受内源性抑制剂的调控,如组织金属蛋白酶抑制剂(tissue inhibitors of metalloprotease,TIMPs)、α2-巨球蛋白、肝素和反转录富含半胱氨酸蛋白(reversion inducing cysteine-rich protein with Kazal motifs,RECK)等[11]。
蛋白质的功能通常是通过蛋白质之间的相互作用来调节的,蛋白质的结构决定其功能,蛋白质晶体结构的解析为分析酶相互作用及催化机理提供了研究基础。对部分MMP与TIMPs晶体结构的分析发现,TIMPs直接与MMP活性位点的催化区域的Zn2+结合,从而抑制酶的活性[12-13]。然而,由于一些MMP的晶体结构难以获得,因此它们与抑制剂的相互作用及抑制机理研究甚少。近年来,由于生物信息学的不断发展,对已知序列进行三维建模获得其结构的方法已非常成熟,在探究分子间相互作用方面也已广泛使用,为一些难以获得晶体结构的蛋白质的研究提供了新方法,这些方法也被用于解释酶和抑制剂的相互作用关系及抑制机理[14-15]。
与哺乳动物MMP的研究相比,鱼类MMP的研究还相当匮乏,特别是对MMP内源性抑制剂的研究则更少。因此,本研究利用分子生物学手段,在大肠杆菌中克隆并表达了相对分子质量为37 ku的鲢鱼MMP-2催化结构域(rHm-MMP-2c),利用此酶进一步从鲢鱼肌肉中筛选分离了一种对rHm-MMP-2c有抑制作用的蛋白质,经质谱分析鉴定,发现该蛋白质为载脂蛋白A-I(Apo A-I)。为探究Apo A-I与rHm-MMP-2c的相互作用机理,对这2个蛋白质同源建模并进行分子对接,探究其相互作用方式,为研究MMP-2及其抑制剂提供了一定的理论参考。
1 材料与方法
1.1 材料与试剂
白鲢鱼购于福建省厦门市集美区菜市场(2~3 kg/条),即杀后取肌肉放置于冰上,立即用于实验。
分子克隆所用引物均在厦门博瑞生物科技有限公司合成;U-Clone Master Mix,美国Evomic公司;表达载体pET30a(+)-V29H(V29H),美国EMD生物科学公司;合成荧光底物Mca-Pro-Leu-Gly-Leu-Dap (Dnp)-Ala-Arg-NH2(MOCA),日本Peptide Institute公司;TEV酶,美国Sigma公司;Ni-NTA亲和柱、DEAE-Sepharose和Phenyl Sepharose,美国GE Healthcare产品;鲢鱼I型胶原蛋白,集美大学海洋食品与生物工程学院实验室制备;其他试剂均为分析级。
1.2 实验方法
1.2.1 rHm-MMP-2c的克隆及表达
RNA提取步骤参考总RNA提取试剂盒说明书进行,cDNA按PrimeScript TM Ⅱ 1st Strand cDNA合成试剂盒说明书合成。利用DNAMAN软件设计引物5’-CGAGAATCTTTATTTCCAAGGTTCTGTCGACAAGCCCAAGTGGGGACAGAAAAAC-3’和5’-AGTTAGCTTGCGGCCGCAGAGTCGACACCATACAG
CTCCTGGATGCCTTTAA-3’(引物均含有SalI酶切位点)。构建鲢鱼MMP-2催化结构域克隆载体,将测序正确的质粒和V29H载体质粒分别用SalⅠ单酶切处理,用U-Clone Master Mix将截断的rHm-MMP-2c基因片段和线性化的质粒V29H在50 ℃下连接1 h,并将连接产物转化至大肠杆菌BL21(DE3)中筛选阳性菌并测序,测序正确的质粒命名为V29H-rHm-MMP-2c。重组蛋白表达方法参考文献[16],利用SDS-PAGE和明胶酶谱检测表达结果,用Lowry法测定蛋白质浓度。
1.2.2 rHm-MMP-2c抑制剂的纯化
将新鲜的鲢鱼敲击致死后,取肌肉150 g,加入8倍体积的20 mmol/L Tris-HCl缓冲液,pH=8.0,用组织捣碎机捣碎,在12 000 r/min下离心20 min并用绢布过滤。上清液60 ℃加热30 min,在冰上冷却至室温后再次离心,上清液用50%~90%的硫酸铵分级沉淀,用上述缓冲液溶解沉淀并充分透析,透析后体积为40~50 mL。将透析后的样品依次上样于DEAE-Sepharose阴离子交换柱和Phenyl Sepharose层析柱(5 mL),测定A280值和抑制活性,收集有抑制活性部分进行电泳分析。
1.2.3 抑制剂的质谱分析
纯化蛋白进行SDS-PAGE分析,将样品在凝胶状态下用测序级胰蛋白酶酶解后,用串联飞行时间质谱仪(5800 MALDI-TOF/TOF,AB SCIEX)进行分析。质谱条件:激光源为335 nm的Nd:YAG激光器,加速电压为2 000 V,扫描范围为800~4 000 u。选择信噪比大于50的母离子进行二次质谱(MS/MS)分析,二次质谱(MS/MS)激光叠加2 500次。
1.2.4 rHm-MMP-2c酶活力测定
rHm-MMP-2c酶活力测定采用Nagase[17]描述的方法并略加修改,在900 μL的20 mmol/L Tris-HCl(含1 mmol/L Ca2+、1 μmol/L Zn2+、pH= 8.0)(buffer A)中加入50 μL rHm-MMP-2c和50 μL的10 μmol/L合成荧光底物MOCA,在37 ℃下反应30 min后,加入1.5 mL终止液(V(甲醇)∶V(异丙醇)∶V(蒸馏水)=35∶30∶35)终止反应。在激发波长为328 nm、发射波长为393 nm下测定反应释放的Mca-Pro-Leu-Gly荧光强度。酶活力单位(U)定义为每分钟释放1 nmol Mca-Pro-Leu-Gly所需的酶量。
1.2.5 抑制剂对rHm-MMP-2c的抑制酶活力测定
将800 μL buffer A、50 μL rHm-MMP-2c(3 μmol/L)和100 μL(3 μmol/L)抑制剂混匀,在4 ℃下孵育30 min后加入10 μmol/L合成荧光底物MOCA,于37 ℃下反应30 min,加入1.5 mL终止液终止反应,在激发波长为328 nm、发射波长为393 nm下测定反应释放的Mca-Pro-Leu-Gly荧光强度,抑制率=(1-A/B)×100%,式中:A为实验组的荧光吸收值;B为对照组的荧光吸收值。
1.2.6 抑制剂对rHm-MMP-2c的抑制动力学分析
根据节1.2.5活性测定方法测定内源性抑制剂的抑制活性,分别测定抑制剂浓度为0,3,5,10 μmol/L的rHm-MMP-2c的活性(rHm-MMP-2c浓度为0,3,6,10 μmol/L),并计算反应初速率,分析抑制剂对MMP-2的抑制类型。参考陈清西[18]的方法进行抑制动力学分析,根据所得数据计算半抑制浓度(IC50)。
1.2.7 抑制剂对rHm-MMP-2c降解I型胶原的抑制作用分析
rHm-MMP-2c可有效降解胶原蛋白,为探究抑制剂(Apo A-I)的抑制作用,将纯化的rHm-MMP-2c与I型胶原蛋白在4 ℃下进行孵育。反应系统总量为150 μL,由50 μL I型胶原蛋白(40 μg)、50 μL rHm-MMP-2c(20 ng)和50 μL buffer A(含或不含20 ng Apo A-I)组成,分别在4 ℃孵育0,24,48,72,96 h。阳性对照为50 μL I型胶原、50 μL rHm-MMP-2c、50 μL buffer A(含10 mmol/L EDTA)。阴性对照为50 μL I型胶原蛋白和100 μL buffer A。在4 ℃下孵育96 h,取样进行电泳分析。
1.2.8 分子对接
分子对接是一种研究蛋白质与配体相互作用的有效方法[19]。根据人MMP-2(PDB:1AV1)的晶体结构,用Swissmodel(https://swissmodel.expasy.org/)三维建模获得了不同物种鱼类的MMP-2c的结构。用I-TASSER服务器(http://hdl.handle.net/1808/12854)预测Apo A-I的结构[20]。MOCA的三维结构在Chem3D Ultra(8.0)中绘制得到。用Autodock Vina(1.1.3)进行来自不同物种的MMP-2c与荧光底物MOCA的分子对接。rHm-MMP-2c与Apo A-I的对接使用ZDOCK服务器(http://zdock.umassmed.edu/)完成。结合力、结合能和结合位点的结果用PDBePISA(https://www.ebi.ac.uk/msd-srv/prot_int/pistart.html)和Discovery Studio(2019)处理。
1.3 统计分析
本文中所有数据均为3次重复的平均值,采用Excel 2019对数据进行处理并进行误差分析。制图及排版在PowerPoint 2019和Adobe Illustrator CS5上完成。
2 实验结果与分析
2.1 rHm-MMP-2c的分子克隆
从NCBI(GenBank:KR822184.1)中获得鲢鱼MMP-2的全长cDNA序列(2 792 bp),通过DNAMAN(8.0)分析得到,其编码332个氨基酸残基的催化结构域(MMP-2c),设计引物进行克隆,预测相对分子质量为37.3 ku,pI为4.38。BLASTp分析结果显示,鲢鱼MMP-2与草鱼(Ctenopharyngodonidella)MMP-2同源性为98%(GenBank:ADU34084.1),与斑马鱼(Daniorerio)MMP-2同源性为93%(GenBank:AAH76545.1),与日本海参(Apostichopusjaponicus)MMP-2同源性为92%(GenBank:AYL88763.1)。在rHm-MMP-2c催化结构域中发现了3个纤连蛋白结构域(Fibronectin Ⅱ domain,Fn)。有研究表明,Fn区对MMP-2的催化活性起着至关重要的作用[21]。另外,MMP-2的Zn2+结构域(ZBG)和位于催化结构中心的序列HFGHXLGLXHS在不同的物种中是保守的,序列中的3个组氨酸残基与Zn2+结合密切相关,对酶活性的维持起着重要的作用[22]。在rHm-MMP-2c中,位于催化结构中心的保守序列为His290到Ser301(HEFGHALGLEHS),其中3个组氨酸(His290、His294和His300)和ZBG结合并发挥催化作用(见图1)。

2.2 rHm-MMP-2c的原核表达与鉴定
rHm-MMP-2c在上清液中表达,由于载体含有可溶标签麦芽糖结合蛋白(MBP),需经TEV酶酶解切掉MBP才能得到目的蛋白(见图2a),用Ni-NTA亲和层析柱即可除去MBP[23]。纯化得到目的蛋白rHm-MMP-2c,其相对分子质量为37 ku(见图2b的第6泳道),与理论值37.3 ku一致。明胶酶谱验证了酶的活性(见图2b的第7泳道),显示了其降解明胶的活性。
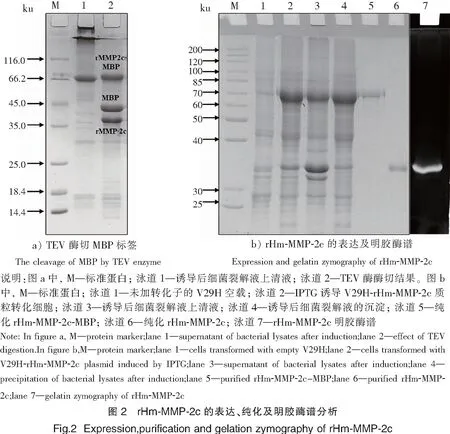
由于鱼肌肉中MMP-2的含量很少,而天然MMP-2的纯化又非常困难,因此对MMP-2的研究大多是通过对其进行克隆和表达来进行的[24]。此前,Wang等[25]对鲤鱼MMP-2的催化结构域进行了克隆和表达。然而,鲤鱼MMP-2的催化结构域表达在沉淀中进行,复性过程繁琐复杂,不利于大量纯化和应用。在本研究中,rHm-MMP-2c可以在上清液中高效表达并有活性,易于分离纯化,有利于筛选其内源性抑制剂。
2.3 rHm-MMP-2c抑制剂的纯化
为除掉样品中大部分杂蛋白质,对鲢鱼肌肉样品60 ℃加热后进行50%~90%硫酸铵盐析,根据目标蛋白的特性采用柱层析纯化。预处理后的样品经透析后上样于DEAE-Sepharose阴离子交换柱,活性峰出现在0~0.2 mol/L的NaCl阶段洗脱处,如图3a所示,抑制酶活力呈单一峰型,收集活性部分进行下一步层析。当硫酸铵浓度为2 mol/L时,样品能有效吸附在Phenyl-Sepharose疏水层析柱上,降低盐浓度可以将目的蛋白洗脱下来。由图3b可以看出,大部分的杂蛋白在流洗部分被除去,目的蛋白在硫酸铵浓度为0.5 mol/L左右被洗脱下来,抑制酶活性峰与蛋白质峰一致。收集具有抑制活性部分,用buffer A透析后保存,进行电泳处理及后续抑制活性测定。2次柱层析之后,抑制剂已经被高度纯化,得到相对分子质量为28 ku的单一蛋白质条带(见图3c的泳道4)。

2.4 rHm-MMP-2c抑制剂的质谱鉴定
为了获得抑制剂的一级结构信息,对蛋白质进行了质谱分析。选择信噪比大于50的肽段进行质谱分析,二级质谱分析结果如图4a所示,共得到11个含有146个氨基酸残基的多肽(见表1)。将质谱/质谱分析结果与NCBI数据库中的蛋白质序列进行比较(见图4b),得到的序列与鲢鱼的Apo A-I序列(gi|295314922)相似性为100%,证明纯化后的蛋白质为Apo A-I。Apo A-I是一种主要的载脂蛋白,可以参与机体内脂蛋白的代谢,维持正常血脂代谢的平衡[26-27]。本研究获得的Apo A-I相对分子质量为28 ku,与鲤鱼中纯化的Apo A-I(27.5 ku)一致。研究表明,在虹鳟鱼、大西洋鲑、日本鳗鲡、红鳍东方鲀等硬骨鱼中发现有2个亚型Apo A-I,这些不同亚型的出现可能是由于一些特征谱系的硬骨鱼类和鳐鳍鱼类进化中全基因组复制导致,而Apo A-I的许多亚型在不同的组织中有不同的调节方式[28-29]。
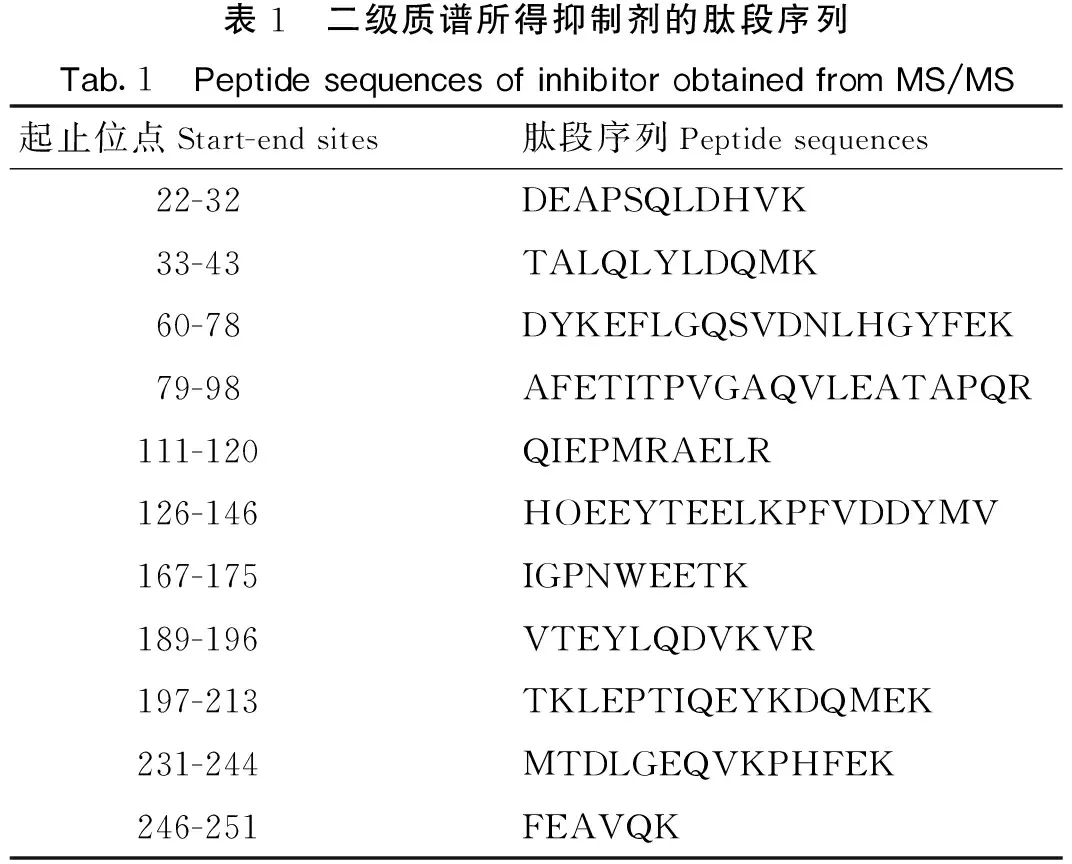
表1 二级质谱所得抑制剂的肽段序列Tab.1 Peptide sequences of inhibitor obtained from MS/MS起止位点Start-end sites肽段序列Peptide sequences22-32 DEAPSQLDHVK33-43 TALQLYLDQMK60-78 DYKEFLGQSVDNLHGYFEK79-98 AFETITPVGAQVLEATAPQR111-120 QIEPMRAELR126-146 HOEEYTEELKPFVDDYMV167-175 IGPNWEETK189-196 VTEYLQDVKVR197-213 TKLEPTIQEYKDQMEK231-244 MTDLGEQVKPHFEK246-251 FEAVQK

2.5 Apo A-I对rHm-MMP-2c降解I型胶原的抑制
将鲢鱼I型胶原和rHm-MMP-2c置于4 ℃孵育96 h,检测冷藏时酶对I型胶原蛋白的降解情况,结果显示,酶能消化I型胶原蛋白的β链、α1链和α2链(见图5泳道1~5)。金属蛋白酶抑制剂EDTA可完全抑制rHm-MMP-2c的酶活性(见图5泳道8)。在Apo A-I存在下,rHm-MMP-2c对I型胶原蛋白的降解被抑制70%(见图5泳道6)。Apo A-I对rHm-MMP-2c的抑制力较EDTA弱,主要原因可能是其分子量大,但这也证明了Apo A-I可以有效抑制由该酶引起的胶原蛋白在4 ℃下的降解。
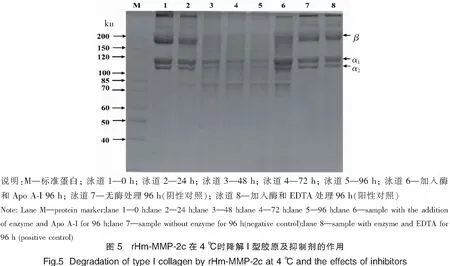
鱼肉冷藏过程中胶原蛋白的降解是其软化的重要原因,而胶原蛋白的降解与鱼体内存在的内源酶密切相关[30]。有研究表明,在鱼死后的冷藏过程中都能检测到MMP活性,MMP对胶原蛋白的降解作用是导致鱼类肌肉在冷藏过程中软化的主要原因[31]。本研究表明,在冷藏过程中,rHm-MMP-2c对I型胶原蛋白有降解作用,而Apo A-I作为内源性抑制剂可以在一定程度上抑制其降解进程。
2.6 Apo A-I对rHm-MMP-2c的抑制动力学
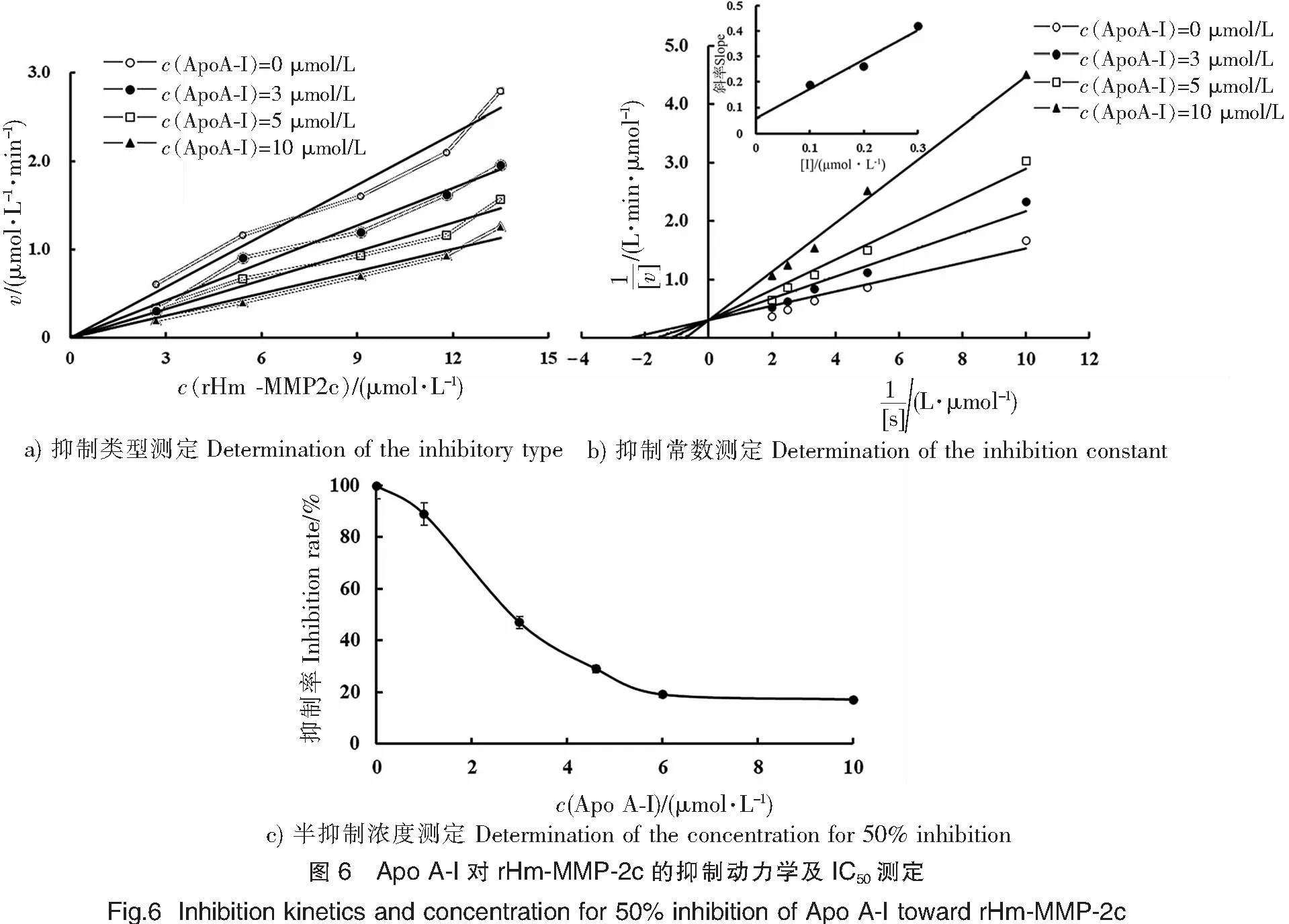
抑制动力学研究可以阐释抑制剂与酶的相互作用机制。如图6a所示,不同浓度的Apo A-I对不同浓度rHm-MMP-2c的抑制曲线均交于原点,表明Apo A-I对rHm-MMP-2c的抑制是可逆的。利用不同浓度的抑制剂Apo A-I、底物MOCA与rHm-MMP-2c测定反应初速率,以底物浓度的倒数为横坐标,初速率的倒数为纵坐标,绘制Lineweaver-Burk双倒数图,根据曲线的交点可知其抑制类型。如图6b所示,不同浓度的线性回归曲线交于Y轴的正半轴,表现为竞争抑制,即不改变酶的最大反应速度vm,酶的Km随着抑制剂浓度的增加而增加。用二次作图法求出双倒数图的斜率,计算得出Apo A-I的抑制常数Ki为1.31 μmol/L。
根据rHm-MMP-2c抑制活性检测方法,测定不同浓度的特异性抑制剂Apo A-I对rHm-MMP-2c的抑制率。如图6c所示,以不同浓度的Apo A-I(0,3,5,10 μmol/L)为横坐标,以抑制率为纵坐标,计算出Apo A-I对rHm-MMP-2c的半抑制浓度(IC50)为3.33 μmol/L。Sarker等[32]从人类血清中发现,纤维蛋白原是MMP-2的反竞争抑制剂,其与MMP-2之间的IC50为6.76 μmol/L。而Apo A-I的IC50值与之相比更小,说明Apo A-I对rHm-MMP-2c的抑制作用优于纤维蛋白原。
2.7 分子对接
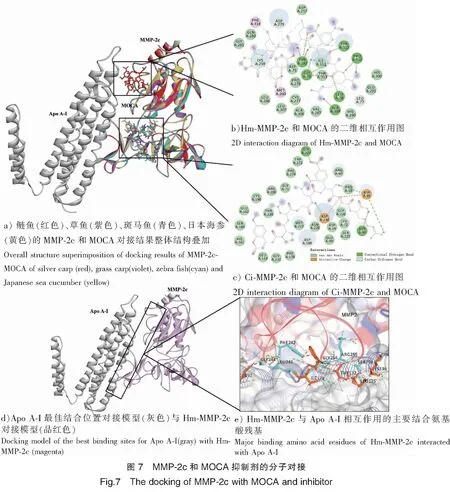
分子对接可以直观地展示rHm-MMP2c-MOCA体系和rHm-MMP2c-Apo A-I体系之间的结合方式。rHm-MMP-2c-MOCA体系对接的结合自由能为-36 kJ/mol,rHm-MMP2c-Apo A-I体系最佳对接结果的自由能为-49.4 kJ/mol,这表明,Apo A-I与rHm-MMP2c的结合比MOCA更强,亲和力更高。
为了探究MOCA与不同物种MMP-2催化结构域的结合位置,由NCBI检索可知,草鱼(Ctenopharyngodonidella)、斑马鱼(Daniorerio)、日本海参(Apostichopusjaponicus)与鲢鱼(Hypophthalmichthysmolitrix)的序列相似性均在92%以上,用人(Homosapiens)MMP-2c的晶体结构(PDB:1EAK)为模板对MMP-2c进行建模后,采用Autodock vina(1.1.3)对酶和底物进行分子对接。将不同物种MMP-2c与MOCA的对接结果进行叠加发现,鲢鱼MMP-2c(Hm-MMP-2c)与MOCA的对接位置与其他3种不同,Hm-MMP-2c与MOCA的结合位点位于其催化腔的催化区域(见图7a)。从图7b中可以看到,Gly76、Leu78、Tyr282、Ala309、Pro310、Tyr312可以与MOCA形成氢键,维持整个体系的稳定性。在鲢鱼中,与MOCA相互作用的残基来自催化结构域和ZBG区域,而其他3种鱼的MMP-2c则通过Fn结合区域与MOCA结合。以草鱼MMP-2c(Ci-MMP-2c)和MOCA为例(见图7c),位于Fn区域的Gly227和Asp94分别与MOCA形成氢键,而Glu162、Asp188、Ser189等Fn区域的残基和MOCA主要以范德华力为主。由鲢鱼、草鱼MMP-2c与MOCA的对接结果可知,虽然酶的一级、二级结构相似,但它们与同一底物的结合可能存在较大差异。对比rHm-MMP-2c与Apo A-I对接的结果,该抑制剂主要通过氢键作用于rHm-MMP-2c的Fn区,包括Asp75、Leu78、Leu286、His300、Glu302、Ile311、Tyr312、Thr313、Lys316、Leu77、His290和Val287(见图7e)。Apo A-I与rHm-MMP-2c在MOCA结合的催化区域发生相互作用,以往的报道表明,催化腔内的残基在抑制剂结合中发挥重要作用[33]。可以推测,Apo A-I形成的空间位阻堵住了底物的入口,从而抑制了rHm-MMP-2c的活性。
3 结论
本研究以鲢鱼为对象,在大肠杆菌中高效表达并纯化了MMP-2的催化结构域(rHm-MMP-2c)。以rHm-MMP-2c为靶标,从鲢鱼肌肉中筛选并纯化了一种内源性抑制剂,质谱分析鉴定为载脂蛋白A-I(Apo A-I)。Apo A-I为rHm-MMP-2c的竞争型抑制剂,其抑制常数(Ki)为1.31 μmol/L,半抑制浓度(IC50)为3.33 μmol/L。rHm-MMP-2c在4 ℃时降解I型胶原蛋白,Apo A-I的加入可有效抑制其降解速率。分子对接结果表明,Apo A-I和rHm-MMP-2c主要以氢键相互作用为主,Apo A-I形成的空间位阻阻碍了底物与酶催化活性中心接近,从而抑制酶的活性。
