门诊患者华法林抗凝稳定性及合并用药情况分析*
2023-07-12陈瑾瑾刘培延杜林哲
陈瑾瑾,刘培延,杜林哲
南京医科大学附属南京医院(南京市第一医院)药学部,南京210006
华法林是临床用于预防和治疗血栓栓塞性疾病最常用的口服抗凝药物[1-3]。华法林预防血栓栓塞的有效性和安全性取决于抗凝治疗的强度和稳定性,当开始华法林治疗时,通过国际标准化比率(international normalized ratio,INR)监测其抗凝强度,理想的INR 范围因疾病而异[4]。华法林抗凝稳定性通过INR 在治疗目标范围内的时间百分比(time in therapeutic range,TTR)进行评价,TTR≥65%可获最佳抗凝效果[5]。但由于其治疗窗口狭窄、患者个体差异大,且与多种药物存在药物相互作用[1-3],华法林治疗的管理往往具有挑战性。为此,本研究回顾性分析了我院门诊患者华法林的相关抗凝情况和合并用药,为加强患者用药管理提供参考。
1 资料和方法
1.1 研究对象
以30%的比例随机抽取我院2021 年1 月~2021 年12 月期间门诊电子信息系统中开具华法林钠片处方患者的临床数据,包括患者姓名、年龄、性别、门诊诊断、处方开具科室、处方药物的品种和数量以及INR 值结果和检测日期。患者需满足以下纳入条件:①至少每三个月在我院门诊监测INR 值一次;②既往已接受华法林治疗≥1 个月;③2021 年1月~2021 年12 月期间无住院治疗记录。排除标准:①门诊病历信息缺失;②INR 测量记录不完整;③2021 年1 月~2021 年12 月期间使用其他品种的抗凝药物;④其他相关的临床信息不符合研究的条件。
1.2 研究方法
使用Rosendaal 插值方法[6]计算纳入患者一年期的TTR,该方法假设两个连续INR 结果之间存在线性关系,计算INR 值在治疗范围内的天数百分比。不同华法林适应症的INR 目标值有所不同,结合相关指南和本医疗机构的临床实际,心房颤动以及预防或治疗深静脉血栓形成的INR 目标值为2~3,心脏机械瓣膜置换术后的INR 目标值为1.8~2.5。亚治疗范围范围定义为华法林INR 监测值小于INR 目标值,治疗范围定义为华法林INR 监测值在INR 目标范围之内,超治疗范围定义为华法林INR 监测值高于INR 目标范围。TTR≥65%定义为华法林抗凝稳定性控制良好,TTR<65%定义为华法林抗凝稳定性控制不良。本研究中合并用药定义为患者在本医疗机构2021 年度门诊处方中开具的除华法林以外的其他所有药物,与华法林存在潜在相互作用的药物的定义主要参考药品说明书和相关临床指南[7]。
1.3 统计学方法
采用SPSS 23.0 软件对所有数据进行汇总统计分析。采用Kolmogorov-Smirnov 检验对所有连续性变量进行正态性检验,正态数据以()表示,采用两独立样本t 检验比较;偏态资料以中位数和四分位数间距表示,采用秩和检验比较;计数资料以频数和百分数表示,采用χ2检验;P <0.05 表示差异具有统计学意义。采用二分类logistic 回归分析确定影响华法林TTR 控制不良的因素。
2 结果
2.1 门诊服用华法林患者一般特征
根据入排标准进行筛选患者,具体的入选流程图见图1。共有110 例患者纳入研究,男性42 例(38.18%),女性68 例(61.81%);年龄范围在27~82岁,中位年龄63 岁。华法林的主要适应症为心脏机械瓣膜置换术后68 例(61.81%),心房颤动39 例(35.45%)和预防或治疗深静脉血栓形成3 例(2.73%)。INR 目标值范围为2~3 有42 例(38.18%),而范围为1.8~2.5 的患者有68 例(61.81%)。其中高血压是纳入患者最常见的合并症,占31.82%,其次分别为感染性疾病(20.00%)和冠心病(18.18%)。纳入研究患者的一般临床特征详见表1。

表1 患者一般临床特征(n=110)[n(%)]

图1 纳入患者入选流程图
2.2 门诊患者华法林合并用药情况
纳入患者2021 年度平均合并用药(4.93 ±4.19)种。超过五成的患者合并用药的数量不超过四种,其中,合并其他两种药物的患者所占比例最高,达14.55%(16/110);未开具除华法林钠片以外的其他药物的患者占比为12.73%(14/110);合并其他一种和三种药物的患者占比相等,均为10%(11/110);而合并用药的数量超过十种的患者不足一成,有1例患者(0.91%)最多合并开具了其他17 种药物。
对患者合并用药的具体药物品种进行分析,合并使用中成药的患者比例最高,高达42.73%(47/110);其次分别为β 受体阻滞剂(38.18%)、利尿剂(25.45%)、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂(23.64%)、调脂类药物(20.00%)、钙离子通道拮抗剂(16.36%)、抗菌药物(16.36%)、强心苷类(10.00%)、非甾体抗炎药(9.09%)、糖皮质激素类(8.18%)、抗血小板药物(7.27%)、镇定催眠药物(7.27%)、抗心律失常药物(7.27%)、降糖药物(6.36%)。
纳入的患者中有45 例(40.90%)至少使用了一种与华法林存在潜在相互作用的药物,其中,有29例(64.44%)使用了1 种存在潜在相互作用的药物,13 例(28.89%)使用了2 种潜在相互作用的药物,2例(4.44%)使用了3 种潜在相互作用的药物,1 例(2.22%)最多使用了4 种存在潜在相互作用的药物品种。不同INR 目标值患者使用与华法林存在潜在相互作用药物的比列有所不同,INR 目标值1.8~2.5 和2~3 的患者中分别有23 例(33.82%)和22 例(52.38%)使用了与华法林存在潜在相互作用的药物。纳入患者使用与华法林存在潜在相互作用的药物的具体品种见表2。

表2 与华法林存在潜在相互作用的具体药物品种使用情况[n(%)]
2.3 门诊患者华法林INR 值监测情况
共收集纳入患者我院门诊INR 监测数据1011个,其中监测次数最少为5次,最多为26次,平均每人的监测次数为(9.19±2.55)次;最长间隔91 天监测一次,最短间隔1 天监测一次,平均间隔(39.41±18.05)天监测一次。纳入患者INR 值波动范围在0.96~5.95,INR 监测值在1.5~2.0 范围内的次数最多,有436 次(43.13%),其次为INR 值在2.0~2.5 范围内,有282 次(27.89%),INR 监测值≥3.0 的次数较少,仅43 次(4.25%)。纳入患者在不同INR 值间隔的分布见图2。
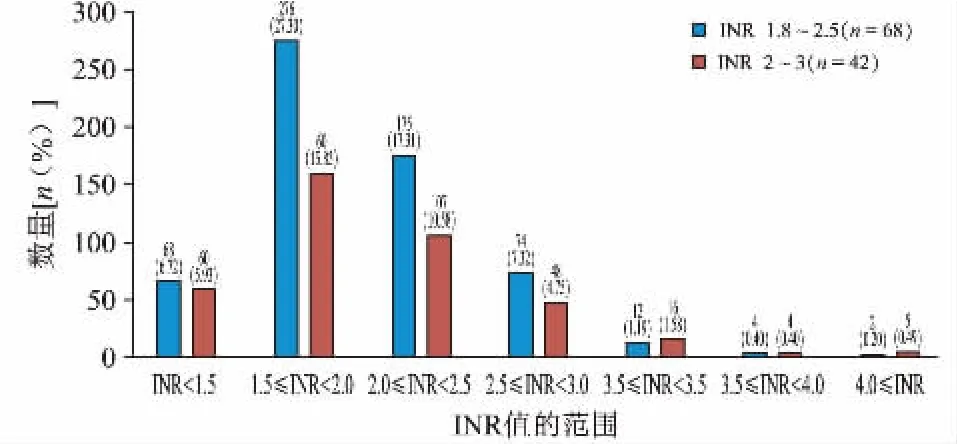
图2 门诊患者华法林在不同INR 值间隔内的分布
患者INR 值在亚治疗和超治疗范围内的TTR分别为39.86%和11.90%。不同INR 目标值患者INR 值在亚治疗、治疗和超治疗范围内的TTR 有所不同:INR(1.8~2.5)目标值组在治疗范围内的TTR与INR(2.0~3.0)目标值组差异无统计学意义(P >0.05);INR(1.8~2.5)目标值组在亚治疗范围内的TTR 低于INR(2.0~3.0)目标值组(P <0.05);INR(1.8~2.5)目标值组在超治疗范围内的TTR 高于INR(2.0~3.0)目标值组(P <0.05),见图3。

图3 门诊患者华法林INR 在亚治疗、治疗和超治疗范围内的所占时间百分比
纳入患者华法林TTR 平均值为(48.18 ±21.49)%,其中,稳定性控制良好(TTR≥65%)的患者仅24 例(21.82%),稳定性控制不良(TTR<65%)的患者86 例(78.18%),有18 例(16.36%)TTR<40%。INR目标值1.8~2.5 的患者中有15 例(22.06%)华法林稳定性良好,INR 目标值2~3 的患者中有9 例(21.43%)华法林稳定性良好,两者无显著性差异(P <0.05)。表3 汇总了不同目标值的门诊患者华法林TTR 的具体达标情况。
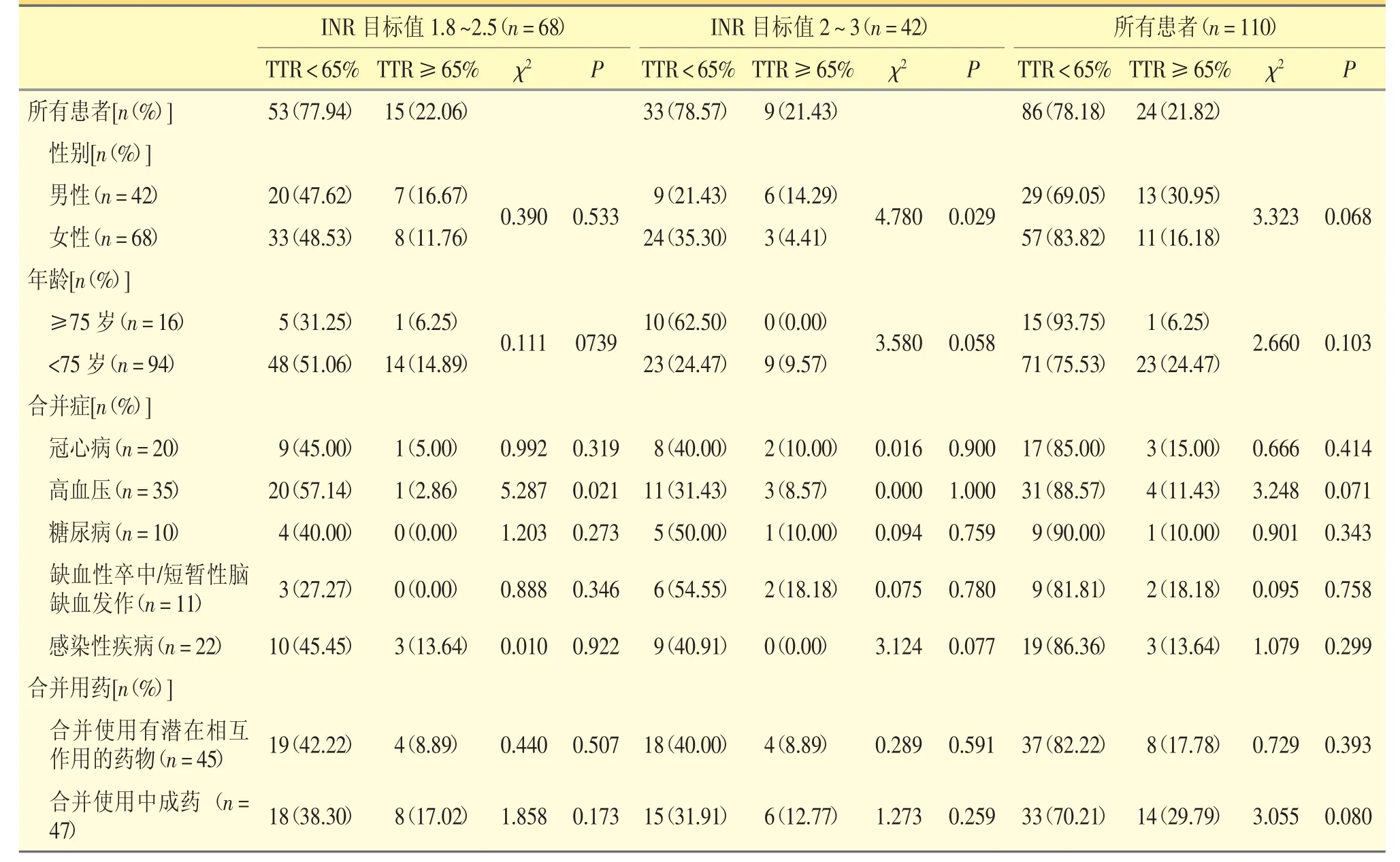
表3 门诊患者华法林TTR 具体达标情况[n(%)]
2.4 门诊患者华法林抗凝稳定性影响因素分析
采用二分类logistic 回归分析评估患者华法林抗凝稳定性控制不良的预测因素,以TTR 控制情况(TTR ≥65%定义为控制良好,TTR <65%定义为控制不良)为因变量,将单因素分析时统计学上或存在临床意义的变量:性别、年龄≥75 岁、高血压和合并使用中成药作为自变量进行回归分析。分析结果显示,合并高血压(HR 0.229;0.066~0.790;P <0.05)和合并使用中成药(HR 3.048;1.124~8.263;P <0.05)均显著影响门诊患者华法林的抗凝稳定性,具体回归分析结果见表4。
3 讨论
TTR 是评估华法林治疗安全性和有效性的重要指标,TTR 的最大化能显著降低患者中风、大出血或死亡的风险[8]。在既往随机对照试验[5]中,华法林的TTR 值比较理想,可达60%以上,但是在临床实践中华法林TTR 值的管理存在挑战,尤其在发展中国家,TTR 值往往更不理想[9]。在我们的研究中也证实了这一观点,纳入患者平均TTR 值为48.18%,仅有21.82%的患者TTR ≥65%。为提高临床患者华法林TTR 值的达标情况,我们需要分析患者TTR值偏低的可能原因并寻找相应的对策。
纳入患者在亚治疗范围时间比远高于超治疗范围时间比(39.86% vs 11.90%,P <0.05);INR(1.8~2.5)目标值组的平均TTR 值高于INR(2.0~3.0)目标值组(51.22% vs 43.26%,P >0.05)。INR 指标值越高,带来的出血风险也越高,基于此,推测这一现象产生的原因可能是医患双方对于较高INR 值会增加出血风险的担心。值得一提的是,不同INR 目标值患者在亚治疗和超治疗范围内所占平均时间百分比有所不同,INR(1.8~2.5)目标值组在亚治疗范围的平均时间占比低于INR(2.0~3.0)目标值组(P <0.05);但在超治疗范围的平均时间占比却高于INR(2.0~3.0)目标值组(P <0.05),由此可以看出,较高的INR 目标值使医患双方对抗凝的态度更加谨慎,更倾向于低强度的抗凝治疗。
在我们的研究中发现,门诊患者华法林INR 监测频率为(39.41±18.05)天监测一次,未能按照专家建议[4,7]进行及时监测,且由于我们的纳入条件的设定,临床实际中患者华法林的监测频率可能间隔时间更长,这可能也是导致患者TTR 值普遍未达标的原因之一。密切监测对华法林患者的管理是不可或缺的,需进一步提高门诊患者对获取华法林INR的依从性,增加密切监测华法林的意识。
患者的合并症对华法林抗凝稳定性的影响已有报道[10],本次研究结果显示,合并高血压(HR 0.229;0.066~0.790;P<0.05)是患者华法林抗凝稳定性的影响因素之一,这一发现与既往研究结果一致[11,12]。我们猜测患者高血压控制不良以及因高血压导致患者药物使用品种的增加,从而导致的药物-疾病及药物-药物的相互作用可能会导致患者TTR 值不达标。
门诊患者一般病情较为稳定,但是如伴随着其他慢性病往往需要多种长期伴随药物,而当患者身体状态发生改变如发热、腹泻、过敏等,也需临时加用其他药物,因此患者发生药物相互作用的风险很高。既往研究表明[13,14],高达60%~70%的华法林使用者暴露于潜在的药物相互作用,而本研究中发现,患者接受与华法林存在潜在相互作用的药物比例为40.90%,低于既往研究。这可能由于本研究是在一家以心血管科为优势科室的三级甲等医院进行,纳入的患者主要在心胸外科、心血管内科和神经内科治疗,而这些科的临床医生可能对华法林联合用药安全性的意识更高。
本研究发现,在患者合并用药的具体药物品种中,使用中成药占比高达42.73%,该现象未在国外的相关研究报道中发现[13-15],造成这种差异的原因可能是由于中外临床实践的不同。中成药在合并慢性疾病的国人中的使用较为常见,且为多组分药物,作用机理较为复杂,有研究报道了华法林联合中成药产品存在INR 波动及出血等不良反应风险[16,17]。本研究发现,合并使用中成药(HR 3.048;1.124~8.263;P<0.05)是门诊患者华法林抗凝控制不良的预测因素之一。国人对中成药的偏好导致了我国临床上中成药的普遍使用,同时由于文献中关于华法林—中成药相互作用在体内和体外实验、药理学和临床研究中均表现出不一致的结果[17],因此中成药与华法林发生药物相互作用的可能性容易被临床医生忽视。
由于我院没有设立专门的抗凝门诊,使用华法林治疗的患者通常随机在普通门诊就诊,这导致针对这类患者综合性管理存在欠缺。南京鼓楼医院在2010 年建立了我国第一家药师管理的抗凝门诊,为门诊患者华法林个体化抗凝治疗管理模式提供了很好的借鉴模板[18]。在今后的工作中,我们可以借鉴鼓楼医院抗凝门诊的经验,开设以药师主导的抗凝门诊,让药师参与到门诊患者华法林的管理当中来发挥积极作用。
本研究最大的局限性是样本量有限,由于时间和人力的限制,目前未能统计全年门诊患者华法林的抗凝控制情况,同时本研究是在一家医院中进行的,我们也无法获取患者可能转诊到其他医疗机构中的临床数据,因此本次研究结果可能无法推断到所有门诊患者华法林;本研究为回顾性研究,一些可能影响华法林抗凝稳定性的其他因素,如饮食、饮酒和用药依从性等信息无法从门诊就诊记录中获取,这可能会导致影响因素的遗漏。在未来的研究中,我们可以进行更大的样本量和更细致的随访计划来验证我们的研究结果。
本研究表明目前我院门诊患者华法林抗凝质量较低,门诊患者目前存在的主要问题在于监测间隔过长,TTR 达标率较低,且华法林治疗过程中使用潜在相互作用药物的比例较高。该结果提示需对接受华法林治疗的门诊患者制定详细的随访计划以及管理华法林相互作用的药物,实现精细化的抗凝管理模式。
