芍药红斑病病原菌鉴定、生物学特性及有效药剂筛选
2023-07-11李培谦冯宝珍赵燕飞
李培谦 冯宝珍 ,* 赵燕飞 王 琳
(1运城学院生命科学系,山西 运城 044000;2运城学院理科实验中心,山西 运城 044000;3太原海关技术中心,山西 太原 030000)
芍药(PaeonialactifloraPall.)是中国的传统名花,品种多、花色丰富、花型多变,被誉为“五月花神”,具有很高的观赏价值[1]。芍药适应性强,能露地越冬,各地园林普遍栽培。近年来,因其花期稍长,花色丰富,已成为深受大众喜爱的切花材料,在国内外都有广阔的市场[2]。另外,芍药肉质根是常用的中药材[3-4]。近年来,随着芍药种植面积的扩大和种植品种的增多,病害发生逐年增多,危害越来越重。芍药红斑病,又称黑斑病、褐斑病,是一种严重危害芍药叶片、枝干的真菌病害。植株发病后,叶片及枝干上出现不规则红褐色病斑,导致植株光合能力下降,严重影响芍药长势及观赏价值[5-6]。
目前已有很多关于芍药病害病原调查的研究,病害的防治大多采用筛选抗性品种、加强管理等农业措施[7-9]。不同病原物可能引起相似的症状,某种植物病害在不同生态条件、不同地域也可能存在病原菌的差异。关于芍药红斑病病原方面的研究,前人报道的病原包括枝孢属(Cladosporiumpaeoniae)[7]、二岐枝孢(Dichocladosporiumchlorocephalum)[5]、链格孢(Alternaria alternata)[9]等侵染,以及链格孢(A.alternata)和细极链格孢(A.tenuissima)复合侵染[10],可见不同地域不同生态条件下,芍药红斑病病原菌差异较大。
明确当地红斑病病原菌并筛选杀菌效果良好的药剂,对于芍药红斑病的科学防治具有重要意义。因此,本研究以山西省运城市舜帝公园发病芍药为研究对象,从病株上分离纯化病原物,根据病原菌的形态学特征,并利用病原菌多基因,即核糖体基因转录间隔区(rDNA-internal transcribed spacer,rDNA-ITS)、真核延伸因子(translation elongation factors 1α,TEF-1α)以及RNA 聚合酶II 第二大亚基(the second largest RNA polymerase subunit,RPB2)基因序列构建系统发育树,确定病原菌分类地位,明确病原菌适宜培养基、最适碳源、氮源等生长条件,同时对7 种常用杀菌剂进行毒力测定,筛选该病害防治的有效药剂,以期为运城市芍药红斑病的有效防控提供理论基础。
1 材料与方法
1.1 发病样品采集
2020年5月至2022年的8月在运城市舜帝公园芍药种植园里选取疑似芍药红斑病的植株。记录其发病症状、发病部位,拍照后采集发病样品,用无菌自封袋封装并带回实验室,置于4 ℃冰箱中保存待用。
1.2 分离纯化病原菌
利用组织分离法分离病原菌[11]。将采集的芍药发病组织用清水冲洗并晾干,在病健交界处剪取病变组织,发病叶片和发病茎段约5 mm×5 mm 大小,先用75%酒精消毒1 min,再用0.1%的升汞消毒2 min,无菌水冲洗3 遍,置于滤纸上吸干表面水分,接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板上,25 ℃恒温培养5~7 d,待病样组织周围长出菌落后,采用单孢分离法对病原菌进行纯化[12],至菌落形体一致。纯化后,切取带有培养基的菌丝条,装入含有少许无菌水的2 mL冻存管,于4 ℃冰箱保存。
1.3 分离菌株的致病性测定
根据柯赫氏法则,采集大富贵芍药健康幼嫩茎叶,采用离体接种法进行致病性测定[13-14]。首先配制新鲜病原菌孢子悬浮液,调节浓度至1×106个·mL-1备用。先用无菌水冲洗再用75%酒精对芍药健康幼嫩茎叶表面消毒,在叶片或茎秆组织上用无菌注射器制造微创伤口,然后将20 µL 孢子悬液滴在伤口处,以无菌水为空白对照。然后将接种组织置于铺有湿润滤纸的无菌培养皿中,25 ℃恒温培养,每隔24 h 观察记录组织发病情况,待发病后重新分离病原菌并检验形态特征是否与接种病原一致。
1.4 分离菌株的形态学鉴定
从纯化后的菌落边缘挑取少许病原菌菌丝,接种在PDA 平板上,25 ℃恒温培养5~7 d,每天观察菌落生长快慢、大小、颜色等特征。待菌丝产孢后,挑取少量菌丝制作装片,在显微镜下观察分生孢子和分孢梗形态特征,对孢子形状、颜色、纵横隔膜等形态特征进行记录,测量孢子大小,参考文献[15-16]的方法确定病原菌种类。
1.5 分离菌株的分子生物学鉴定
将分离菌株菌丝块接种于液体马铃薯葡萄糖培养液(potato dextrose broth,PDB),25 ℃、150 r·min-1条件下震荡培养5 d 后收集菌丝,根据基因组DNA 提取试剂盒说明书(北京天根生化科技有限公司)提取基因组DNA。分子鉴定所用引物(表1)由生工生物工程(上海)股份有限公司合成。根据文献[17]所述的方法扩增目的基因片段并测序,将获得的ITS、TEF-1α和RPB2基因序列在NCBI 数据库(https://blast.ncbi.nlm.nih.gov/Blast.cg)进行BLAST比对分析,并上传至GenBank 数据库(https://submit.ncbi.nlm.nih.gov/about/genbank)。下载GenBank 中链格孢属参考菌株的相应序列,并使用BioEdit 7.0.9.0 软件[18]将各菌株的3 个基因序列进行整合。经过软件CLUSTALX 1.83 进行多重序列比对[19],利用MEGA-X采用邻接法(neighborjoining methods,NJ)对整合序列构建系统发生树,设置1 000 次循环检验[20],选择囊状匍柄霉(Stemphylium vesicarium)作为外群,根据分离菌株与已知菌株的亲缘关系确定其分类地位[17,21]。
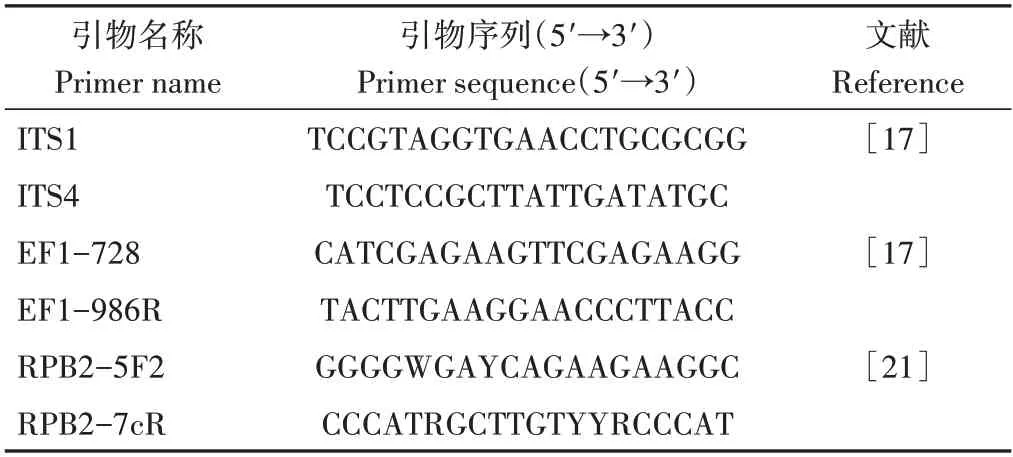
表1 分子鉴定所用引物Table 1 Primers for molecular identification
1.6 生物学特性测定
1.6.1 不同培养基对病原菌菌落生长影响 参照文献[22-23]中对病原菌生物学特性的研究方法,将制备好的马铃薯葡萄糖琼脂培养基PDA、马铃薯蔗糖琼脂培养基(potato sucrose agar,PSA)、马铃薯胡萝卜琼脂培养基(potato and carrot agar,PCA)、燕麦培养基(oatmeal agar,OA)、查氏培养基(Czapek’s)、淀粉琼脂培养基(starch agar,SA)、葡萄糖蛋白胨琼脂培养基(glucose peptone agar,GPA)、麦芽糖琼脂培养基(maltose agar,MA)、酵母浸膏琼脂培养基(yeast extract agar,YEA)融化后倒在9 cm 培养皿中制成平板。在已活化的病原菌平板边缘用打孔器打取5 mm菌饼,每平板中央接种一个菌饼,3 个重复,25 ℃培养7 d后,观察病原菌在不同培养基上菌落形态并用十字交叉法测量菌落直径。
1.6.2 不同碳源、氮源对病原菌菌落生长影响 以查氏培养基为基础培养基和对照[9],查氏培养基中的蔗糖分别以等质量的可溶性淀粉、麦芽糖、半乳糖、葡萄糖、果糖、木糖代替。以硝酸钾、硝酸铵、硝酸钙、氯化铵、蛋白胨、牛肉浸膏等质量替换查氏培养基中的NaNO3配制成不同氮源培养基。铺制平板并接种病原菌,按照1.6.1 中的方法分析不同碳源、氮源对菌丝生长的影响。
1.6.3 温度条件对病原菌菌落生长的影响 按照1.6.1 的方法打取菌饼并接种在PDA 平板上,温度处理分别设置为5、10、15、20、25、30、35、40 ℃,每个处理3 个重复。连续培养7 d 后,用十字交叉法测量菌落直径[24]。
1.6.4 不同pH 值对病原菌菌落生长的影响 用1 mol·L-1的HCL 和NaOH 分别将PDA 培养基调节其pH值至4、5、6、7、8、9、10、11,铺制平板,接种病原菌,每处理重复3皿,25 ℃连续培养7 d后按照1.6.1的方法测量菌落直径分析不同pH值对菌落生长的影响[22]。
1.7 不同浓度杀菌剂对病原菌的室内毒力测定
1.7.1 含药平板的制备 选择7 种目前常用于防治链格孢病害的化学药剂,将供试药剂按照表2 浓度稀释备用。无菌条件下,分别取0.5 mL 各浓度的农药加入49.5 mL 冷却至60 ℃左右的PDA 培养基中,最终稀释倍数如表2所示,混匀后倒入4个培养皿制成含药平板,以不加农药的PDA平板作为对照[22]。

表2 供试药剂及其稀释倍数Table 2 Different fungicides and their dilution multiple
1.7.2 不同药剂对病原菌菌丝生长的毒力测定 用直径为5 mm 的打孔器从活化的病原菌平板边缘打取菌饼,将其贴在各含药PDA 平板中央,各供试药剂及浓度见表2,以加无菌水为空白对照,每处理4次重复。25 ℃恒温培养,待7 d后,对照组菌落基本长满平板,按照1.6.1的方法测量不同药剂浓度平板上的菌落直径,参考前人的方法计算各药剂处理对菌丝生长抑制率和独立回归方程、抑制中浓度(EC50)和相关系数[18,25]。
1.8 数据分析
试验数据采用Excel 2010 软件进行统计分析,并利用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 病害症状
2020—2022 年,连续两年在运城市舜帝公园和运城学院芍药种植园调查发现,每年6—8 月,芍药红斑病发生严重,危害叶片、茎秆,发病率达50%以上。发病初期,叶片、茎秆上出现黄绿色小点,随后逐渐扩大至圆形或不规则形病斑,可连片生长,病斑一般发生在叶脉两侧或叶片边缘,病斑中心呈黄褐色透明状(图1-a),后期病斑中间成焦枯状,严重时整个叶片焦枯死亡。受害茎秆初期出现紫红色的(长)圆形小点,随后病斑逐渐扩展,直至相连成片,病斑长轴扩展至1~3 cm,略有凹陷(图1-b),最后整株凋萎。

图1 芍药红斑病的症状Fig.1 Symptoms of peony red spot disease
2.2 病原菌分离及致病性测定
从发病组织病健交界处随机分离病原,经形态初筛主要分离到两种疑似病原菌,分别选取代表性菌株SY-1、SY-6 制备孢子悬浮液对芍药健康叶片和茎秆进行室内接种试验。结果表明,2 d后叶片接种处开始出现直径约3 mm 黑色圆形病斑,5 d后,病斑直径扩展至8~10 mm,病斑中央出现坏死状;茎秆病斑处呈暗褐色,略有凹陷,周围有暗紫色扩展晕圈,而接种无菌水对照组叶片和茎秆上未见病斑出现。两病原菌接种后的叶片、茎秆发病症状与田间发病症状相同(图1-c~e)。从发病组织上重新分离得到与接种病原菌一致的病原物,因此,确定病原物SY-1和SY-6均为芍药红斑病的致病菌。
2.3 病原菌鉴定
2.3.1 形态学特征 从发病芍药组织上分离到病原真菌12 株,经纯化和单孢培养,得到两种疑似病原菌,选取代表菌株SY-1、SY-6,于PDA平板上25 ℃培养培养1~2 d,菌丝呈白色绒毛状,气生菌丝发达致密,3 d后,SY-6菌落转为灰色至灰黑色、墨绿色,背面黑褐色,菌落隆起呈不规则圆形(图2-a);SY-1菌落初期白色,3 d后转为灰色、灰绿色,菌丝较短,菌落辐射状生长,无明显隆起,边缘颜色略浅,菌落背面灰黑色(图2-b)。显微镜下,SY-1分生孢子倒棒状、狭长卵形或长椭圆形,浅褐色,约(6.5~7.8)µm×(28.5~35.6)µm,具纵横隔膜,有细长柱状喙或假喙(图2-d)。SY-6 分生孢子梗暗色直立,分枝或不分枝、长短不一,分生孢子深褐色,有深色纵横隔膜,分隔处大多具有缢缩现象,呈椭圆形、卵圆形、倒梨形,孢子大小为(6.3~9.6)µm×(9.5~21.6)µm,短喙为浅褐色柱状或锥状(图2-c)。综合菌落特征和分生孢子形态,参照《真菌鉴定手册》[15]及《中国真菌志》[26]初步鉴定SY-6 为链格孢(Alternaria alternata),SY-1为细极链格孢(A.tenuissima)。
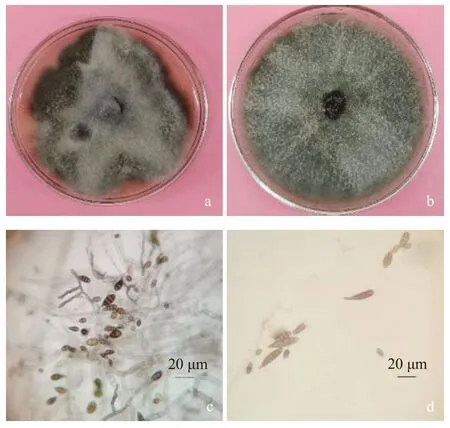
图2 芍药红病病原菌SY-1和SY-6的菌落形态及分生孢子特征Fig.2 Colony morphology and conidial characteristics of the pathogen causing red spot disease on peony
2.3.2 多基因序列联合分析 以病原菌SY-1 和SY-6 的基因组DNA 为模板,分别用引物对ITS1/ITS4、EF1-728/EF1-986R、RPB2-5F2/RPB2-7cR 进行PCR扩增并测序。菌株SY-1的ITS、TEF-1α、RPB2的序列长度分别为573、280、980 bp,测序结果提交至GenBank(ITS 为OP962320,TEF-1α为OP980552,RPB2为OP980553);SY-6的ITS、TEF-1α、RPB2的序列长度分别为572、282、978 bp,测序结果提交至GenBank(ITS为OP962321,TEF-1α为OP980554,RPB2为OP980555);基于rDNA ITS、TEF-1α和RPB2基因联合序列构建的系统发育树显示(图3),菌株SY-1、SY-6 分别与A.tenuissimaCBS 918.96、A.alternataCBS 130263 聚为一支。结合病原菌的形态特征、致病性测定和多基因序列联合分析,芍药红斑病为链格孢菌(A.alternata)和细极链格孢菌(A.tenuissima)复合侵染引起。
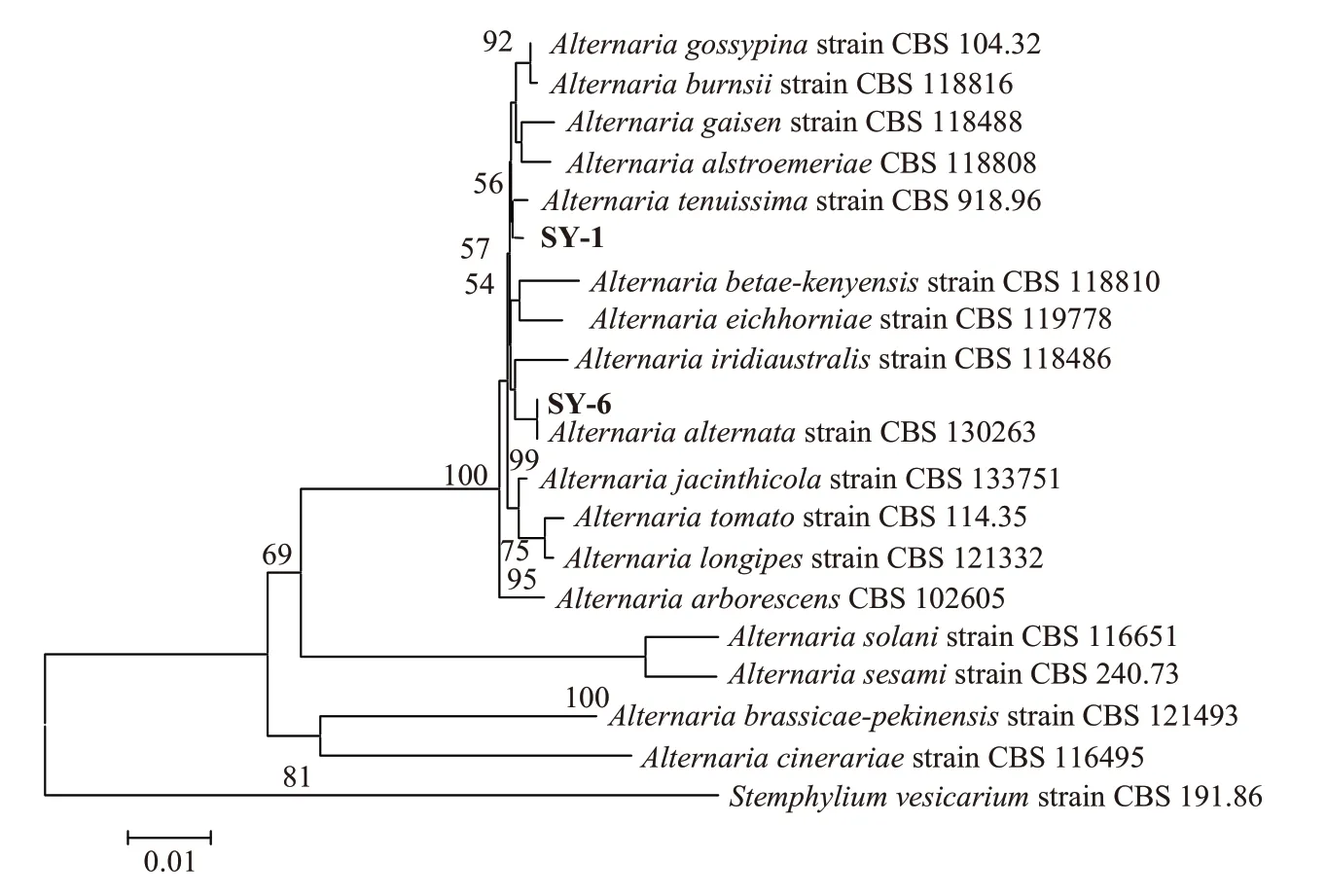
图3 基于rDNA-ITS、TEF-1α和RPB2 基因序列系统发育分析Fig.3 Phylogenetic analysis based on multiple sequences of rDNA-ITS,TEF-1α and RPB2
2.4 病原菌的生物学特性
2.4.1 不同培养基对病原菌生长的影响 病原菌SY-1 和SY-6 在供试培养基上均能生长,其菌落直径在不同培养基上存在显著差异(P<0.05)。两种供试菌株在PDA 和PSA 培养基上菌株生长旺盛,菌落直径最大,其次是OA、GPA 和MA 培养基,而在PCA、SA、Czapek′s 以及YEA 培养基上生长缓慢,菌落直径明显小于其他培养基上的菌落直径(图4)。
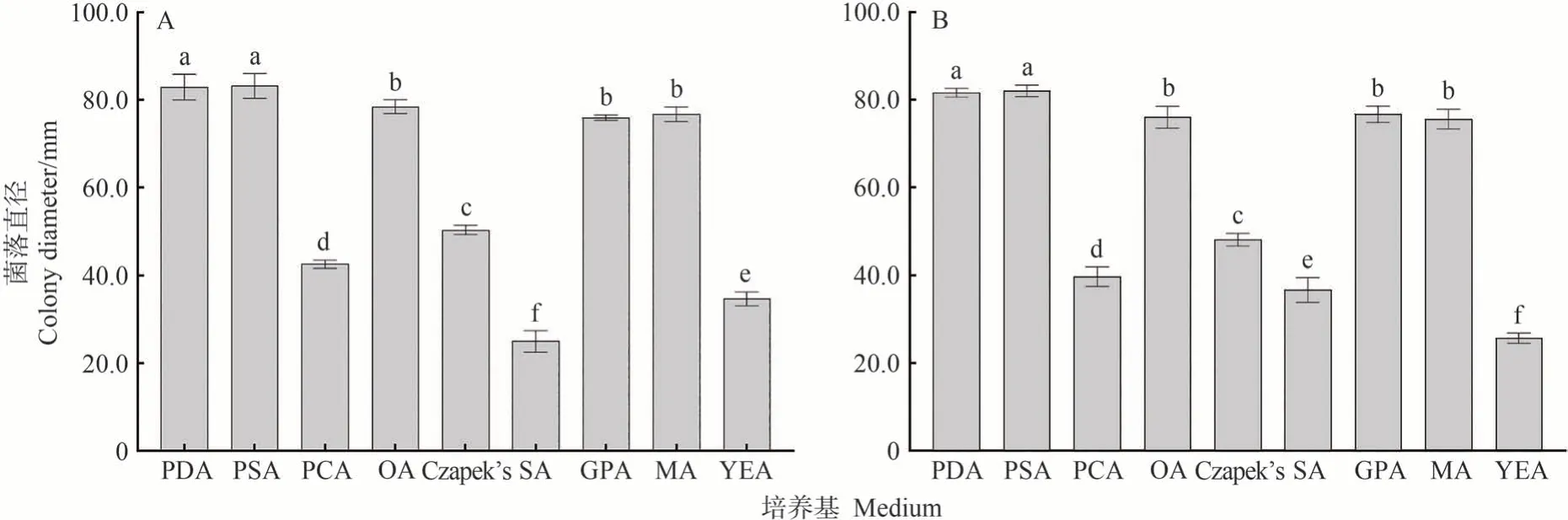
图4 不同培养基对病原菌菌株SY-1、SY-6菌丝生长的影响Fig.4 Effects of different media on mycelial growth of strains SY-1 and SY-6
2.4.2 不同温度对病原菌生长的影响 5~40 ℃的环境下病原菌都能生长,但温度为25~30 ℃时病原菌菌丝生长迅速,菌落生长良好,并且菌株SY-1和SY-6均在28 ℃时菌落直径最大,然而当温度低于5 ℃时或超过35 ℃时菌落生长非常缓慢,说明菌株SY-1 和SY-6生长适宜温度为25~30 ℃(图5)。

图5 温度对病原菌菌株 SY-1、SY-6菌丝生长的影响Fig.5 Effects of different temperatures on mycelial growth of the isolates SY-1 and SY-6
2.4.3 不同pH 对病原菌生长的影响 如图6 所示,病原菌菌株生长具有比较宽泛的pH 范围,pH 值为4.0~11.0 的环境下均能生长,但是不同pH 值条件下的菌落生长状态之间存在显著差异(P<0.05)。整体来看,两种菌株适宜生长的pH 值范围为7.0~8.0,此时,菌落生长良好,菌落直径最大。

图6 不同pH下病原菌菌株 SY-1、SY-6菌落大小差异Fig.6 Effects of different pH on mycelial growth of the isolates SY-1 and SY-6
2.4.4 不同碳源、氮源对病原菌生长的影响 碳源测试结果显示,病原菌SY-1和SY-6在以麦芽糖、可溶性淀粉为碳源的培养基上菌落生长良好,菌落直径显著大于以蔗糖为碳源的对照组;以葡萄糖、果糖为碳源的培养基上菌落大小与对照差异不显著;而以半乳糖和木糖为碳源的培养基上菌落直径较小,显著小于对照组(表3)。氮源测试结果显示,病原菌SY-1 和SY-6在以NaNO3、蛋白胨为氮源的培养基上菌落生长良好;在以NH4NO3、NH4Cl、Ca(NO3)2及牛肉膏为氮源的培养基上菌落生长不良,菌落直径显著小于对照组(表3)。上述结果表明,菌株SY-1和SY-6倾向利用麦芽糖、可溶性淀粉作为碳源,NaNO3、蛋白胨作为氮源。

表3 不同碳源及氮源对菌株SY-1、SY-6菌丝生长的影响Table 3 Effect of different carbon and nitrogen sources on mycelial growth of the strain SY-1 and SY-6
2.5 病原菌对杀菌剂的敏感性
参照抑制率计算公式,得出各药剂的抑菌情况。室内毒力测定结果表明,病原菌对测试的7 种杀菌剂均表现不同程度的敏感性。由表4 可知,病原菌SY-1对25%吡唑醚菌酯、50%咯菌腈敏感性较好,其EC50<1.0 mg·L-1;对10%苯醚甲环唑、80%代森锰锌、30%戊唑醇敏感性次之,为1.0 mg·L-1
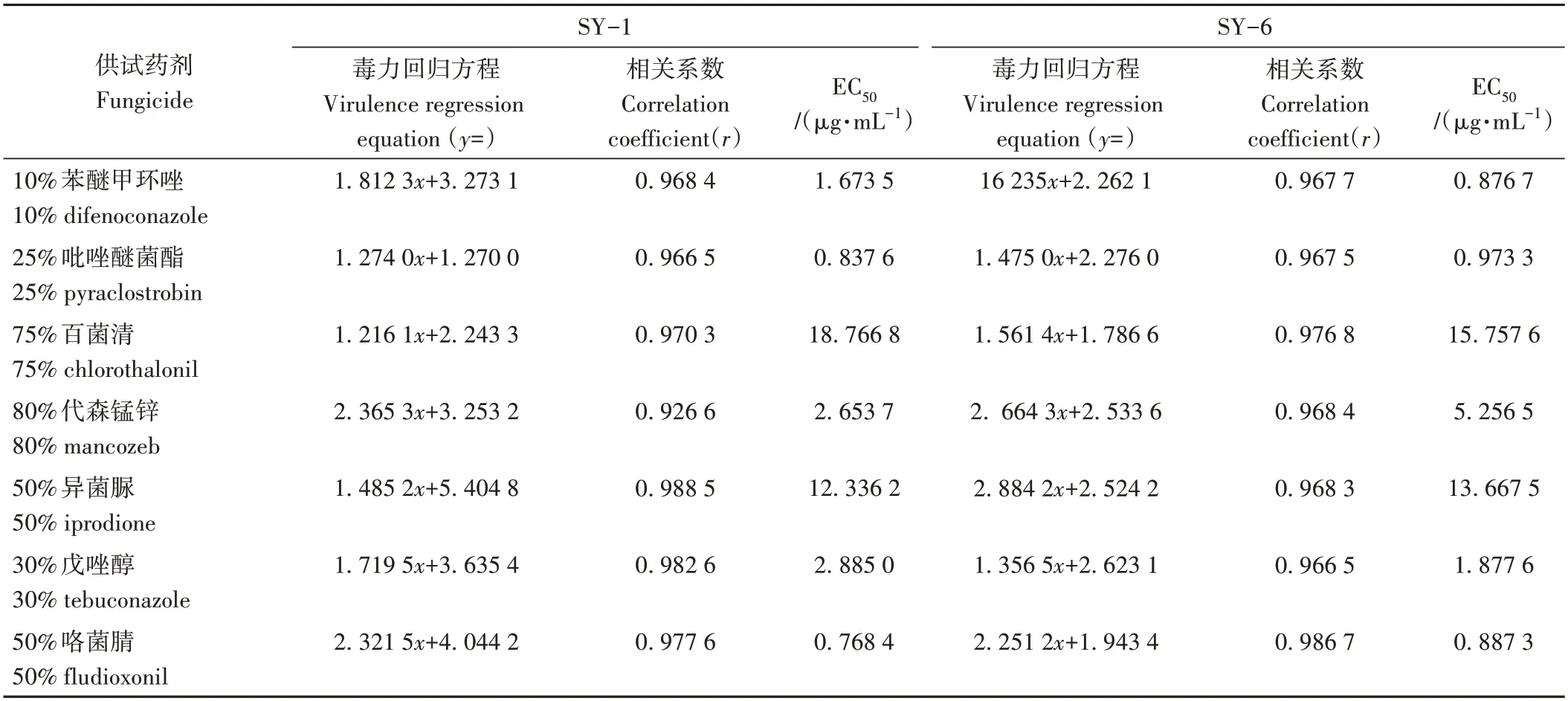
表4 7 种杀菌剂对菌株SY-1、SY-6的室内毒力测定结果Table 4 Determination of the virulence of seven fungicides to Strain SY-1and SY-6 in laboratory
3 讨论
红斑病是芍药栽培中常见病害,严重影响了芍药的植株长势和观赏价值[5-6]。因此,准确鉴定该病害的致病菌进而筛选有效防治药剂对芍药栽培十分重要。本研究对山西运城地区芍药红斑病的症状进行了描述,对红斑病病原菌进行了分离、致病性测定,通过多基因序列联合系统发育分析,明确了芍药红斑病的病原菌为链格孢(A.alternata)和细极链格孢(A.tenuissima)。本研究病原菌鉴定结果与李丽等[10]报道的山东地区芍药红斑病病原鉴定结果一致。但是植株发病症状略有不同:本研究发病芍药叶片病斑中心呈黄褐色透明状,受害茎秆上病斑后期略有凹陷;而山东发病芍药叶片病斑圆形或不规则形,呈现红色、红褐色、栗褐色至黑色,茎受害后,病斑从紫红色至深红褐色如烧焦状,部分凸起,说明同样的病原菌在不同环境下,引起的植物症状存在差异。芍药红斑病可由多种病原菌侵染引起,研究发现枝孢霉(Cladosporiumpaeoniae)能够引起芍药红斑病[7,27-28];链格孢(A.alternata)[9]、Dichocladosporium chlorocephalum[3]单一侵染也可引起芍药叶部红斑病。可见,同一寄主在不同环境下也会发生“同症不同病”现象。
链格孢属(Alternaria)真菌菌落特征、孢子形态等具有明显的特征,属级特征可通过形态学鉴定。但是,病原菌小孢子形态特征容易受寄主植物、环境条件影响,种级特征变异较大,种类鉴定需要结合形态学特征和系统发育分析[26,29]。近年来,人们借助分子生物技术,利用甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因[30],ITS、抗原相关蛋白Alt、TEF1-α3 个基因[31],ITS、Alt、ATPase、His34 个基因[32]或者ITS、tef1、LSU、SSU、GAPDH、RPB26 个基因[33]等构建系统发育树来确定分类地位。例如:利用ITS、EF-1ɑ、β-tubulin3个基因联合分析鉴定了珠芽魔芋叶斑病菌为细极链格孢(A.tenuissima)[34]。本研究利用ITS、TEF-1ɑ、RPB23 个基因序列构建系统发育树,通过进化分支确定病原菌为链格孢(A.alternata)和细极链格孢(A.tenuissima)。
病原菌SY-1 和SY-6 对温度、pH 值、培养基种类等要求不严格,表明病原菌能适应较宽的环境温度、广泛的酸碱环境和多种碳氮源,具有较强的适应能力,这也是病害能够在运城干旱、炎热的夏季发生流行的原因。本研究中病原菌的最佳碳源为麦芽糖、可溶性淀粉,最佳氮源为NaNO3、蛋白胨,而青海樱桃叶斑病链格孢(A.alternata)最适为碳源肌醇和乳糖[22];芒果链格孢叶斑病菌(A.tenuissima)最适氮源为KNO3和L-天冬酰胺[35]。这说明链格孢(Alternaria)属不同菌株的最适生长条件不同,其生物学特性受寄主植物、地域环境的影响而存在差异。
本研究所选7 种药剂对病原菌均有不同程度的抑制作用,病原菌对吡唑醚菌酯、咯菌腈敏感性较好,其EC50低于1.0 mg·L-1,对百菌清、异菌脲敏感性较差,其EC50均大于10 mg·L-1,这一结果为芍药红斑病的防治提供了理论数据。而本研究结果仅是室内敏感性测定,田间药剂防治效果还需综合考虑对芍药生长的安全性、对环境的影响及用药成本等因素,因此还需要进一步开展田间防治效果的相关研究。
4 结论
芍药红斑病由链格孢A.alternata和细极链格孢A.tenuissima复合侵染引起的。该病原菌最适培养基为PSA、PDA,菌丝生长最适温度为25~30 ℃,最适pH 值为7~8,病原菌最适碳源为麦芽糖和可溶性淀粉,最适氮源为NaNO3和蛋白胨。室内毒力测定发现25%吡唑醚菌酯和50%咯菌腈对病原菌抑制效果良好,可用于芍药红斑病化学防治。
