酸叶胶藤化学成分及其抗氧化活性研究
2023-07-11李远飞丁钟慧李丽梅
李远飞,曾 婷,丁钟慧,冯 楠,韦 振,李丽梅
(1.西南民族大学药学院,四川 成都 610041;2.成都医学院科研实验中心,四川 成都 610500;3.成都至纯本草生物科技有限公司,四川 成都 610000)
自由基是人体生命活动中各种生化反应的中间代谢产物,具有高度的化学活性. 但若在反应中产生过多自由基且不能及时清除,则会加速人体细胞乃至器官衰老[1],亦会引起多种疾病如心脑血管疾病[2-3]、糖尿病[4]、癌症[5]等.消除人体内过剩自由基除依靠人体自身抗氧化酶作用外,还可以通过维生素、食物或草药及其提取物来补充抗氧化物质[6]. 合理补充抗氧化物质有益人体健康,从植物中分离的天然产物,如有机酸、香豆素和黄酮类化合物,因其有效性和安全性而受到高度认可.
酪氨酸酶是黑色素生产过程中的关键限速酶,但若在体内过度表达,则易引起衰老、皮肤病变甚至会引起神经退行性疾病[7].研究显示一些抗氧化剂对酪氨酸酶有一定的抑制作用[8],抑制酪氨酸酶的生成即可抑制人体中过多的黑色素,从而延缓衰老减少与黑色素相关疾病的发生.
酸叶胶藤(Urceola rosea(Hooker & Arnott) D. J.Middleton)又名酸叶藤、头林心等. 是一种酸味类野菜,嫩茎叶可炒食亦可炖煮,是云南南部一些民族的最爱[9].同时酸叶胶藤也为传统民族药,主治跌打瘀肿、风湿骨痛、疔疮、喉痛和眼肿等[10].现代研究表明其具有抗菌[11]、抗炎活性[12]以及对肿瘤细胞的细胞毒活性[13].本文通过研究其化学成分对自由基与酪氨酸酶的抗氧化活性,为其作为抗氧化活性植物开发提供科学依据.
1 仪器与材料
1.1 仪器
核磁共振波谱仪(400 MHz or 600 MHz Bruker AvanceIII);多功能全波长酶标仪(美国伯腾仪器有限公司);METTLER TOLE -DOAE240 十万分之一电子分析天平(梅特勒-托利多仪器(上海)仪器有限公司).
1.2 试药
酸叶胶藤枝叶采自云南西双版纳勐腊县,由西双版纳热带植物园纳智研究员鉴定, 标本(NO.LMER0903)保存在西南民族大学药学院.
酪氨酸酶(25KU;成都埃法生物科技有限公司);儿茶素(成都康邦生物科技有限公司);左旋多巴(L-DOPA;成都硕博研创科技有限公司);磷酸盐缓冲液(PBS;广州硕谱生物有限公司);2,2 -二苯基-1-苦基肼(DPPH;上海麦克林生化科技有限公司);2,2 -联氮-二(3 -乙基-苯并噻唑-6 -磺酸)二铵盐(ABTS;成都力信和有限公司);硅胶(200 ~300 目)与薄层GF254硅胶板(青岛海洋化学试剂有限公司);D101 大孔树脂、聚酰胺(成都科龙化工试剂厂);ODS(日本YMC 公司);Sephadex LH -20(GE Healthcare Bio-Sciences AB,Sweden);硫酸亚铁、水杨酸、过氧化氢、无水乙醇、甲醇、二氯甲烷、乙酸乙酯等试剂均为分析纯试剂(成都力信和化工有限公司).
2 实验方法
2.1 酸叶胶藤化合物提取与分离
称取并粉碎干燥酸叶胶藤枝叶15 kg,所得药材粉末用95%(v/v)乙醇于室温条件下浸泡提取7 d,重复3 次.合并提取液,经减压浓缩得到酸叶胶藤总提物浸膏.将浸膏用水混悬后用乙酸乙酯萃取,蒸干溶剂得到乙酸乙酯相和水相. 水相选用D101 大孔树脂以(乙醇∶水0∶1 ~1∶0)为洗脱剂进行初步分离,最终合并得到水相SⅠ和SⅡ,SⅠ经硅胶柱层析(氯仿∶甲醇,20∶1 ~1∶1)分为Fr1 -3 三个馏分.Fr1 析出结晶,用甲醇重结晶得到化合物2(52 mg),剩余母液Sephadex LH-20(MeOH)柱层析先后得到化合物10(56 mg)和化合物3(86 mg).Fr-2 选用硅胶柱层析(氯仿∶甲醇,50∶1 ~1∶1),得到Fr -2a 与Fr -2b 两个组分. Fr-2a 经ODS 柱(甲醇∶水,0∶1 ~1∶0)层析、甲醇重结晶与Sephadex LH -20(MeOH)柱层析得到化合物1(17 mg)与化合物7 (32 mg).Fr -2b 选用硅胶柱层析(氯仿∶甲醇100∶1 ~1∶1)得到化合物8(11 mg)、化合物9(10 mg)、化合物4 (20 mg) 与化合物5(49 mg).Fr-3 先用聚酰胺柱层析(乙醇∶水,0∶1 ~1∶0),后用Sephadex LH -20(MeOH)柱纯化,最终得到化合物6(1.5 g).
2.2 化合物抗氧化活性研究
2.2.1 ABTS+自由基清除
参考文献方法[14],将配制好的ABTS+溶液(7.4 mmol/L)与过硫酸钾溶液(2.5 mmol/L)混合均匀,在室温避光条件下反应14 h,得到ABTS+自由基溶液.将ABTS 自由基溶液以蒸馏水稀释到在734 nm处吸光度为0. 7 ± 0. 02. 吸取50 μL 样品溶液与150 μL稀释后ABTS+自由基溶液于96 孔板中,混合均匀,避光反应10 min,在734 nm 处测定其吸光度.
Ac为实验组吸光度值;Ae为空白组(超纯水与样品溶液)吸光度值;Aj为对照组(超纯水与ABTS+自由基溶液)吸光度值.
2.2.2 DPPH 自由基清除
以文献方法为基础加以修改[15]. 无水乙醇为溶剂将DPPH 配制为浓度为0.1 mg/mL 的自由基溶液,吸取50 μL DPPH 自由基溶液与50 μL 样品溶液在96 孔板中混合均匀,避光反应30 min,以无水乙醇调零,于517 nm 处测定其吸光度.
A1为实验组吸光度值;A2为空白组(无水乙醇与样品溶液)吸光度值;A0为对照组(超纯水与DPPH 自由基溶液)吸光度值.
2.2.3 OH 自由基清除
按文献方法[16]稍作修改,配制9 mmol/L 的硫酸亚铁溶液与水杨酸溶液以及8.8 mmol/L 的过氧化氢(30%).在96 孔板中依次加入50 μL 的硫酸亚铁溶液、水杨酸溶液与待测样品溶液,最后再加入50 μL的过氧化氢.水浴37 ℃反应30 min,于510 nm 处测定吸光度.
其中A3为实验组吸光度值;A4为空白组(过氧化氢与样品溶液)吸光度值;A5为对照组(超纯水与样品溶液)吸光度值.
2.2.4 酪氨酸酶抑制活性
按文献方法[17]加以修改,将50 μL PBS(pH =6.8)、50 μL 不同浓度样品溶液与50 μL 酪氨酸酶溶液(0.06 mg/mL)在96 孔板中混合均匀,在30 ℃条件下反应20 min,于475 nm 处监测其吸光度值变化.而后立即加入100 μL L -DOPA 溶液(0.5 mM),同样在30 ℃反应20 min,在475 nm 处测定其吸光度值变化.所有样品都溶解在DMSO 中,最终反应体系中DMSO 含量不超过3%.
其中B1为样品在0 min 时的吸光度,B2为样品在20 min 时的吸光度;C1为0 min 时空白组的吸光度,C2为20 min 时空白组的吸光度.
2.3 化合物3 与酪氨酸酶分子对接研究
通过分子对接程序AutoDock Vina 预测了化合物3 与酪氨酸酶作用的形式. 酪氨酸酶的晶体结构从RCSB 数据库中获取(PBD ID:2Y9X),酪氨酸酶包含四个相同的亚基,其中一个被选为本文的对接靶标.对接前对酪氨酸酶蛋白进行了预处理,如去除水分子、删除原始配体和加氢. 化合物3 的SDF 结构于PubChem 数据库中下载得到.
2.4 数据处理
实验数据均重复验证3 次,使用Graph Pad Prism软件对数据进行处理与图片绘制.最终数据结果均以平均值±标准差表示.使用Discovery Studio 与PyMol对分子对接结果进行可视化.
3 结果与分析
3.1 酸叶胶藤化合物结构鉴定
干燥酸叶胶藤用乙醇提取得到酸叶胶藤粗提物,粗提物在经过柱色谱方法纯化最终得到10 个化合物.其中化合物1 ~3、化合物6、7 为酚类化合物,化合物4、5 为三萜类成分,8 为脂肪酸,9 和10 为甾体类化合物,结构如图1.
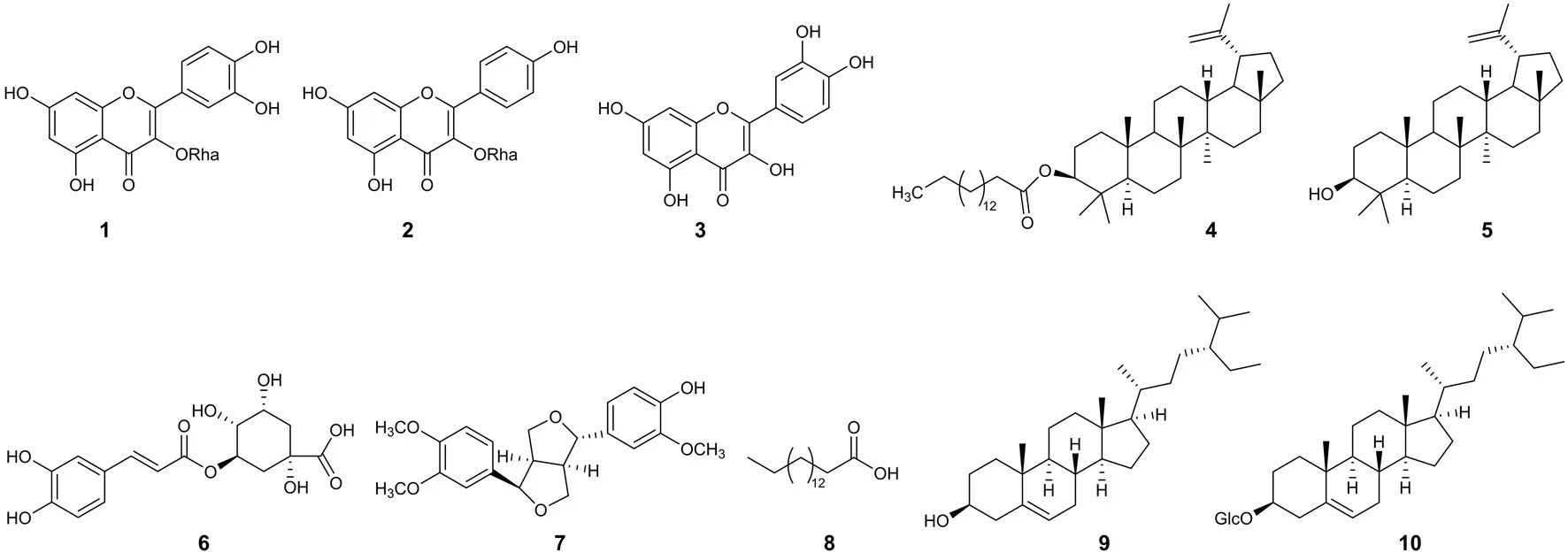
图1 化合物1 ~10 结构式Fig.1 Chemical structures of compounds 1-10
化合物1:1H NMR (400 MHz,CD3OD)δ:7. 31(s,1H,H-2),7.27 (d,J=7.9 Hz,1H,H-6′),6.89(d,J=8.0 Hz,1H,H-5),6.32 (s,1H,H -8),6.16(s,1H,H-6).13C NMR (100 MHz,CD3OD)δ:179.68(C-4),165.87(C-7),163.22(C -5),159.38(C-9),158.54(C -2),149.83(C -4),146.44(C -3′),136.30(C -3),123.05(C -6′,C -1′),117.07(C-5′),116.48(C-2′),105.98(C-10),103.59(C-1″),99.93(C -6),94.86(C -8),73.35(C -4″),72.12(C-3″),72.00(C -2″),17.77(C -6″). 上述数据与文献数据大概一致[18],鉴定为槲皮苷.
化合物2:1H NMR (400 MHz,CD3OD)δ:7.73(d,J=8.4 Hz,2H,H -2′,6′),6.91 (d,J=8.5 Hz,2H,H-3′,5′),6.34 (s,1H,H-6),6.17 (s,1H,H-8),5.35 (s,1H,H -1″),4.21 (s,1H,H -4″),3.71(d,J=5.2 Hz,1H,H-2″),3.31 (d,J=2.1 Hz,1H,H-5″),0.90 (d,J=5.2 Hz,1H,H -6″).13C NMR(100 MHz,CD3OD)δ179.67 (C -4) 165.90 (C -7),163.23 (C -4′),161.60 (C -5),159.40 (C -2),158.58 (C-9),136.28 (C-3),132.03 (C -2′,6′),122.71 (C-1′),116.64 (C-3′,5′),106.02 (C-10),103.57 (C-1″),99.98 (C -6),94.92 (C -8),73.29 (C-5″),72.21 (C -4″),72.14 (C -3″),72.02 (C-2″),17.77 (C -6″). 与文献数据进行比对[19],数据基本相同,鉴定为山奈酚-3 -O-鼠李糖苷
化合物3:1H NMR (400 MHz,DMSO-d6)δ:12.49 (s,1H,OH-5),10.80 (s,1H,OH -7),9.60 (s,1H,OH-3′),9.37 (s,1H,OH-3),7.68 (s,1H,H-2′),7.54 (dd,J=8.5,2.0 Hz,1H,H-6′),6.88 (d,J=8.5 Hz,1H,H -5′),6.41 (s,1H,H -8),6. 19(s,1H,H -6).13C NMR (100 MHz,DMSO -d6)δ:175.95 (C -4),164.11 (C -7),160.84 (C -5),156.25 (C-9),156.12,147.71 (C -4′),146.80 (C-2),145.21 (C-3′),135.73 (C-3),121.94 (C -1′),119.96 (C-6′),115.57 (C -5′),115.05 (C -2′),103.00 (C-10),98.14 (C-6),93.32 (C-8).
与文献数据比对[20],数据基本相同,鉴定为槲皮素
化合物4:白色无定形粉末(氯仿),分子式C46H80O2,ESI-MSm/z:665.6[M +H]+.1H NMR (600 MHz,CDCl3)δ:4. 69 (d,J=1. 8 Hz,1H,H -29),4.61 (d,J=1.8 Hz,1H,H-29),4.45 (dd,J=10.4,5.8 Hz,1H,H-3),2.35 (s,1H,H -19),2.28 (t,J=7.5Hz,2H,H-2′),1.70 (s,3H,H-30),1.23 (s,3H,H -28),1. 04 (s,3H,H -26).13C NMR (151 MHz,CDCl3)δ:173.9(C-1′),151.1(C -20),109.5(C-29),80.8(C -3),55.5(C -5),50.5(C -9),48.4(C -18),48.2(C -19),43.2(C -17),43.0(C-14),41.0(C-8),40.2(C -22),38.5(C -4),38.2(C -10),38.0(C -1),37.2(C -13),35.7(C -16),35.0(C-2′),34.4(C -7),32.1(C -21),29.9(C-20′),29.3 (C -4′),28.1(C -23),27.6(C -15),25.3(C -12,3′),23.9(C -2),22.9(C -21′),21.1(C -11),19.4(C -30),18.4(C -28),18.2(C-6),16.7(C -26),16.3(C -24),16.1(C -25),14.7(C -27),14.3(C -22′). 与文献数据比对[21],大致相同,鉴定为3β-羽扇豆醇棕榈酸酯.
化合物5:1H NMR (600 MHz,CD3OD)δ:0.77(s,3H,H-24),0.97 (s,3H,H-27),1.71 (s,3H,H-30),2. 45 (m,1H,H -19),3. 11 (dd,1H,J=11.4,4.8 Hz,H-3),4.59 (s,1H,H-29a),4.71 (s,1H,H-29b).13C NMR (100 MHz,CD3OD)δ:151.9(C-20),110.2 (C -29),39.5 (C -1),79.7 (C -3),56.8 (C-5),51.9 (C -9),49.5 (C -19),49.1(C-18),44.1 (C -17),43.8 (C -14),41.0 (C -8),40.1 (C-22),40.0 (C -4),38.3 (C -13),36.7 (C-10),35.9 (C-16),35.3 (C -7),30.9 (C -21),28.6 (C -2),28.3 (C -23),28.0 (C -15),26.5 (C-12),22.1 (C -11),19.5 (C -30),18.6(C-6),18.0 (C -28),16.7 (C -25),16.6 (C -26),15.8 (C -24),15.0 (C -27). 与文献数据比对[22],大致相同,鉴定为羽扇豆醇.
化合物6:1H NMR (400 MHz,D2O)δ:1.94 (dd,1H,J=13.2,9.6 Hz,H -2a),2.00 (dd,1H,J=15.2,3.2 Hz,H-2b),2.08 (ddd,1H,J=13.2,4.4,2.0 Hz,H-6b),3.75 (dd,1H,J=9.6,3.2 Hz,H -4),5.18 (s,1H,H -5),6.81 (d,1H,J=8.0 Hz,H -5′),7.04 (s,1H,H-2′),7.46 (1H,d,J=15.6 Hz,H-7′).13C NMR (100 MHz,D2O)δ:180.9 (C -7),169.2 (C-9′),147.2 (C-4′),146.1 (C-7′),144.3 (C-3′),127.0 (C-1′),122.7 (C-6′),116.3 (C-5′),115.1 (C -2′),72.7 (C -4),71.1 (C -5),70.9 (C-3),38.5 (C-6),37.2 (C -2).与文献数据比对[23],大致相同,鉴定为绿原酸.
化合物7:1H NMR (400 MHz,CDCl3)δ:6.93,6.90,6.88,6. 85,6. 83,6. 82 (6H,Ar - H),5. 63 (s,1H,OH),4. 87 (d,J=7. 2 Hz,1H,H - 6),3. 91,3.89,3.87 (9H,3 ×OCH3),3.36 -2.85 (m,2H,H-1,5);13C NMR (100 MHz,CDCl3) δ:148.7 (C-3′),148.0 (C-4′),146.5 (C-3″),145.4 (C-4″),130.8 (C-1′),119.3 (C-6″),117.5 (C-6′),110.8 (C-5′),108.8 (C -2′),87.7 (C -2),82.1 (C -1),69.7 (C-8),55.8 (OCH3),50.1 (C-1).与文献数据比对[24],大致相同,鉴定为( +) -phillygenin.
化合物8:1H NMR (400 MHz,CDCl3)δ:2. 37(2H,J=7.5 Hz,2H,H -2),1.63 (m,2H,H -3),1.04 -1.30 (m,24H,H -4 ~15),0.85 (t,3H,J=6.0 Hz,H-16).与文献数据比对[25],大致相同,故鉴定为棕榈酸.
化合物9:无色针状结晶,Liebermann -Burchard反应呈阳性,与标准品在3 种溶剂中经TLC 分析,Rf值均相同,因此鉴定化合物9 为β-谷甾醇.
化合物10:白色粉末,经TLC 分析,化合物10 与标准品在多种溶剂体系下展开Rf 值均相同,以10%硫酸-乙醇溶液显色呈红色斑点,故鉴定为β -胡萝卜苷.
3.2 化合物抗氧化活性结果
具有抗氧化性与抑制酪氨酸酶活性的化合物一般为酚类化合物,因此本部分实验测定了分离所得的5 个酚类成分的抗氧化活性.
3.2.1 ABTS+自由基清除率
实验结果表明,所测定的5 个酚类化合物中,化合物3 对ABTS+自由基的清除作用最好,IC50值为(9.485 ±0.26) μg/mL,化合物2 相比于其他不够高效,其IC50值达到(495 ±75.09) μg/mL;其余化合物1、6、7 的IC50值则分别为(13. 53 ±0. 39) μg/mL、(23.22 ±0.83) μg/mL 与(19. 64 ±1. 69) μg/mL.ABTS+自由基清除率如图2 -A.
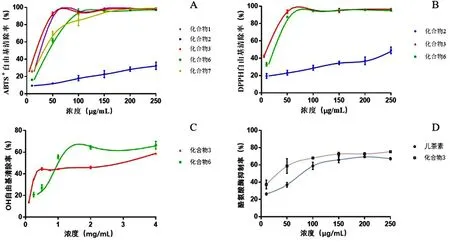
图2 酸叶胶藤中化合物对ABTS +、DPPH、OH 自由基与酪氨酸酶抑制率曲线Fig.2 Curve of ABTS +,DPPH,OH radical scavenging rate and tyrosinase inhibition rate of U.rosea compounds
3.2.2 DPPH 自由基清除率
如图2 -B 所示,在此实验中,仅化合物2、3 和6有清除DPPH 自由基的作用,IC50值分别为(255.3 ±15.63) μg/mL;(6.286 ±0.17) μg/mL 与(13.26 ±0.47) μg/mL.其中化合物3 清除DPPH 自由的基活性最好,化合物2 在浓度梯度范围内清除DPPH 自由基效果不够显著.
3.2.3 OH 自由基清除率
实验结果显示,化合物3 与化合物6 可以有效清除OH 自由基,其IC50分别为(1.69 ±0.142) mg/mL与(1.16 ±0.011) mg/mL,可以看出化合物6 对OH自由基的清除作用略优于化合物3. OH 自由基清除率如图2 -C.
3.2.4 酪氨酸酶抑制活性
以儿茶素为阳性对照根据上述实验方案测定5个化合物对酪氨酸酶的抑制活性.实验结果表明只有化合物3 对酪氨酸酶有显著的抑制作用,其IC50值为(47.23 ±4.12) μg/mL,明显优于阳性对照儿茶素(IC50=(84.74 ±5.87) μg/mL).此外,据图2 -D 所示,随着化合物3 浓度的升高,其对酪氨酸酶的抑制作用越强,呈现了明显的浓度依赖性.
3.3 化合物3 与酪氨酸酶分子对接结果
分子对接技术可以提供很多小分子配体与蛋白质受体的结合信息,如结合能与结合构象等[26].研究认为受体与配体之间结合能越低结合构象越稳定,通常结合能<-5 kcal/mol 则表明两者之间亲和力良好[27].本研究中化合物3 与酪氨酸酶的结合能为-7.8 kcal/mol,说明化合物3 可以与酪氨酸酶自主结合,有良好的酪氨酸酶抑制能力,分子对接的结果也与酪氨酸酶抑制活性的实验结果保持一致.
酪氨酸酶是一种含有两个铜离子的金属蛋白,位于疏水腔中的两个铜离子以及连接的氨基酸残基是酪氨酸酶的活性中心[28]. 如图3 -A 所示,分子对接结果表明化合物3 可与酪氨酸酶活性中心相结合,并改变酪氨酸酶的中心构象,这应该是化合物3 能使酪氨酸酶活性降低的重要原因. 图3 -C 显示化合物3与酪氨酸酶蛋白的氨基酸残基Cu400、Cu401、HIS61、HIS259、HIS279、ASN260、MET257、MET280、GLY281间形成范德华力,与HIS244、HIS263 连接以形成氢键,化合物3 的苯环部分与SER、PHE、HIS263 连接形成π-π 堆积、π -π T 型作用力,与VAL、ALA 连接形成sigma-π 超共轭作用力与π 烷基化超共轭作用力.
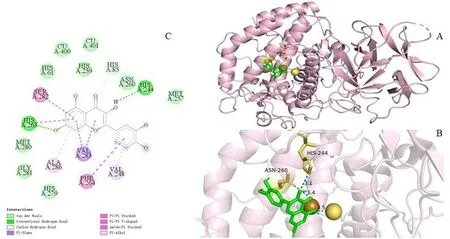
图3 化合物3 与酪氨酸酶的分子对接构象Fig.3 Molecular docking conformation of compound 3 and tyrosinase
4 结论
本文通过各种柱色谱方法和核磁共振波谱技术从酸叶胶藤枝叶中分离鉴定了10 个化合物,采用ABTS+、DPPH、OH 自由基清除法与抑制酪氨酸酶活性法考察了其中5 个酚性化合物的抗氧化性能.实验结果表明,化合物3 对ABTS+与DPPH 自由基清除效果较好,但清除OH 自由基能力较化合物6 稍差. 化合物2 也被证明有一定的抗氧化性能,但与其他能清除自由基的化合物对比其活性较弱.化合物1、6、7 清除ABTS+自由基能力与化合物6 清除DPPH 自由基能力都较好,但对酪氨酸酶活性无法产生抑制作用.五个酚类化合物中只有化合物3 显现了良好的酪氨酸酶抑制作用,其IC50值明显优于阳性对照儿茶素,因此化合物3 是一种可抑制酪氨酸酶活性的抗氧化剂.分子对接进一步验证了化合物3 对酪氨酸酶活性抑制作用,通过分子间作用力将化合物3 与酪氨酸酶活性中心的氨基酸残基稳固结合,从而改变酪氨酸酶的中心构象,以达到抑制其活性的作用. 研究结果证明了酸叶胶藤所含的酚类成分有较好的抗氧化作用,因此,其作为抗氧化活性成分源植物具有一定的科学基础.
