白虎加人参汤对高脂饮食诱导的2 型糖尿病MKR 小鼠白色脂肪组织炎症及肝脏脂肪变性的影响
2023-07-11谭丹妮喻嵘吴勇军刘旭向琴刘秀史留阳湖南中医药大学湖南长沙40208中医方证研究转化医学湖南省重点实验室湖南长沙40208
谭丹妮,喻嵘,2,吴勇军,刘旭,向琴,刘秀,史留阳(. 湖南中医药大学,湖南 长沙 40208;2.中医方证研究转化医学湖南省重点实验室,湖南 长沙 40208)
肥胖症和2 型糖尿病(type 2 diabetes mellitus,T2DM)是人类最普遍的代谢性疾病,也是当今社会卫生保健遇到的最大挑战之一[1]。在过去几十年里,肥胖症和T2DM 的患病率不断上升,并且涉及呼吸系统(如睡眠呼吸暂停综合征)、内分泌系统(如月经紊乱)、胃肠系统(如非酒精性脂肪性肝病)以及心血管系统等慢性疾病风险的增加[2]。因此,研究如何防治肥胖症合并T2DM,对提高患者生存质量,减少并发症,降低社会医疗经济负担,具有重要意义。胰岛素抵抗(insulin resistance,IR)是连接肥胖症与T2DM 的中心环节。研究[3-4]证实,由肥胖引起的白色脂肪组织(white adipose tissue,WAT)炎症被认为是促进肝脏脂肪变性、胰岛素抵抗的始动因素,并最终导致T2DM 的发生。
白虎加人参汤是张仲景的经典名方,具有益气生津、清热润燥等功效,临床常用于T2DM、中枢性高热、饥饿症等的治疗。现代药理学研究[5]表明,白虎加人参汤具有抗糖尿病、抗炎、解热、增强免疫力、保护心肌细胞等作用。
骨骼肌特异性胰岛素样生长因子1 受体功能缺失(loss of skeletal muscle-specific insulin-like growth factor-1 receptor function,MKR)小鼠是一种以FVB/N 小鼠为背景的转基因糖尿病小鼠,是目前研究T2DM 较为成熟的模型动物。
课题组在前期研究[6-9]中发现,白虎加人参汤具有调节MKR 糖尿病小鼠血糖、血脂,抑制胰岛细胞凋亡,减轻IR 等作用。基于此,本研究期望通过长期高脂饮食干预的方式作用于MKR 糖尿病小鼠,复制肥胖症合并T2DM 糖尿病疾病模型,探讨白虎加人参汤是否可以通过改善其肝脏脂肪变性和白色脂肪组织炎症,发挥抗肥胖T2DM 作用,为白虎加人参汤的临床应用提供科学依据。
1 材料与方法
1.1 动物及饲料 MKR 小鼠,雄性,SPF 级,8 周龄,体质量(18±2)g,由美国国立卫生研究院Dr.LeRoith 等于2001 年建立并馈赠引进,由本课题组配种后繁殖的子代用于本次实验研究,使用许可证号:SYXK(湘)2013-0005[10]。FVB 小鼠,雄性,SPF级,8 周龄,体质量(18±2)g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2019-0008,动物质量合格证号:110322211101769214。所有动物饲养于湖南中医药大学SPF 级实验动物中心,置于(24±2)℃、相对湿度(50±10)%、12 h/12 h明暗交替的环境。本研究经湖南中医药大学第一附属医院实验动物伦理委员会审核批准(批准号:ZYFY20201229)。高脂饲料含60%脂肪、20%碳水化合物、20%蛋白质,购自江苏省协同生物有限公司,配方编号:D12492。
1.2 药物及试剂 白虎加人参汤,组方为知母、石膏、炙甘草、人参、粳米,均购自湖南中医药大学第一附属医院中药房,经湖南中医药大学药学院吴勇军副教授鉴定,符合2020 年版《中华人民共和国药典》规定标准。盐酸二甲双胍片,浙江亚太药业股份有限公司,国药准字H33020106;葡萄糖溶液,湖南科伦制药有限公司,国药准字H20058338;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号:CSB-E04639m)、白细胞介素1β(interleukin-1β,IL-1β)检测试剂盒(批号:CSBE08054m)、白细胞介素6(interleukin-6,IL-6)检测试剂盒(批号:CSB-E04741m),均购自武汉华美生物工程有限公司;TNF-α 抗体(批号:17590-1-AP)、IL-6 抗体(批号:66146-1-Ig)、IL-1β 抗体(批号:26048-1-AP)、GAPDH 抗体(批号:10494-1-AP)、HRP 标记的山羊抗兔IgG 抗体(批号:SA00001-2),均购自美国Proteintech 公司;SDS 裂解液,爱必信生物科技有限公司,批号:ABS9117;苏木素- 伊红(hematoxylin-eosin ,HE)染液,武汉谷歌生物科技有限公司,批号:G1004;4%多聚甲醛组织固定液,兰杰柯科技有限公司,批号:BL539A。
1.3 仪器 GA-3 型血糖仪,三诺生物传感股份有限公司;德国Heidolph 旋转蒸发仪,海道尔夫仪器设备有限公司;H1650R 台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;PW-812 全自动酶标洗板机,深圳市汇松科技发展有限公司;MB-530 多功能酶标分析仪,深圳市汇松科技发展有限公司;7020 型全自动生化分析仪,日本株式会社日立高新技术公司;HP-500D 电热恒温培养箱,北京市永光明医疗仪器有限公司;DYCZ-40D 型转膜仪,北京六一生物科技有限公司;JJ224BC 型电子天平,美国双杰兄弟集团有限公司;BMJ-A 型生物组织包埋机,常州中威电子仪器有限公司;S1801367 型轮转式切片机,上海赛默飞世尔仪器有限公司;YD-A 型生物组织摊片机,金华市益迪医疗设备有限公司;BA410E 型三目生物显微镜,麦克奥迪实业集团中国有限公司。
1.4 药物制备 本研究根据李冀主编、中国中医药出版社出版的“十三五”教材《方剂学·清热剂》中白虎加人参汤剂量:石膏50 g、知母18 g、炙甘草6 g、粳米9 g、人参9 g 进行配制。按比例称取上述药材,8 倍蒸馏水浸泡30 min,煎煮30 min,倒出药液;第2 次加入6 倍蒸馏水煎煮25 min,合并煎液后用纱布过滤,用旋转蒸发仪将滤液浓缩至含生药量2 g·mL-1药液,放置4 ℃冰箱贮存备用。
1.5 模型复制 30 只8 周龄且经遗传鉴定的雄性MKR 小鼠,10 只同龄雄性FVB 小鼠,称取体质量后,FVB 小鼠给予普通饮食,MKR 小鼠给予高脂饮食,喂养12 周后,测量小鼠体质量与体长,计算其Lee’s 指数。高脂饮食组MKR 小鼠与普通饮食组FVB 小鼠的Lee’s 指数进行组间比较,若差异有统计学意义(P<0.05),且MKR 小鼠空腹血糖(fasting blood glucose,FBG)≥11.1 mmol·L-1,即表示肥胖症合并T2DM 的小鼠模型复制成功。
1.6 分组及给药方法 按照随机数字表法将模型复制成功的MKR 小鼠随机分为模型组、二甲双胍组、白虎加人参汤组,以FVB 小鼠作为正常对照组,每组均10 只。按体表面积等效剂量系数折算法,选用60 kg 的成人体质量与30 g 的小鼠体质量换算临床等效剂量为13.5 g·kg-1,参考本课题组前期量效关系研究基础,白虎加人参汤给予相当于4 倍的临床剂量54 g·kg-1灌胃;二甲双胍组给予0.2 g·kg-1灌胃;模型组和正常对照组给予等体积蒸馏水灌胃,灌胃容量为20 mL·kg-1,每日1 次,定时灌胃,持续6 周。
1.7 样本采集 末次给药后,禁食不禁水12 h 过夜,称取各组小鼠体质量后,使用乙醚进行麻醉。将干燥的棉球平铺于麻醉缸内,倒入乙醚,待乙醚挥发约1 min 左右,逐个放入实验小鼠,观察到小鼠被完全麻醉倒下后立即取出。然后使用摘除眼球取血法收集血液样本,放入4 ℃冷冻离心机,离心半径6 cm,以3 000 r·min-1的转速离心15 min,提取上清液,得到血清;迅速打开腹腔,分离出小鼠完整肝脏及双侧附睾白色脂肪组织,用生理盐水洗涤后,将肝脏与部分附睾白色脂肪组织放入4%多聚甲醛固定液中常温保存,剩余部分附睾白色脂肪组织放入液氮速冻后于-80 ℃保存。
1.8 观察指标
1.8.1 口服糖耐量试验(oral glucose tolerance test,OGTT) 取材前进行OGTT 试验,禁食不禁水12 h,给予每只小鼠20%葡萄糖溶液灌胃,灌胃体积为10 mL·kg-1。灌胃第1 s 开始计时,采取小鼠尾静脉血液,用血糖试纸分别检测小鼠灌胃前0 min 及灌胃后30 min、60 min、120 min 的4 个时间点血糖值,然后计算OGTT 时间-血糖曲线的曲线下面积(area under thecurve,AUC)。
1.8.2 血清指标检测 取小鼠血清,使用全自动生化分析仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)的含量;参照酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒说明书方法测定血清中TNF-α、IL-1β、IL-6 的含量。
1.8.3 病理组织检测 HE 染色:肝组织石蜡包埋切片,厚度3~4 μm,60 ℃烤片1~2 h;脱蜡,切片置于二甲苯中10min,2 次;依次在100%、95%、85%和75%乙醇中放置5 min;蒸馏水浸洗5 min;苏木素染5~10 min,PBS 返蓝;伊红染3~5 min,蒸馏水冲洗;梯度酒精脱水;中性树胶封片,显微镜观察。Masson 染色:肝组织石蜡包埋切片;切片脱蜡至水,核染液染色3~5 min;冲洗染色液,PBS 浸泡切片5~10 min 胞核返蓝;滴加浆染液染色2 min;分色液分色30 s;滴加复染液染色6~8 min,无水乙醇冲洗干净;吹干、透明、封片,显微镜观察。油红O 染色:组织冰冻切片;蒸馏水清洗;60%异丙醇浸润;油红O 稀释液避光染色10~15 min;60%异丙醇浸润1 min;水洗后苏木素染液染色3~5 min;水洗后1%盐酸酒精分化1~2 s;流水冲洗1~3 h;吹干、封片,显微镜观察。
1.8.4 蛋白免疫印迹法(Western Blot)检测 冻存的附睾白色脂肪组织标本提取总蛋白,并根据蛋白定量的结果点样,以恒定电压78 V 开始电泳2.5 h,电泳结束后电转移至硝酸纤维素膜,4 ℃封闭过夜。封闭后加入TNF-α(1∶1 000),IL-6(1∶3 000),IL-1β(1∶1 000),GAPDH(1∶3 000)一抗,室温孵育90 min;再加入HRP 标记的山羊抗兔IgG(1∶6 000)二抗,室温孵育90 min;ECL 化学发光液与膜孵育1 min,滤纸吸尽液体。最后在化学发光成像系统仪里面拍照,将曝光后的底片扫描,使用Quantity One专业灰度分析软件进行分析。
1.9 统计学处理方法 采用SPSS 19.0 和GraphPad Prism 9.0 统计软件进行数据分析,计量资料结果以均数± 标准差(±s)表示。满足正态性者,多组间比较采用单因素方差分析,两两比较用最小明显性差异法检验;不满足正态性资料用Kruskal-Wallis 秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 高脂饮食对MKR 小鼠空腹血糖、体质量及Lee’s 指数的影响 结果见图1。高脂饮食干预12 周后,与普通饮食组比较,高脂饮食组MKR 小鼠的空腹血糖浓度(≥11.1 mmol·L-1)、体质量及Lee’s 指数明显增加,差异有统计学意义(P<0.01),说明以长期高脂饮食干预的方式作用于MKR 小鼠,可以成功诱导其形成肥胖症合并T2DM 疾病模型。

图1 高脂饮食对骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)小鼠空腹血糖、体质量及Lee’s 指数的影响 (±s)Figure 1 Effects of high-fat diet on fasting blood glucose,body mass and Lee’s index in loss of sketal muscle-specific insulin-like growth factor-1 receptor function(MRK)mice(±s)
2.2 白虎加人参汤对肥胖MKR 糖尿病小鼠空腹血糖的影响 结果见图2。与正常对照组比较,模型组小鼠空腹血糖浓度明显增加,差异有统计学意义(P<0.01)。与模型组比较,二甲双胍组从治疗后的第2 周起空腹血糖浓度开始明显下降,差异有统计学意义(P<0.01);而白虎加人参组从治疗后的第4 周起空腹血糖浓度开始明显下降,差异有统计学意义(P<0.01)。与二甲双胍组比较,在治疗前期(2 周时)白虎加人参汤组降低血糖作用不及二甲双胍组,差异有统计学意义(P<0.05);而在治疗的后期(从4 周起),两组疗效相当,差异无统计学意义(P>0.05)。结果表明,白虎加人参汤可以降低肥胖MKR糖尿病小鼠空腹血糖浓度。

图2 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1受体功能缺失(MKR)糖尿病小鼠空腹血糖的影响(±s)Figure 2 Effect of Baihu Jia Renshen Decoction on fasting blood glucose in obese MKR diabetic mice(±s)
2.3 白虎加人参汤对肥胖MKR 糖尿病小鼠口服糖耐量的影响 结果见图3。各组小鼠经葡萄糖灌胃后,血糖浓度持续上升,模型组血糖处于明显高值。与正常对照组比较,模型组小鼠在葡萄糖溶液灌胃后30 min 血糖浓度达到峰值,OGTT-AUC 明显升高,差异有统计学意义(P<0.01)。与模型组比较,白虎加人参汤组小鼠在葡萄糖溶液灌胃后30 min 血糖浓度达到峰值,二甲双胍组小鼠在葡萄糖溶液灌胃后60 min 血糖浓度达到峰值,且均小于模型组小鼠的血糖峰值;灌胃后120 min,用药组血糖浓度和OGTT-AUC 均明显下降,差异均有统计学意义(P<0.01),提示白虎加人参汤可以抑制小鼠口服葡萄糖负荷后的血糖升高。

图3 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠口服糖耐量的影响(±s)Figure 3 Effect of Baihu Jiarenshen Decoction on oral glucose tolerance in obese MKR diabetic mice(±s)
2.4 白虎加人参汤对肥胖MKR 糖尿病小鼠TC、TG、HDL-C、LDL-C 和体质量的影响 结果见图4。与正常对照组比较,模型组小鼠体质量、TG、TC 和LDL-C 水平明显增高,而HDL-C 水平明显降低,差异均有统计学意义(P<0.01),提示肥胖MKR 糖尿病小鼠存在血脂代谢紊乱及高胆固醇血症。与模型组比较,药物干预组能明显降低小鼠TG、TC 和LDL-C 水平,升高HDL-C 水平,并能减轻小鼠体质量,差异均有统计学意义(P<0.01,P<0.05)。结果表明,白虎加人参汤具有抗肥胖,改善肥胖MKR 糖尿病小鼠血脂代谢异常及高胆固醇血症的作用。

图4 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠TC、TG、HDL-C、LDL-C 和体质量的影响(±s)Figure 4 Effects of Baihu Jiarenshen Decoction on TC,TG,HDL-C,LDL-C and body mass in obese MKR diabetic mice(±s)
2.5 白虎加人参汤对肥胖MKR 糖尿病小鼠肝脏组织病理的影响 结果见图5。油红O 染色光镜下,正常对照组肝脏组织未见明显橘红色脂滴;与正常对照组比较,模型组肝细胞内出现大范围橘红脂滴沉积;与模型组比较,白虎加人参汤组与二甲双胍组橘红脂滴覆盖范围明显减少。HE 染色光镜下,正常对照组小鼠切片组织清晰,肝细胞结构完整,排列整齐,未见变性坏死及炎性细胞;与正常对照组比较,模型组肝细胞结构紊乱,模糊不清,肝细胞出现脂肪变性肿胀,出现少量炎性细胞;与模型组比较,白虎加人参汤组与二甲双胍组炎性细胞减少,肝细胞肿胀明显减轻。Masson 染色光镜下可见,正常对照组肝组织汇管区周围蓝色区域较少,胶原纤维不明显;与正常对照组比较,模型组肝组织汇管区周围蓝色区域增加,整体上看纤维化改变较少;与模型组比较,白虎加人参汤组与二甲双胍组汇管区周围未见明显蓝色区域。结果表明,肥胖MKR 糖尿病小鼠存在肝脏脂肪变性以及轻度纤维化和炎症改变,而白虎加人参汤可以改善上述病理现象。
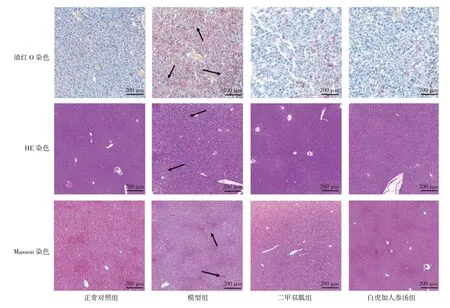
图5 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠肝脏组织病理的影响(油红O染色,×100;HE 染色,×100;Masson 染色,×100)Figure 5 Effect of Baihu Jiarenshen Decoction on liver histopathology in obese MKR diabetic mice(Oil red O staining,×100;HE staining,×100;Masson staining,×100)
2.6 白虎加人参汤对肥胖MKR 糖尿病小鼠ALT 和AST 的影响 结果见图6。与正常对照组比较,模型组小鼠ALT、AST 水平明显增高,差异有统计学意义(P<0.01),说明肥胖MKR 糖尿病小鼠存在一定程度的肝功能异常。与模型组比较,白虎加人参汤组与二甲双胍组小鼠ALT、AST 水平明显下降(P<0.01),两组间比较差异无统计学意义(P>0.05)。

图6 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1受体功能缺失(MKR)糖尿病小鼠ALT 和AST 水平的影响(±s)Figure 6 Effects of Baihu Jiarenshen Decoction on ALT and AST in obese MKR diabetic mice(±s)
2.7 白虎加人参汤对肥胖MKR 糖尿病小鼠附睾白色脂肪组织病理的影响 结果见图7。HE 染色光镜下可见,正常对照组脂肪细胞结构清晰,大小均匀;与正常对照组比较,模型组脂肪细胞结构紊乱,大小不一,出现细胞内脂质减少,细胞膜皱塌陷,多灶炎性细胞浸润;与模型组比较,白虎加人参汤组与二甲双胍组附睾白色脂肪组织的炎性细胞浸润明显减少,未见明显脂肪细胞膜皱塌陷,结构较为完整。

图7 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠附睾白色脂肪组织病理的影响(HE染色,×200)Figure 7 Effect of Baihu Jiarenshen Decoction on white adipose histopathology in obese MKR diabetic mice(HE staining,×200)
2.8 白虎加人参汤对肥胖MKR 糖尿病小鼠血清IL-1β、IL-6 和TNF-α 水平的影响 结果见图8。与正常对照组比较,模型组小鼠血清IL-1β、IL-6、TNF-α 水平均明显上升,差异有统计学意义(P<0.01)。与模型组比较,白虎加人参汤组与二甲双胍组小鼠血清IL-1β、IL-6、TNF-α 水平明显下降,差异有统计学意义(P<0.01),说明用药组小鼠体内炎症水平得到改善。

图8 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠血清IL-6、IL-1β 和TNF-α 水平的影响(±s)Figure 8 Effects of Baihu Jiarenshen Decoction on serum IL-6,IL-1β and TNF-α in obese MKR diabetic mice(±s)
2.9 白虎加人参汤对肥胖MKR 糖尿病小鼠附睾白色脂肪组织IL-1β、IL-6 和TNF-α 蛋白表达的影响 结果见图9。与正常对照组比较,模型组附睾白色脂肪组织IL-1β、IL-6、TNF-α 蛋白表达水平明显上调(P<0.01)。与模型组比较,白虎加人参汤组与二甲双胍组附睾白色脂肪组织IL-1β、IL-6、TNF-α 蛋白表达水平明显下降(P<0.01),两组间比较差异无统计学意义(P>0.05)。
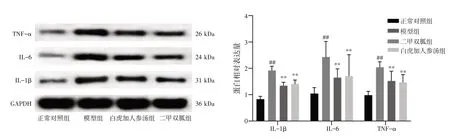
图9 白虎加人参汤对肥胖骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)糖尿病小鼠附睾白色脂肪组织IL-1β、IL-6和TNF-α 蛋白表达的影响(±s)Figure 9 Effects of Baihu Jiarenshen Decoction on the protein expressions of IL-1β,IL-6 and TNF-α in white adipose tissue of epididymal of obese MKR diabetic mice(±s)
3 讨论
课题组前期研究已证实骨骼肌特异性胰岛素样生长因子1 受体功能缺失(MKR)小鼠是研究T2DM 较好的动物模型之一,5 周龄即表现出明显的肌肉、肝脏、脂肪的胰岛素抵抗,以及高糖血症、胰岛β 细胞功能紊乱和脂质代谢异常[11]。本研究通过12 周高脂饮食喂养诱导后,MKR 小鼠体质量、Lee’s 指数及空腹血糖水平明显增高,表明高脂饮食对MKR 小鼠发展为肥胖症合并T2DM 疾病模型存在有效作用。先前的研究[12]表明,白虎加人参汤无论是合方或拆方均能有效降低T2DM 小鼠血糖值。其中,知母的有效成分知母皂苷具有α 葡萄糖苷酶抑制剂的作用[13];知母聚糖具有修复受损胰岛β 细胞,提高糖尿病小鼠骨骼肌对葡萄糖摄取的作用[14];人参及其有效成分提取物具有改善胰岛β 细胞功能,促进外周组织及靶器官对葡萄糖利用和调节脂质代谢等作用[15];石膏的有效成分二硫酸钙,含有大量的钙离子,能有效促进胰岛素分泌,且与人参、知母同用时,能够明显增强白虎加人参汤整体的降糖效果[16]。
众所周知,白色脂肪组织是机体重要的内分泌器官之一,可以表达和分泌各种脂肪因子,参与调节葡萄糖稳态、能量及脂肪代谢过程[17]。然而,在肥胖状态下,过量的营养物质以甘油三酯的形式储存于脂肪细胞,脂肪细胞在这个蓄积过程中增生肥大,导致其运动分泌模式改变。瘦素、单核细胞趋化蛋白1(monocyte chemotactic protein- 1, MCP- 1)、TNF-α、IL-1β、IL-6 以及抵抗素等促炎特性脂肪因子分泌水平增高,脂联素、白细胞介素10(interleukin-10,IL-10)等抗炎特性脂肪因子分泌水平减少[18]。最近的研究[19]表明,促炎特性脂肪因子TNF-α、IL-1β、IL-6 在胰岛素抵抗和T2DM 发病机制中起着核心作用。TNF-α 能够诱导脂肪组织特异性炎症,并可以激活各种炎症转录介导的通路[20]。早在1993 年,Hotamisligil.GS 就提出促炎细胞因子产生的中心来源是脂肪组织,他证实了TNF-α 是潜在的胰岛素抵抗介质,在正常脂肪组织中进行生理性表达,在肥胖脂肪组织中则过度表达[21]。而缺乏TNF-α 或其受体的肥胖小鼠可以表现出对胰岛素抵抗的保护作用[22]。IL-6 可以激活JAK-STAT 信号通路,促进细胞因子信号转导抑制因子1(suppressor of cytokine signaling 1,SOCS1)和细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)蛋白表达,阻断胰岛素受体与胰岛素受体底物蛋白相互作用,参与胰岛素抵抗[23]。IL-1β 通过与其受体结合,激活p38 丝裂原活化蛋白激酶(p38 mitogenactivated protein kinase,p38 MAPK),抑制胰岛素信号转导,促进胰岛素抵抗[24]。此外,白色脂肪组织炎症会导致脂肪细胞过度脂解,伴随门静脉循环,肝脏被直接暴露于高浓度的游离脂肪酸与炎症因子中,持续作用下脂质将沉积于肝脏,从而阻碍肝糖原的合成和肝脏胰岛素信号的转导[25]。
综上,白虎加人参汤能够明显减轻肥胖MKR 糖尿病小鼠体质量,改善附睾白色脂肪组织多灶炎性细胞浸润以及肝脏脂质沉积,降低血清TC、TG 、LDL-C 浓度,并减少血清TNF-α、IL-1β、IL-6 含量,提示白虎加人参汤可纠正肥胖MKR 糖尿病小鼠糖脂代谢紊乱,改善肝脏脂肪变性,可能与其抑制白色脂肪组织炎症细胞因子IL-1β、IL-6、TNF-α 的蛋白表达有关。此外,本研究的不足之处是剂量仅局限在54 g·kg-1,相对于目前临床用药剂量过高,且尚未完善药物毒理性实验,因此还有待进一步研究。
