不同盐度对酱油发酵中酵母自溶及酱油风味的影响
2023-07-10

摘要:对酵母在酱油发酵过程中的自溶现象及对成品酱油风味的影响进行了研究,酱油理化指标均在正常范围内。细胞数变化结果表明,20%盐度发酵时,酵母生长速度最慢,死亡率最高,达到72.9%;而16%和12%盐度发酵组死亡率分别为61.7%、52.8%。染色图片表明,随着发酵的进行,细胞结构均受到不同程度的破坏,呈现出明显的蓝色。风味分析实验表明,20%盐度发酵组细胞自溶加速,同时过度抑制酵母生长,不利于酱油风味的形成,12%盐度发酵组酵母细胞数量最高,其酸类物质含量也明显高于其他两组,过多的酸类物质会使酱油产生不良气味,影响酱油的感官品质。综合实验结果表明,16%盐度发酵组有利于酱油的发酵以及酱油综合风味的形成。
关键词:酱油;鲁氏接合酵母;自溶;风味
中图分类号:TS264.21 文献标志码:A 文章编号:1000-9973(2023)07-0014-06
Abstract: The autolysis phenomenon of yeast in the fermentation process of soy sauce and its effect on the flavor of finished soy sauce product are studied. The physical and chemical indexes of soy sauce are all in the normal range. The results of cell number changes show that when fermenting at 20% salinity, the yeast growth speed is the slowest and the mortality rate is the highest, reaching 72.9%, while the mortality rates of the 16% and 12% salinity fermentation groups are 61.7% and 52.8% respectively. The staining images show that the cell structure is damaged to varying degrees as the fermentation goes on, showing a distinct blue color. The flavor analysis experiment shows that cell autolysis of 20% salinity fermentation group accelerates. At the same time, the growth of yeast is excessively inhibited, which is not conducive to the formation of soy sauce flavor. The 12% salinity fermentation group has the largest number of yeast cells, and its acids' content is also significantly higher than that of the other two groups. Excessive acids will make soy sauce have bad flavor and affect the sensory quality of soy sauce. The comprehensive experiment results show that the 16% salinity fermentation group is more conducive to the fermentation of soy sauce and the formation of comprehensive flavor of soy sauce.
Key words: soy sauce; Zygosaccharomyces rouxii; autolysis; flavor
醬油是起源于我国的一种调味品,主要以富含蛋白质和淀粉的大豆、小麦等为原料,经预处理、制曲、发酵、压榨等工序生产出来的一种香气独特、滋味鲜美的调味品,并且由于营养丰富,对机体有一定的功效而逐渐被西方国家接受[1-2]。
酵母菌是应用最早的一类微生物,从酱醪中分离出的酵母菌有7个属,32个种,其中球拟酵母、鲁氏接合酵母等与酱油质量、风味的形成密切相关[3]。
自溶现象(autolysis)在1875年被Salkowski发现并命名,解释为随着细胞的死亡而发生的一种胞内大分子在多种水解酶的作用下分解为小分子物质的现象,这种现象通常发生在稳定期后期,是一种自发的、全局化、不可逆的细胞代谢反应[4-5]。而微生物的自溶现象受多种外界因素的影响,比如温度、压力、pH等控制不当都会提高酵母自溶的概率,氯化钠含量也是影响酵母自溶的关键因素之一[6]。高盐稀态酱油发酵工艺最突出的特点是食盐添加量的增加,这或许会对酵母自溶产生一定影响[7]。目前对酵母自溶的研究多集中于啤酒如何减轻酵母自溶现象,保持良好的啤酒特性,而对酱油发酵中酵母是否发生自溶、自溶程度、发生原因以及对酱油品质的影响等研究较少。本研究主要围绕着酱油发酵常用菌种鲁氏接合酵母展开,分析其在酱油发酵过程中的自溶现象以及其对酱油风味的影响。
1 材料与方法
1.1 材料
鲁氏接合酵母:天津科技大学食品营养与安全国家重点实验室菌种保藏中心存放。
1.2 实验试剂及培养基
YPD培养基:北京索莱宝科技有限公司;氢氧化钠、硼酸:天津津东天正精细化学试剂厂;盐酸:天津市化学试剂一厂;氯化钠、硫酸钾:天津市风船化学试剂科技有限公司;硫酸铜:博欧特(天津)化工贸易有限公司。
1.3 主要仪器设备
无菌操作台 江苏苏净集团有限公司;立式高压蒸汽灭菌锅 上海申安医疗器械厂;生化培养箱 上海一恒科学仪器有限公司;显微镜 日本SANYO公司;GC-MS(ISQ7000)气相色谱-质谱联用仪 日本岛津公司;酶标仪 美国Thermo Fisher Scientific公司;自动凯氏定氮仪 山东海能科技有限公司。
1.4 方法
1.4.1 总酸测定
根据GB 12456—2021规定的方法测定[8]。
1.4.2 氨基酸态氮测定
根据GB 5009.235—2016规定的方法测定[9]。
1.4.3 全氮测定
称取0.2 g硫酸铜与3 g硫酸钾至消化管内,并加入10 mL浓硫酸以及10 mL稀释10倍后的样品液,设置仪器温度为200 ℃,保持40 min,再调节至300 ℃,保持30 min,最后调节至420 ℃,保持90 min,待反应体系冷却至室温后,使用自动凯氏定氮仪蒸馏5 min,用0.1 mol/L的盐酸标准液进行滴定,颜色出现紫红色为滴定终点,并记录盐酸消耗量,同时做空白对照。
1.4.4 还原糖测定
还原糖含量根据DNS法进行测定[10]。
1.4.5 酱汁中酵母细胞数的变化及生长状态观察
酱汁中酵母细胞数的变化采用血球计数板进行测定。在计数板中央滴1滴0.1%吕氏碱性美蓝染色液,取稀释至适当倍数的样品稀释液加入染色液中混匀,染色2~3 min,加盖玻片,在显微镜下进行观察,计数变蓝的细胞。计数使用25×16型计数板,取左上、左下、右上、右下以及中间5个大格内的细胞。每个样品重复计数3次,并计算死亡率。
25×16型血球计数板计算公式:
酵母菌细胞数(mL)=80小格内酵母菌总数80×400×10×1 000×稀释倍数。
死亡率=死细胞总数总细胞数×100%。
1.4.6 酱醪中酵母菌落数的变化
根据GB 4789.15—2016进行测定[11]。高盐稀态酱醪用无菌生理盐水进行稀释后,选取3个适宜稀释度样品悬液吸取100 μL涂布于YPD固体培养基,每个梯度进行3次重复实验,30 ℃下培养3 d,根据国标要求进行计数。
1.4.7 酱油风味变化
酱油中风味物质的测定采用固相微萃取-气质联用的方法。
1.5 结果分析
利用SIMCA 14.1对数据进行分析;采用Origin软件进行作图分析。
2 结果与分析
不同盐含量对酱油各项指标有重要影响,总酸、氨基酸态氮、全氮和还原糖是反映酱油品质的重要指标,与酱油发酵有着密切的联系。为确保后续实验在正常发酵条件下进行,首先对不同盐含量发酵酱油的各项理化指标进行测定。
2.1 酱油总酸含量变化
总酸是酱油的重要理化指标,适量的总酸可以缓和因含盐量过高而带来的咸味,使滋味变得柔和,这些酸类物质与酱油中的酯类物質可进一步发生反应,丰富酱油的风味物质[12]。不同盐含量发酵组酱油的总酸含量变化见图1。
由图1可知,3组样品在发酵0~30 d内总酸含量呈快速上升状态,之后上升缓慢,这是因为在发酵前期各类酶活力相对旺盛,原料中的大分子物质逐渐分解为小分子产物,酸类物质增多,一些耐盐性产酸微生物的生长等都使得前期总酸含量增加;发酵结束时,3组总酸含量分别为2.00,1.86,1.81 g/dL。整个发酵期间,盐含量越高的发酵组其总酸含量越低,即12%>16%>20%,这种现象可能是由于盐含量的降低对一些产酸微生物的抑制作用减弱。
2.2 酱油氨基酸态氮含量变化
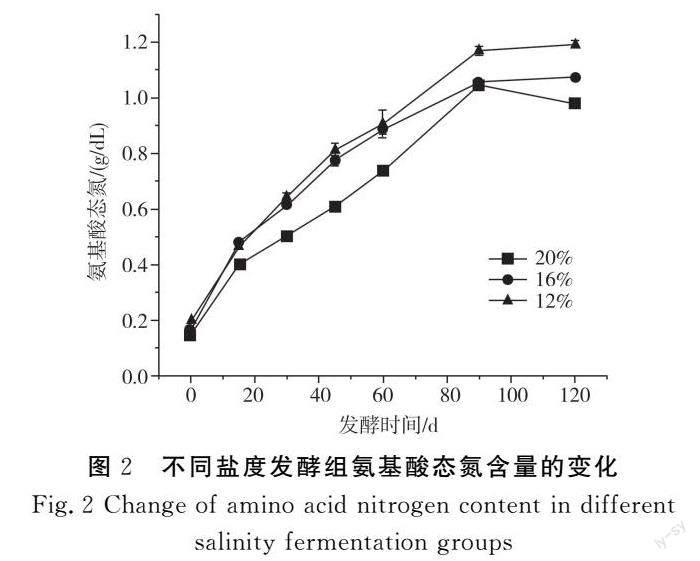
氨基酸态氮是以氨基酸形式存在的氮的总和,是酱油分级的重要标准之一。不同盐含量发酵组酱油的氨基酸态氮含量变化见图2。
由图2可知,3组氨基酸态氮均随发酵时间的延长而逐渐增加,各类酶活力旺盛,对原料分解迅速,导致前期增加较快,同时由于高浓度盐水的加入,原料中被分解的可溶性氮和盐水在渗透压的作用下发生交换现象,也使其含量快速增加。发酵后期整个体系中的酶活力下降,各类微生物的代谢也消耗掉部分氨基酸态氮,最终使氨基酸态氮含量增加缓慢[13]。发酵结束时,3组酱油的氨基酸态氮含量分别为1.19,1.07,0.98 g/dL,均达到国标中对特级酱油的要求。在发酵期间,盐浓度越高的组别其氨基酸态氮含量越低,这是因为盐分降低后微生物含量更丰富,对酶活的抑制作用更低,导致氨基酸态氮含量更高。
2.3 酱油全氮含量变化
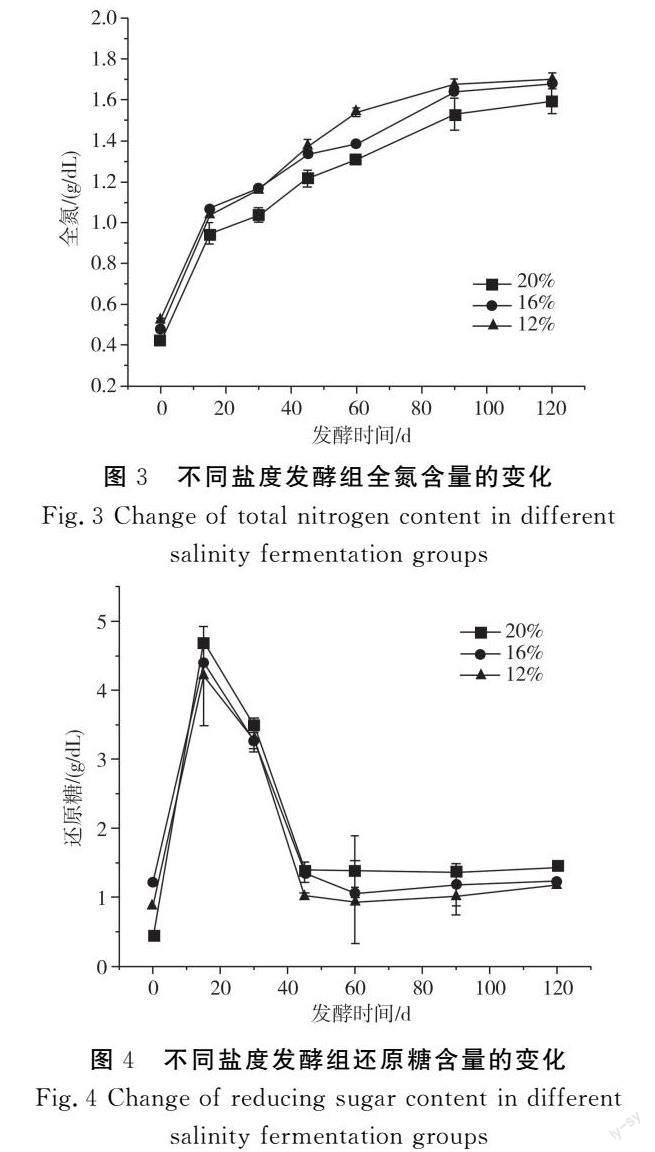
全氮是酱油中可溶性含氮化合物的总称,既包括原料和菌体中蛋白质水解产生的游离氨基酸,也包括发酵过程中蛋白质过度分解产生的游离氨基酸、多肽氮、菌体自溶后释放的核酸类水解物等,是衡量原料利用率和酱油优劣的重要指标[14]。3组酱油全氮含量的变化见图3。
由图3可知,3组酱油全氮含量的变化均呈现在前30 d左右时增加较快随后缓慢增加至稳定状态的趋势,最终发酵结束时3组酱油全氮含量分别为1.70,1.67,1.59 g/dL,全氮含量均达到国标要求。
2.4 酱油还原糖含量变化
在发酵过程中,淀粉质原料在糖化酶、淀粉酶等的作用下被分解为还原糖,酱油的口感、风味、色泽等都与还原糖含量密切相关。不同盐含量发酵组酱油的还原糖含量变化见图4。
由图4可知,3组酱油还原糖含量均呈现先快速上升后逐渐降低至稳定波动的趋势,在发酵第15天时,3组酱油还原糖含量均达到最大值,分别为4.20,4.39,4.64 g/dL。发酵初期,淀粉酶等活力旺盛,能快速将淀粉质原料水解成葡萄糖、麦芽糖等还原糖,因此前期还原糖含量快速升高,此时还原糖生成速度高于消耗速度。随着发酵时间增加,酶活力下降,生成还原糖速度降低,并且酵母菌的加入消耗还原糖,形成醇类、酯类等风味物质,所以还原糖含量降低[15]。发酵后期,酱醪中pH下降,微生物活动受到抑制,导致还原糖含量趋势逐渐变缓。
综合以上理化指标,3组酱油发酵均为正常发酵,可继续进行后续实验。
2.5 酱汁中酵母细胞数变化
自溶程度目前并没有较明确的判断指标,国外研究者通过实验指出可测定培养液中的腺苷酸激酶含量来判定酵母自溶,但此方法所用仪器较难获得;ASBC报道,在酵母自溶过程中,游离脂肪酸辛酸和癸酸的含量与其自溶有关,但测定方法较复杂[16—17]。氯化钠常作为一种经济、安全的促溶剂应用于菌体自溶中,氯化钠可以提高胞外渗透压,导致细胞质壁分离,质壁分离达到一定程度会引起细胞降解、胞内物质外溢[18]。细胞数的变化可以反映出酵母自溶的程度,首先利用酱汁模拟发酵,通过美蓝染色法区分活细胞与死细胞或者代谢作用微弱的衰老细胞,可初步判断发酵中酵母的自溶程度。
由圖5可知,在发酵前期,3组细胞数均快速上升,后期缓慢下降,在发酵17 d左右时,3组酵母细胞数均达到最大值,分别为2.45×107、2.2×107、2.1×107 个/mL。在发酵过程中,高盐发酵组的酵母细胞数始终低于低盐发酵组。由图6可知,盐度越高的发酵组其细胞死亡率也逐渐升高,20%盐度发酵组细胞死亡率达到79.2%,出现这一现象的原因可能是细胞长期处于高盐环境下,使得细胞内外的渗透压发生变化,胞内水分流失,影响细胞的增殖,膜内外压力的变化使细胞出现收缩或死亡,导致后期细胞数出现下降,活细胞减少[19]。这说明高浓度的氯化钠可以加速细胞的衰老死亡,促使酵母细胞更快地出现自溶现象。
在显微镜下分别观察了发酵前期和发酵后期酵母细胞的出芽现象(见图7),a~c是发酵前期在显微镜下观察到的酵母生长图,视野中可以看到大量酵母细胞出芽旺盛,通过染色发现,只有个别酵母细胞被染为蓝色,显示了活细胞氧化还原性强的特征;d~f为发酵后期时显微镜观察图,视野内可观察到的细胞数目明显减少,大多细胞以单细胞形式存在,只有极少数存在出芽现象,染色后观察到同一视野内的细胞多数被染为蓝色,这与整体酵母细胞数的变化趋势相对应,前期快速增加,后期缓慢下降,且细胞并不是全部死亡,仍有部分细胞处于出芽繁殖,说明自溶是一个长期的过程。
2.6 酱醪中酵母菌落数变化
酱汁模拟发酵并不能完全代表真实发酵体系中酵母自溶的程度,因此测定了酱醪发酵过程中酵母菌落数的变化情况,其数量变化见图8。
酵母初始接入量为1×106CFU/g,酵母加入当天计为第0天,每隔15 d进行一次取样。由图8可知,在酵母加入初期,3组酵母菌落数量与加入第0天相比均增加,在加入第15天时,12%发酵组菌落数量达到最大值,为1.2×106 CFU/g,而此时16%与20%两组其数量较第0天有所下降,这是因为高浓度氯化钠对酵母细胞的抑制作用增强,细胞正常生长繁殖能力下降,导致生长能力滞后;而到第30天时,20%和16%两组酵母菌落数量达到最大值,分别为1.02×106,1.1×106 CFU/g,说明此时酵母已经适应高盐环境,能够生长繁殖。30 d之后,3组菌落数均出现了不同程度的下降,到第90天时,20%发酵组已无菌落生长,16%和12%两组仍有菌落生长,但与前期相比数量下降明显,只有9×103,1.8×104 CFU/g;继续监测至第105天,3组均无菌落生长。这一现象表明酵母在整个发酵过程中可以进行较彻底的自溶,这一变化趋势与上述酱汁模拟发酵中细胞数的变化趋势相似,进一步证明了氯化钠浓度对酵母自溶的影响。
2.7 酵母自溶对酱油风味的影响
自溶是一个缓慢且长期的过程,这一过程中会释放自溶产物并对酱油风味产生影响,对成品酱油利用GC-MS进行风味物质检测,结果见图9。
由图9可知,3组酱油样品共检测出155种香气化合物成分,其中醇类物质27种,醛类物质20种,酚类物质5种,酮类物质21种,酯类物质34种,酸类物质10种,吡嗪类物质10种,呋喃类物质3种,烷烃类物质10种以及其他类化合物15种。其中20%发酵组中酯类物质最多,12%发酵组中酸类物质最多。
为区分不同发酵组中的差异风味代谢物,采用偏最小二乘回归方程的方法(PLS-DA模型)对不同条件下的样本进行分析。由图10可知,不同样本间得到了较好的分离,20%盐浓度发酵组分布在第一象限,12%发酵组分布在第三象限,16%发酵组分布在第四象限。进一步采用VIP值筛选不同条件下的差异代谢物,进行200次假设验证,选取VIP值大于1的物质,即为不同样本间的差异代谢物,共筛选出24种差异代谢物,差异代谢物聚类分析见图11。
差异代谢物中醇类物质有7种,包括苯乙醇、1-辛烯-3-醇、异戊醇、乙醇、2-甲基丁醇、(2S,3S)-(+)-2,3-丁二醇、反式-2-辛烯-1-醇,醇类物质是酱油的主要呈香物质,1-辛烯-3-醇带有蘑菇香气,使酱油鲜香醇厚,苯乙醇可赋予酱油蜂蜜的香气,异戊醇具有麦芽香气,能赋予酱油浓郁感[20]。由图11可知,12%发酵组醇类物质含量最高,结合酵母细胞数和菌落数在发酵过程中的变化分析这种现象出现的原因是酵母在低浓度氯化钠中抑制作用较小,细胞正常生长,其代谢产生的风味物质含量较高。20%和16%两组醇类物质含量降低,一方面是由于高浓度氯化钠的抑制作用使酵母细胞数量出现差异,另一方面是在氯化钠作用下,酱醪中的酵母细胞被破坏,酵母自溶进程加快,风味物质在发酵过程中释放,发酵结束时部分风味物质含量出现降低。
酸类物质包括醋酸、异戊酸、2-甲基丁酸,由图11可知,酸类物质含量在12%发酵组中最高,其原因与氯化钠对微生物的抑制作用减弱、微生物的产酸增加有关,同时也与理化指标中12%发酵组总酸含量最高相一致。异戊酸和2-甲基丁酸具有奶酪香,可以丰富酱油的香气,但是过多的酸类物质则会使酱油产生不良风味。
醛类物质有6种,包括苯乙醛、苯甲醛、异戊醛、2-甲基丁醛、2,4-二甲基苯甲醛、反-2-辛烯醛;醛类物质在酱油中的含量一般较少,但微量的醛类对酱油的香气成分有着一定的调和作用,这些物质可为酱油提供花香、杏仁香、咖啡可可香、苹果香等气味,都是酱油中的关键香气化合物。
酯类物质有4种,分别是苯乙酸甲酯、乙酸乙酯、亚油酸甲酯、反式-13-十八烯酸甲酯。酯类物质具有香甜、浓郁柔和的味道,可以使关键香味更加醇厚,起到掩盖不良风味、减淡咸味的作用,酯类物质除了酯化反应生成外,酵母的酯酶还可以将游离脂肪酸游离出来,进一步转化为酯类物质[21]。其中乙酸乙酯、苯乙酸乙酯在12%发酵组中含量最高,导致酯类物质含量降低的原因可能是酯酶被降解以及前体物醇类被消耗。
呋喃酮类物质5-乙基-4-羟基-2-甲基-3(2H)-呋喃酮可以为酱油提供焦糖香气,缓和盐味,有研究指出这类物质主要是由酱油酿造原料中的D-木酮糖-5-磷酸在酵母的作用下生成的[22]。
吡嗪类物质包括川芎嗪和2,3,5-三甲基吡嗪,酮类物质包括3-辛酮。
3 结论
本文以工业发酵用菌种鲁氏接合酵母为研究对象,设置不同盐度发酵组,考察氯化钠浓度对酵母自溶的影响以及成品酱油风味的变化。酱汁中酵母细胞以及酱醪中菌落数的变化均说明高浓度的氯化钠会抑制酵母细胞生长,加速酵母的死亡,促进酵母提前出现自溶现象,无法充分参与酱醪成熟与风味物质的生成,同时因自溶提前使风味物质挥发;12%发酵组的抑制作用不明显,微生物快速生长,风味分析发现酸类物质含量明显高于其他两组。综合考虑认为,16%发酵组更有利于酱油发酵,一方面酵母在发酵中可以彻底完成自溶且自溶进程并不会提前,另一方面对产酸微生物等有较强的抑制作用,有利于促进酱油综合风味的形成。该研究为评价酱油发酵过程中酵母自溶现象以及进一步提升酱油风味提供了一定依据。
参考文献:
[1]梁小玲,张巧苑,李洁珠.酱油酿造工艺分析[J].现代食品,2022,28(8):65-67.
[2]谭戈,徐晴元,郭丽琼,等.酿造酱油微生物多样性及风味物质研究进展[J].中国调味品,2021,46(6):160-163,179.
[3]张丽.高盐稀态酱油发酵过程中添加酵母的研究[D].贵阳:贵州大学,2019.
[4]WANG J J, LI M Q, ZHENG F Y, et al. Cell wall polysaccharides: before and after autolysis of brewer's yeast[J].World Journal of Microbiology & Biotechnology,2018,34(9):137.
[5]PONSMERCAD P, GIMNEZ P, VILOMARA G, et al. Monitoring yeast autolysis in sparkling wines from nine consecutive vintages produced by the traditional method[J].Australian Journal of Grape and Wine Research,2021,28(3):347-357.
[6]杨更.脉冲电场对诱导酿酒酵母自溶及其自溶产物品质影响的研究[D].广州:华南理工大学,2020.
[7]郭明威.产生酱油关键香气物质4-乙基愈创木酚的微生物和发酵工艺研究[D].广州:华南理工大学,2021.
[8]国家卫生健康委员会,国家市场监督管理总局.食品安全国家标准 食品中总酸的测定:GB 12456—2021[S].北京:中国标准出版社,2021.
[9]国家卫生和计划生育委员会.食品安全国家标准 食品中氨基酸态氮的测定:GB 5009.235—2016[S].北京:中国标准出版社,2016.
[10]牛亚冰.三株米曲霉菌种发酵性能的比较[D].天津:天津科技大学,2018.
[11]国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2016[S].北京:中国标准出版社,2016.
[12]谭戈,朱新贵,李学伟,等.强化鲁氏接合酵母对酱油品质的影响[J].食品工业科技,2022,43(13):86-93.
[13]TIN H S,周斌,侯莎,等.盐分对广式高盐稀态酱油发酵微生物菌群结构的影响[J].食品与发酵工业,2022,48(1):45-54.
[14]郭琳.不同酱油发酵工艺的比较研究[D].天津:天津科技大学,2017.
[15]庄婉菁,覃旋,刘晓艳,等.高盐稀态酱油酿造过程中理化指标的动态变化研究[J].农产品加工,2019(17):66-68.
[16]KATERˇINA , TOM B, JAKUB N, et al. Application of high-pressure processing to assure the storage stability of unfiltered lager beer[J].Molecules,2020,25(10):2414.
[17]张明芳.高温敏感型啤酒酵母的选育及其自溶研究[D].无锡:江南大学,2020.
[18]BOONYEUN P, SHOTIPRUK A, PROMMUAK C, et al. Enhancement of amino acid production by two-step autolysis of spent Brewer's yeast[J].Chemical Engineering Communications,2011,198(12):1594-1602.
[19]俞曉霞.高盐胁迫诱导光滑球拟酵母细胞凋亡的生理机制及内外源调控策略[D].无锡:江南大学,2015.
[20]GAO X L, FENG T, SHENG M J, et al. Characterization of the aroma-active compounds in black soybean sauce, a distinctive soy sauce[J].Food Chemistry,2021,364:130334.
[21]邓岳,杨阳,梁丽静,等.传统工艺酿造酱油微生物多样性与风味研究[J].中国调味品,2021,46(3):104-108.
[22]郭建,伍学明,樊君,等.鲁氏酵母和球拟酵母不同接种方式对高盐稀态酿造酱油品质的影响[J].中国调味品,2019,44(2):100-104.
