钾钠互作对棉花光系统Ⅱ和光系统Ⅰ荧光参数的影响
2023-07-10张晓甜王素芳马珂薛惠云张志勇
张晓甜 王素芳 马珂 薛惠云 张志勇

摘要:了解钾离子与钠离子之间的相互作用和对植物的生理效应,对于缓解钾肥资源短缺、提高缺钾土壤和盐地作物的产量有着重要意义。钾和盐胁迫影响了棉花生长,但两者相互作用对光合系统特别是光系统Ⅰ(PSⅠ)光化学效率等荧光参数的差异影响尚不清楚。本试验在温室条件下,测定低钾、盐胁迫和低钾+盐胁迫处理对棉株生长及叶绿素荧光参数的影响。低钾、盐胁迫及低钾+盐胁迫处理均显著制约了棉株的生长,但低钾条件下适宜的钠及盐胁迫下适宜的钾均显著促进了棉株生长。其中,低钾条件下适宜的钠使棉株根和叶面积恢复到CK水平,且茎和叶的生长也得到一定的恢复,盐胁迫下适宜的钾能恢复棉株根、茎、叶生长,特别是叶生长。此外,与对照相比,低钾、盐胁迫及低钾+盐胁迫处理均不同程度地影响了光合系统的荧光参数。与低钾+盐胁迫处理相比,低钾条件下适宜的钠显著降低了PSⅡ的光化学淬灭qP和实际光化学效率Y(Ⅱ)、PSⅠ的实际光化学效率Y(Ⅰ)、由供体侧限制引起的非光化学能量耗散的量子产量Y(ND),显著增加了PSⅡ的调节性能量耗散量子产量Y(NPQ)和PSⅠ受体侧限制引起的非光化学能量耗散的量子产量Y(NA)。与低钾+盐胁迫处理相比,盐胁迫下适宜的钾使Y(Ⅱ)、Y(NPQ)和Y(ND)显著升高,而Y(NO)和Y(NA)显著降低。由此可见,低钾条件下适宜的钠主要靠恢复棉株根系和叶面积的生长,从而缓解钾缺乏,盐胁迫下适宜的钾,提高了棉株的热耗散能力,修复对光合系统的损伤,特别是在PSⅠ中,提高了叶片的光合速率,进而促进棉株生长及干物质的积累。
关键词:棉花幼苗;低钾;盐胁迫;PSⅡ;PSⅠ;叶绿素荧光
中图分类号:S562.06文献标志码:A文章编号:1002-1302(2023)11-0097-09
棉花是一种喜钾的农作物,钾元素一方面能够提高棉花的水分利用率,加快植株内部物质向其他部位运输的速率;另一方面钾元素能够激活与植物光合作用相关的几种酶,提高光合效率,从而有利于植物干物质的积累,提高植株抗逆性[1]。20世纪90年代以来,棉花因缺钾而引起叶片早衰成为生产上的普遍现象。为缓解我国钾资源短缺的问题,钠作为钾最大优势的替补阳离子逐渐受到人们的关注[2]。此外,现今土壤盐渍化已经成为全球性生态问题,其不仅影响作物正常的生长发育,而且严重制约农作物的增产稳产[3]。棉花虽是耐盐性比较强的农作物,但盐碱地棉花产量仍亟待提高,而改良棉花新品种的耐盐碱性是最主要的途径[4]。盐胁迫通常涉及2种机制:渗透胁迫和离子胁迫,若胁迫主要是由NaCl引起的,起關键作用的Na+不仅会造成植物对其他矿质元素(K+、Ca2+、Mn2+等)的吸收不均衡[5],还会通过非选择性K+通道进入细胞质并积累到毒性水平[6]。有学者指出,K+/Na+比值可作为评估植物物种耐盐性的一个有用参数[7]。Taffouo等通过对3个不同品种的花生施加不同浓度的NaCl处理,测定根系和地上部Na+、K+含量以及K+/Na+比值,发现随着NaCl浓度的不断增加,K+从根系向茎的吸收和转移减少,导致根和茎中的K+含量降低[8]。有研究表明,高浓度的Na+会抑制土壤中的K+活性,导致K+的有效性降低[1]。Wu等同样发现,高盐条件下保持K+的吸收效率能够提高植物耐盐性[9]。
光合作用是植物生长发育的重要基础,是保证作物产量、品质的重要生理过程[10]。叶绿素分子吸收光能后经3个途径转换:驱动光合作用、以热能形式耗散、产生荧光,三者存在一种竞争机制[11],因此,叶绿素荧光可以反映叶片的光合能力。荧光不仅仅是光能的浪费,当入射光能超过植物吸收能力时,荧光可以保护光合机构免受伤害,从而减少光诱导氧化损伤。因此,在逆境生理研究中叶绿素荧光已被广泛应用于评价植物健康状态[12-14]。前人已通过叶绿素荧光参数研究了棉花对多种环境胁迫的响应机制。Shahenshah等以棉花和花生为材料,分别向其施加不同程度的水分胁迫,结果显示水分胁迫导致棉花和花生的光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)降低,非光化学猝灭(NPQ)上升,2种作物的PSⅡ均产生光损伤[15]。钾缺乏降低了棉花叶片叶绿素含量、净光合速率(Pn)、气孔导度(Gs)、Fv/Fm、实际光化学效率(ΦPSⅡ),从而显著影响棉花叶片光合能力[16]。高盐会使叶绿体的膜通透性和类囊体功能遭到破坏[17],光系统活性和叶绿素荧光也逐渐下降[18]。在大麦和水稻中,Yamane等研究了盐胁迫下叶绿素荧光与叶绿体超微结构(如类囊体形态)的相关性,发现耐盐品种的类囊体膨大程度会有所降低,PSⅡ电子传递活性相对较高,最大叶绿素荧光产量下降缓慢,延迟了植株的衰老[19]。张国伟等记录了5个土壤盐分水平下棉花功能叶片气体交换和叶绿素荧光参数的日变化,结果显示耐盐品种保持较高Pn的重要原因之一是其在盐胁迫下具有相对较高的热耗散能力[20]。Qu等研究发现,钾缺乏显著抑制了盐胁迫下玉米的光合作用,破坏了光系统Ⅰ(PSⅠ)和PSⅡ的光反应途径[21]。但前人较少系统分析钾缺乏、盐胁迫条件下钾钠互作对棉花生长和2个光合系统叶绿素荧光参数的差异性影响,特别是PSⅠ。因此,本试验通过测定钾胁迫、盐胁迫及钾胁迫+盐胁迫对棉花根系和地上部干质量、鲜质量等生物量的影响,对比分析棉花叶绿素荧光参数的变化,探究K+和Na+的相互作用,以期为进一步提高钾肥利用效率、培育耐盐性新品种、增加低钾土壤和盐性土壤的作物生产力提供理论支撑。
1材料与方法
1.1试验材料和培养条件
该试验以河南科技学院棉花研究所培育的棉花品种百棉1号为供试材料,于2021年11月在人工气候室进行。首先选取饱满度一致的种子,用10%的双氧水消毒30 min,自来水冲洗3次,之后将种子在自来水中浸泡24 h。浸泡后的种子置于水充分湿润的无菌培养沙中发芽。培养室光照度为 31 800 μmol/(m2·s),光照/黑暗时间为10 h/14 h,昼/夜温度设为30 ℃/25 ℃,湿度保持在50%左右。待棉花幼苗子叶展开时转移至改良的霍格兰氏营养液中培养[22]。培养盒尺寸为20 cm×13 cm×15 cm,营养液的体积为4 L,每个培养盒中种植8株。培养3 d后,更换营养液,并开始低钾、盐胁迫及其复合处理[22]。
参考苏莹等的棉花营养液培养法[23],对照设置为2.5 mmol/L KCl+2 mmol/L NaCl(CK)、低钾处理为0.05 mmol/L KCl+2 mmol/L NaCl(LK)、盐胁迫处理为2.5 mmol/L KCl+200 mmol/L NaCl(SS)、低钾+盐胁迫处理为0.05 mmol/L KCl+200 mmol/L NaCl(LK+SS),其他营养液组成保持一致,每个处理设置3个重复[22]。
1.2叶绿素荧光参数的测定
处理5 d时,利用双通道葉绿素荧光分析仪(DUAL PAM-100,Walz公司,德国)测定棉花叶绿素荧光参数[24],每个处理6个重复。为了尽量减少昼夜节律对光合效率的影响,所有测量均在白天进行。测定前首先对叶片进行暗处理30 min,在弱检测光[40 μmol/(m2·s)]下测得初始荧光(Fo),然后打开0.2~1.5 s的饱和脉冲[640 000 μmol/(m2·s)],获得最大荧光(Fm),接着打开光化光[40 000 μmol/(m2·s)],等荧光曲线处于稳定状态后,关闭光化光,测量过程结束,获得荧光参数(表1)。
1.3棉花幼苗生长参数的测定
处理6 d时,从每个处理组选取6株长势一致的幼苗,测量株高后分解为根、茎、叶,然后分部位称量,获得鲜质量。称质量后,用爱普生V800扫描仪进行扫描,然后用WinRHIZO Pro 2017图片分析软件进行根长、叶面积等形态指标的分析。最后,将根、茎、叶在105 ℃下杀青30 min,然后75 ℃烘至恒质量,称量,得到根、茎、叶干质量。计算得出各部分干物质积累量,计算公式如下:干物质积累量[g (DW)/100 g (FW)]=干质量/鲜质量×100[30]。
1.4数据整理与分析
利用Excel 2019和Origin 9.0进行数据整理及绘图,所有试验结果采用SPSS 25.0软件进行统计分析,并基于最小显著差异法(LSD)多重比较处理间的均值差异,所有显著性分析均在α=0.05水平上进行。
2结果与分析
2.1低钾、盐胁迫及低钾+盐胁迫处理对棉花不同器官生长的影响
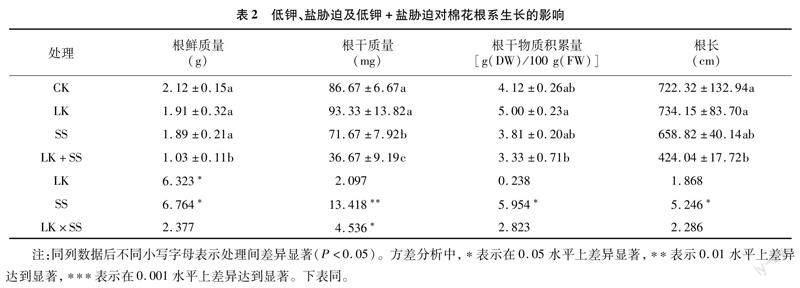
由表2可知,与CK相比,LK处理使根干质量、根干物质积累量和根长分别增加7.68%、21.36%和1.64%,使根鲜质量降低9.91%,但差异均未达到显著水平;与CK相比,SS处理使根鲜质量、干质量、干物质积累量和根长分别降低10.85%、17.31%、7.52%、8.79%,除根干质量外,其他差异均未达到显著水平;LK+SS处理下的根鲜质量、干质量、干物质积累量和根长较CK分别下降51.42%、57.69%、19.17%和41.29%,除根干物质积累量外,其他差异均达到显著水平。另外,与LK+SS相比,LK处理使根鲜质量、干质量、干物质积累量和根长分别显著升高85.44%、154.51%、50.15%、73.13%,而SS处理使根系鲜质量、干质量、干物质积累量、根长分别增加83.50%、95.45%、14.41%、55.37%,其中LK+SS处理与SS处理下根鲜质量、干质量差异均达到显著水平。
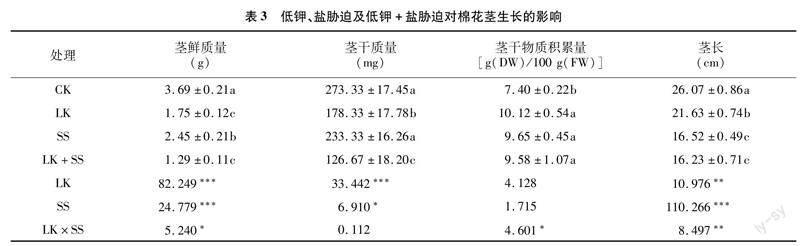
由表3可知,与CK相比,LK处理使茎鲜质量、干质量、茎长分别显著降低52.57%、34.76%、17.03%,使茎干物质积累量显著增加36.76%;与CK相比,SS使茎鲜质量、干质量、茎长分别降低33.60%、14.63%、36.63%,使茎干物质积累量显著增加30.41%;LK+SS处理下的茎鲜质量、干质量和茎长较CK分别显著下降65.04%、53.66%和37.74%,使茎干物质积累量显著增加29.46%。与LK+SS相比,LK处理使茎鲜质量、干质量、干物质积累量和茎长分别增加35.66%、40.78%、5.64%、33.27%,SS处理使茎鲜质量、干质量、干物质积累量、茎长分别升高89.92%、84.20%、0.73%、1.79%。
由表4可知,与CK相比,LK处理使叶鲜质量、干质量、叶面积分别降低36.07%、32.58%、8.35%,使叶干物质积累量增加6.04%;与CK相比,SS处理使叶鲜质量和叶面积分别降低1.51%、54.02%,叶干质量、干物质积累量分别显著提高20.60%、24.90%;LK+SS处理下的叶鲜质量、干质量、叶面积较CK分别显著下降55.29%、53.56%和68.43%,叶干物质积累量增加2.60%。另外,与LK+SS相比,LK处理使叶鲜质量、干质量、叶面积分别显著升高43.00%、45.16%、190.33%,SS处理下叶鲜质量、干质量、干物质积累量、叶面积较LK+SS处理分别显著升高120.29%、159.67%、21.73%、45.67%。
由图1可知,与CK相比,LK处理使植株总干质量显著下降28.98%,使总干物质积累量显著增加19.84%;与对照CK相比,SS处理使总干质量降低3.08%、总干物质积累量显著增加20.55%;LK+SS处理下的总干质量较CK显著降低54.04%,总干物质积累量增加7.80%。另外,与LK+SS相比,LK处理使总干质量、总干物质积累量分别升高54.51%、11.18%,SS处理使总干质量、总干物质积累量分别上升110.86%、11.83%。
2.2低钾、盐胁迫及低钾+盐胁迫对棉花叶绿素荧光参数的影响
2.2.1低钾、盐胁迫及低钾+盐胁迫对棉花PSⅡ叶绿素荧光参数的影响由图2可知,与CK相比,LK处理使Fo、Fm、Fv/Fm分别下降1.42%、7.16%
和1.63%,除Fv/Fm外,其他差異均未达到显著水平;与CK相比,SS处理使Fo、Fm、Fv/Fm分别降低0.44%、9.16%、2.34%;LK+SS处理下的Fm、Fv/Fm较CK分别下降5.38%、2.34%,Fo较对照升高3.50%。各处理与CK相比,均只有Fv/Fm显著降低。与LK+SS相比,LK处理使Fo、Fm分别降低4.75%、1.88%,Fv/Fm升高0.73%,SS处理下Fo、Fm较LK+SS处理分别降低3.80%、4.00%,但均未达到显著水平。
由图3可知,与CK相比,LK处理使qP、NPQ分别下降46.58%、17.54%,且NPQ差异显著;与CK相比,SS处理使qP、NPQ分别显著升高63.63%、17.06%;LK+SS处理下的qP较CK显著升高29.38%,NPQ较CK显著降低18.65%。另外,与LK+SS相比,LK处理下qP显著降低58.71%,NPQ上升1.36%,SS处理使qP、NPQ分别升高26.47%、43.90%,其中SS处理下的NPQ与LK+SS处理差异达到显著水平。
2.2.2钾钠互作对棉花叶片PSⅡ与PSⅠ光分配的影响在PSⅡ中,光化学反应、叶绿素荧光和非光化学猝灭是消耗叶片吸收光能的3种途径。根据能量守恒定律荧光产量、光化学产量和非光化学猝灭产量之和等于1,且当植物适应不断变化的环境时,这3种产量之间的关系需要权衡[31]。由图4-A可知,与CK相比,LK处理使Y(Ⅱ)显著降低45.80%、Y(NPQ)降低4.94%,Y(NO)显著提高16.06%;与CK相比,SS处理使Y(Ⅱ)显著升高50.94%、Y(NPQ)升高1.79%,使Y(NO)显著降低12.89%;LK+SS处理下Y(Ⅱ)、Y(NO)较CK分别升高29.61%、9.33%,Y(NPQ)较CK显著下降11.28%;另外,与LK+SS相比,LK处理下Y(Ⅱ)显著降低58.18%,Y(NO)升高6.17%,Y(NPQ)显著升高7.15%,SS处理使Y(Ⅱ)、Y(NPQ)分别显著上升16.46%、14.74%,Y(NO)显著降低20.32%。
植物光合作用中能量分配的变化不止发生在PSⅡ中,植物PSⅠ也会受到胁迫的影响,并且导致光系统之间能量分配出现不平衡。由图4-B可知,与CK相比,LK处理使Y(Ⅰ)下降13.94%、Y(ND)显著下降63.07%,使Y(NA)显著升高148.80%;与CK相比,SS处理使Y(Ⅰ)显著升高26.44%,Y(ND)升高14.59%,使Y(NA)显著降低47.85%;与CK相比,LK+SS处理下Y(Ⅰ)显著升高35.49%,Y(NA)升高29.50%,Y(ND)下降22.39%。另外,与LK+SS相比,LK处理使Y(Ⅰ)、Y(ND)分别显著下降36.49%、52.42%,使Y(NA)显著升高92.12%;SS处理下Y(NA)显著下降59.73%,Y(Ⅰ)降低6.68%,Y(ND)显著升高47.65%。
2.3植株干质量与叶绿素荧光参数的相关性分析
由图5可见,根干质量除了与Y(NA)呈正相关外,与其他叶绿素荧光参数均呈负相关,但均不显著;茎干质量除了与Y(ND)呈正相关外,与其他叶绿素荧光参数均呈负相关,但均未达到显著水平;叶干质量与Y(NA)呈显著负相关,相关性系数为 -0.43;总干质量除了与NPQ、Y(ND)呈正相关外,与其他叶绿素荧光参数均呈负相关,且均不显著。
3讨论与结论
棉花是重要的经济作物和纺织工业原料。据海关统计数据,2020年我国棉花产量591万t,进口原棉216万t,出口原棉仅占年产量的1%[32]。由此可见,我国的棉花供需极不平衡,提高棉花产量仍是棉花产业发展的重大需求。棉早衰通常导致棉花产量降低10%左右,严重时达20%。在盐碱地上,棉花早衰情况更加严重[33]。目前,生产上解决棉花缺钾导致早衰的主要办法是增施钾肥,但增施钾肥会增加成本且钾肥利用效率低。K几乎和所有生长必须的矿质元素互作[34]。钾缺乏对植物根系生长的影响在一定程度上可以因其他因素得到恢复。钾缺乏对大豆根系生长的抑制可以得到低浓度硅(Si)和Na元素的缓解,但前者的缓解作用明显优于后者[35]。在钾缺乏条件下施加52.5 mmol/L Ca,此时棉花的根系长度和表面积可恢复至正常钾水平下[33]。Na不仅在化学性质和结构方面与K相似,而且在某种程度上可以替代钾的许多功能,如内部渗透调节。本试验中,与CK相比,LK处理和LK+SS处理均显著降低了茎鲜质量、茎干质量、茎长、叶鲜质量、叶干质量、总干质量。与LK+SS处
理相比,LK处理下根鲜质量、根干质量、根干物质积累量、根长、茎干质量、茎长、叶鲜质量、叶干质量、叶面积、总干质量均显著升高,且LK处理的根鲜质量、根干质量、根干物质积累量、根长、叶面积与CK的上述指标无显著差异。由此可见,在钾缺乏的情况下,正常浓度的Na(2 mmol/L NaCl)有助于缓解低钾对植物造成的伤害,使棉花根和叶面积恢复到CK水平,且茎和叶的生长也得到一定的恢复。另一方面,K+也可通过增加细胞中K+/Na+比例来缓解盐胁迫对植物的伤害[36],主要机制包括高水平的供钾量会增加植物组织中K+的积累,从而降低胞内Na+浓度,提高K+/Na+比例,其中可能包含一些Na+特异性转运或Na+-K+共转运的HKT转运蛋白(高亲和力K+转运蛋白)家族成员,这些转运体在调节Na+、K+稳态和植物耐盐性方面具有关键作用[37]。Merwad报告称,较高的盐度对甜菜的根、茎、叶有负面影响,但外源施加足量钾对大多数在盐胁迫下栽培的甜菜品种有积极作用[38];Saida等观察到,在150 mmol/L NaCl盐胁迫处理下,应用2.39 mmol/L KH2PO4,可以增加番茄根系、茎的鲜质量和干质量[39];Fayez等通过对作物大麦(Hordeum vulgare)进行NaCl和KNO3不同组合处理,发现在150 mmol/L NaCl胁迫下,茎的鲜质量和高度下降,但经10 mmol/L KNO3处理后,其茎鲜质量和高度得到改善[40]。在本试验中,与CK相比,SS处理和LK+SS处理均显著降低了根干质量、茎鲜质量、茎长和叶面积。与LK+SS处理相比,SS处理显著提高了根鲜质量、根干质量、茎鲜质量、茎干质量、叶鲜质量、叶干质量、叶干物质积累量、叶面积、总干质量,而SS处理的叶干质量、叶干物质积累量均显著高于CK。可知,盐胁迫下足量钾能够缓解盐胁迫对棉株造成的伤害,恢复根、茎、叶生长,特别是叶生长。总之,K+与Na+二者存在一定的互补作用,即钾缺乏时适宜浓度的Na+能够缓解该胁迫对植物造成的伤害,而盐胁迫时足量的K+也能够减弱盐胁迫对植物的损伤程度,恢复植株生长。
植物受到胁迫的显著特征之一为光合作用的下降。叶绿素荧光参数可反映光反应中心活性的微小变化,因此叶绿素荧光技术已成为研究植物胁迫响应和解析胁迫机制的一个强有力工具[41]。前人研究发现,在多数逆境下PSⅡ更容易发生光抑制,PSⅠ在大多数逆境下比较稳定,只有冷敏感植物在低温光胁迫下才会发生明显的PSⅠ光抑制[42-43]。本试验中,与CK相比,LK处理使Fv/Fm显著降低1.63%,而LK+SS处理下Fv/Fm较CK显著降低2.34%,前者的下降幅度小于后者,但LK和LK+SS处理差异不显著。因此,本试验又进一步对光系统中光分配进行分析,結果显示,与LK+SS相比LK处理使棉花叶片的Y(Ⅱ)、Y(Ⅰ)和Y(ND)显著降低,Y(NPQ)和Y(NA)显著升高,可见钾胁迫下适宜钠不利于单叶光合能力的提升,但钾胁迫下适宜钠显著促进了根系的生长及叶面积的增加,从而有助于缓解钾胁迫,促进干物质量的积累。Qu等通过探究钾缺乏和盐胁迫二者相互作用对玉米幼苗光合作用的影响,发现与对照(正常钾+正常盐)相比,正常钾+盐胁迫、低钾+盐胁迫均导致玉米幼苗Fv/Fm下降,且低钾+盐胁迫的下降幅度大于正常钾+盐胁迫的下降幅度,前者约为后者的 1.5~2.0倍[21]。本试验结果显示,与CK相比,SS处理和LK+SS处理均导致Fv/Fm显著降低,这与上述他人研究结果一致,说明盐胁迫能导致棉花光合能力下降,使其对光能的转化效率降低。此外,对光系统中的能量分配进行分析可知,与LK+SS相比SS处理使Y(Ⅱ)、Y(NPQ)和 Y(ND) 显著升高,而Y(NO)和Y(NA)显著降低,说明适宜钾能够增强植物在高盐胁迫下以热的形式耗散那些不能用于光合电子传递的多余光能的能力,修复对PSⅡ和 PSⅠ 的损伤,从而促进植物光合作用的进行,使根、茎、叶生长,特别是叶生长得以恢复。进一步对植物各器官干质量与叶绿素荧光参数的相关性进行分析发现,叶干质量与Y(NA)显著负相关,即当由于受体侧限制引起的PSⅠ非光化学能量耗散的量子产量减少时,叶干质量相对增加,说明在不同条件下棉花叶片干质量主要取决于PSⅠ受体侧的光损失程度。
综上所述,钾缺乏条件下,适宜浓度的Na能够使棉花根和叶面积恢复到CK水平,且茎和叶的生长也得到一定的恢复,从而缓解钾缺乏对棉株造成的伤害,而适量K又能缓解高盐胁迫,提高棉株的热耗散能力,修复对PSⅡ和PSⅠ的损伤,特别是 PSⅠ,提高棉花叶片的光合速率,进而促进植物干物质的积累。
参考文献:
[1]Wang M,Zheng Q S,Shen Q R,et al. The critical role of potassium in plant stress response[J]. International Journal of Molecular Sciences,2013,14(4):7370-7390.
[2]王晓丽,姜存仓,郝艳淑,等. 钠和其他离子对钾离子替代作用的研究进展[J]. 中国土壤与肥料,2012(1):1-6,13.
[3]Matuszak-Slamani R,Bejger R,Cies'la J,et al. Influence of humic acid molecular fractions on growth and development of soybean seedlings under salt stress[J]. Plant Growth Regulation,2017,83(3):465-477.
[4]胡根海,李春平,张志勇,等. 盐胁迫对百棉1号与中棉所44的影响比较[J]. 湖北农业科学,2012,51(15):3173-3176.
[5]McCue K F,Hanson A D.Salt-inducible betaine aldehyde dehydrogenase from sugar beet:cDNA cloning and expression[J]. Plant Molecular Biology,1992,18(1):1-11.
[6]Flowers T J. Improving crop salt tolerance[J]. Journal of Experimental Botany,2004,55(396):307-319.
[7]Cuin T A,Miller A J,Laurie S A,et al. Potassium activities in cell compartments of salt-grown barley leaves[J]. Journal of Experimental Botany,2003,54(383):657-661.
[8]Taffouo V D,Wamba O F,Youmbi E,et al. Growth,yield,water status and ionic distribution response of three Bambara groundnut [Vigna subterranea (L.) verdc.]landraces grown under saline conditions[J]. International Journal of Botany,2010,6(1):53-58.
[9]Wu H H,Shabala L,Barry K,et al. Ability of leaf mesophyll to retain potassium correlates with salinity tolerance in wheat and barley[J]. Physiologia Plantarum,2013,149(4):515-527.
[10]Wang L,Yang Y M,Zhang S Y,et al. GWAS reveals two novel loci for photosynthesis-related traits in soybean[J]. Molecular Genetics and Genomics,2020,295(3):705-716.
[11]Maxwell K,Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51(345):659-668.
[12]張永江. 植物叶绿素荧光被动遥感探测及应用研究[D]. 杭州:浙江大学,2006.
[13]Genty B,Briantais J M,Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta-General Subjects,1989,990(1):87-92.
[14]Schreiber U,Bilger W,Neubauer C. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[M]//Ecophysiology of photosynthesis.Berlin,Heidelberg:Springer,1995:49-70.
[15]Shahenshah,Isoda A. Effects of water stress on leaf temperature and chlorophyll fluorescence parameters in cotton and peanut[J]. Plant Production Science,2010,13(3):269-278.
[16]梁振娟,张亚黎,罗宏海,等. 钾营养对棉花叶片光合作用及衰老特性的影响[J]. 石河子大学学报(自然科学版),2013,31(3):265-270.
[17]Wang R L,Hua C,Zhou F,et al. Effects of NaCl stress on photochemical activity and thylakoid membrane polypeptide composition of a salt-tolerant and a salt-sensitive rice cultivar[J]. Photosynthetica,2009,47(1):125-127.
[18]Tiwari B S,Bose A,Ghosh B. Photosynthesis in rice under a salt stress[J]. Photosynthetica,1998,34(2):303-306.
[19]Yamane K,Kawasaki M,Taniguchi M,et al. Correlation between chloroplast ultrastructure and chlorophyll fluorescence characteristics in the leaves of rice (Oryza sativa L.) grown under salinity[J]. Plant Production Science,2008,11(1):139-145.
[20]张国伟,张雷,唐明星,等. 土壤盐分对棉花功能叶气体交换参数和叶绿素荧光参数日变化的影响[J]. 应用生态学报,2011,22(7):1771-1781.
[21]Qu C X,Liu C,Gong X L,et al. Impairment of maize seedling photosynthesis caused by a combination of potassium deficiency and salt stress[J]. Environmental and Experimental Botany,2012,75:134-141.
[22]Arnon D I,Hoagland D R. Crop production in artificial culture solutions and in soils with special reference to factors influencing yields and absorption of inorganic nutrients[J]. Soil Science,1940,50:463-485.
[23]苏莹,郭安慧,华金平. 棉花耐盐性鉴定方法探讨[J]. 中国农业大学学报,2021,26(12):11-19.
[24]Klughammer C,Schreiber U. Saturation Pulse method for assessment of energy conversion in PS Ⅰ[J]. Pam Application Notes,2008,1:11-14.
[25]van Kooten O,Snel J F H. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynthesis Research,1990,25(3):147-150.
[26]张守仁.叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.
[27]Long S P,Lichtenthaler H K. Applications of chlorophyll Ⅱ fluorescence in photosynthesis research,stress physiology,hydrobiology and remote sensing[J]. Journal of Applied Ecology,1990,27(2):764-765.
[28]Shirke P A,Pathre U V. Diurnal and seasonal changes in photosynthesis and photosystem 2 photochemical efficiency in Prosopis juliflora leaves subjected to natural environmental stress[J]. Photosynthetica,2003,41(1):83-89.
[29]Pfündel E,Klughammer C,Schreiber U. Monitoring the effects of reduced PS II antenna size on quantum yields of photosystems Ⅰ and Ⅱ using the Dual-PAM-100 measuring system[J]. Pam Application Notes,2008,1:21-24.
[30]张志勇,卜晶晶,王素芳,等. 冠菌素对不同钾水平下TTC法测定的棉花根系活力的影响[J]. 植物生理学报,2015,51(5):695-701.
[31]Baker N R. Chlorophyll fluorescence:a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology,2008,59:89-113.
[32]国家统计局. 中国统计年鉴2020[M]. 北京:中国统计出版社,2020.
[33]张志勇. 钾营养与棉花质外体氧化还原平衡[M]. 北京:中国农业出版社,2020.
[34]Pervez H,Makhdum M I,Ashraf M T. The interactive effects of potassium nutrition on the uptake of other nutrients in cotton (Gossypium Hirsutum L.) under an arid environment [J]. Journal of Chemical Society of Pakistan,2006,28(3):256-265.
[35]Miao B H,Han X G,Zhang W H. The ameliorative effect of silicon on soybean seedlings grown in potassium-deficient medium[J]. Annals of Botany,2010,105(6):967-973.
[36]Shabala S,Cuin T A. Potassium transport and plant salt tolerance[J]. Physiologia Plantarum,2008,133(4):651-669.
[37]Mian A,Oomen R J F J,Isayenkov S,et al. Over-expression of an Na+-and K+-permeable HKT transporter in barley improves salt tolerance[J]. The Plant Journal,2011,68(3):468-479.
[38]Merwad A R M A. Efficiency of potassium fertilization and salicylic acid on yield and nutrient accumulation of sugar beet grown on saline soil[J]. Communications in Soil Science and Plant Analysis,2016,47(9):1184-1192.
[39]Saida C,Houria B,Mébarek B. Interactive effects of salinity and potassium on physio-morphological traits of tomato (Lycopersicon esculentum Mill.;var:Heintz) [J]. Agriculture and Biology Journal of North America,2014,5(3):135-143.
[40]Fayez K A,Bazaid S A. Improving drought and salinity tolerance in barley by application of salicylic acid and potassium nitrate[J]. Journal of the Saudi Society of Agricultural Sciences,2014,13(1):45-55.
[41]Bauriegel E,Brabandt H,Grber U,et al. Chlorophyll fluorescence imaging to facilitate breeding of Bremia lactucae-resistant lettuce cultivars[J]. Computers and Electronics in Agriculture,2014,105:74-82.
[42]Zhang Z S,Jia Y J,Gao H Y,et al. Characterization of PSⅠ recovery after chilling-induced photoinhibition in cucumber (Cucumis sativus L.) leaves[J]. Planta,2011,234(5):883-889.
[43]張子山,杨程,高辉远.植物光系统Ⅰ的低温光抑制及恢复[J]. 植物生理学报,2013,49(4):301-308. 李翔,杜双林,朱文平,等. 水稻隐性雄性不育突变体osnp3的败育特征及基因定位[J]. 江苏农业科学,2023,51(11):106-112.
