不同营养类型培养基番茄内生细菌群落结构研究
2023-07-10张泽宇肖扬詹亚斌魏雨泉徐道清李季
张泽宇 肖扬 詹亚斌 魏雨泉 徐道清 李季

摘要:通过采用Biolog EcoPlate 培养、16S r RNA基因高通量测序技术等方法研究不同培养基上植物内生细菌群落结构的组成差异,探究不同培养基等营养条件对番茄内生细菌群落结构的影响。结果表明:(1)4种培养基上生长的内生菌群在Biolog EcoPlate 微平板培养96 h 后,菌群生长达到稳定期,且在牛肉膏蛋白胨(NA)培养基下菌群代谢活性较高。R2A培养基下菌群代谢活性较低。(2) 番茄内生微生物组包括柠檬酸杆菌属(Citroebacteria)、芽孢杆菌属(Bacillus)、鞘脂单胞菌(Sphingbacterium)、布克氏菌属(Burkholderia)。(3)LB、TSA培养基分离到的内生菌多为芽孢杆菌属;在NA、R2A培养基中番茄内生菌组成多为柠檬酸杆菌、芽孢杆菌、鞘脂单胞菌、布克氏菌,为优势菌种。(4)NA培养基中番茄内生微生物组香农指数高于其他处理(P<0.05)差异;PCoA分析显示4种培养基中番茄内生细菌群落结构具有差异(P<0.05)。(5)网络分析发现NA、R2A培养基中番茄内生细菌微生物组模块化水平更高,而且网络拓扑性更高。(6)LEfSe分析发现,LB富集的物种为芽孢杆菌,NA培养基富集物种多为假单胞菌(Pseudomonas),R2A培养基富集物种多鞘脂单胞菌,TSA培养基富集物种多布克氏菌属。 本研究通过高通量测序分析不同营养类型培养基对番茄内生微生物组群落结构的影响,对于生产中通过利用营养条件调控植物内生菌群群落结构组成及靶向筛选有益微生物具有重要的指导意义。
关键词:培养基;营养条件;Biolog EcoPlate微平板;16S rRNA基因高通量测序;内生菌群
中图分类号:S182文献标志码:A文章编号:1002-1302(2023)11-0128-05
植物内生菌是指真菌和细菌在某个生活阶段能够进入活体植物组织内,并且在植物组织内不引起显著变化的一类微生物[1]。植物内生菌主要来源于土壤微生物,或者大气中的微生物通过植物气孔、自然伤口进入植物组织内。内生细菌作为一类特殊的微生物,与植物宿主一同演化共生,但不引起宿主的明显症状,所处环境稳定,营养来源丰富、可靠[2]。研究表明,植物内生菌产生的次生代谢产物,如各类型保护酶、生长素等物质,可以调节植物代谢,帮助植物抵御逆境胁迫,促进植物生长,具有良好的生态功能[3]。
植物内生菌是一类多样性十分丰富的微生物类群,与宿主存在协同进化关系[4],随着研究领域的不断扩宽和研究方法的改進,探寻植物内生菌的最适营养条件成为当下植物与微生物互作研究的热点领域之一[5]。自然生长环境下有很多因素均可以影响植物内生菌的组成结构,如碳源、氮源、根系分泌物等关键营养因子[6-7]。内生菌群与植物之间的相互作用对植物的各项生命活动具有重要影响,如促进植物生长、防止病原微生物的侵害[8-10]等。
随着高通量测序技术的发展和微生物组研究的深入,越来越多的模式植株如拟南芥、水稻、小麦、番茄、甜菜等多种植物根系微生物组的结构得到了解析。研究表明,无论是单子叶植物还是双子叶植物,根系微生物组多集中于变形菌门、放线菌门、拟杆菌门、厚壁菌门[4]。由植物自身代谢引起的营养调节作用对植物内生细菌的组成有很大影响[4],因此从营养成分差异角度揭示营养成分对番茄内生细菌群落结构组成的影响对于有益内生菌的定向筛选及有益生物学功能的发挥具有重要意义。
本研究通过将番茄根部组织研磨液涂布在LB、TSA、NA、R2A这4种培养基上,通过制备不同营养条件下的番茄内生微生物组,通过Biolog Ecoplate测定和16S r RNA gene高通量测序技术分析番茄根部内生细菌群落结构多样性,研究不同营养类型培养基对内生细菌群落结构的影响,以期能够利用营养条件定向调控内生菌群落结构组成,以期为靶向筛选目标内生菌提供理论依据。
1材料与方法
番茄植株来自于中国农业大学科学园温室,栽培管理措施均按日常管理措施进行。
1.1供试分离培养基
R2A培养基:称取R2A琼脂培养基41 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
LB培养基:酵母提取物5 g,胰蛋白胨5 g,NaCl 10 g,蒸馏水1 000 mL,琼脂20 g,pH值7.4,121 ℃高压蒸汽灭菌 20 min。
TSA培养基:称取TSA琼脂培养基40 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌 20 min。
NA培养基:称取蛋白胨 10 g,牛肉粉3 g,NaCl 5 g,蒸馏水1 000 mL,琼脂15 g,121 ℃高压蒸汽灭菌 20 min。
PBS缓冲液:8 g NaCl,0.2 g KCl,1.44 g Na2HPO4,pH值7.4,去离子水定容至1 L,121 ℃高压蒸汽灭菌 20 min。
1.2番茄根部内生微生物组的制备
番茄植株于2021年8月采集自中国农业大学科学园温室,栽培管理措施均按照日常管理措施进行。采集4叶期番茄苗,称取番茄根1 g,在PBS缓冲液中将其研磨后将研磨液用无菌水按照倍比稀释法,取100 μL稀释液分别涂布于TSA、LB、NA、R2A培养基中,25 ℃培养箱中培养7 d,各培养基平板上生长的菌落即为番茄根部内生微生物组。
1.3Biolog EcoPlate测定
植物研磨液在各类型培养基培养7 d后,用无菌水冲洗各个培养基平板,并用涂布棒将培养基平板上的菌在无菌水中涂抹均匀,最后用移液器吸取各培养基平板上的菌悬液1 mL到装有10 mL PBS缓冲溶液的50 mL离心管中,振荡2 min 后,5 000 g 离心5 min,取1 mL上清液加入到装有20 mL PBS缓冲液的离心管中,混合均匀后加入到Biolog EcoPlate 平板中,每孔加入100 mL悬浮液。将接种后的微平板置于25 ℃ 培养箱中培养,每隔 24 h用细菌读数仪读取微平板吸光度,连续测定5 d。
1.416S rRNA基因高通量测序分析内生细菌群落结构多样性
培养7 d后,用无菌水冲洗各培养基平板,并用涂布棒涂抹,用移液枪吸取各平板上的菌悬液1 mL提取菌悬液DNA,采用特异性引物799F(5′-AACMGGATTAGATACCCKG-3′) 和1193R (5′-ACGTCATCCCCACCTTCC-3′),以菌悬液DNA为模板,扩增16S rRNA基因V7~V9区,扩增片段大小约为394 bp。反应体系25 μL:TaKaRa Mix 12.5 μL,779F 1 μL,1392R 1 μL,DNA 1 μL,ddH2O 9.5 μL,PCR 扩增程序如下:94 ℃ 2 min;94 ℃ 30s;55 ℃ 30 s;72 ℃ 1 min共25个循环,最后72 ℃延伸 5 min。产物经过1%琼脂糖凝胶电泳检测。用PCR纯化试剂盒(Cycle-Pure Kit,OMEGA,美国)将PCR产物纯化,按照说明书的操作步骤进行,然后将纯化后的产物按照测序要求建立测序文库,送交广州美格生物科技有限公司进行高通量测序,并分析结果。
1.5数据分析
采用IBM SPSS Statistics 20.0软件对数据进行单因素方差分析,并采用Duncan's新复极差法进行差异显著性分析,独立样本t检验,用Origin软件画图。
2结果与分析
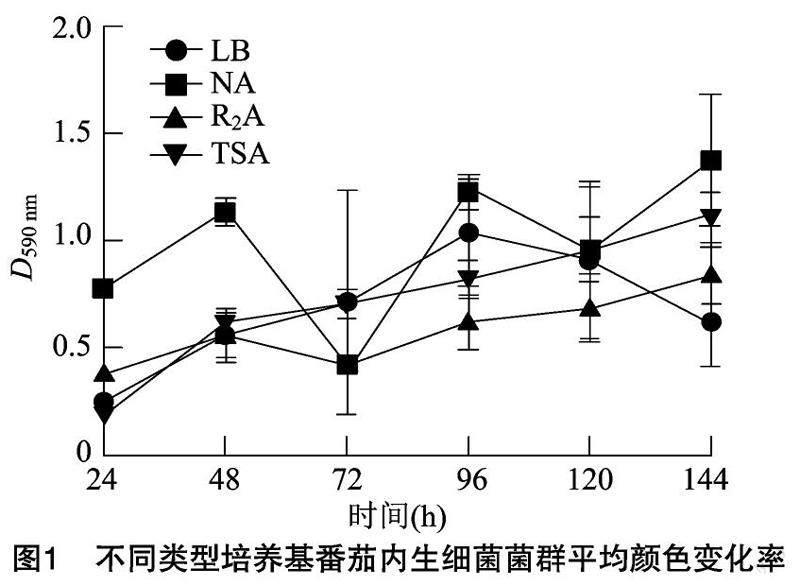
2.1番茄内生菌菌群的AWCD值随培养时间的变化
平均颜色变化率(AWCD)是反映微生物代谢活性(即微生物利用碳源的能力)的指标(图1),随着培养时间的延长,微生物利用碳源数量整体逐渐增加。在24~96 h内,番茄内生菌群处于对数生长期,菌群代谢活性逐渐升高;在培养96 h后,番茄菌群的生长达到稳定期,NA培养基下菌群代谢活性较高。R2A培养基下菌群代谢活性较低。
2.2不同类型培养基番茄内生细菌种属分布
各个类型培养基分离出的内生菌大部分属于柠檬酸杆菌属(Citrobacter)、芽孢杆菌属(Bacillus)、鞘脂单胞菌(Sphinogbacterium)、布克氏菌属(Burkholderia)。R2A培养基作为一种广谱的营养来源,内生细菌组成种类较多,各类型内生菌分布较为均匀;NA培养基中内生菌分布情况与R2A类似:芽孢杆菌、布克氏菌属、鞘脂单胞菌、柠檬酸杆菌均为优势物种;但是在TSA和LB培养基中,内生菌群中芽孢杆菌属丰度较高,所占比例均在80%左右,成为该培养基中的优势物种(图2)。
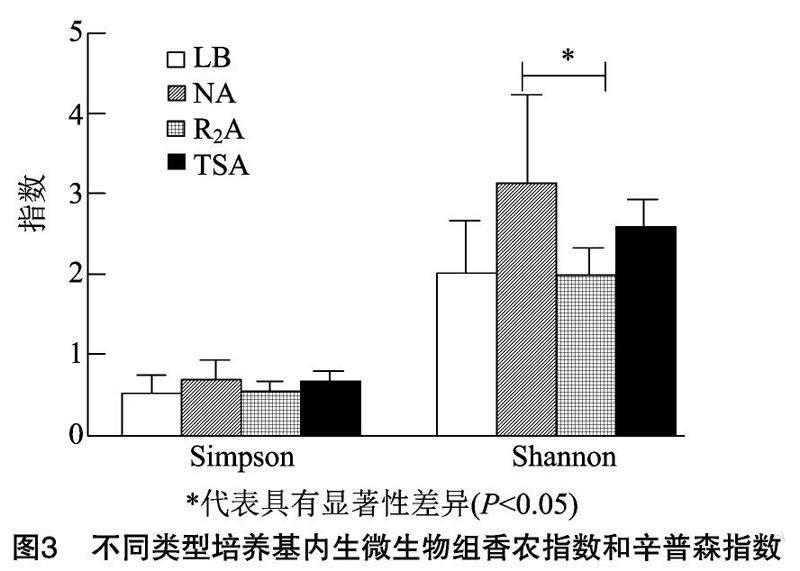
2.3不同类型培养基番茄内生菌群多样性分析
TSA、LB、NA、R2A 4种类型的培养基上内生菌群结构具有显著差异(P<0.05),不同营养类型的培养基成分对植物内生菌群结构具有显著影响。α多样性分析中,辛普森指数(Simpson)之间没有显著差异,但从香农指数(Shannon)来看,牛肉膏蛋白胨(NA)培养基中的番茄内生微生物组高于其他处理(P<0.05)(图3)。
主成分分析可以将不同样本的多元变量变换为互不相关的主元变量(PC1和PC2),在降维后主元向量空间中可以利用点的位置直观反映出不同培养基微生物群落代谢特征。发现4种培养基培养条件下番茄内生细菌群落结构具有显著差异(P<0.05)(图4)。
2.4不同类型培养基番茄内生菌群网络共线性分析及物种差异分析
网络共线性分析发现,NA、R2A培养基中番茄
内生细菌微生物组模块化水平更高,而且网络拓扑性更高,LB、TSA培养基中番茄内生细菌微生物组模块化水平较低(图5)。LEfSe分析发现LB培养基富集的物种为芽孢杆菌,NA培养基富集物种多为假单胞菌(Pseudomonas),R2A培养基富集物种多为鞘脂单胞菌,TSA培养基富集物种多为布克氏菌属(图6)。
3讨论
本研究通过高通量测序技术对各类型培养基上得到的番茄内生微生物组组成进行分析发现,LB、TSA培养基中芽孢杆菌属是优势物种,但是在R2A、NA培养基中,内生菌群组成较为均匀,不存在绝对的优势物种。
微平板培养96 h后,菌群生长达到稳定期,NA培养基下菌群代谢活性较高。R2A培养基下菌群代谢活性较低,可能是NA培养基中氨基酸含量较高引起[11]。可见氮源对于增强微生物代谢活性具有重要意义。4种培养基分离到的内生菌多为柠檬酸杆菌属、芽孢杆菌属、鞘脂单胞菌、布克氏菌属,且不同营养类型的培养基下内生菌群中优势物种有所差异:LB、TSA培养基分离到的内生菌多为芽孢杆菌,为优势物种;NA、R2A培养基分离到的内生菌中柠檬酸杆菌、芽孢杆菌、鞘脂单胞菌、布克氏菌为优势菌属。何红通过高通量测序发现番茄内生菌中放线菌、假单胞菌含量较高[12],与本研究结果有所差异。可见通过培养组学获得的物种信息与生物信息学分析相比,还存在一定差距,今后还需要改善营养条件以期获得更为全面的物种分类信息。PCoA分析显示β多樣性有显著差异(P<0.05),即在不同营养水平下番茄内生菌群落结构不同,文才艺等也发现了类似的结果[13]:不同生境下的番茄微生物组不同,可能是由于理化环境中营养条件的异质性引起的。
本研究中培养基内的营养条件与自然环境植物相比,成分有所不同[14],番茄根系分泌物中多含有醛类、酸类等物质,根系分泌物等复杂化学物质对番茄内生菌群结构的影响有待于进一步研究。
不同种类微生物所需要的营养条件不同,根据试验目的可通过调控营养水平达到靶向分离内生细菌的方法。本研究分析了外源营养物质对于番茄内生菌群的影响,进一步探求内生菌群中的重要成员结构变化,分析各类型营养条件下优势菌群特征,为更好地研究内生菌与植物互作奠定基础,同时为改善植物生长环境达到服务于农业生产的目的创造理论基础。
4结论
(1)4种培养基上生长的内生菌群在Biolog 微平板培养96 h 后,菌群生长达到稳定期,NA培养基
下菌群代谢活性较高,R2A培养基下菌群代谢活性较低。(2)4种培养基下番茄微生物组成分多为柠檬酸杆菌属、芽孢杆菌属、鞘脂单胞菌、布克氏菌属,且群落结构具有显著差异。(3)LB、TSA培养基分离到的内生菌多为芽孢杆菌属,为优势物种;NA、R2A培养基分离到的内生菌中柠檬酸杆菌、芽孢杆菌、鞘脂单胞菌、布克氏菌为优势菌种。(4)网络共线性分析发现,R2A、NA培养基中的网络模块化程度更高,具有更强的网络拓扑性。
参考文献:
[1]陆蓝翔,江明明,王焱,等. 两株樟树促生抗病内生细菌的分离、筛选及鉴定[J]. 南京林业大学学报(自然科学版),2018,42(6):128-136.
[2]Nafis A,Kasrati A,Azmani A,et al. Endophytic Actinobacteria of medicinal plant Aloe vera:isolation,antimicrobial,antioxidant,cytotoxicity assays and taxonomic study[J]. Asian Pacific Journal of Tropical Biomedicine,2018,8(10):513-518.
[3]马荣琴,曹毅,周俊雄,等. 番茄根内生假单胞菌的分离与鉴定[J]. 生物技术,2015,25(6):564-568,580.
[4]黎起秦,谢义灵,林纬,等. 广西番茄内生细菌的多样性和数量动态[J]. 生物多样性,2006,14(6):534-540.
[5]王美琴,刘慧平,韩巨才,等. 番茄内生细菌种群动态分析及拮抗菌株的筛选[J]. 中国农学通报,2010,26(9):277-282.
[6]李艳琴,申泉,刘彬彬,等. 番茄内生菌分离及其ERIC-PCR指纹图谱分析[J]. 微生物学通报,2003,30(5):89-93.
[7]黎起秦,罗宽,林纬,等. 番茄青枯病内生拮抗细菌的筛选[J]. 植物病理学报,2003,33(4):364-367.
[8]曹理想,田新莉,周世宁. 香蕉内生真菌、放线菌类群分析[J]. 中山大学学报(自然科学版),2003,42(2):70-73.
[9]冯永君,宋未. 植物内生细菌[J]. 自然杂志,2001,23(5):249-252.
[10]Dong C J,Wang L L,Li Q,et al. Bacterial communities in the rhizosphere,phyllosphere and endosphere of tomato plants[J]. PLoS One,2019,14(11):e0223847.
[11]Constantin M E,de Lamo F J,Vlieger B V,et al. Endophyte-mediated resistance in tomato to Fusarium oxysporum is independent of ET,JA,and SA[J]. Frontiers in Plant Science,2019,10:979.
[12]何紅,邱思鑫,胡方平,等. 植物内生细菌生物学作用研究进展[J]. 微生物学杂志,2004,24(3):40-45.
[13]文才艺,吴元华,田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志,2004,23(2):86-91.
[14]胡雅丽,戴睿,刘永鑫,等. 水稻典型品种日本晴和IR24根系微生物组的解析[J]. 遗传,2020,42(5):506-518.
