通过TLR4/NF-κB通路探讨白藜芦醇对急性脑出血大鼠脑损伤的作用机制
2023-07-07董秀娟
杨 龙,董秀娟
脑出血是指自发性急性脑实质出血,具有较高的致死率和致残率,发病后30 d内死亡率超过30%,1年内死亡率超过60%,且超过50%的幸存病人留有运动障碍、语言障碍、认知障碍等残疾[1]。脑出血的病理机制复杂,其中脑血肿占位、脑水肿、炎症反应、氧化应激及神经细胞凋亡参与疾病进展[2-3]。特异性存在于脑组织中的小胶质细胞是先天性免疫细胞,脑出血后小胶质细胞被迅速激活,并分泌细胞因子、趋化因子等,从而参与炎症反应、氧化应激调节,其中Toll样受体4(Toll-like receptor 4,TLR4)/核转录因子-κB(nuclear factor-κB,NF-κB)通路发挥着重要的调控作用[4-6]。白藜芦醇(resveratrol,RES)是存在于花生、葡萄等多种植物中的天然多酚类化合物,具有抗炎、抗氧化、抗凋亡、调节免疫力等多种药理学作用[7-9]; RES通过抑制TLR4/NF-κB信号通路对脂多糖所致急性肺损伤、缺氧/复氧所致肝损伤等发挥保护作用[10-11]。本研究通过制备急性脑出血大鼠模型并给予RES治疗,观察RES对急性脑出血大鼠脑组织损伤的保护作用及其机制,以期为防治脑出血提供依据。
1 材料与方法
1.1 实验动物 健康清洁级雄性Wistar大鼠240只,8周龄,体质量(230±20)g,购自河北省实验动物中心[生产许可证号:SCXK(冀)2018-004],动物合格号:202006008;分笼饲养于沧州医学高等专科学校[使用许可证号:SCXK(冀)2019-006],饲养温度25 ℃,相对湿度55%~65%、光照周期12 h/12 h,自由饮水进食,适应性喂养1周后开展实验。本研究经沧州市中心医院动物伦理委员会批准。
1.2 实验药物与试剂 RES购自成都普斯生物科技股份有限公司(纯度≥99%,批号:20191207);尼莫地平(nimodipine,NMP)注射液购自辰欣药业股份有限公司(批号:202003016);末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)试剂盒购自南京建成生物工程研究所(批号:20200313);白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附法(enzyme-linked immunoassay,ELISA)试剂盒和丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)试剂盒购自北京索莱宝生物科技有限公司(批号:SEKR-0002、SEKR-0005、SEKR-0009、BC0020、BC0170、BC0200);2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)购自北京博奥森生物技术有限公司(批号:D10616);兔源离子钙结合适配分子1(ionic calcium binding aptamer 1,Iba1)、TLR4、NF-κB、β-肌动蛋白(β-actin)和山羊源IgG二抗购自北京博奥森生物技术有限公司(批号:bs-1363R、bs-20595R、bs-20355R、bs-0061R、bs-0295G);SP法免疫组化试剂盒购自北京中杉金桥生物技术有限公司(批号:ZLI-2719);二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自北京索莱宝生物科技有限公司(批号:DA1015)。
1.3 实验仪器 DW-2000型脑立体定位仪(成都泰盟软件有限公司);微量注射器(上海高欣玻璃仪器);Multiskan FC型酶标仪(美国Thermo Fisher Scientific公司);Allegra 21R型低温离心机(美国Beckman公司);UV-1200紫外-可见分光光度计(上海美谱达仪器有限公司);EG1150H型包埋机、RM2245型石蜡切片机、CM1950型冰冻切片机(德国Leica公司);DYCZ-40型电泳仪(北京六一仪器厂);PAC300型转膜仪(美国Bio-Rad公司);BX43型光学显微镜(日本Olympus公司);GFL-230型烤箱(天津市莱波瑞仪器设备有限公司)。
1.4 实验方法
1.4.1 动物分组、模型制备与给药 将240只实验用Wistar大鼠随机分为假手术组、模型组、RES低剂量组、RES中剂量组、RES高剂量组和NMP组,每组40只。除假手术组外,其余组均参照孟令丽等[12]报道的自体血注射法复制脑出血大鼠模型:造模前禁食禁水12 h,腹腔注射10%水合氯醛溶液(3 mL/kg)麻醉后,由右侧股动脉穿刺取血100 μL备用,取俯卧位固定于脑立体定位仪,沿正中切开头皮与骨膜、暴露前囟,之后在中线右侧旁3 mm及前囟前0.2 mm交汇处钻孔,缓慢进针6 mm后,以10 μL/min速度缓慢注射50 μL自体血,留针10 min后缓慢退针,无菌骨蜡封闭颅骨钻孔,逐层缝合皮肤,碘伏消毒。造模完成后,RES低剂量组、RES中剂量组、RES高剂量组分别每日1次腹腔注射浓度6 mg/mL、12 mg/mL、18 mg/mL的RES溶液[13],NMP组每日1次腹腔注射浓度2 mg/mL的NMP溶液[14],假手术组和模型组给予0.9%氯化钠溶液,注射体积均为5 mL/kg,疗程均为7 d。
1.4.2 神经功能缺失评分 各组随机取10只大鼠,参照Longa评分标准进行神经功能缺失评分[15]:无神经功能缺失,计0分;瘫痪侧前肢弯曲、不能正常伸展,计1分;不能直线行走、向瘫痪侧转圈,计2分;不能正常站立、向瘫痪侧倾倒,计3分;意识降低、不能主动爬行,计4分。评分越高说明神经功能缺失越严重。
1.4.3 失重法测定脑组织含水量 腹腔注射10%水合氯醛溶液(3 mL/kg)麻醉后,颈椎脱臼处死后断头取脑,去除嗅球、小脑和脑干后称重记为W1,置于100 ℃烘箱中24 h,烘干至恒重后称重记为W2,脑组织含水量(%)=[(W1-W2)/W1]×100%。
1.4.4 脑血肿体积 各组随机取10只大鼠,腹腔注射10%水合氯醛溶液(3 mL/kg)麻醉后,颈椎脱臼处死后断头取脑,4%多聚甲醛溶液固定72 h后,以自体血注射孔为中心行0.5 mm厚度冰冻切片,血肿呈暗红色,测量血肿最大层面互为垂直的血肿最大横径(mm)和最大纵径(mm),采用多田公式计算脑血肿体积[14],脑血肿体积(mm3)=(π/6)×最大横径(mm)×最大纵径(mm)×血肿层数×切片厚度(mm)。
1.4.5 HE染色法观察脑组织病理学改变 各组随机取10只大鼠,腹腔注射10%水合氯醛溶液(3 mL/kg)麻醉后,颈椎脱臼处死后断头取脑,去除嗅球、小脑和脑干,4%多聚甲醛溶液固定72 h后,经石蜡包埋、4 μm厚度连续切片、展片、二甲苯透明、梯度乙醇溶液脱蜡处理后行常规HE染色,封片后采用显微镜观察脑组织病理学改变。
1.4.6 TUNEL观察神经细胞凋亡状况 取制备好的脑组织石蜡切片,经二甲苯透明、梯度乙醇溶液脱蜡处理后,按照TUNEL试剂盒操作说明进行处理,封片后通过显微镜观察神经细胞凋亡状况。凋亡指数(apoptosis index,AI)的计算:每张切片选取互不重叠的5个视野,计数视野内凋亡细胞数和细胞总数,AI(%)=(凋亡细胞数/细胞总数)×100%。
1.4.7 ELISA检测脑组织IL-1β、IL-6、TNF-α含量 取各组剩余的10只大鼠,腹腔注射10%水合氯醛溶液(3 mL/kg)麻醉后,颈椎脱臼处死后断头取脑,取血肿周围大脑组织,在冰上剪碎后加入4 ℃ 预冷裂解液,冰上静置裂解30 min后,4 ℃离心(转速3 500 r/min,10 min)后取上清液,按照ELISA试剂盒操作说明进行处理,采用酶标仪检测脑组织IL-1β、IL-6、TNF-α含量。
1.4.8 分光光度法检测脑组织MDA含量和SOD、CAT活性 取血肿周围大脑组织经裂解且离心后的上清液,按照试剂盒操作说明进行处理,采用紫外-可见分光光度计检测脑组织MDA含量和SOD、CAT活性。
1.4.9 免疫组织化学(immunohistochemistry,IHC)法检测脑组织Iba1蛋白表达 取制备的脑组织石蜡切片,经二甲苯透明、梯度乙醇溶液脱蜡处理后,采用枸橼酸缓冲液进行抗原修复30 min,冷却至室温后,采用3%的过氧化氢溶液避光孵育10 min,5%的山羊血清避光孵育30 min进行再封闭,滴加Iba1抗体(1∶1 000)4 ℃避光孵育过夜,滴加二抗(1∶200)37 ℃孵育60 min后滴加DAB染色,苏木素复染1 min后0.4%盐酸乙醇溶液进行分化,自来水冲洗返蓝,之后脱水、二甲苯透明和封片后,采用显微镜观察脑组织Iba1蛋白表达并拍照,使用Image Pro Plus软件计算图片平均积分吸光度值(IOD)。
1.4.10 蛋白免疫印迹法(Western Blot)检测脑组织TLR4、NF-κB p65表达 取制备的脑组织裂解溶液,4 ℃离心(转速12 000 r/min,25 min)后取上清液,BCA法进行蛋白定量后沸水浴10 min,之后依次采用十二烷基酸钠聚丙烯酰胺(SDS-PAGE)分离蛋白、湿法转聚偏二氟乙烯(PVDF)膜、5%脱脂奶粉溶液室温封闭1.5 h,滴加TLR4(1∶800)、NF-κB p65(1∶1000)、β-actin(1∶3 000)一抗4 ℃孵育过夜,滴加IgG二抗(1∶5 000)室温孵育2 h,滴加DAB显色,以目标蛋白条带与内参β-actin条带灰度值的比值表示目标蛋白相对表达量。
2 结 果
2.1 各组大鼠神经功能缺失评分、脑含水量、血肿体积比较 与假手术组比较,模型组大鼠神经功能缺失评分、脑含水量、血肿体积增加(P<0.01);与模型组比较,RES中剂量组、RES高剂量组和NMP组神经功能缺失评分、脑含水量、血肿体积均降低(P<0.05或P<0.01);与NMP组比较,RES高剂量组神经功能缺失评分、血肿体积降低(P<0.05);两组脑含水量比较差异无统计学意义(P>0.05)。详见表1。
表1 各组大鼠神经功能缺失评分、脑含水量、血肿体积比较(±s)
2.2 各组大鼠脑组织病理学改变 假手术组大鼠脑组织未见血肿,脑组织结构和神经细胞形态均未见异常;模型组脑组织呈片状红细胞,脑组织水肿,神经细胞形态不规则,神经细胞数量减少、间隙增大、细胞固缩、细胞核深染,炎性细胞浸润等病理学改变;与模型组比较,RES各剂量组和NMP组大鼠脑组织病理学呈不同程度改善,RES组上述效应呈一定的剂量依赖性。详见图1。

图1 各组大鼠脑组织病理学改变(HE,×200)
2.3 各组大鼠神经细胞凋亡状况比较 假手术组大鼠脑组织可见极少量凋亡细胞;与假手术组比较,模型组脑组织凋亡细胞数量增多;与模型组比较,RES各剂量组和NMP组凋亡细胞数量不同程度减少,RES组上述效应呈一定的剂量依赖性。与假手术组比较,模型组AI升高(P<0.01);与模型组比较,RES中剂量组、RES高剂量组和NMP组AI降低(P<0.01);与NMP组比较,RES高剂量组AI降低(P<0.01)。详见图2、表2。

图2 各组大鼠神经细胞凋亡状况(TUNEL,×200)
表2 各组大鼠神经细胞AI比较(±s) 单位:%
2.4 各组大鼠脑组织TNF-α、IL-1β、IL-6含量比较 与假手术组比较,模型组大鼠脑组织TNF-α、IL-1β、IL-6含量升高(P<0.01);与模型组比较,RES中剂量组、RES高剂量组和NMP组TNF-α、IL-1β、IL-6含量降低(P<0.05或P<0.01);与NMP组比较,RES高剂量组TNF-α、IL-6含量降低(P<0.05)。详见表3。
表3 各组大鼠脑组织TNF-α、IL-1β、IL-6含量比较(±s) 单位:pg/mL
2.5 各组大鼠脑组织MDA含量和SOD、CAT活性比较 与假手术组比较,模型组大鼠脑组织MDA含量升高,SOD、CAT活性降低(P<0.01);与模型组比较,RES中剂量组、RES高剂量组和NMP组MDA含量降低,SOD、CAT活性升高(P<0.05或P<0.01);与NMP组比较,RES高剂量组MDA含量降低,SOD、CAT活性升高(P<0.05)。详见表4。
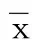
表4 各组大鼠脑组织MDA含量和SOD、CAT活性比较(±s)
2.6 各组大鼠脑组织Iba1表达比较 与假手术组比较,模型组大鼠脑组织Iba1表达升高(P<0.01),部分小胶质细胞形态呈阿米巴虫样;与模型组比较,RES中剂量组、RES高剂量组和NMP组Iba1表达降低(P<0.01),阿米巴虫样小胶质细胞数量减少;与NMP组比较,RES高剂量组Iba1表达降低(P<0.01),阿米巴虫样小胶质细胞数量减少。详见表5、图3。

图3 各组大鼠脑组织Iba1表达(IHC,×200)
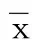
表5 各组大鼠脑组织Iba1表达比较(±s)
2.7 各组大鼠脑组织TLR4、NF-κB p65蛋白表达比较 与假手术组比较,模型组大鼠脑组织TLR4、NF-κB p65蛋白表达升高(P<0.01);与模型组比较,RES中剂量组、RES高剂量组和NMP组TLR4、NF-κB p65蛋白表达降低(P<0.01);与NMP组比较,RES高剂量组TLR4、NF-κB p65蛋白表达降低(P<0.01)。详见图4、表6。
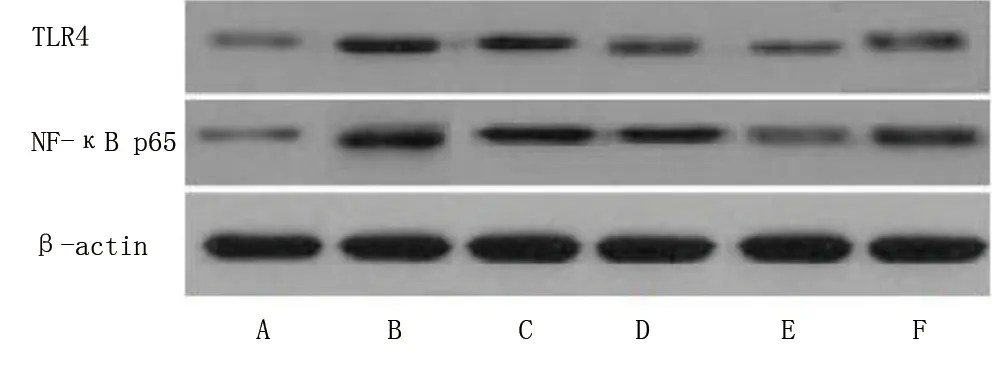
图4 各组大鼠脑组织TLR4、NF-κB p65蛋白表达条带图(A为假手术组;B为模型组;C为RES低剂量组;D为RES中剂量组;E为RES高剂量组;F为NMP组)
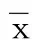
表6 各组大鼠脑组织TLR4、NF-κB p65蛋白表达比较(±s)
3 讨 论
急性脑出血发病率约占脑卒中的15%,是死亡率较高的脑卒中类型,且存活病人多留有严重的神经功能障碍,是临床亟待解决的难题[16]。脑出血病理机制复杂,其中炎症反应、氧化应激及继发性神经细胞凋亡在疾病进展过程中发挥着重要作用[17-18]。目前,西医治疗急性脑出血主要采取外科手术结合血压管理的方案,虽然可挽救部分病人生命,但死亡率和残疾率仍居高不下。
近年来,中医药治疗急性脑出血逐渐得到人们的关注与认可。中医学将脑出血归属于“中风”范畴,其病机在于“气虚血瘀、痰瘀阻络”[19]。RES是一种具有多种生物学活性的非黄酮类多酚化合物,天然存在于葡萄、花生、桑椹、虎杖等植物中,因1939年首次从白藜芦的根茎中提取出而得名。NMP是一种钙离子阻滞剂类降压药,是临床防治脑出血等急性脑血管病的常用药物。本研究通过自体血注射法制备急性脑出血大鼠模型,其病理生理特征与临床相似,是脑出血动物实验常用的造模方法[20]。本研究结果显示,经RES或NMP治疗可改善急性脑出血大鼠神经功能,降低脑组织含水量和血肿体积,改善神经细胞病变,减轻炎性细胞浸润,抑制神经细胞凋亡,且RES的作用具有一定的剂量依赖性,RES高剂量组优于NMP组,提示RES具有抑制急性脑出血大鼠脑组织损伤,改善神经细胞凋亡的作用。
小胶质细胞是中枢神经系统重要的免疫细胞,脑出血所致血肿占位和颅内高压等将病理性刺激小胶质细胞活化,分泌细胞因子、炎性趋化因子,引发氧化应激和炎性级联反应[21-22]。Iba1是小胶质细胞特异性蛋白,非活化状态小胶质细胞Iba1主要表达于细胞质中,呈细长分枝状;脑出血时,小胶质细胞活化,Iba1蛋白表达量升高,细胞形态呈肥大的阿米巴虫样[23]。本研究采用IHC法观察RES对急性脑出血大鼠脑组织Iba1表达量和形态的影响,结果显示,经RES或NMP治疗可降低Iba1表达量,减少阿米巴虫样小胶质细胞数量,RES高剂量组作用优于NMP组,提示RES具有抑制急性脑出血大鼠小胶质细胞活化的作用。
活化的小胶质细胞将大量分泌TNF-α、IL-1β、IL-6等炎性因子加重炎症反应,且IL-1β、TNF-α作为炎性趋化因子引发炎症级联反应[24]。SOD和CAT是机体重要的抗氧化酶,可清除体内过量的活性氧,减少脂质过氧化产生的毒性MDA,减轻氧化应激损伤。本研究结果显示,经RES或NMP治疗可降低急性脑出血大鼠脑组织TNF-α、IL-1β、IL-6、MDA含量,提高SOD、CAT活性,RES高剂量组的作用优于NMP组,提示RES可抑制急性脑出血后炎症反应,减轻氧化应激损伤。
存在于小胶质细胞中的TLR4是一类跨膜识别受体,在脑组织炎症反应调节过程中发挥着重要的信号传导作用[25]。NF-κB为TLR4下游靶基因,可被TLR4诱导表达,活化NF-κB核转位后NF-κB p65亚基与染色体特定位点结合,进而诱导炎性细胞因子释放,加重炎症反应[26]。本研究结果显示,经RES或NMP治疗可降低急性脑出血大鼠脑组织TLR4、NF-κB p65表达量,RES高剂量组作用优于NMP组,提示RES可抑制急性脑出血大鼠TLR4/NF-κB信号通路,可能是RES抑制炎症反应的重要分子机制。
综上所述,RES可抑制脑出血大鼠脑组织炎症反应、氧化应激和神经细胞凋亡,减轻脑组织损伤,其机制可能与抑制小胶质细胞活化和TLR4/NF-κB通路有关。本研究为RES防治脑出血提供了依据。
