哈巴俄苷通过抑制TLR4/MyD88/NF-κB通路减轻神经炎症诱导的神经元损伤
2023-07-06郝任娟胡颖超于顾然秦秀德陆韵薇
郝任娟,胡颖超,于顾然,秦秀德,陆韵薇
哈巴俄苷通过抑制TLR4/MyD88/NF-κB通路减轻神经炎症诱导的神经元损伤
郝任娟1,胡颖超2,于顾然2,秦秀德3,陆韵薇3*
1. 广东省中医院,广东 广州 510030 2. 南京中医药大学附属医院,江苏 南京 210029 3. 深圳市中医院,广东 深圳 518000
研究哈巴俄苷对神经炎症诱导神经元损伤的作用。采用MTT检测血管紧张素II(angiotensin II,Ang II)和哈巴俄苷对小鼠小胶质BV2细胞活性的影响;观察BV2细胞的形态变化;检测细胞上清液中炎症因子水平;采用免疫荧光检测核因子-κB p65(nuclear factor-κB p65,NF-κB p65)核易位以及CD86、髓系细胞触发受体2(triggering receptor expressed on myeloid cells 2,TREM2)的表达;采用Western blotting检测Toll样受体4(Toll like receptor 4,TLR4)、髓样分化因子88(molecule myeloid differentiation factor 88,MyD88)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)蛋白表达。分别使用脂多糖(lipopolysaccharide,LPS)和TLR4抑制剂(TAK-242)进一步验证哈巴俄苷的作用机制。建立BV2-HT22细胞共培养模型,检测线粒体膜电位、细胞凋亡情况以及凋亡相关蛋白表达,研究哈巴俄苷对神经炎症引起的神经元损伤的影响。Ang II显著上调BV2细胞TLR4、MyD88、IL-1β、TNF-α和iNOS蛋白表达(<0.01、0.001),促进NF-κB p65入核(<0.001),调节小胶质细胞表面炎症标志物CD86和TREM2的表达(<0.05)。哈巴俄苷和TAK-242可逆转Ang II或LPS诱导的BV2细胞的作用(<0.05、0.01、0.001)。此外,哈巴俄苷可显著下调BV2-HT22共培养模型HT22细胞中凋亡相关蛋白的表达(<0.01、0.001),抑制HT22细胞凋亡(<0.05、0.001)。哈巴俄苷可能通过抑制Ang II诱导的BV2细胞TLR4/MyD88/ NF-κB通路的激活来减轻炎症反应,进而缓解炎症引起的神经元细胞的凋亡。
哈巴俄苷;血管紧张素II;神经炎症;凋亡;共培养
高血压为脑小血管病最常见的发病原因,研究表明血压的过度波动会对大脑产生影响,与认知障碍、中风及痴呆的发生有关[1-2]。血管紧张素II(angiotensin II,Ang II)可引起高血压的发生,可与体内的肾素血管紧张素(renin angiotensin system,RAS)效应系统结合并引起慢性激活,导致机体多个系统的血管和组织炎症和稳态失衡[3-4]。Ang II可以诱导脑中小胶质细胞的激活,导致神经系统炎症以及认知损伤[4]。完整的血脑屏障可阻止Ang II入脑,而持续的高血压可以增加血脑屏障的通透性,引起Ang II持续入脑以及病理反应的发生[5]。
炎症反应是一把“双刃剑”,适量的炎症因子可以通过清除有害物质发挥保护作用,而其过度释放则会破坏细胞和组织的稳态。许多研究表明,小胶质细胞可维持神经系统稳态[6-8],参与大脑中的炎症反应[9]。脂多糖(lipopolysaccharide,LPS)可激活小胶质细胞并促进脑中炎性因子等有害物质的产生,导致神经元损伤[10]。Toll样受体(Toll like receptors,TLRs)作为模式识别受体可被小胶质细胞识别[11-12],其主要在神经系统中的星形胶质细胞和小胶质细胞中表达,与炎症反应调控有关[13-14]。TLR4在小胶质细胞中高表达,用于监测炎症反应[11]。研究证明TLR4通路已成为Ang II诱导小胶质细胞活化及细胞炎症因子产生的潜在作用机制[15]。核因子-κB(nuclear factor-κB,NF-κB)位于TLR4信号通路的下游,可介导多种炎症过程[16]。TLR4可以招募下游信号分子髓样分化因子88(molecule myeloid differentiation factor 88,MyD88),促进NF-κB入核,诱导白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、一氧化氮合酶等炎性介质的释放[12,17-18]。
哈巴俄苷为环烯醚萜类化合物,是玄参Hemsl.的主要活性成分,可用于治疗类风湿关节炎、骨质疏松、糖尿病、神经退行性疾病等多种疾病[19-20]。课题组前期已证明哈巴俄苷可通过抑制氧化损伤,上调bEnd.3细胞连接蛋白以减轻Ang II诱导的血脑屏障损伤[21],尚未发现哈巴俄苷对Ang II诱导的小胶质细胞活化及神经元损伤的研究。本研究以Ang II处理小鼠小胶质BV2细胞并构建BV2-小鼠海马神经元HT22细胞共培养细胞模型,探讨哈巴俄苷的抗炎作用及神经保护作用,并进一步研究其相关机制。
1 材料
1.1 细胞
BV2细胞购自CoBioer Biosciences生物;HT22细胞购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
哈巴俄苷(批号MUST-19082120,质量分数≥98%)购自成都曼斯特生物有限公司,溶于PBS配制浓度8 mmol/L于−80 ℃保存;Ang II(质量分数≥93%,批号HY-13948)、LPS(批号HY-D1056)、TLR4抑制剂TAK-242(批号HY-11109)购自MCE公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号67-68-5)、MTT(批号298-93-1)购自美国Sigma公司;IL-1β ELISA试剂盒(批号88-7013)、TNF-α ELISA试剂盒(批号88-7324)、FITC-CD86单克隆抗体(批号11-0862-82)购自美国Thermo Fisher Scientific公司;NO试剂盒(批号S0021S)、JC-1荧光探针(批号C2003S)购自上海碧云天生物;Annexin V-FITC/PI凋亡试剂盒(批号A211-01/02)、TUNEL染色(批号A113-01/02/03)购自南京诺唯赞生物公司;鬼笔环肽(批号CA1610)购自北京索莱宝生物公司;DMEM-F12培养基(批号31331093)、DMEM培养基(批号11965092)、胎牛血清(fetal bovine serum,FBS,批号10091)购自美国Gibco公司;TLR4抗体(批号66350-1-Ig)、MyD88抗体(批号66660-1-Ig)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(批号18985-1-AP)、TNF-α抗体(批号17590-1-AP)、Caspase-3抗体(批号19677-1-AP)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号12789-1-AP)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号50599-2-Ig)、NF-κB p65抗体(批号10745-1-AP)、髓样细胞触发受体2(triggering receptor expressed on myeloid cell 2,TREM2)抗体(批号13483-1-AP)、离子钙结合适配器分子-1(ionized calcium binding adapter molecule-1,Iba-1)抗体(批号10904-1-ap)、β-actin抗体(批号66009-1-Ig)、CoraLite488-conjugated羊抗兔/鼠IgG抗体(批号SA00013-2)购自Proteintech公司;IL-1β抗体(批号31202S)、Caspase-8抗体(批号4790)、Caspase-9抗体(批号9508)、细胞色素C(cytochrome C,Cyt C)抗体(批号11940)购自美国CST公司;HRP标记的山羊抗兔IgG抗体(批号ZB-2301)、HRP标记的山羊抗小鼠IgG抗体(批号ZB-2305)购自北京中杉金桥生物。
1.3 仪器
1300A2型生物安全柜、HERA cell 1501型CO2细胞培养箱、Heraeus Fresco21离心机(美国Thermo Fisher Scientific公司);CKX41型倒置相差显微镜(日本Olympus公司);ELX800型酶标仪(美国Bio-Tek公司);电泳仪及转膜仪(北京六一仪器厂);CHEMIDOC XRS+凝胶系统成像仪(美国Bio-Rad公司);FACSCelesta型分析型流式细胞仪(美国BD公司);DS-Qi2型正置荧光显微镜(日本Nikon公司)。
2 方法
2.1 细胞培养
BV2细胞用含10% FBS的DMEM-F12培养基,HT22细胞用含10% FBS的DMEM培养基,于37 ℃的培养箱中培养,每1~2天换液,当细胞生长至80%密度时,用于后续实验。
2.2 MTT法检测细胞活性
BV2细胞以5×103/孔接种于96孔板中,培养24 h,之后加入不同浓度的Ang II(0、0.001、0.01、0.1、1 μmol/L)或哈巴俄苷(0、0.1、1、10、50、75、100、150、200、300 μmol/L),以加入DMSO作为空白,继续培养24 h。加入10 μL MTT溶液,于37 ℃的细胞培养箱中培养4 h,加入DMSO充分震荡10 min,采用酶标仪测定490 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(实验-调零)/(空白-调零)
2.3 Ang II诱导BV2细胞炎症反应的剂量筛选
BV2细胞以5×105/孔接种于6孔板中,培养24 h后,加入不同浓度(0、0.001、0.01、0.1、1 μmol/L)的Ang II处理24 h。收集细胞,用预冷的PBS洗涤细胞3次,加入裂解液,冰上裂解细胞20~30 min,收集细胞液,超声3次,每次15 s,4 ℃、12 000 r/min离心20 min,取上清液为细胞总蛋白。用BCA试剂盒检测蛋白浓度,加入上样缓冲液,100 ℃加热10 min使蛋白变性。蛋白样品经10%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶室温封闭60 min,分别加入TLR4、MyD88、iNOS、TNF-α、IL-1β和β-actin抗体,4 ℃孵育过夜;TBST洗涤3次,加入二抗,室温孵育60 min;TBST洗涤3次,加入ECL化学发光试剂显影,采用Image Lab软件分析条带灰度。
2.4 鬼笔环肽染色检测哈巴俄苷对Ang II诱导的BV2细胞形态变化的影响
罗丹明标记的鬼笔环肽可以特异地与真核细胞中的肌动蛋白结合,从而表示细胞骨架分布。BV2细胞接种于含细胞爬片的12孔板中,培养24 h后加入0、50、75、100 μmol/L的哈巴俄苷预保护处理,2 h后加入0.1 μmol/LAng II处理24 h。弃去培养基,PBS洗涤细胞2次,4%多聚甲醛室温固定20 min,0.5% Triton X-100室温通透20 min,鬼笔环肽避光孵育30 min,DAPI染色3 min,细胞封片后,正置荧光显微镜下观察。
2.5 ELISA和Griess法检测哈巴俄苷对Ang II诱导的BV2细胞上清液中炎症因子水平的影响
BV2细胞以5×105/孔接种于6孔板中,培养24 h,加入0、50、75、100 μmol/L的哈巴俄苷或TAK-242(1 μmol/L)预保护处理2 h,之后加入0.1 μmol/LAng II处理24 h。离心收集上清,按照ELISA试剂盒说明书测定细胞上清液中IL-1β和TNF-α水平,通过Griess法检测上清液中NO含量。
2.6 Western blotting检测哈巴俄苷对BV2细胞TLR4/MyD88通路蛋白表达的影响
BV2细胞以5×105/孔接种于6孔板中,培养24 h后,加入0、50、75、100 μmol/L的哈巴俄苷或TAK-242(1 μmol/L)预保护处理2 h,之后加入0.1 μmol/LAng II或1 mg/mL LPS处理24 h。收集细胞,按“2.3”项下方法检测TLR4、MyD88、iNOS、TNF-α、IL-1β蛋白表达。
2.7 免疫荧光染色检测哈巴俄苷对BV2细胞NF-κB p65、TREM2和Iba-1蛋白表达的影响
BV2细胞以1×104/孔接种于12孔板中,培养24 h,加入0、100 μmol/L的哈巴俄苷或TAK-242(1 μmol/L)预保护处理2 h,之后加入0.1 μmol/LAng II或1 mg/mL LPS处理24 h。PBS洗涤后,4%多聚甲醛室温固定20 min,0.3% Triton X-100室温通透20 min,加入免疫荧光染色封闭液,于摇床上室温封闭60 min;滴加NF-κB p65(1∶500)、TREM2(1∶500)、Iba-1(1∶500)抗体,4 ℃孵育过夜;PBST洗涤3次,滴加荧光二抗,室温避光孵育60 min,PBST洗涤3次,DAPI染色10 min,PBST洗涤3次,每次10 min,扣片并用指甲油封片,于正置荧光显微镜下拍照。
2.8 BV2-HT22共培养模型构建
先单独培养BV2细胞,用不同浓度的哈巴俄苷处理BV2细胞2 h,之后加入Ang II进一步刺激。同时单独培养HT22细胞于Transwell小室下层,Ang II刺激BV2细胞24 h后收集BV2细胞置于Transwell小室上层,与HT22细胞共培养24 h,之后用于后续实验。
2.9 MTT法检测哈巴俄苷对共培养模型HT22细胞活性的影响
BV2-HT22细胞共培养体系加入50、75、100 μmol/L哈巴俄苷或TAK-242(1 μmol/L),加入10 μL MTT溶液,按“2.2”项下方法测定细胞活性。
2.10 JC-1染色检测BV2-HT22共培养模型线粒体膜电位变化
JC-1探针用于检测细胞线粒体膜电位的变化。JC-1聚集在正常细胞的线粒体中,激发出红色荧光,而当线粒体膜电位去极化时,JC-1以绿色单体的形式存在。一般情况下,绿色荧光的增加和红色荧光的减少表明细胞凋亡[22-23]。BV2-HT22细胞共培养体系加入50、75、100 μmol/L哈巴俄苷或TAK-242(1 μmol/L),加入JC-1工作液,于细胞培养箱中避光孵育30 min。PBS洗涤3次后,于正置荧光显微镜下观察JC-1单体及聚集物的相对变化。采用Image J软件进行分析。
2.11 TUNEL染色检测共培养模型细胞凋亡情况
BV2-HT22细胞共培养体系加入100 μmol/L哈巴俄苷或TAK-242(1 μmol/L),用4%多聚甲醛室温固定细胞,3% TritonX-100室温通透细胞,37 ℃与TUNEL染色液反应60 min,然后室温下与DAPI染色10 min,PBS洗涤3次后,于正置荧光显微镜下观察。细胞核中红色荧光的增加表明细胞凋亡。
2.12 Annexin V-FITC/PI染色检测共培养模型细胞凋亡情况
BV2-HT22细胞共培养体系加入100 μmol/L哈巴俄苷或TAK-242(1 μmol/L),用不含EDTA的胰酶消化并收集细胞,预冷的PBS洗细胞3次,然后用Binding buffer对细胞进行重悬,分别用Annexin V-FITC和PI染色液对细胞进行染色,室温避光孵育10 min,加入400 μL Binding buffer。用BD流式细胞分选仪进行检测,采用FlowJo软件分析数据。
2.13 Western blotting检测共培养模型细胞凋亡相关蛋白表达
BV2-HT22细胞共培养体系加入100 μmol/L哈巴俄苷或TAK-242(1 μmol/L),收集细胞,按“2.3”项下方法提取蛋白,并检测Caspase-3、Bax、Bcl-2、Caspase-8、Caspase-9、Cyt C蛋白表达。
2.14 统计学分析
3 结果
3.1 Ang II和哈巴俄苷对BV2细胞活性的影响
如图1所示,不同浓度(0.001、0.01、0.1、1 μmol/L)的Ang II对BV2细胞活性无显著影响。如图2所示,0~300 μmol/L的哈巴俄苷对BV2细胞活性也无显著影响,因此选择50、75、100 μmol/L的哈巴俄苷进行后续实验。
3.2 Ang II对BV2细胞TLR4/MyD88通路蛋白表达的影响
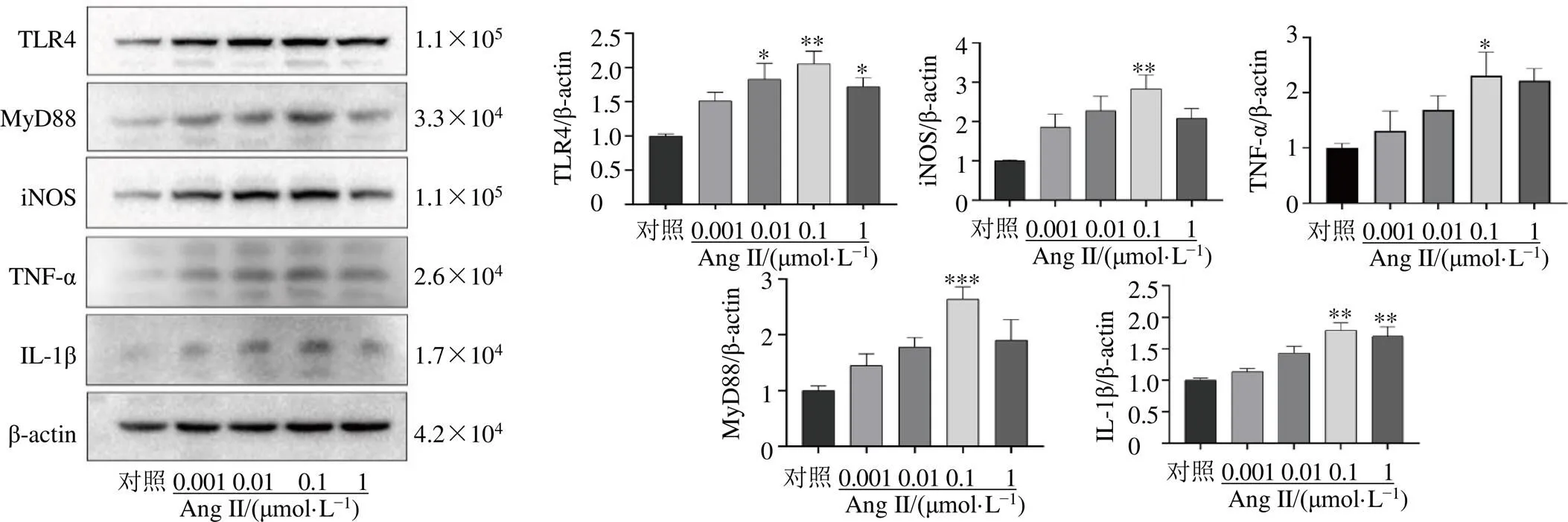
为了确定Ang II诱导炎症反应的最佳浓度,采用Western blotting检测不同浓度的Ang II对BV2细胞TLR4/MyD88通路蛋白表达的影响,如图3所示,Ang II能够剂量相关性地诱导BV2细胞产生炎症反应,随着浓度增加,TLR4、MyD88及炎症相关蛋白IL-1β、TNF-α、iNOS的表达逐渐升高,以0.1 μmol/L Ang II组的表达量最高(<0.05、0.01、0.001)。由于0.1 μmol/L Ang II对BV2细胞活力无损伤,且具有最明显的促炎作用,因此选择0.1 μmol/L Ang II作为后续模型诱导浓度。
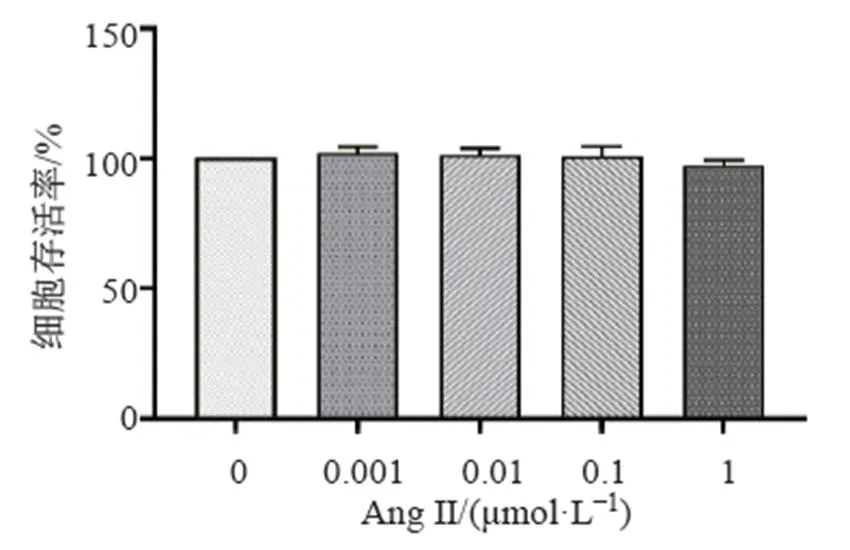
图1 Ang II对BV2细胞活性的影响(, n = 3)
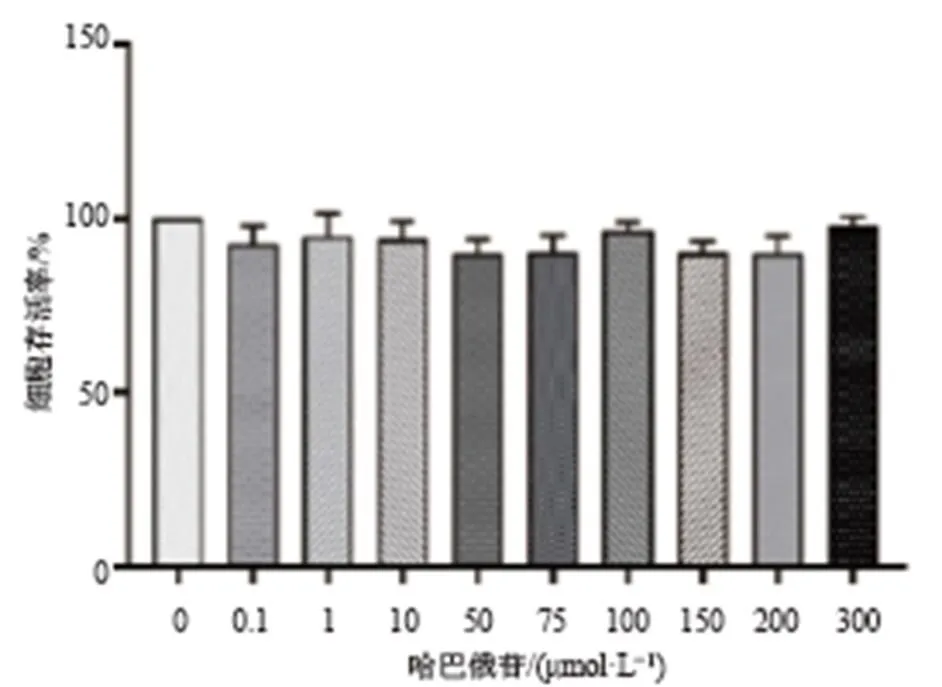
图2 哈巴俄苷对BV2细胞活性的影响(, n = 3)
3.3 哈巴俄苷对Ang II诱导的BV2细胞形态变化的影响
如图4所示,Ang II可以诱导BV2细胞形态改变,表现为阿米巴样形态;而哈巴俄苷可以抑制BV2细胞形态的变化,表明其可以抑制细胞的活化,并呈剂量相关性。
与对照组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
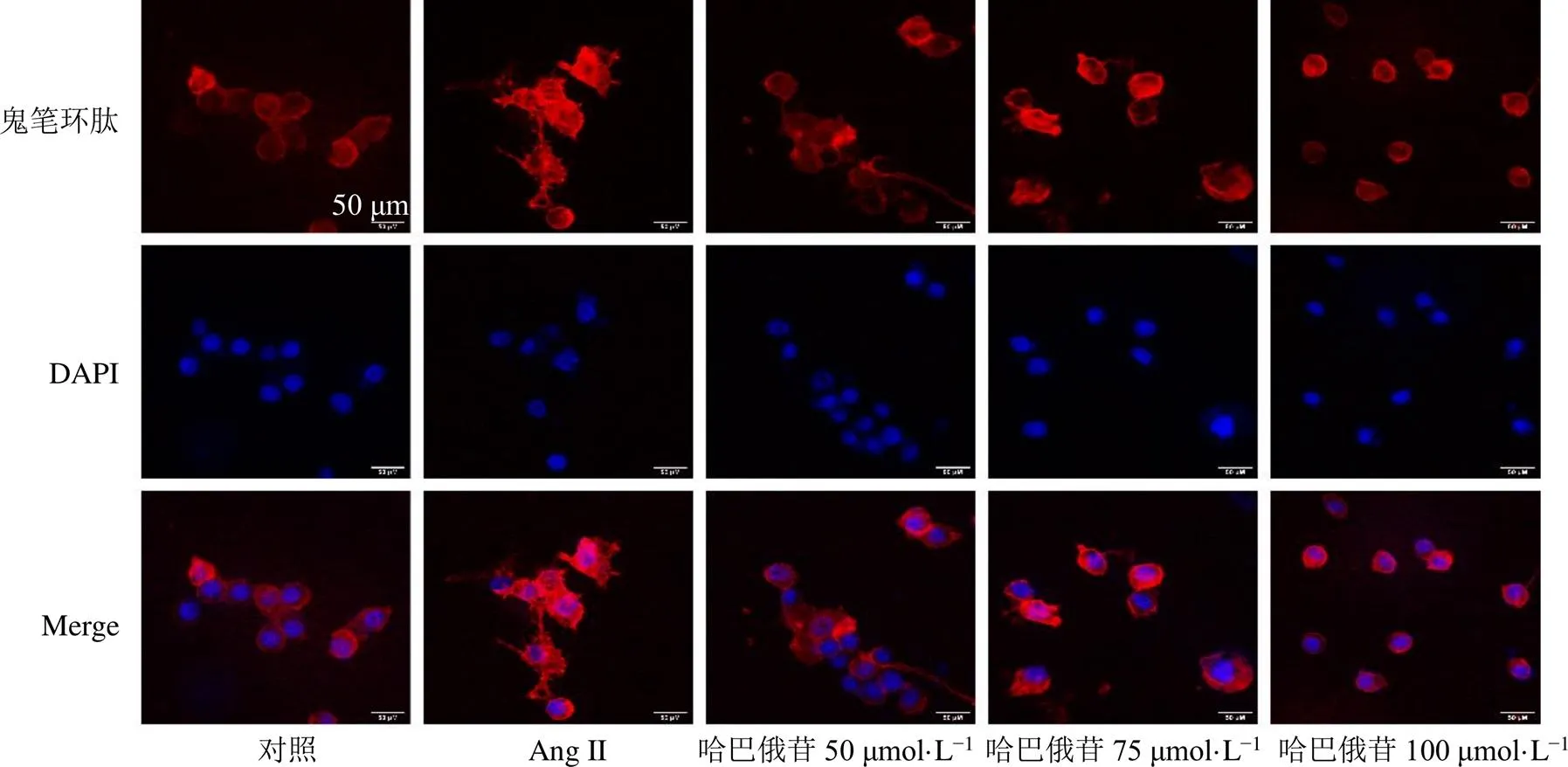
图4 哈巴俄苷对Ang II诱导的BV2细胞形态变化的影响 (×200)
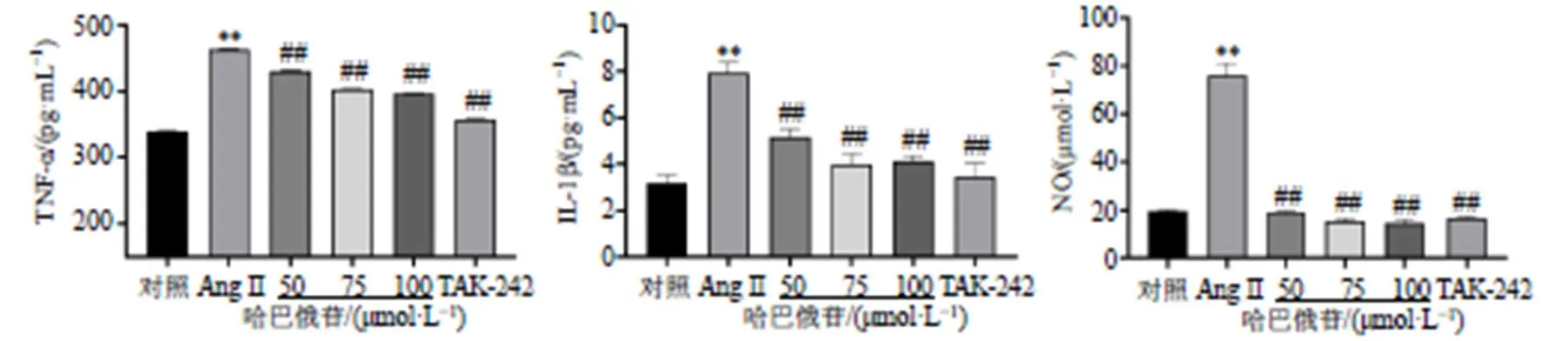
3.4 哈巴俄苷对Ang II诱导的BV2细胞上清液中炎症因子水平的影响
如图5所示,与对照组比较,Ang II显著诱导细胞上清液中TNF-α、IL-1β的分泌(<0.01),促进NO的生成(<0.01),而哈巴俄苷的干预可以减少上述炎症相关产物的合成(<0.01),TLR4通路抑制剂TAK-242也表现出与哈巴俄苷相似的保护作用。
3.5 哈巴俄苷对BV2细胞TLR4/MyD88通路蛋白表达的影响
如图6所示,75、100 μmol/L的哈巴俄苷显著抑制Ang II诱导的BV2细胞中TLR4、MyD88、iNOS、TNF-α和IL-1β表达(<0.05、0.01、0.001)。
为了进一步验证哈巴俄苷对TLR4/MyD88通路的作用,以小胶质细胞中TLR4激动剂LPS(1 mg/mL)[18]以及TLR4通路抑制剂TAK-242(1 μmol/L)[24]处理细胞,如图7、8所示,结果显示100 μmol/L的哈巴俄苷可以显著抑制LPS诱导的TLR4/MyD88通路的激活及炎症产物的释放(<0.05、0.01、0.001),与TAK-242表现出相似的作用。此外,对于Ang II诱导的BV2细胞,哈巴俄苷和TAK-242均表现出相似的保护作用。
与模型组(Ang II或LPS)比较:#P<0.05 ##P<0.01 ###P<0.001,下图同
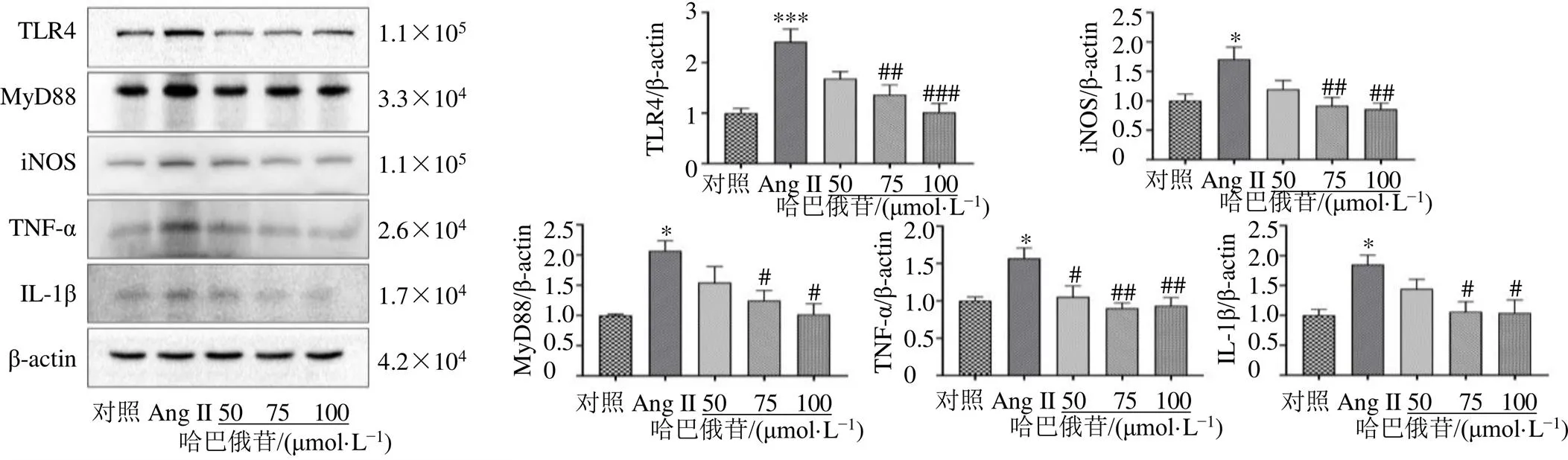
图6 哈巴俄苷对Ang II诱导的BV2细胞TLR4/MyD88通路蛋白表达的影响(, n = 3)
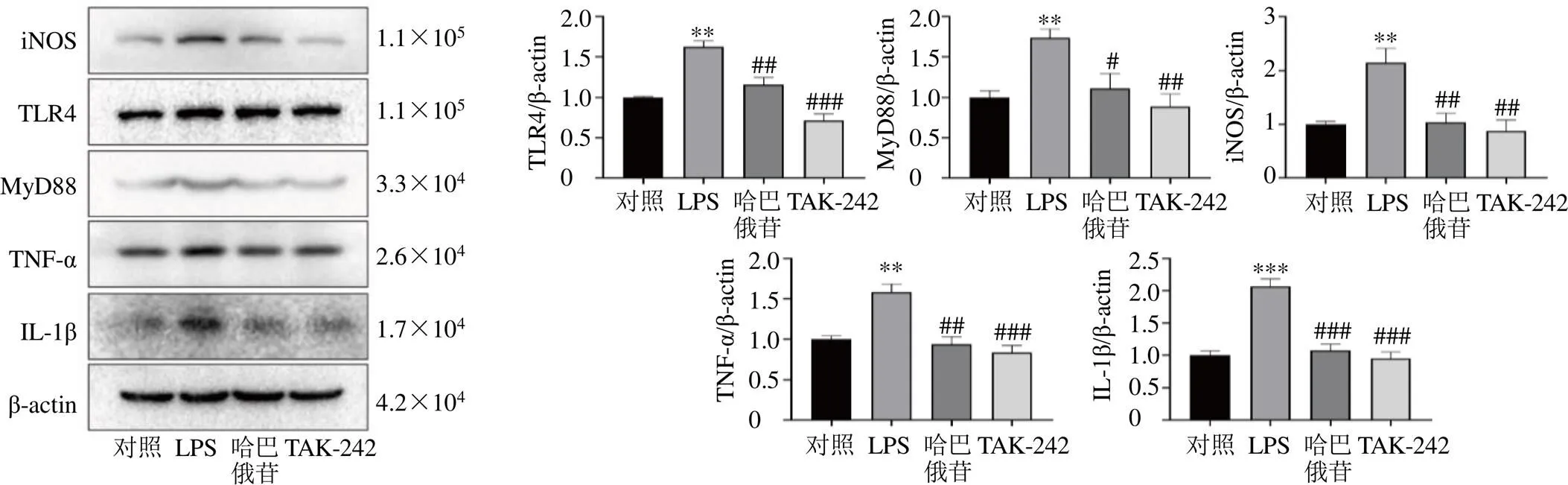
图7 哈巴俄苷对LPS诱导的BV2细胞TLR4/MyD88通路蛋白表达的影响(, n = 3)
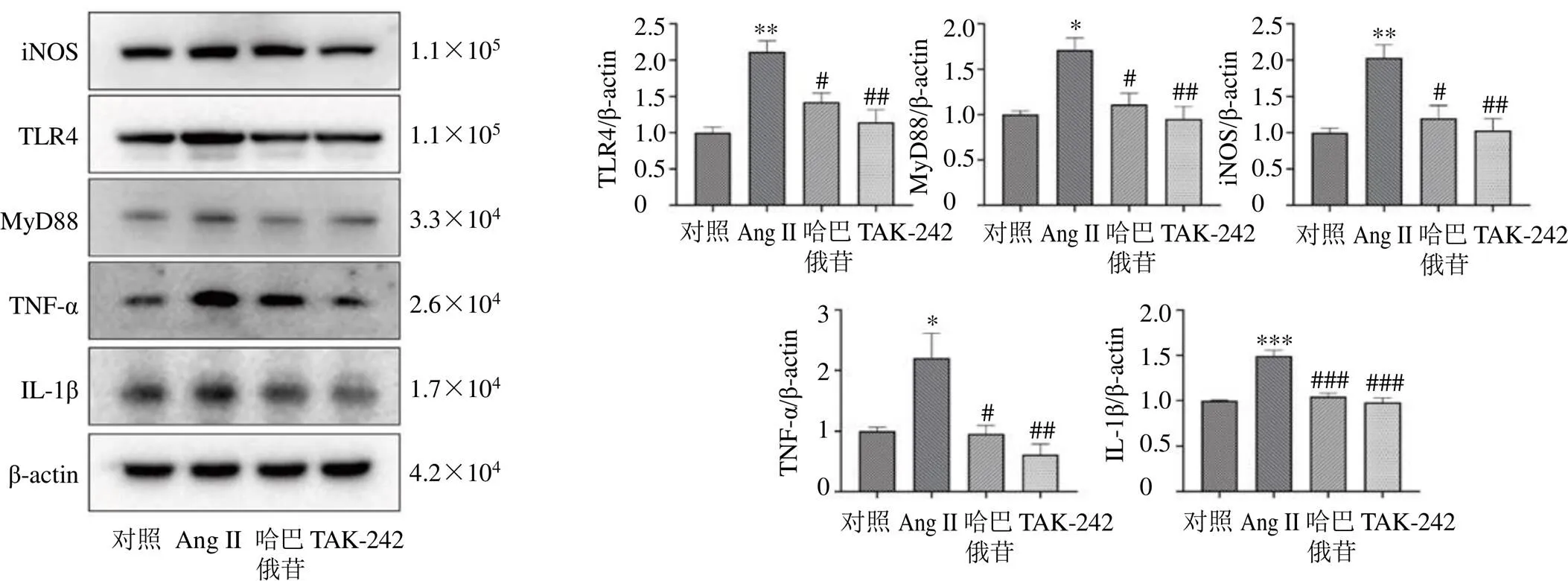
图8 哈巴俄苷和TAK-242对Ang II诱导的BV2细胞TLR4/MyD88通路蛋白表达的影响(, n = 3)
3.6 哈巴俄苷对NF-κB入核的影响
NF-κB是一种可被MyD88激活的核转录因子,其核异位的增加与炎症反应相关。通过NF-κB p65免疫荧光染色观察其核异位情况,进一步研究哈巴俄苷与NF-κB的关系。如图9所示,Ang II和LPS均可诱导NF-κB p65的入核(<0.01、0.001),而哈巴俄苷的干预可以减少NF-κB p65核异位(<0.05、0.01),发挥抗炎作用。表明哈巴俄苷可以通过减少NF-κB p65的入核进而抑制后续的炎症级联反应。因此,在Ang II诱导的BV2细胞中,哈巴俄苷可以通过抑制TLR4/MyD88/NF-κB通路发挥抗炎作用。
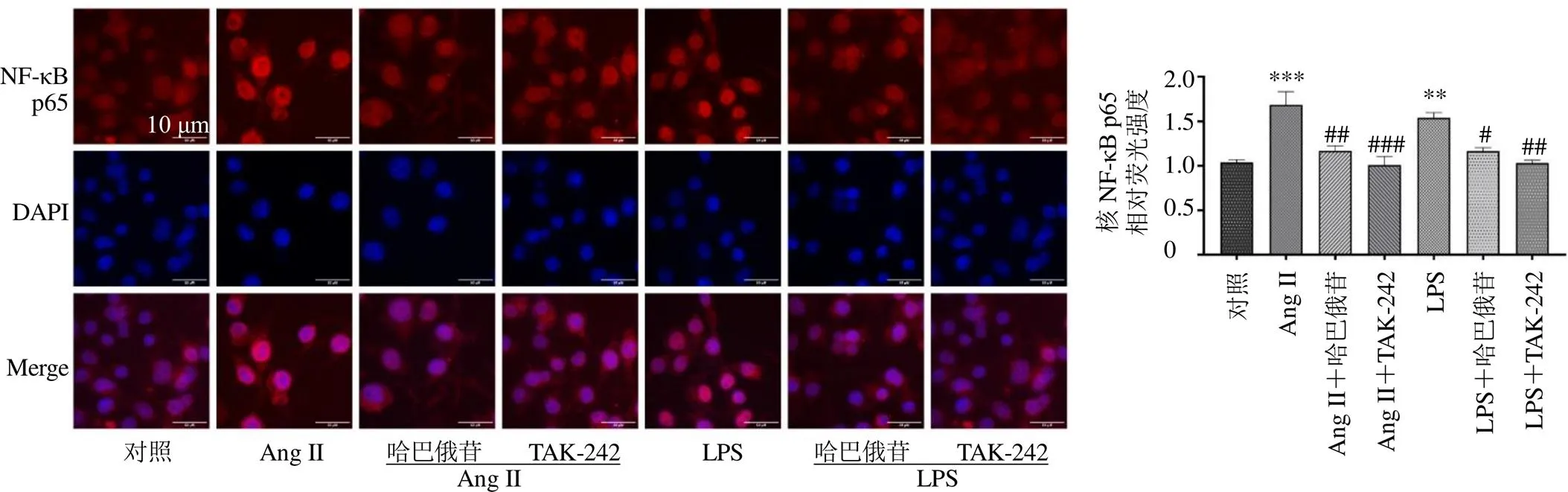
图9 哈巴俄苷对NF-κB p65入核的影响 (×400; , n = 3)
3.7 哈巴俄苷对BV2细胞CD86和TREM2表达的影响
通过免疫荧光染色进一步观察了哈巴俄苷对小胶质细胞炎症标志物CD86和TREM2表达的影响。如图10、11所示,Ang II可以诱导CD86的上调以及TREM2的下调(<0.05),而哈巴俄苷的作用相反,可以抑制CD86的表达并增加TREM2的表达(<0.01),表现出保护作用。此外,LPS处理细胞可导致CD86的高表达以及TREM2的低表达(<0.001),哈巴俄苷同样表现出保护作用,抑制剂TAK-242也具有相似的保护作用。
3.8 哈巴俄苷对BV2-HT22共培养模型中HT22活性的影响
前述实验证明哈巴俄苷可以抑制Ang II诱导的细胞炎症反应,接下来构建BV2-HT22共培养细胞模型观察BV2的活化对细胞的损伤作用以及哈巴俄苷的药理作用。通过MTT法检测共培养模型中HT22细胞的活性。如图12所示,Ang II显著抑制共培养模型中HT22细胞的活性(<0.001),诱导细胞损伤;100 μmol/L哈巴俄苷可以显著升高细胞活力(<0.05),减轻HT22细胞的损伤。
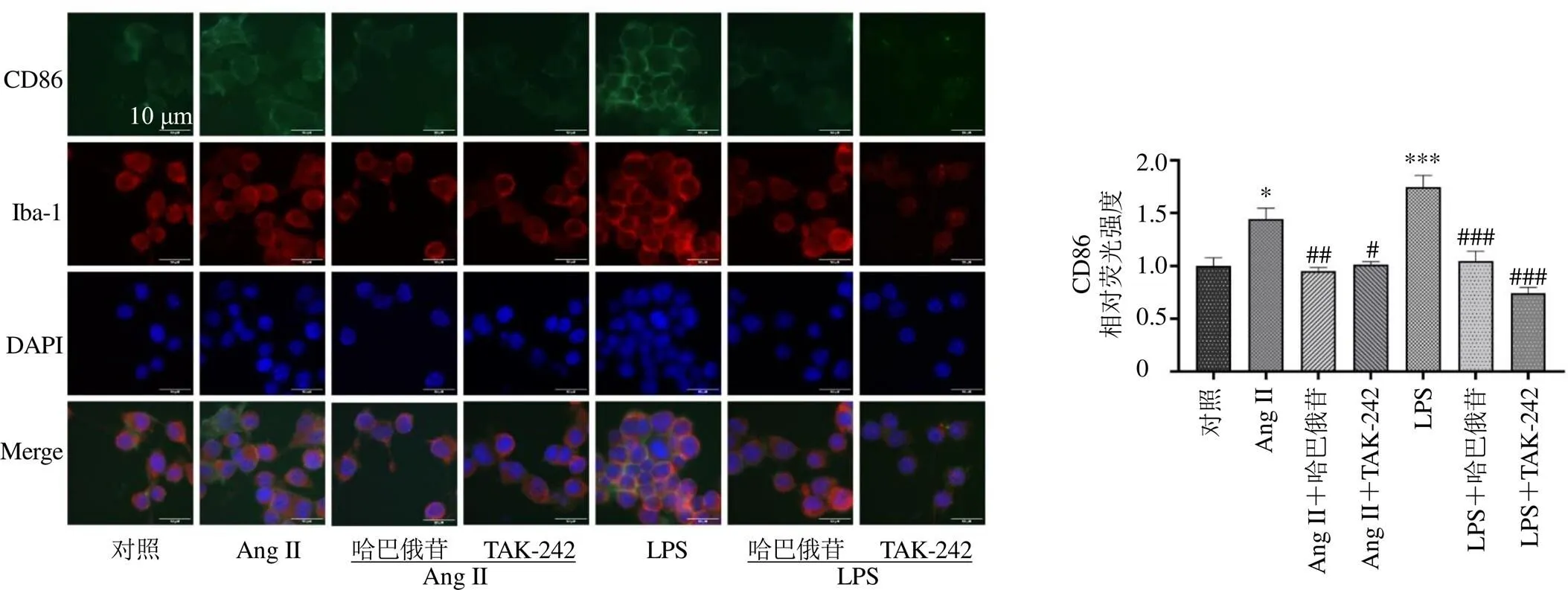
图10 哈巴俄苷对CD86表达的影响(×400; , n = 3)
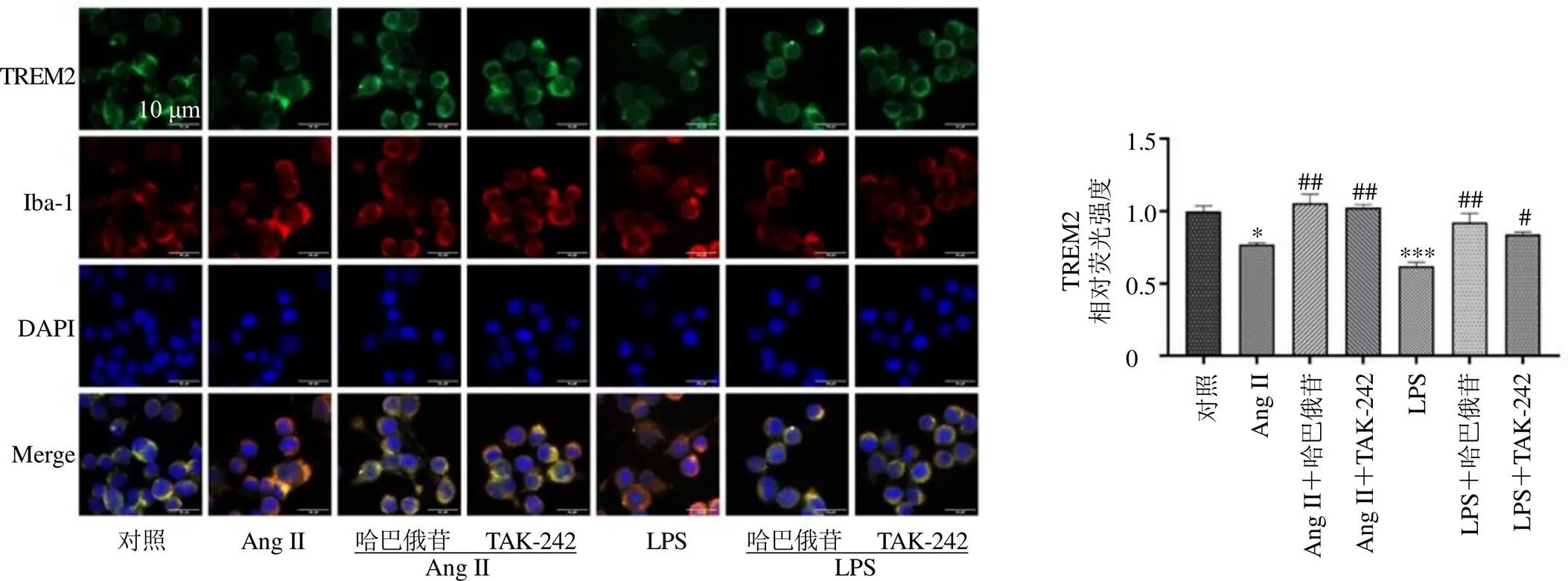
图11 哈巴俄苷对TREM2表达的影响(×400; , n = 3)
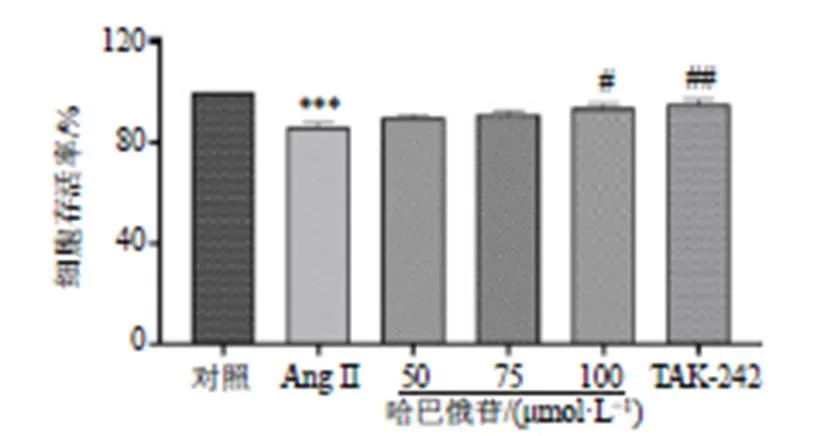
图12 哈巴俄苷对共培养模型中HT22细胞活性的影响(, n = 3)
3.9 哈巴俄苷对共培养模型中HT22细胞凋亡的影响
使用JC-1探针检测线粒体膜电位的变化,如图13所示,Ang II可以增加绿色荧光及红色荧光的比值(<0.001),而哈巴俄苷可以降低绿色荧光及红色荧光的比值(<0.001),增加线粒体膜电位,减少细胞凋亡。TUNEL染色结果(图14)显示哈巴俄苷可以减轻Ang II诱导的细胞凋亡。细胞流式结果(图15)也表明Ang II可明显增加凋亡细胞的数量(<0.01),而哈巴俄苷可以减少Ang II诱导的细胞凋亡(<0.05)。
3.10 哈巴俄苷对共培养模型中HT22凋亡相关蛋白表达的影响
Caspases家族可以调节细胞死亡。进一步分析共培养模型中HT22细胞凋亡相关蛋白的表达情况。如图16所示,Ang II可明显增加cleaved Caspase-3/ Caspase-3、cleaved Caspase-8/Caspase-8、cleaved Caspase-9/Caspase-9、Bax/Bcl-2及Cyt C表达(<0.01、0.001);而用哈巴俄苷处理后,上述凋亡相关蛋白表达均显著降低(<0.01、0.001),表明哈巴俄苷可在体外减少炎症引起的神经元损伤。
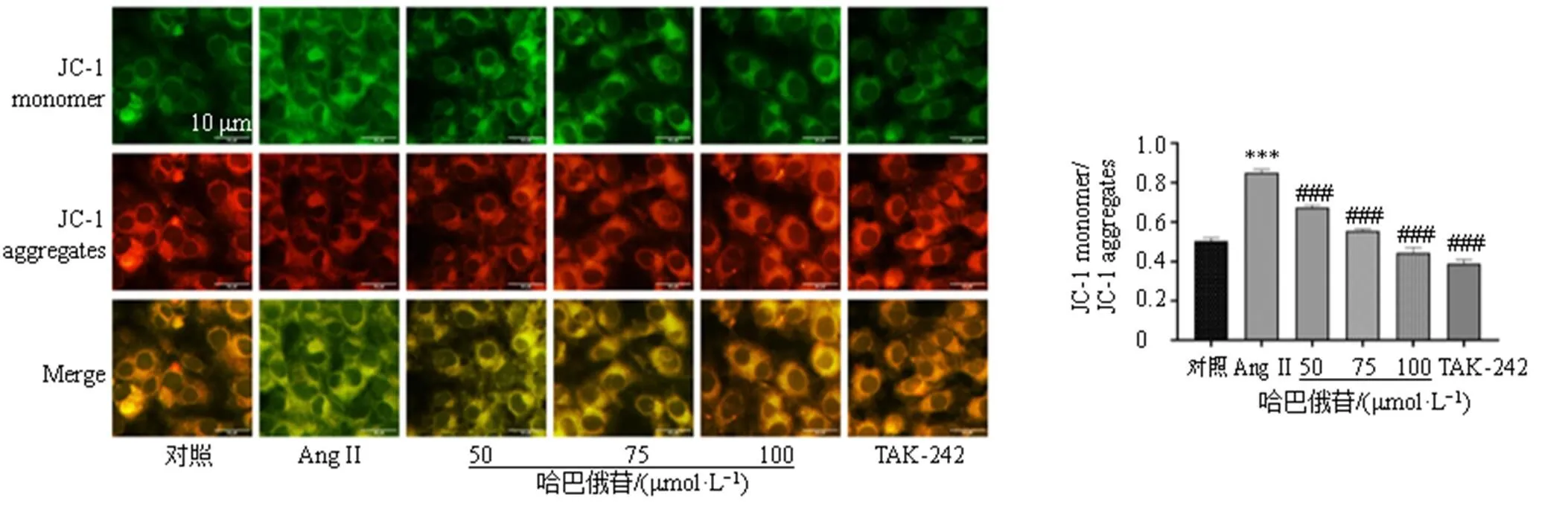
图13 JC-1探针检测线粒体膜电位变化(×400; , n = 3)
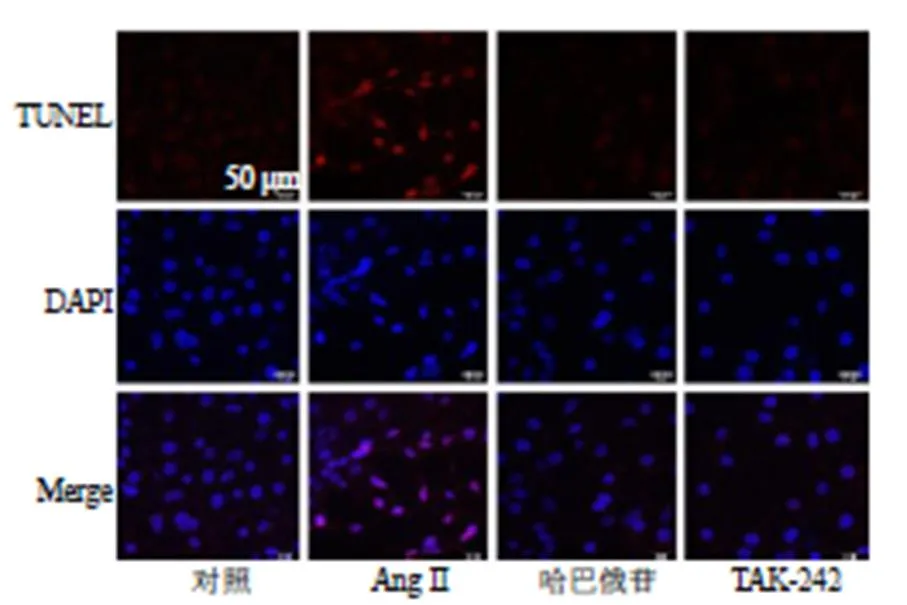
图14 TUNEL染色检测细胞凋亡 (×200)
4 讨论
小胶质细胞是中枢神经系统的先天免疫细胞,在许多神经退行性疾病中,其慢性激活可产生大量的炎症介质以及有害物质,导致神经元的死亡[11]。Ang II是高血压的主要发病因素,其在体内积累可导致血管和组织炎症,与小胶质细胞的激活有关,可促进多种神经系统疾病的进展[4,25]。因此,抑制小胶质细胞的炎性激活可能为高血压脑小血管疾病的潜在治疗靶点。本研究证明了哈巴俄苷可抑制BV2小胶质细胞的激活,保护神经元细胞免受炎症损伤,而这可能是通过调控TLR4/MyD88/NF-κB通路来实现的。
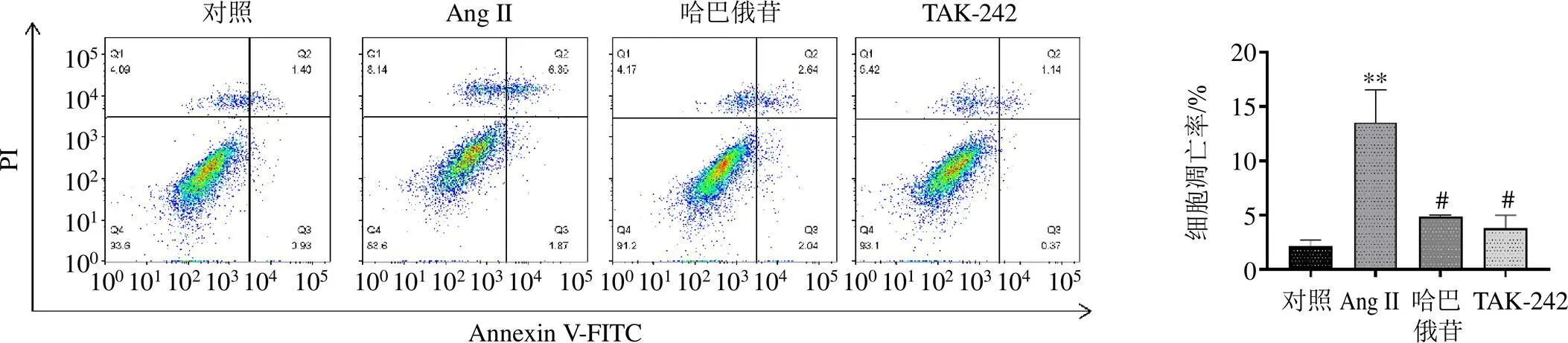
图15 流式细胞术检测细胞凋亡(, n = 3)
小胶质细胞在维持神经系统稳态方面发挥着重要作用。小胶质细胞的持续激活可在体内产生高水平的有害介质,包括TNF-α、IL-1β和iNOS,具有神经毒性作用[11,26]。TLR4在小胶质细胞中高表达,参与了多种神经退行性疾病的小胶质细胞激活[11]。激活的TLR4可募集下游的MyD88靶向NF-κB信号级联[27]。Ang II可介导炎症反应,此外还可以激活小胶质细胞中TLR4介导的信号通路[28-29]。Ang II可诱导TLR4、MyD88、iNOS、TNF-α和IL-1β蛋白表达量增加,促进BV2上清中TNF-α、IL-1β和NO的分泌,诱导NF-κB p65向细胞核内异位。因此,推测Ang II通过TLR4/MyD88/NF-κB通路激活小胶质细胞,使用TLR4抑制剂TAK-242进行验证,发现TAK-242可产生细胞保护作用。
哈巴俄苷可调节体外3T3-L1脂肪细胞[30]、骨关节炎软骨细胞[31]和BEAS-2B细胞[32]的炎症反应。本研究已证明Ang II可通过TLR4/MyD88/NF-κB通路激活BV2细胞的炎症反应。为了探索哈巴俄苷对小胶质细胞的药理作用,用哈巴俄苷预处理Ang II诱导的BV2细胞。结果表明,哈巴俄苷可降低细胞中TLR4、MyD88、iNOS、TNF-α和IL-1β蛋白表达,减少BV2上清中TNF-α、IL-1β和NO的分泌,抑制NF-κB p65向细胞核的转运,表现出与TAK-242相似的药理作用。总之,哈巴俄苷可通过下调Ang II诱导的BV2小胶质细胞TLR4/MyD88/ NF-κB通路激活发挥抗炎作用。TLR4可以识别多种病原体相关分子模式,LPS作为TLR4主要配体之一,与中枢神经系统中的其他细胞相比,主要作用于小胶质细胞[11]。通常LPS与CD14蛋白结合并转移到TLR4/MD-2复合物,靶向MyD88依赖的炎症反应[33]。因此,采用LPS进一步研究哈巴俄苷对上述通路的作用。结果表明,100 μmol/L哈巴俄苷可抑制LPS诱导的BV2细胞TLR4、MyD88、iNOS、TNF-α和IL-1β蛋白表达及NF-κB p65向细胞核内的转运,与TAK-242的作用相同。即哈巴俄苷确实参与TLR4/MyD88/NF-κB通路。综上,哈巴俄苷可抑制Ang II处理的BV2细胞TLR4/MyD88/NF-κB通路发挥抗炎作用。
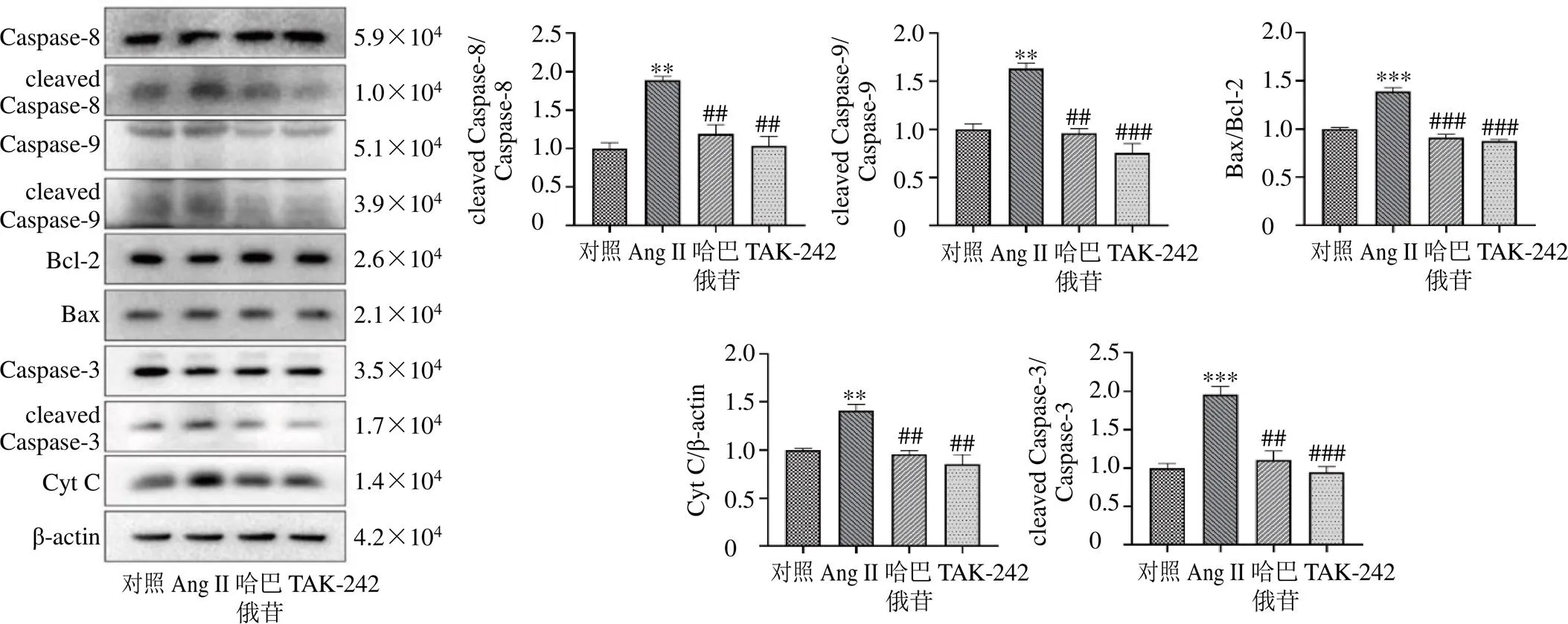
图16 共培养模型中HT22细胞凋亡相关蛋白的表达(, n = 3)
研究发现,小胶质细胞可极化为促炎M1型和抗炎M2型[11]。M1表型的小胶质细胞与iNOS、TNF-α、IL-1β、CD86、主要组织相容性复合物II(major compatibility complex II,MHC-II)、IL-6等的上调有关,M2表型小胶质细胞具有高水平的CD206、TREM2等[11,34]。TREM2主要在小胶质细胞上表达,可减轻大脑炎症[35]。通过观察CD86和TREM2的表达分析小胶质细胞的状态,CD86的上调表示其促炎活性增加,而TREM2的表达在一定程度上起到了保护作用。结果显示,在Ang II/LPS处理的小胶质细胞中,CD86表达上调,TREM2表达下调。而哈巴俄苷和TAK-242预处理均可以抑制CD86的表达,增加TREM2的表达。因此,哈巴俄苷可能通过调节小胶质细胞CD86和TREM2的表达来抵抗Ang II或LPS诱导的细胞凋亡。
BV2细胞产生的炎症分子可导致周围神经元细胞损伤[11]。为了进一步验证哈巴俄苷是否具有神经保护作用,构建了体外BV2-HT22细胞共培养模型。结果表明,哈巴俄苷可减轻共培养体系中HT22细胞的损伤,100 μmol/L哈巴俄苷、TAK-242与模型组比较均有统计学意义。用100 μmol/L哈巴俄苷预处理共培养模型,分析由BV2细胞炎症导致的HT22细胞凋亡。凋亡是一种细胞程序性死亡,主要由Caspases的激活引起。细胞凋亡途径包括线粒体途径和死亡受体途径。死亡受体与其配体结合,激活并水解Caspase-8,进一步激活下游的Caspase-3(死亡受体通路)。炎症因子可改变线粒体膜通透性,影响促凋亡Bax家族和抗凋亡Bcl-2家族的表达,调节细胞色素C的释放,进而激活Caspase-9(线粒体依赖途径)。Caspase-8和Caspase-9均可激活Caspase-3,诱导细胞凋亡[36-38]。哈巴俄苷可降低Ang II诱导的共培养模型中HT22细胞凋亡相关蛋白cleaved Caspase-3/Caspase-3、cleaved Caspase-8/ Caspase-8、cleaved Caspase-9/Caspase-9、Bax/Bcl-2和Cyt C的表达。JC-1染色、TUNEL染色和流式细胞术也证实了哈巴俄苷可减少HT22细胞的凋亡。表明哈巴俄苷可能通过抑制线粒体通路和死亡受体通路,减轻Ang II介导的共培养模型中HT22细胞的凋亡(图17)。
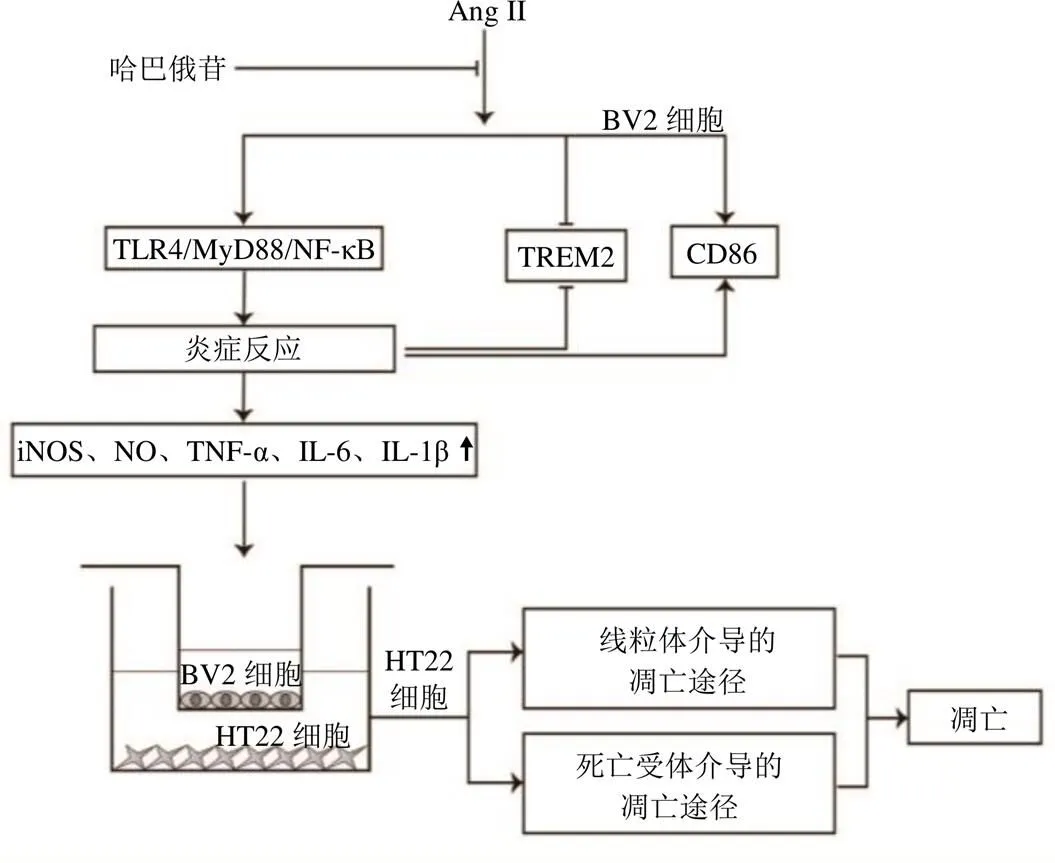
图17 哈巴俄苷通过抑制TLR4/MyD88/NF-κB通路减轻神经炎症诱导的神经元损伤
综上,哈巴俄苷可能通过抑制TLR4/MyD88/ NF-κB通路对Ang II诱导的小胶质细胞发挥抗炎作用,进而减轻神经炎症引起的神经元损伤,表明哈巴俄苷在预防或治疗高血压脑小血管疾病及其他中枢神经系统炎症疾病方面具有潜在的药用价值。
利益冲突 所有作者均声明不存在利益冲突
[1] Sargurupremraj M, Suzuki H, Jian X Q,. Cerebral small vessel disease genomics and its implications across the lifespan [J]., 2020, 11(1): 6285.
[2] Ma Y, Song A, Viswanathan A,. Blood pressure variability and cerebral small vessel disease [J]., 2020, 51(1): 82-89.
[3] Jackson L, Eldahshan W, Fagan S C,. Within the brain: The renin angiotensin system [J]., 2018, 19(3): 876.
[4] Benicky J, Sánchez-Lemus E, Honda M,. Angiotensin II AT1 receptor blockade ameliorates brain inflammation [J]., 2011, 36(4): 857-870.
[5] Park H S, You M J, Yang B,. Chronically infused angiotensin II induces depressive-like behavior via microglia activation [J]., 2020, 10(1): 22082.
[6] Prinz M, Jung S, Priller J. Microglia biology: One century of evolving concepts [J]., 2019, 179(2): 292-311.
[7] Nayak D, Roth T L, McGavern D B. Microglia development and function [J]., 2014, 32: 367-402.
[8] Wolf S A, Boddeke H M, Kettenmann H. Microglia in physiology and disease [J]., 2017, 79: 619-643.
[9] Kwon H S, Koh S H. Neuroinflammation in neurodegenerative disorders: The roles of microglia and astrocytes [J]., 2020, 9(1): 42.
[10] Zusso M, Lunardi V, Franceschini D,. Ciprofloxacin and levofloxacin attenuate microglia inflammatory response via TLR4/NF-kB pathway [J]., 2019, 16(1): 148.
[11] Subhramanyam C S, Wang C, Hu Q D,. Microglia-mediated neuroinflammation in neurodegenerative diseases [J]., 2019, 94: 112-120.
[12] Rodríguez-Gómez J A, Kavanagh E, Engskog-Vlachos P,. Microglia: Agents of the CNS pro-inflammatory response [J]., 2020, 9(7): 1717.
[13] Vijay K. Toll-like receptors in immunity and inflammatory diseases: Past, present, and future [J]., 2018, 59: 391-412.
[14] Kouli A, Horne C B, Williams-Gray C H. Toll-like receptors and their therapeutic potential in Parkinson’s disease and α-synucleinopathies [J]., 2019, 81: 41-51.
[15] Biancardi V C, Bomfim G F, Reis W L,. The interplay between angiotensin II, TLR4 and hypertension [J]., 2017, 120: 88-96.
[16] Zhu L P, Han J K, Yuan R R,. Berberine ameliorates diabetic nephropathy by inhibiting TLR4/NF-κB pathway [J]., 2018, 51(1): 9.
[17] Lawrimore C J, Crews F T. Ethanol, TLR3, and TLR4 agonists have unique innate immune responses in neuron-like SH-SY5Y and microglia-like BV2 [J]., 2017, 41(5): 939-954.
[18] Wang Y, Hu H S, Yin J,. TLR4 participates in sympathetic hyperactivity post-MI in the PVN by regulating NF-κB pathway and ROS production [J]., 2019, 24: 101186.
[19] Menghini L, Recinella L, Leone S,. Devil’s claw () and chronic inflammatory diseases: A concise overview on preclinical and clinical data [J]., 2019, 33(9): 2152-2162.
[20] Wang J Z, Zhang Y F, Xu F,. Investigation of themetabolism of harpagoside and distribution of its metabolites in rats by HPLC-IT-TOF-MSn[J]., 2018, 32(7): e4218.
[21] Lu Y W, Hao R J, Wei Y Y,. The protective effect of harpagoside on angiotensin II (Ang II)-induced blood-brain barrier leakage[J]., 2021, 35(11): 6241-6254.
[22] Chaoui D, Faussat A M, Majdak P,. JC-1, a sensitive probe for a simultaneous detection of P-glycoprotein activity and apoptosis in leukemic cells [J]., 2006, 70(3): 189-196.
[23] Voloboueva L A, Liu J K, Suh J H,. ()-alpha-lipoic acid protects retinal pigment epithelial cells from oxidative damage [J]., 2005, 46(11): 4302-4310.
[24] Zhou K, Wu J, Chen J,. Schaftoside ameliorates oxygen glucose deprivation-induced inflammation associated with the TLR4/Myd88/Drp1-related mitochondrial fission in BV2 microglia cells [J]., 2019, 139(1): 15-22.
[25] Ali Bhat S, Sood A, Shukla R,. AT2R activation prevents microglia pro-inflammatory activation in a NOX-dependent manner: Inhibition of PKC activation and p47phoxphosphorylation by PP2A [J]., 2019, 56(4): 3005-3023.
[26] Gliozzi M, Scicchitano M, Bosco F,. Modulation of nitric oxide synthases by oxidized LDLs: Role in vascular inflammation and atherosclerosis development [J]., 2019, 20(13): E3294.
[27] Yang J, Wu Y P, Xu Y,. Dexmedetomidine resists intestinal ischemia-reperfusion injury by inhibiting TLR4/MyD88/NF-κB signaling [J]., 2021, 260: 350-358.
[28] Yang H Y, Song X S, Wei Z M,. TLR4/MyD88/NF-κB signaling in the rostral ventrolateral medulla is involved in the depressor effect of candesartan in stress-induced hypertensive rats [J]., 2020, 11(19): 2978-2988.
[29] Biancardi V C, Stranahan A M, Krause E G,. Cross talk between AT1 receptors and Toll-like receptor 4 in microglia contributes to angiotensin II-derived ROS production in the hypothalamic paraventricular nucleus [J]., 2016, 310(3): H404-H415.
[30] Kim T K, Park K S. Inhibitory effects of harpagoside on TNF-α-induced pro-inflammatory adipokine expression through PPAR-γ activation in 3T3-L1 adipocytes [J]., 2015, 76(2): 368-374.
[31] Haseeb A, Ansari M Y, Haqqi T M. Harpagoside suppresses IL-6 expression in primary human osteoarthritis chondrocytes [J]., 2017, 35(2): 311-320.
[32] Boeckenholt C, Begrow F, Verspohl E J. Effect of silymarin and harpagoside on inflammation reaction of BEAS-2B cells, on ciliary beat frequency (CBF) of trachea explants and on mucociliary clearance (MCC) [J]., 2012, 78(8): 761-766.
[33] Płóciennikowska A, Hromada-Judycka A, Borzęcka K,. Co-operation of TLR4 and raft proteins in LPS-induced pro-inflammatory signaling [J]., 2015, 72(3): 557-581.
[34] Aryanpour R, Pasbakhsh P, Zibara K,. Progesterone therapy induces an M1 to M2 switch in microglia phenotype and suppresses NLRP3 inflammasome in a cuprizone-induced demyelination mouse model [J]., 2017, 51: 131-139.
[35] Liu W F, Taso O, Wang R,. Trem2 promotes anti-inflammatory responses in microglia and is suppressed under pro-inflammatory conditions [J]., 2020, 29(19): 3224-3248.
[36] Shalini S, Dorstyn L, Dawar S,. Old, new and emerging functions of caspases [J]., 2015, 22(4): 526-539.
[37] Zhang J H, Zhang Y P, Herman B. Caspases, apoptosis and aging [J]., 2003, 2(4): 357-366.
[38] Nicotera P. Apoptosis and age-related disorders: Role of caspase-dependent and caspase-independent pathways [J]., 2002, 127(1/3): 189-195.
Harpagoside alleviates neuronal damage caused by neuroinflammation via suppressing TLR4/MyD88/NF-κB pathway
HAO Ren-juan1, HU Ying-chao2, YU Gu-ran2, QIN Xiu-de3, LU Yun-wei3
1. Guangdong Provincial Hospital of Chinese Medicine, Guangzhou 510030, China 2. Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China 3. Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518000, China
To study the effect of harpagoside on neuron injury induced by neuroinflammation.The effects of angiotensin II (Ang II) and harpagoside on viability of mouse microglia BV2 cells were detected by MTT assay; The morphological changes of BV2 cells was observed; The levels of inflammatory factors in cell supernatant were detected; The nuclear translocation of nuclear factor-κB p65 (NF-κB p65) and expressions of CD86 and triggering receptor expressed on myeloid cells 2 (TREM2) in myeloid cells were detected by immunofluorescence; Toll like receptor 4 (TLR4) and myeloid differentiation factor 88 (MyD88), inducible nitric oxide synthase (iNOS), tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) protein expressions were detected by Western blotting. Lipopolysaccharide (LPS) and TLR4 inhibitor (TAK-242) were used to further verify the mechanism of harpagoside. The co-culture model of BV2-HT22 cells was established, mitochondrial membrane potential, apoptosis and expressions of apoptosis-related proteins were detected to study the effect of harpagoside on neuronal damage caused by neuroinflammation.Ang II significantly increased the protein expressions of TLR4, MyD88, IL-1β, TNF-α and iNOS in BV2 cells (< 0.01, 0.001), promoted the nucleation of NF-κB p65 (< 0.001), and regulated the expressions of inflammatory markers CD86 and TREM2 on the surface of microglia (< 0.05). Harpagoside and TAK-242 could reverse the effects of Ang II or LPS on BV2 cells (< 0.05, 0.01, 0.001). In addition, harpagoside could significantly down-regulate the expressions of apoptosis-related proteins in HT22 cells of BV2-HT22 co-culture model (< 0.01, 0.001), and inhibit the apoptosis of HT22 cells (< 0.05, 0.001).Harpagoside may alleviate the inflammatory response by inhibiting the activation of TLR4/MyD88/ NF-κB pathway in BV2 cells induced by Ang II, thus alleviating the apoptosis of neurons caused by inflammation.
harpagoside; angiotensin II; neuroinflammation; apoptosis; co-culture
R285.5
A
0253 - 2670(2023)13 - 4202 - 12
10.7501/j.issn.0253-2670.2023.13.013
2023-01-03
国家重点研发计划项目(2022YFC3501403);江苏省自然科学基金资助项目(BK20191506);深圳市“医疗卫生三名工程”项目(SZZYSM202111011)
郝任娟(1996—),硕士研究生,主要从事神经系统疾病的中医药研究。E-mail: 1320597106@qq.com
通信作者:陆韵薇(1990—),主治医师,博士,主要从事神经系统疾病的中医药研究。E-mail: 417213243@qq.com
[责任编辑 李亚楠]
