盘龙参化学成分研究
2023-07-06赵目聪黄兹宝曹明玉刘辰鹏张小坡
于 蕾,赵目聪,董 琳,黄兹宝,姬 敏,曹明玉,刘辰鹏*,张小坡, 3*
• 化学成分 •
盘龙参化学成分研究
于 蕾1,赵目聪1,董 琳2,黄兹宝2,姬 敏2,曹明玉2,刘辰鹏2*,张小坡2, 3*
1. 哈尔滨商业大学药学院,黑龙江 哈尔滨 150076 2. 海南医学院药学院,海南 海口 571199 3. 海南省药物研究与开发科技园,海南 海口 571157
研究盘龙参根的化学成分。采用95%乙醇回流提取,石油醚萃取获得萃取物,运用硅胶柱色谱、凝胶柱色谱和半制备高效液相色谱等方法进行分离制备,采用波谱学方法鉴定化合物结构。采用计算电子圆二色谱法(ECD)判定新化合物的绝对构型。体外考察化合物对棕榈酸诱导MIN6细胞损伤后的细胞活力影响。从盘龙参根乙醇提取物石油醚萃取部位中分离得到11个化合物,分别鉴定为()-2-(2,4-二甲氧基-8-{4-羟基-5,6-二甲基-四氢呋喃[7,8]}-9,10-二氢菲)(1)、红门兰酚(2)、spiranthesphenanthrene A(3)、2-methoxy-4,7-dihydroxy-6-isopentenyl-9,10- dihydrophenanthrene(4)、3,5-二羟基-4,7-二甲氧基黄酮(5)、樱花素(6)、5-羟基-3,7,3,4-四甲氧基黄酮(7)、5-hydroxy- 4-[(2-isopentenyl)oxy]-3,7,3-trimeoxyflavone(8)、hydroxydihydro-bovolide(9)、原儿茶醛(10)、β-谷甾醇(11)。活性测试结果显示化合物1(0.39~25 μmol/L)或11(12.5~50 μmol/L)与棕榈酸共同处理后的各组细胞增殖活力均明显增强。化合物1为新的二氢菲类化合物,命名为盘龙参醇A;化合物6~7、9~10为首次从绶草属中分离得到;化合物1和11能够拮抗棕榈酸对MIN6细胞的损伤作用,促进细胞的生长和增殖。
盘龙参;二氢菲类;MIN6细胞活力;盘龙参醇A;樱花素;5-羟基-3,7,3,4-四甲氧基黄酮
盘龙参为兰科(Orchidaceae)绶草属Rich.植物盘龙参(Pers.) Ames,别名猪辽参、龙抱柱、龙缠柱、猪牙参等。盘龙参以根或全草入药,具有滋阴益气、凉血解毒、润肺止咳的功效[1]。盘龙参广泛分布于全国各地,主产于海南、贵州、云南、四川等地,常见于海拔200~3400 m的山坡林下、灌从下、草地或河滩沼泽草甸中[2-3]。盘龙参最早记载于《诗经·陈风》,作为药材最早记载于《滇南本草》称其:味甘,性温。入肺、肝、肾三经。《天宝本草》记载盘龙参“添精壮阳、治头晕、腰痛酸软”。《湖南药物志》记载盘龙参“止虚热口渴,肺瘤咳血”[4]。在我国藏医、蒙医中也有使用[5]。盘龙参化学成分类型丰富,包括二氢菲类、黄酮类、苯丙素类等[6-9]。其中,二氢菲类成分是其特征性成分,目前,已分离得到20余个二氢菲类化合物。此类化合物具有多种生物活性,如抗糖尿病、抗氧化、抗肿瘤等[10-16]。本研究采用乙醇回流提取盘龙参,富集石油醚萃取部位中的化学成分,进一步运用硅胶柱色谱、Sephadex LH-20柱色谱和半制备高效液相色谱等多种色谱方法从中分离得到11个化合物,利用核磁共振波谱和高分辨质谱等技术,分别鉴定为()-2-(2,4-二甲氧基-8-{4′-羟基- 5′,6′-二甲基-四氢呋喃[7,8]}-9,10-二氢菲) [()-2′- (2,4-dimethoxy-8-{4′-hydroxy-5′,6′-dimethyl-tetra- hydrofuran [7,8]}-9,10-dihydrophenanthrene),1]、红门兰酚(orchinol,2)、spiranthesphenanthrene A(3)、2-methoxy-4,7-dihydroxy-6-isopentenyl-9,10-dihydro phenanthrene(4)、3,5-二羟基-4,7-二甲氧基黄酮(3,5-dihydroxy-4,7-dimethoxyflavone,5)、樱花素(sakuranetin,6)、5-羟基-3,7,3,4-四甲氧基黄酮(5- hydroxy-3,7,3,4-tetramethoxyflavone,7)、5-hydroxy- 4-[(2-isopentenyl)oxy]-3,7,3-trimeoxyflavone(8)、hydroxydihydro-bovolide(9)、原儿茶醛(protocatechuic aldehyde,10)、β-谷甾醇(β-sitosterol,11),结构见图1。其中,化合物1为1个新的9,10-二氢菲类化合物,命名为盘龙参醇A;化合物6~7、9~10首次绶草属分离得到。采用棕榈酸诱导MIN6细胞损伤后,评价待测化合物对MIN6细胞增殖活力的影响,结果表明,化合物1和11可显著增强MIN6细胞的活力,产生对MIN6细胞的保护作用。

图1 化合物1~11的结构
1 仪器与材料
SB-1100型旋转蒸发仪(上海爱朗仪器有限公司),BRUKERAV Ⅲ600型核磁共振仪(德国布鲁克公司),四孔水浴锅(江苏中大仪器科技有限公司),ZF-20D暗箱式紫外分析仪(上海宝山顾村电光仪器厂),KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司),柱色谱硅胶(200~300目,青岛海洋化工有限公司),SephadexLH-20(GE Healthcare),硅胶GF254预制板(青岛海洋化工有限公司),半制备型高效液相色谱用岛津液相色谱LC-16系统、配SPD-16检测器和YMC柱(ODS,250 mm×2.5 mm,5 μm,日本岛津公司),电子天平(杭州万特衡器有限公司),精密天平(日本岛津公司),赛默飞LTQ液质离子阱质谱仪液质联用仪(赛默飞公司),Model 680型酶标仪(美国Bio-Rad公司),甲醇、正丁醇、二氯甲烷、醋酸乙酯、石油醚(分析纯,佛山西陇化工有限公司),甲醇(色谱级)(天津康科德科技有限公司),RPMI Medium 1640培养基、胎牛血清、胰酶溶液、PBS均购自Gibco公司,CCK8(碧云天生物技术有限公司),棕榈酸(海南泓科生物科技有限公司),小鼠胰岛细胞MIN6(安徽微分基因科技有限公司)。
盘龙参产于贵州省毕节市赫章县,于2021年8月采摘,经海南医学院曾念开教授鉴定为兰科绶草属植物盘龙参(Pers.) Ames的干燥根。植物标本(SS202108)保存于海南医学院天然药物化学实验室。
2 提取与分离
干燥的盘龙参药材(20 kg)粉碎,经95%乙醇回流提取,每次2 h,提取2次,过滤浓缩得总浸膏1 203.1 g。将总浸膏加水分散均匀后,依次用石油醚、醋酸乙酯、正丁醇萃取3次,浓缩得石油醚部位(169.4 g)、醋酸乙酯部位(80.2 g)、正丁醇部位(168.3 g)。盘龙参石油醚萃取部位上硅胶柱进行分离,选用石油醚-醋酸乙酯体系的流动相进行洗脱,共得到14个组分A~N。D4组分通过重结晶得到化合物11(15.0 mg)。根据薄层及液相初步分析,选取E6,E9组分,分别用Sephadex LH-20柱色谱(甲醇)进行分离,分别得到E6-1~E6-6;E9-1~E9-6组分。E6-6、E9-6、E9-3、E9-4组分经HPLC(甲醇-水85∶15~75∶25),检测波长(254、210 nm),体积流量2 mL/min,得到化合物2(3.0 mg)、3(5.0 mg)、4(3.5 mg)、5(2.8 mg)、8(3.2 mg)。F~G组分经TLC检识后合并,通过硅胶柱色谱(石油醚-醋酸乙酯100∶0~0∶100、甲醇)分离得到FG1~FG12。FG5流分经TLC检识合并得到FG5-11~FG5-16,通过HPLC(甲醇-水85∶15),检测波长(254 nm,210 nm),体积流量2 mL/min,得到化合物1(2.7 mg)、6(3.5 mg)、7(3.4 mg)、9(1.0 mg)。I组分经硅胶柱色谱(石油醚-醋酸乙酯100∶0~0∶100、甲醇)分离得到I1~I9。其中I5各流分经TLC合并得到I5-6~I5-8,再将上述组分在酸性条件下通过薄层色谱(石油醚-二氯甲烷-醋酸乙酯7∶1∶1)制备得到化合物10(4.5 mg)。
3 结构鉴定

1H-1H COSY显示H7.89 (H-5) 与H6.59 (H-6) 相关,H3.67 (H-2′) 与H2.88 (H-3′) 相关,H2.57 (H-9) 与H2.65 (H-10) 相关, 说明存在3个结构片段 (C-5-C-6, C-2′-C-3′, C-9-C-10)(图2)。HMBC谱中显示,H-3与C-1, C-2和C-4相关;2-OCH3,4-OCH3与C-2和C-4相关。因此,确定了2个甲氧基的连接位置;同时,2个甲基氢H1.30 (-CH3), 1.14 (-CH3) 与69.1 (C-2′), 76.5 (C-4′) 存在相关,确证结构中的异戊烯基片段环合成为呋喃环,且环合位置在C-7和C-8。同时,H-3(H2.88, 2.06) 与C-7 (151.2)、C-8 (117.7) 和C-8a (137.3) 存在相关,证实了以上推测。通过实测和计算的ECD光谱(图3)分析,推断出化合物1的绝对构型为。综上,化合物1鉴定为()-2'-(2,4-二甲氧基-8- {4'-羟基-5',6'-二甲基-四氢呋喃[7,8]}-9,10-二氢菲),经检索,该化合物为新化合物,命名为盘龙参醇A。1H-和13C-NMR数据见表1。
化合物2:黄色粉末状固体,ESI-MS/: 279.1[M+Na]+。1H-NMR (600 MHz, DMSO-6): 7.95 (1H, d,= 8.5 Hz, H-5), 6.63 (1H, d,= 2.6 Hz, H-6), 6.61 (1H, dd,= 2.8, 8.5 Hz, H-8), 6.51 (1H, d,= 2.6 Hz, H-3), 6.48 (1H, d,= 2.6 Hz, H-1), 3.82 (3H, s, 4-OCH3), 3.78 (3H, s, 2-OCH3), 2.65 (2H, m, H-9), 2.60 (2H, m, H-10);13C-NMR (150 MHz, DMSO-6): 158.6 (C-2), 157.6 (C-4), 155.8 (C-7), 140.3 (C-10a), 139.3 (C-8a), 129.1 (C-5), 123.9 (C-4b), 116.4 (C-4a), 114.7 (C-8), 113.2 (C-6), 105.7 (C-1), 98.0 (C-3), 56.0 (2-OCH3), 55.6 (4-OCH3), 30.6 (C-10), 29.9 (C-9)。以上核磁数据与参考文献基本一致[17],故鉴定化合物2为红门兰酚。
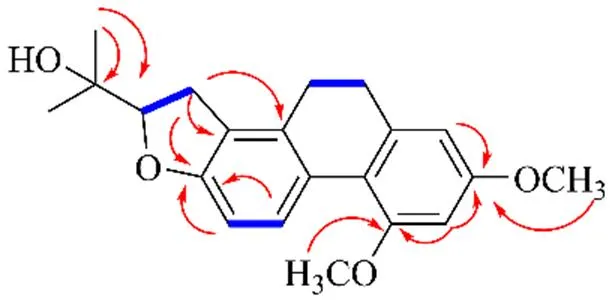
图2 化合物1的主要1H-1H COSY () 和HMBC ()相关
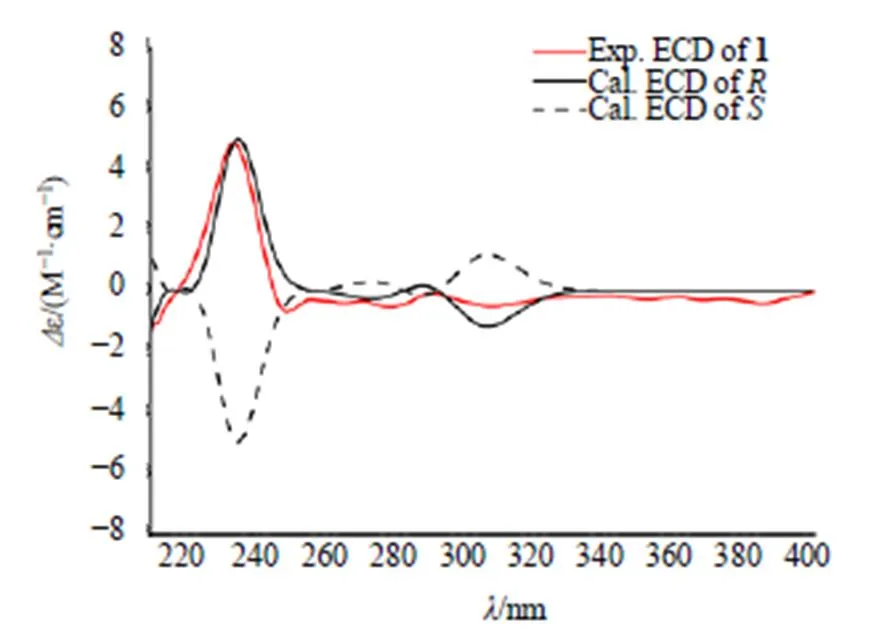
图3 化合物1的实测和计算ECD谱图
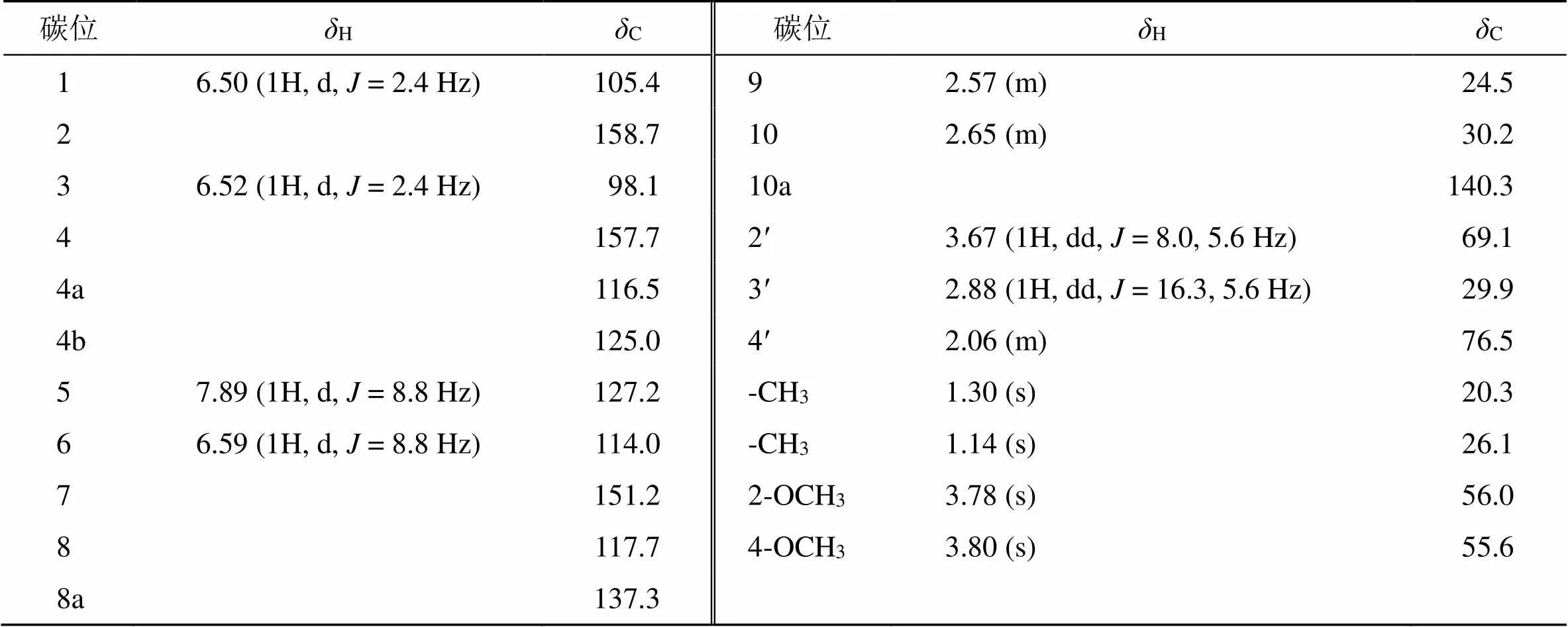
表1 化合物1的1H- 和13C-NMR数据 (600/150 MHz, DMSO-d6)
化合物3:红色粉末,ESI-MS/: 333.1 [M+Na]+。1H-NMR (600 MHz, CDCl3): 7.80 (1H, d,= 8.2 Hz, H-5), 6.77 (1H, d,= 8.2 Hz, H-6), 6.48 (1H, d,= 2.4 Hz, H-1), 6.35 (1H, d,= 2.4 Hz, H-3), 3.78 (3H, s, 2-OCH3), 2.78 (2H, t,= 6.8 Hz, H-4′), 2.73 (2H, m, H-10), 2.66 (2H, m, H-9), 1.86 (2H, t,= 6.8 Hz, H-3′), 1.37 (6H, s, H-7′, 8′);13C-NMR (150 MHz, CDCl3): 158.2 (C-2), 153.5 (C-4), 152.5 (C-7/6′), 140.7 (C-10a), 137.9 (C-8a), 124.5 (C-5), 124.3 (C-4b), 118.6 (C-8, 5′), 115.3 (C-4a), 106.1 (C-1), 100.6 (C-3), 73.2 (C-2′), 55.6 (2-OCH3), 33.0 (C-3′), 26.5 (C-7′, 8′), 24.5 (C-9), 20.6 (C-4′)。以上数据与参考文献基本一致[14],故鉴定化合物3为spiranthesphenanthrene A。
化合物4:无色粉末,ESI-MS/: 333.1 [M+Na]+。1H-NMR (600 MHz, CDCl3): 7.80 (1H, s, H-5), 6.74 (1H, s, H-8), 6.45 (1H, d,= 2.1 Hz, H-1), 6.35 (1H, d,= 2.1 Hz, H-3), 5.35 (1H, t,= 7.2 Hz, H-2′), 5.16 (2H, brs, -OH), 3.80 (3H, s, -OCH3), 3.42 (2H, d,= 7.2 Hz, H-1′), 2.67 (4H, m, H-9, 10), 1.83 (3H, s, H-5′), 1.80 (3H, s, H-4′);13C-NMR (150 MHz, CDCl3): 159.0 (C-2), 153.7 (C-4), 152.9 (C-7), 141.5 (C-10a), 138.6 (C-8a), 135.3 (C-3′), 127.8 (C-5), 125.7 (C-4b), 124.5 (C-6), 122.2 (C-2′), 116.0 (C-8), 115.4 (C-4a), 109.9 (C-3), 107.0 (C-1), 55.6 (-OCH3), 30.8 (C-10), 30.2 (C-1′), 30.0 (C-9), 25.8 (C-4′), 18.0 (C-5′)。以上数据与参考文献基本一致[13],故鉴定化合物4为2-methoxy-4,7-dihydroxy-6-isopentenyl- 9,10-dihydrophenanthrene。
化合物5:黄色粉末,ESI-MS/: 337.1 [M+Na]+。1H-NMR (600 MHz, CDCl3): 11.74 (1H, s, 5-OH), 8.16 (2H, d,= 8.8 Hz, H-2′, 6′), 7.00 (2H, d,= 8.8 Hz, H-3′, 5′), 6.57 (1H, s, 3-OH), 6.44 (1H, d,= 2.2 Hz, H-8), 6.38 (1H, d,= 2.2 Hz, H-6), 3.85 (3H, s, 3-OCH3), 3.83 (3H, s, 4′-OCH3);13C-NMR (150 MHz, CDCl3): 175.0 (C-4), 165.5 (C-7), 161.0 (C-4′), 160.5 (C-5) 156.6 (C-9), 145.8 (C-2), 135.5 (C-3), 129.5 (C-2′, 6′), 123.0 (C-1′), 114.4 (C-3′, 5′), 103.8 (C-10), 97.8 (C-6), 92.0 (C-8), 55.6 (7-OCH3), 55.2 (4′-OCH3)。以上数据与参考文献基本一致[18],故鉴定化合物5为3,5-二羟基-4,7-二甲氧基黄酮。
化合物6:白色粉末状固体,ESI-MS/: 307.1 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 12.12 (1H, s, 5-OH), 9.88 (1H, s, 4-OH), 7.33 (2H, d,= 8.6 Hz, H-2, 6), 6.80 (2H, d,= 8.5 Hz, H-3, 5), 6.10 (1H, d,= 2.3 Hz, H-8), 6.08 (1H, d,= 2.3 Hz, H-6), 5.50 (1H, dd,= 13.0, 2.9 Hz, H-2), 3.79 (3H, m, 7-OCH3), 3.36~3.31 (1H, m, H-3α), 2.71 (1H, dd,= 17.2, 3.1 Hz, H-3β);13C-NMR (150 MHz, DMSO-6): 197.5 (C-4), 167.9 (C-7), 163.7 (C-5), 163.4 (C-9), 158.3 (C-4), 129.1 (C-1), 128.9 (C-2, 6), 115.7 (C-3, 5), 103.1 (C-10), 95.1 (C-6), 94.2 (C-8), 79.1 (C-2), 56.4 (7-OCH3), 42.5 (C-3)。以上数据与文献报道基本一致[19],故鉴定化合物6为樱花素。
化合物7:黄色粉末,ESI-MS/: 381.1 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 12.64 (1H, s, 5-OH), 7.74 (1H, dd,= 8.5, 2.1 Hz, H-6), 7.67 (1H, d,= 2.2 Hz, H-2), 7.18 (1H, d,= 8.5 Hz, H-5), 6.79 (1H, s, H-8), 6.38 (1H, s, H-6), 3.88, 3.87, 3.87, 3.83 (12H, s, 3, 7, 3, 4-OCH3);13C-NMR (150 MHz, DMSO-6): 178.5 (C-4), 165.7 (C-7), 161.7 (C-5), 156.9 (C-9), 155.9 (C-2), 151.8 (C-4′), 149.0 (C-3′), 138.8 (C-3), 122.6 (C-6′), 122.5 (C-1′), 112.1 (C-5′), 111.7 (C-2′), 105.9 (C-10), 98.4 (C-6), 92.8 (C-8), 60.3, 56.6, 56.1, 55.3 (3, 7, 3, 4-OCH3)。以上数据与文献数据对照基本一致[20-21],故鉴定化合物7为5-羟基-3,7,3,4-四甲氧基黄酮。
化合物8:黄色粉末状固体,ESI-MS/: 435.1 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 12.6 (1H, s, 5-OH), 7.72 (1H, dd,= 8.6, 2.2 Hz, H-6′), 7.67 (1H, d,= 2.2 Hz, H-2′), 7.19 (1H, d,= 8.7 Hz, H-5′), 6.79 (1H, s, H-8), 6.38 (1H, s, H-6), 5.47 (1H, t,= 6.8 Hz, H-2′′), 4.65 (2H, d,= 6.9 Hz, H-1′′), 3.88 (3H, s, 4′-OCH3), 3.86 (3H, s, 7-OCH3), 3.83 (3H, s, 3-OCH3), 1.77 (3H, s, H-5′′), 1.74 (3H, s, H-4′′);13C-NMR (150 MHz, DMSO-6): 178.5 (C-4), 165.7 (C-7), 161.7 (C-5), 156.9 (C-9), 155.9 (C-2), 151.0 (C-4′), 149.2 (C-3′), 138.8 (C-3), 138.2 (C-3′′), 122.5 (C-1′), 122.4 (C-6′), 120.0 (C-2′′), 111.8 (C-2′), 113.2 (C-5′), 105.8 (C-10), 98.4 (C-6), 92.8 (C-8), 65.5 (C-1′′), 60.3 (3-OCH3), 56.5 (7-OCH3), 56.1 (4′-OCH3), 25.9 (C-5′′), 18.5 (C-4′′)。以上数据与参考文献基本一致[22],故鉴定化合物8为5-hydroxy-4- [(2-isopentenyl)oxy]-3,7,3-trimeoxyflavone。
化合物9:淡黄色油状物,ESI-MS/: 199.1 [M+H]+。1H-NMR (600 MHz, CDCl3): 1.86 (3H, s, H-11), 1.81 (2H, m, H-6a, 6b), 1.71 (3H, s, H-12), 1.24 (6H, m, H-7a, 7b, H-8, 9), 0.85 (3H, t,= 6.8 Hz, H-10);13C-NMR (150 MHz, CDCl3): 173.0 (C-2), 158.4 (C-4), 125.0 (C-3), 107.6 (C-5), 35.8 (C-6), 31.5 (C-7), 22.7 (C-8), 22.4 (C-9), 14.3 (C-10), 11.1 (C-11), 8.6 (C-12)。以上数据与文献报道基本一致[23],故鉴定化合物9为hydroxydihydro-bovolide。
化合物10:棕红色粉末,ESI-MS/: 161.0 [M+Na]+。1H-NMR (600 MHz, CD3OD): 9.60 (1H, s, H-1), 7.25~7.28 (2H, m, H-3, 8), 6.84 (1H, d,= 8.0 Hz, H-9);13C-NMR (150 MHz, CD3OD): 190.6 (C-1), 150.7 (C-6), 144.2 (C-4), 127.8 (C-2), 123.5 (C-9), 113.2 (C-3), 112.3 (C-8)。以上数据与文献报道基本一致[24],故鉴定化合物10为原儿茶醛。
化合物11:白色针晶(甲醇),ESI-MS/: 437.4 [M+Na]+。1H-NMR (600 MHz, CDCl3): 5.34 (1H, m, H-6), 3.51 (1H, m, H-3), 0.99 (3H, s, H-19), 0.91 (3H, d,= 6.5 Hz, H-21), 0.84 (3H, d,= 7.6 Hz, H-29), 0.80 (3H, d,= 2.0 Hz, H-26), 0.78 (3H, s, H-27), 0.66 (3H, s, H-18);13C-NMR (150 MHz, CDCl3): 140.8 (C-5), 121.8 (C-6), 71.9 (C-3), 56.8 (C-14), 56.1 (C-17), 50.2 (C-9), 45.9 (C-8), 42.4 (C-4), 42.3 (C-13), 39.8 (C-12), 37.3 (C-1), 36.6 (C-10), 36.2 (C-20), 34.0 (C-24), 32.0 (C-7), 31.7 (C-2), 29.8 (C-28), 29.2 (C-25), 28.3 (C-16), 26.1 (C-22), 24.4 (C-15), 23.1 (C-23), 21.2 (C-11), 19.9 (C-26), 19.5 (C-27), 19.1 (C-19), 18.9 (C-21), 12.1 (C-29), 11.9 (C-18)。以上数据与文献报道基本一致[25],故鉴定化合物11为β-谷甾醇。
4 化合物对棕榈酸诱导的MIN6细胞损伤的影响
待测化合物和棕榈酸共同干预细胞24 h后,采用CCK8法[26]检测MIN6细胞的增殖活力。结果表明,在棕榈酸诱导MIN6细胞损伤后,给予化合物干预,化合物1(0.39~25 μmol/L)或11(12.5~50 μmol/L)与棕榈酸共同处理后的各组细胞增殖活力均明显增强(<0.05、0.01、0.001);其余测试化合物与棕榈酸组相比,各组细胞增殖活性没有显著差异(>0.05)。说明化合物1和11能够拮抗棕榈酸对MIN6细胞的损伤作用,促进细胞的生长和增殖,如图4所示。
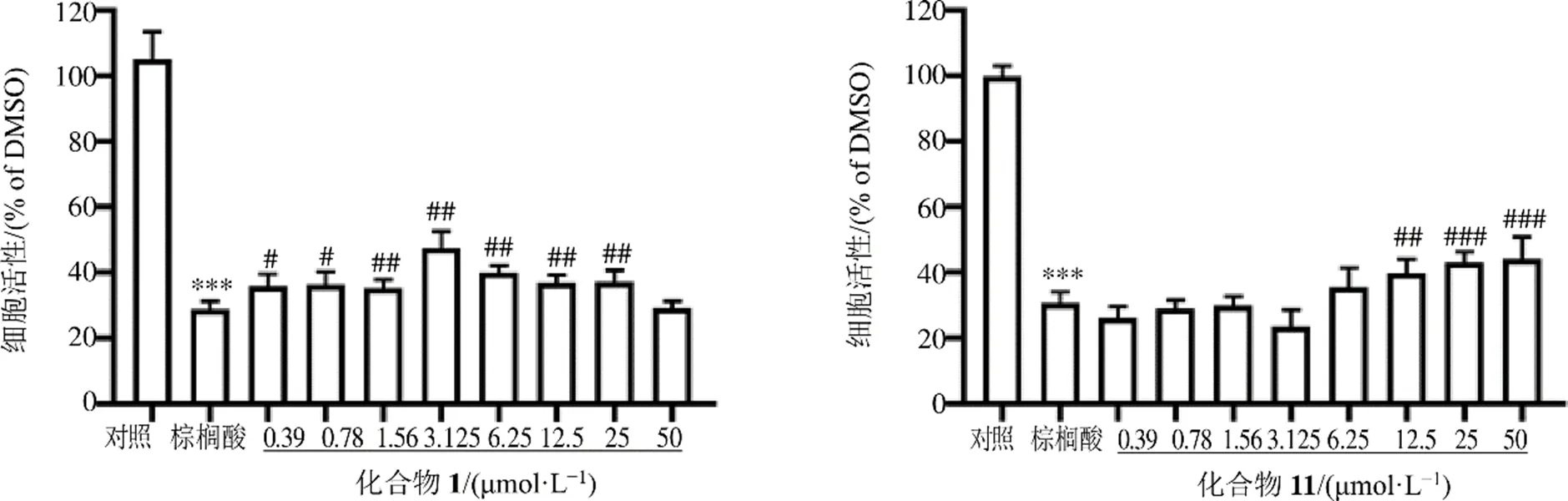
与对照组比较,***P<0.001;与棕榈酸组比较,#P<0.05 ##P<0.01 ###P<0.001
5 结论
本研究运用多种色谱手段,从盘龙参干燥根的95%乙醇提取物石油醚萃取部位中分离得到11个化合物,其中化合物1为新化合物,化合物6~7、9~10首次从绶草属中分离得到。所得的11个化合物中,4个属于9,10-二氢菲类,4个属于黄酮类。化合物1和11在一定浓度显示出增强棕榈酸诱导损伤后的MIN6细胞的活力,拮抗棕榈酸对MIN6细胞的损伤作用,产生对MIN6细胞的保护作用。综上,本研究进一步丰富了盘龙参化学成分,也为盘龙参胰岛保护研究提供了参考和依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局中华本草编委会. 中华本草(卷4) [M]. 上海: 上海科学技术出版社, 1999: 755-757.
[2] 中国科学院中国植物志编辑委员会. 中国植物志: 中名和拉丁名总索引 [M]. 北京: 科学出版社, 2006: 228-231.
[3] 江苏新医学院. 中药大辞典(上册) [M]. 缩印本. 上海: 上海科学技术出版社, 1986: 2187-2188.
[4] 张伟, 金传山, 周亚伟. 盘龙参研究进展[J]. 安徽医药, 2010, 14(7): 748-750.
[5] 照日格图, 萨仁格日乐. 蒙药旺拉嘎的本草考证 [J]. 中药材, 2005, 28(4): 345-346.
[6] Li C Y, Liu J, Su X H,. New dimeric phenanthrene and flavone from[J]., 2013, 15(4): 417-421.
[7] Lin Y L, Huang R L, Don M J,. Dihydrophenanthrenes from[J]., 2000, 63(12): 1608-1610.
[8] 尹永芹, 赵英日, 崔红花, 等. 盘龙参的化学成分研究 [J]. 中国实验方剂学杂志, 2013, 19(19): 76-78.
[9] 崔红花, 罗兰, 王淑美, 等. 盘龙参化学成分预实验 [J]. 时珍国医国药, 2012, 23(2): 359-361.
[10] 王英锋, 杨晓丹, 王碧柠. 綬草对四氧嘧啶致高血糖模型小鼠血糖的影响 [J]. 首都师范大学学报: 自然科学版, 2014, 35(3): 47-49.
[11] Liang C, Chang C A, Liang C E,.antioxidant activities, free radical scavenging capacity, and tyrosinase inhibitory of flavonoid compounds and ferulic acid from(Pers.) Ames [J]., 2014, 19(4): 4681-4694.
[12] Huang S M, Shieh C J, Wu Y L,. Antioxidant activity ofand its protective effect against UVB-induced skin fibroblast damage [J]., 2021, 9(9): 1564.
[13] Lin Y L, Wang W Y, Kuo Y H,. Homocyclotirucallane and two dihydrophenanthrenes from[J]., 2001, 49(9): 1098-1101.
[14] Liu L A, Yin Q M, Yan X,. Bioactivity-guided isolation of cytotoxic phenanthrenes from[J]., 2019, 67(26): 7274-7280.
[15] Shie P H, Yang C P, Huang G J,. Sinensol-C isolated frominhibits adipogenesis in 3T3-L1 cells through the regulation of adipogenic transcription factors and AMPK activation [J]., 2020, 25(18): 4204.
[16] 石东旭, 吕若雪, 宋歌, 等. 绶草中洛罗兰糖苷对STZ诱导高血糖小鼠的降糖作用 [J]. 中国新药杂志, 2020, 29(10): 1159-1165.
[17] 杨明惠, 赵会然, 郭洁, 等. 短瓣兰的化学成分研究 [J]. 云南大学学报: 自然科学版, 2015, 37(4): 556-563.
[18] El-Aarag B, Khairy A, Khalifa S A M,. Protective effects of flavone fromagainst CCl4-induced liver injury in mice mediated by suppression of oxidative stress, apoptosis and angiogenesis [J]., 2019, 20(20): 5215.
[19] 娄璐, 王亚宇, 王婧祎, 等. 差不嘎蒿化学成分的分离与鉴定(2) [J]. 沈阳药科大学学报, 2018, 35(9): 725-728.
[20] 张洁, 李宝泉, 冯锋, 等. 裸花紫珠的化学成分及其止血活性研究 [J]. 中国中药杂志, 2010, 35(24): 3297-3301.
[21] 董琳, 刘明生, 王金辉. 裸花紫珠的脂溶性化学成分 [J]. 中国药物化学杂志, 2009, 19(5): 371-374.
[22] Dong M L, Chen G A, Zhou Z M. Flavonoid constituents fromLindl [J]., 2008, 56(11): 1600-1603.
[23] 李洁, 陈全成, 林挺, 等. 刺苋的化学成分研究 [J]. 中草药, 2013, 44(3): 272-276.
[24] 赵方方, 韩丙军, 吕岱竹, 等. 海南胡椒蔓提取物活性测试及化学成分分离鉴定 [J]. 热带作物学报, 2019, 40(7): 1317-1324.
[25] 廖矛川, 熊姝颖, 杨芳云, 等. 长阳皱皮木瓜化学成分研究 [J]. 中南民族大学学报: 自然科学版, 2013, 32(1): 39-41.
[26] Dong L, Sun W Y, Huang Z B,. Two new scopadulane diterpenoids fromattenuated palmitate-induced viability in MIN6 cells [J]., 2021, 155: 105051.
Chemical constituents from
YU Lei1, ZHAO Mu-cong1, DONG Lin2, HUANG Zi-bao2, JI Min2, CAO Ming-yu2, LIU Chen-peng2, ZHANG Xiao-po2, 3
1. College of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. School of Pharmaceutical Science, Hainan Medical University, Haikou 571199, China 3. Hainan Pharmaceutical Research and Development Science Park, Haikou 571157, China
To study the chemical constituents from.The extracts were extracted by 95% ethanol reflux and petroleum ether. The extracts were separated and prepared by silica gel column chromatography, gel column chromatography and semi-preparative high performance liquid chromatography. The structures of the compounds were identified by spectroscopic methods. The absolute configuration of the new compounds was determined by computational electron circular dichroism (ECD). The effect of the compounds on the cell viability after palmitic acid (PA)-induced MIN6 cell injury was investigated.Eleven compounds were isolated fromand identified as ()-2'-(2,4-dimethoxy-8- {4'-hydroxy-5',6'-dimethyl-tetrahydrofuran [7,8]}-9,10-dihydrophenanthrene) (1), orchinol (2), spiranthesphenanthrene A (3), 2-methoxy-4,7-dihydroxy-6-isopentenyl-9,10-dihydrophenanthrene (4), 3,5-dihydroxy-4,7-dimethoxyflavone (5), sakuranetin (6), 5-hydroxy-3,7,3,4-tetramethoxy-flavone (7), 5-hydroxy-4-[(2-isopentenyl)oxy]-3,7,3-trimeoxyflavone (8), hydroxydihydro- bovolide (9), protocatechuic aldehyde (10), β-sitosterol (11). The results showed that the cell proliferation viability was significantly enhanced in each group after being treated by compound 1 (0.39—25 μmol/L) or 11 (12.5—50 μmol/L) with PA.Compound 1 was a new dihydrophenanthrene compound, named ()-2'-(2,4-dimethoxy-8-{4'-hydroxy-5',6'-dimethyl-tetrahydrofuran [7,8]}-9,10-dihydrophenanthrene), and compounds 6—7 and 9—10 were isolated fromfor the first time. Compounds 1 and 11 could antagonize the damage effect of PA on MIN6 cells and promote the growth and proliferation of MIN6 cells.
(Pers.) Ames; dihydrophenanthrene; MIN6 cell activity; spiranthol A; sakuranetin; 5-hydroxy-3,7,3′,4′- tetramethoxy-flavone
R284.1
A
0253 - 2670(2023)13 - 4089 - 07
10.7501/j.issn.0253-2670.2023.13.001
2023-03-05
国家自然科学基金项目(82060778);黑龙江省自然科学基金项目联合引导项目(LH2020H070);哈尔滨商业大学2021教师创新项目支持计划(LH2020H070)
于 蕾,女,博士,副研究员,主要从事抗肿瘤民族药研究。E-mail: yulei912@163.com
通信作者:刘辰鹏,男,硕士,主要从事南药黎药的研究。E-mail: 313638944@qq.com
张小坡,男,博士,教授,主要从事南药黎药药效物质基础及作用机制研究。E-mail: z_xp1412@163.com
[责任编辑 王文倩]
