海绵共附生链霉菌Streptomyces parvulus 162432次级代谢产物研究
2023-07-06陈瑞强罗祥超林厚文焦伟华
陈瑞强,罗祥超,林厚文, *,焦伟华*
海绵共附生链霉菌162432次级代谢产物研究
陈瑞强1,罗祥超2,林厚文1, 2*,焦伟华2*
1. 上海海洋大学食品学院,上海 201306 2. 癌基因与相关基因国家重点实验室海洋药物研究中心,上海交通大学医学院附属仁济医院,上海 200127
研究海绵共附生链霉菌162432的化学成分。采用十八烷基硅烷键合硅胶填料(ODS)中压柱色谱和半制备高效液相色谱等技术进行分离纯化,得到的单体化合物采用HR-ESI-MS、NMR以及文献比对等方法进行鉴定,新化合物的绝对构型通过计算NMR和圆二色谱(ECD)确定。从菌株162432中分离纯化了9个环二肽类化合物,包括1个新化合物链霉菌二肽A(1)和8个已知化合物:环-(-顺式-羟脯氨酸--苯丙氨酸)(2)、环-(-脯氨酸--苯丙氨酸)(3)、环-(-羟脯氨酸--亮氨酸)(4)、环-(-羟脯氨酸--亮氨酸)(5)、环-(-脯氨酸--亮氨酸)(6)、环-(-脯氨酸--亮氨酸)(7)、环-(-脯氨酸--异亮氨酸)(8)、环-(-亮氨酸--缬氨酸)(9)。对分离得到的化合物1~9进行肿瘤细胞增殖细胞毒和抗菌活性评价,活性结果显示,化合物1~9在10 µg/mL下对肿瘤细胞增殖均未显示出明显的细胞毒活性;化合物9对苏云金芽孢杆菌显示抑菌活性,最小抑菌浓度(minimum inhibitory concentration,MIC)为25 µg/mL。化合物1为新化合物,化合物2和4~9为首次从链霉菌中分离得到,化合物9具有一定的抗菌活性。
海绵;链霉菌162432;链霉菌二肽A;环-(-亮氨酸--缬氨酸);海洋天然产物;抗菌活性
近年来,新型致病菌以及耐药菌株的不断出现引起了药学家们的关注,迫切需要发掘更多的天然活性产物来应对当今所面临的困局[1-3]。海洋放线菌因其次级代谢产物具有丰富的化学多样性和良好的生物活性而受到人们的广泛关注[4]。链霉菌为放线菌中物种最多、分布范围最广且形态特征最为典型的一类菌属,产生了大量生物碱、大环内酯、萜、聚酮及肽等类化合物[5-8],部分化合物表现出抗菌、细胞毒等活性,广泛应用于医疗健康、食品、农业等领域。本课题组前期从西沙群岛采集的海洋海绵的样本中分离得到一株链霉菌,经鉴定为系列,命名为162432。本研究对该菌采用大米固体发酵,对发酵产物的化学成分进行分离鉴定,综合利用ODS中压色谱柱和半制备高效液相色谱等分离手段,从醋酸乙酯层分离得到9个环二肽类化合物,分别为链霉菌二肽A(streptomyces dipeptide A,1)、环-(-顺式-羟脯氨酸--苯丙氨酸) [cyclo-(-cis-Hyp--Phe),2]、环-(-脯氨酸--苯丙氨酸) [cyclo-(-Pro--Phe),3]、环-(-羟脯氨酸--亮氨酸) [cyclo-(-Hyp--Leu),4]、环(-羟脯氨酸--亮氨酸) [cyclo-(-Hyp--Leu),5]、环-(-脯氨酸--亮氨酸) [cyclo-(-Pro--Leu),6]、环-(-脯氨酸--亮氨酸) [cyclo-(-Pro--Leu),7]、环-(-脯氨酸--异亮氨酸) [cyclo-(-Pro--Ile),8]、环-(-亮氨酸--缬氨酸) [cyclo-(-Leu--Val),9],结构见图1。已知化合物的结构由NMR数据及相关文献比对确定,化合物2和4~9为首次从链霉菌中分离得到;新化合物(1)的平面结构通过NMR、HR-ESI-MS数据确定,立体构型通过DP4+分析以及计算ECD确定。同时对分离得到的化合物评价了其细胞毒性和抗菌活性。
1 仪器与材料
1.1 仪器与试剂
Waters 1525/2996型半制备高效液相色谱(Waters公司,美国);Bruker AVANCE-600 MHz核磁共振仪;Interchim puriflash 450 instruments中压色谱仪(Interchim公司,法国);JASCO P-2000型旋光仪(JASCO公司,日本);JASCO FT/IR-4100型分光光度计(JASCO公司,日本);半制备色谱柱为YMC-Pack Pro C18RS(250 mm×10 m,5 μm,YMC公司,日本);柱色谱硅胶(200~300、300~400目,山东青岛海洋化工有限公司);Waters Xevo G2-XS Q-Tof、Waters Q-Tof micro YA019液质联用仪(Waters公司,美国);分析级甲醇和乙腈、二氯甲烷(上海凌峰化学试剂有限公司);色谱级甲醇和乙腈(Merck公司,德国)。万古霉素(Adamas,批号22961A)。
1.2 菌株来源
链霉菌162432是2013年分离自西沙群岛采集的海绵,由生工生物工程股份有限公司经分子生物学方法确定其种属[9],样本存放于上海交通大学附属仁济医院的癌基因与相关基因国家重点实验室海洋药物研究中心。
1.3 细胞
人神经胶质母细胞瘤U343、人急性粒细胞HL-60、人急性早幼粒细胞NB4、人组织细胞淋巴瘤细胞U937均来自ATCC细胞库。
2 方法
2.1 发酵培养
2.1.1 菌株培养基 菌株活化ISP-2培养基:葡萄糖4 g、酵母提取物4 g、麦芽提取物10 g、海盐17.5 g、去离子水1 L、pH为7.0~7.2。大米发酵培养基:海盐17 g、大米105 g、加水定容至200 mL。
2.1.2 菌株发酵 将菌株链霉菌162432从−80 ℃冰箱保藏的甘油管中取出,接种到ISP-2琼脂培养基上,置于30 ℃恒温培养箱中培养4~7 d。挑取单菌落将其接种到ISP-2琼脂培养基中复壮,培养3 d后,将1/2的平板切成小块(1 cm×1 cm)接种于大米培养基内(200 mL培养基/2 L锥形瓶),静置常温(25 ℃)培养6周。共发酵60瓶。
2.2 提取与分离
将大米发酵物用甲醇(800 mL/瓶)渗漉提取,提取液减压浓缩蒸干获得10.2 g粗浸膏。将粗浸膏悬浮于2 L的水中,用等体积的醋酸乙酯萃取5次,获得醋酸乙酯萃取物(1.3 g),经ODS中压柱色谱,乙腈-水(5%→100%,450 min)梯度洗脱获得10个流分(Fr. 1~10)。流分Fr. 5(308.4 mg)经过半制备HPLC(甲醇-水13∶87)纯化,得到化合物1(2.3 mg,R=40 min)、2(6.4 mg,R=23 min)和3(4.8 mg,R=35 min);流分Fr. 6(68.3 mg)经过半制备HPLC(甲醇-水20∶80)纯化,得到化合物4(5.6 mg,R=25 min)、5(3.8 mg,R=34 min)、6(4.7 mg,R=20 min)以及7(2.4 mg,R=40 min);流分Fr. 7(125.8 mg)经过半制备HPLC(甲醇-水25∶75)纯化,得到化合物8(3.3 mg,R=28 min)和9(6.2 mg,R=34 min)。
3 结果
3.1 结构鉴定
化合物1:无色油状物,易溶于甲醇。[α]20 D−48.2 (0.1,CH3OH)。HR-ESI-MS给出/277.119 0 [M+H]+(C14H16N2O4,理论值为277.118 3),有8个不饱和度。IR光谱图显示有1 662.8、3 260.0 cm−1的吸收,推测该化合物含有羰基及氨基或羟基。1H-NMR (600 MHz, CD3OD) 显示出16个质子信号:5个芳香质子重叠信号H-12、H-15、H-16 (H7.26, 3H, d,= 7.3 Hz) 和H-13、H-14 (H7.33, 2H, d,= 7.3 Hz);4个质子所在的碳是连接有氧或氮,分别是H-3 (H4.04, 1H, dd,= 10.0, 4.7 Hz)、H-8 (H4.63, 1H, m)、H-9a (H3.58, 1H, dd,= 12.1, 4.4 Hz) 和H-9b (H3.78, 1H, dd,= 12.1, 6.3 Hz);还有2个亚甲基质子信号H-7a (H2.41, 1H, dd,= 14.0, 6.3 Hz), H-7b (H2.48, 1H, dd,= 14.0, 6.1 Hz) 和H-10a (H3.26, 1H, dd,= 13.3, 10.1 Hz), H-10b (H3.20, 1H, dd,= 13.4, 4.7 Hz)。
13C-NMR (150 MHz, CD3OD) 和DEPT谱显示该化合物含有14个碳:4个季碳,包含2个羰基碳C-2 (C170.0) 和C-5 (C170.2),1个sp2杂化的季碳C-11 (C138.6),1个sp3杂化的季碳C-6 (C88.6);7个次甲基信号,其中C-12/16 (C130.9)、C-13/15 (C130.0) 和C-14 (C128.3) 为sp2杂化,C-3 (C60.8) 和C-8 (C68.4) 为sp3杂化;3个亚甲基C-7 (C46.8)、C-9 (C54.0) 和C-10 (C42.8)。该化合物的核磁谱图和环二肽类化合物的核磁谱图极其相似[10]。1H-1H COSY谱图的H-12/H-13/H-14/ H-15/H-16相关结合在HMBC谱图中的H2-10与C-2、C-12、C-11、C-16相关,确定了单取代苯环的存在。进一步通过H-3/H-10的COSY相关以及(H2-10, H-3)/C-2的HMBC相关推导出该化合物中含有苯丙氨酸残基;1H-1H COSY谱图的H-7/H-8/H-9相关结合在HMBC谱图中的H2-7与C-5相关,H-8与C-6相关,H2-9与C-2相关推导出该化合物含有脯氨酸残基[10]。值得注意的是,该化合物C-6 (C88.6) 和C-8 (C68.4) 化学位移明显增加,推测其H-6和H-8被羟基取代,随后通过HR-ESI-MS进一步确定了推测,确定了化合物1的平面结构(图2)。对化合物1的数据归属(表1)。该化合物有3个手性中心,无法通过ROESY谱图确定该化合物的相对构型,因此通过计算4种相对构型的NMR数据,分别是3R, 6R, 8R、3R, 6R, 8S、3R, 6S, 8R、3R, 6S, 8S,基于NMR数据拟合DP4+分析(99.99%),确定化合物的相对构型为3R, 6R, 8S(图3)。随后用ECD计算2个对映异构体(3, 6, 8、3, 6, 8),计算值和实验值曲线模拟(图4),最后确定化合物的立体构型为3, 6, 8。
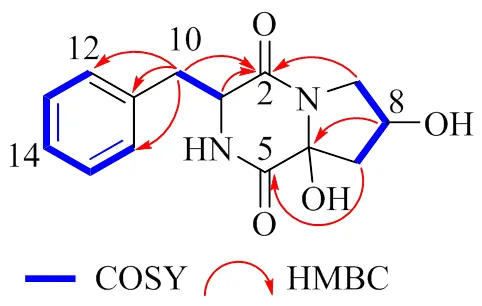
图2 化合物1的COSY和HMBC相关
化合物2:无色油状物,[α]20 D+28 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 4.22 (2H, m, H-3, 8), 2.80 (1H, t,= 8.5 Hz, H-6), 2.24 (1H, m, H-7a), 1.96 (1H, dd,= 13.7, 4.8 Hz, H-10b), 7.19 (2H, m, H-12), 1.98 (1H, m, H-7b), 3.60 (1H, dd,= 12.4, 3.9 Hz, H-9a), 3.34~3.24 (1H, m, H-9b), 3.19(1H, dd,= 13.7, 5.1 Hz, H-10a), 3.01 (1H, dd,= 13.7, 4.8 Hz, H-10b), 7.19 (2H, m, H-12, 16), 7.33~7.28 (3H, m, H-13~15);13C-NMR (150 MHz, CD3OD): 168.0 (C, C-2), 59.9 (CH, C-3), 171.3 (C, C-5), 57.5 (CH, C-6), 38.3 (CH2, C-7), 68.8 (CH, C-8), 54.3 (CH2, C-9), 41.2 (CH2, C-10), 137.1 (C, C-11), 131.5 (CH, C-12, 16), 130.0 (CH, C-13, 15), 128.8 (CH, H-14)。以上谱学数据与文献报道一致[11],故确定该化合物为环-(-顺式-羟脯氨酸--苯丙氨酸)二肽。
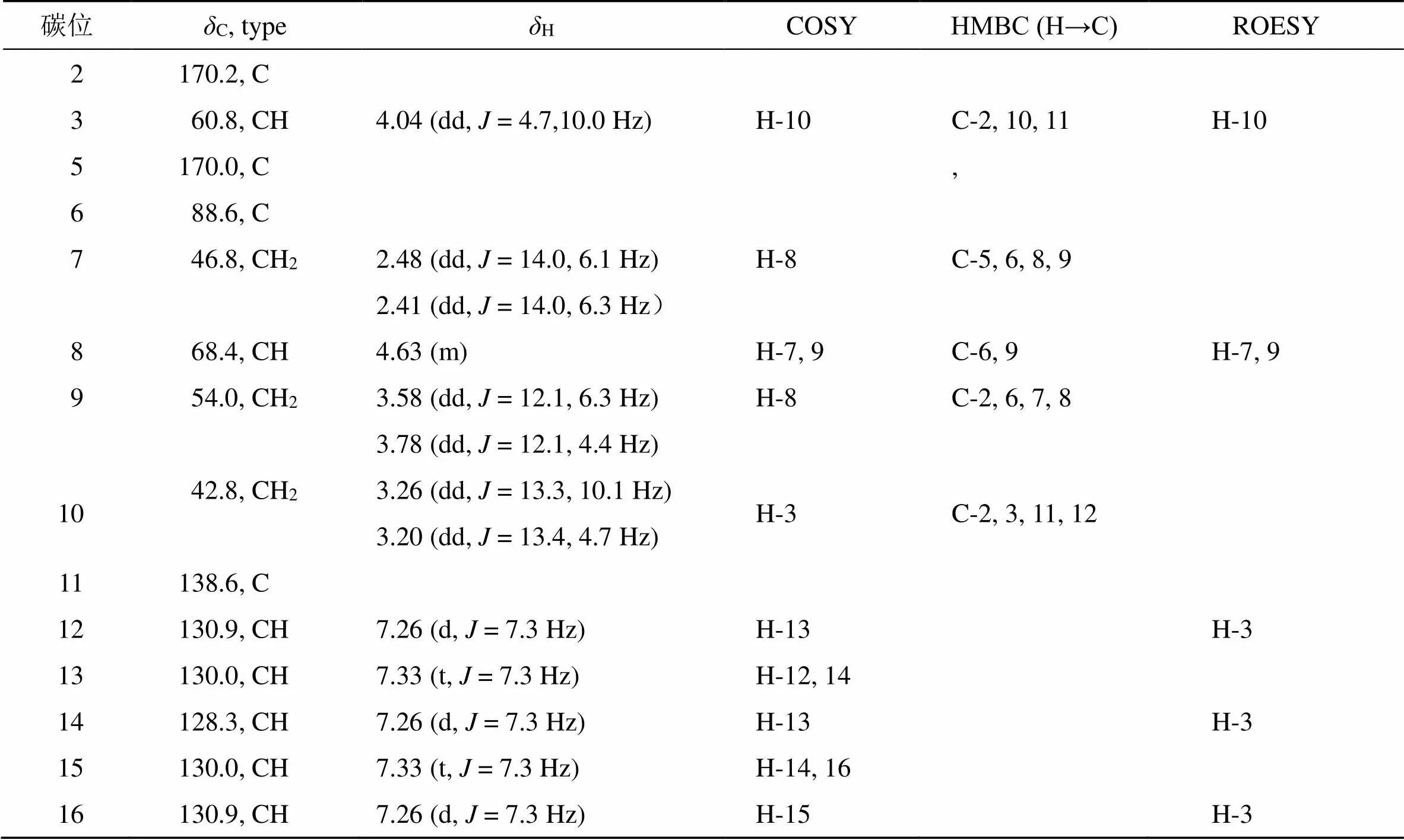
表1 化合物1的一维和二维数据NMR谱图(600/150 MHz,CD3OD)
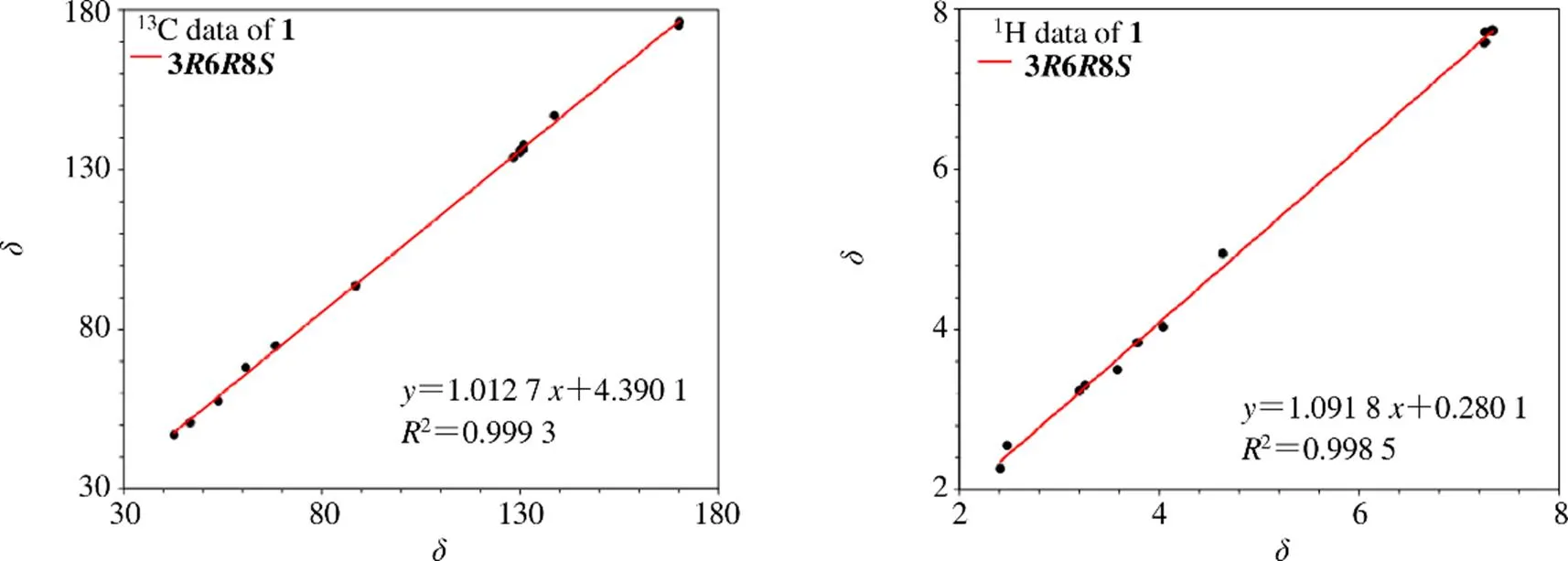
图3 化合物1的实验和计算NMR数据的拟合线
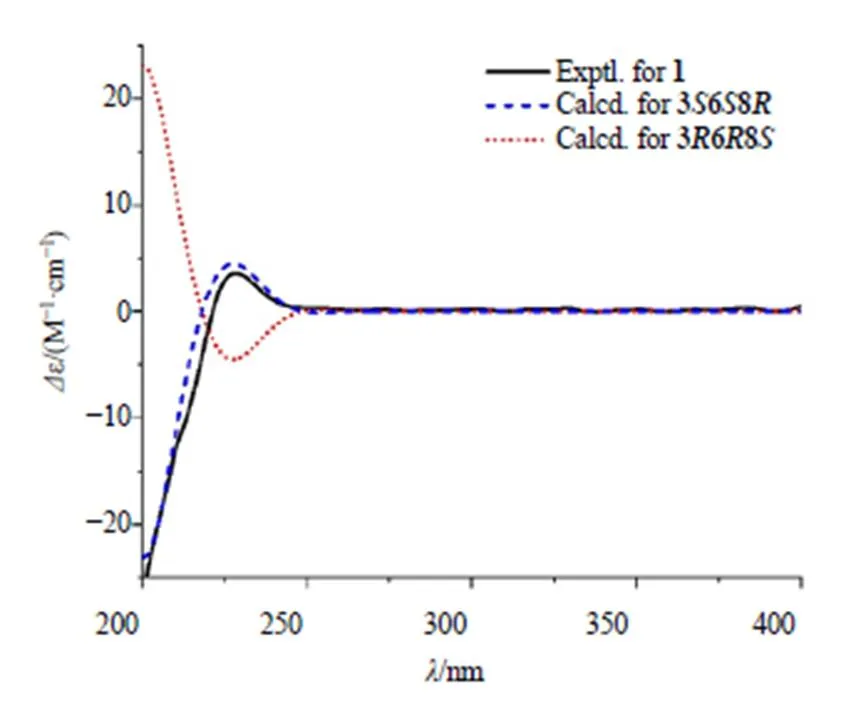
图4 化合物1的实测ECD和计算ECD
化合物3:棕黄色油状物,[α]20 D+65 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 3.50 (1H, m, H-3), 4.16 (1H, m, H-6), 2.00 (1H, m, H-7a), 1.86 (1H, m, H-7b), 1.62 (2H, m, H-8), 3.27 (1H, m, H-9a), 2.58 (1H, m, H-9b), 3.15 (1H, dd,= 13.8, 4.8 Hz, H-10a), 3.00 (1H, dd,= 13.8, 4.8 Hz, H-10b), 7.15 (2H, m, H-12, 16), 7.26 (3H, m, H-13~15);13C-NMR (150 MHz, CD3OD): 171.6 (C, C-2), 59.4 (CH, C-3), 167.7 (C, C-5), 60.0 (CH, C-6), 30.1 (CH2, C-7), 22.8 (CH2, C-8), 46.4 (CH2, C-9), 41.3 (CH2, C-10), 137.0 (C, C-11), 129.9 (CH, C-12, 16), 131.5 (CH, C-13, 15), 128.8 (CH, C-14)。以上谱学数据与文献报道一致[12],故确定该化合物为环-(-脯氨酸--苯丙氨酸)二肽。
化合物4:黄色结晶,[α]20 D−81 (0.15, CH3OH);1H-NMR (600 MHz, CD3OD): 4.17 (1H, m, H-3), 4.46 (1H, t,= 4.2 Hz, H-6), 2.09 (1H, m, H-7a), 2.27 (1H, dd,= 6.0, 13.2 Hz, H-7b), 4.52 (1H, dd,= 6.6, 10.2 Hz, H-8), 3.43 (1H, d,= 12.6 Hz, H-9a), 3.66 (1H, dd,= 4.8, 13.2 Hz, H-9b), 1.51 (1H, m, H-10a), 1.91 (2H, m, H-10b, 11), 0.96 (6H, dd,= 3.0, 6.0 Hz, H-12, 13);13C-NMR (150 MHz, CD3OD): 169.3 (C, C-2), 54.9 (CH, C-3), 173.3 (C, C-5), 59.0 (CH, C-6), 38.5 (CH2, C-7), 69.4 (CH, C-8), 55.5 (CH2, C-9), 39.7 (CH2, C-10), 26.1 (CH, C-11), 22.5 (CH3, C-12), 23.6 (CH3, C-13)。以上谱学数据与文献报道一致[13],故确定该化合物为环-(-羟脯氨酸--亮氨酸)二肽。
化合物5:无色结晶(甲醇),[α]20 D+37 (0.34, CH3OH);1H-NMR (600 MHz, CD3OD): 3.87 (1H, dd,= 5.4, 9.0 Hz, H-3), 4.35 (1H, t,= 9.0 Hz, H-6), 2.23 (1H, m, H-7a), 2.49 (1H, m, H-7b), 4.42 (1H, m, H-8), 3.67 (1H, m, H-9a), 3.45 (1H, m, H-9b), 1.58 (2H, m, H-10), 1.78 (1H, m, H-11), 0.97 (3H, d,= 6.6 Hz, H-12), 1.00 (3H, d,= 6.6 Hz, H-13);13C-NMR (150 MHz, CD3OD): 169.7 (C, C-2), 57.2 (CH, C-3), 171.5 (C, C-5), 57.8 (CH, C-6), 38.0 (CH2, C-7), 69.1 (CH, C-8), 54.6 (CH2, C-9), 43.7 (CH2, C-10), 25.9 (CH, C-11), 22.3 (CH3, C-12), 23.6 (CH3, C-13)。以上谱学数据与文献报道一致[13],故确定该化合物为环-(-羟脯氨酸--亮氨酸)二肽。
化合物6:白色粉末,[α]20 D+42.7 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 3.85 (1H, dd,= 5.4, 9.6 Hz, H-3), 4.26 (1H, m, H-6), 1.93 (2H, m, H-7), 2.02 (1H, m, H-8a), 2.34 (1H, m, H-8b), 3.50 (1H, m, H-9a), 3.58 (1H, m, H-9b), 1.78 (1H, m, H-10a), 1.68 (1H, m, H-10b), 1.57 (1H, m, H-11), 0.97 (3H, d,= 6.6 Hz, H-12), 1.00 (3H, d,= 6.6 Hz, H-13);13C-NMR (150 MHz, CD3OD): 171.9 (C, C-2), 57.2 (CH, C-3), 169.2 (C, C-5), 59.6 (CH, C-6), 30.1 (CH2, C-7), 23.4 (CH2, C-8), 44.0 (CH2, C-9), 46.9 (CH2, C-10), 25.8 (CH, C-11), 22.1 (CH3, C-12), 23.4 (CH3, C-13)。以上谱学数据与文献报道一致[14],故确定该化合物为环-(-脯氨酸--亮氨酸)二肽。
化合物7:白色粉末,[α]20 D−94 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 4.26 (1H, t,= 7.2 Hz, H-3), 4.13 (1H, m, H-6), 2.30 (1H, m, H-7a), 2.03 (4H, m, H-7b, 8a, 10a, 11), 1.89 (1H, m, H-8b), 3.51 (2H, m, H-9), 1.52 (1H, m, H-10b), 0.96 (6H, dd,= 3.6, 6.0 Hz, H-12, 13);13C-NMR (150 MHz, CD3OD): 173.1 (C, C-2), 54.9 (CH, C-3), 169.2 (C, C-5), 60.6 (CH, C-6), 29.4 (CH2, C-7), 23.9 (CH2, C-8), 46.7 (CH2, C-9), 39.7 (CH2, C-10), 26.4 (CH, C-11), 23.6 (CH3, C-12), 22.5 (CH3, C-13)。以上谱学数据与文献报道一致[15],故确定该化合物为环-(-脯氨酸--亮氨酸)二肽。
化合物8:白色粉末,[α]20 D+68 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 3.68 (1H, d,= 6.6 Hz, H-3), 4.24 (1H, dd,= 10.2, 6.6 Hz, H-6), 2.35 (1H, m, H-7a), 1.90 (3H, m, H-7b, 8), 3.49 (1H, m, H-9a), 3.62 (1H, m, H-9b), 2.02 (1H, m, H-10), 1.61 (1H, m, H-11a), 1.23 (1H, m, H-11b), 0.96 (3H, t,= 5.2 Hz, H-12), 1.01 (3H, d,= 4.4 Hz, H-13);13C-NMR (150 MHz, CD3OD): 168.2 (C, C-2), 60.0 (CH, C-3), 171.9 (C, C-5), 63.8 (CH, C-6), 30.6 (CH2, C-7), 23.2 (CH2, C-8), 47.0 (CH2, C-9), 41.3 (CH, C-10), 26.4 (CH2, C-11), 11.9 (CH3, C-12), 16.0 (CH3, C-13)。以上谱学数据与文献中报道的一致[16],故确定该化合物为环-(-脯氨酸--异亮氨酸)二肽。
化合物9:白色粉末,[α]20 D+4 (0.1, CH3OH);1H-NMR (600 MHz, CD3OD): 3.98 (1H, t,= 6.0 Hz, H-3), 3.82 (1H, d,= 4.2 Hz, H-6), 2.32 (1H, m, H-7), 1.05 (3H, d,= 7.2 Hz, H-8), 0.95 (9H, d,= 6.6 Hz, H-9, 12, 13), 1.73 (2H, m, H-10), 1.85 (1H, m, H-11);13C-NMR (150 MHz, CD3OD): 171.9 (C, C-2), 61.6 (CH, C-3), 170.5 (C, C-5), 54.5 (CH, C-6), 33.9 (CH, C-7), 19.1 (CH3, C-8), 17.3 (CH3, C-9), 43.4 (CH2, C-10), 25.5 (CH, C-11), 23.6 (CH3, C-12), 22.8 (CH3, C-13)。以上谱学数据与文献报道一致[17],故确定该化合物为环-(-亮氨酸--缬氨酸)二肽。
3.2 细胞毒和抗菌活性筛选及结果
3.2.1 细胞毒活性 采用CCK8法[18]检测全部化合物对U343细胞、HL-60细胞、NB4细胞、U937细胞的肿瘤增殖抑制活性。首先,在96孔板中配制100 μL的细胞悬液,将细胞U343贴壁处理并将其培养板放入培养箱中预培养24 h(37 ℃、5% CO2),而悬浮细胞(HL-60、NB4、U937)不用预培养,随后向培养板加入10 μL浓度为100 μmol/L的待测化合物,将其放在培养箱培养48 h后,再向每孔加入10 μL CCK8溶液,最后将培养板在培养箱内培养1~4 h后,通过酶标仪测定其在450 nm处的吸光度(),重复实验3次,每组设定3个复孔。按照公式计算抑制率,结果在10 μmol/L下,化合物均未显示明显的细胞毒活性。
抑制率=1-(给药-空白)/(0给药-空白)
给药为具有细胞、CCK8溶液和药物溶液的孔的;空白为具有培养基和CCK8溶液而没有细胞的孔的;0给药为具有细胞、CCK8溶液而没有药物溶液的孔的
3.2.2 抗菌活性 用DMSO将待测样品溶解,并分别配制成50、25、20、15 µg/mL质量浓度,备用。苏云金芽孢杆菌、耐甲氧西林金黄色葡萄球菌(MRSA)和表皮金黄色葡萄球菌接种于TSB培养基,在37 ℃过夜。挑取单菌落接种于液体培养基TSB,在37 ℃条件下过夜培养。取190 µL TSB培养基、1 µL菌液、10 µL待测化合物于96孔板,并以万古霉素(Vancomycin)作为阳性对照,置于37 ℃培养箱中培养24 h(微量肉汤稀释法)[19]。实验结果表明,在浓度为25 µg/mL下,化合物9对苏云金芽孢杆菌显示抗菌活性。
4 讨论
本研究从海绵的共附生链霉菌162432的发酵产物分离得到9个二酮哌嗪类化合物,其中化合物1为新化合物,化合物2和4~9均是首次从该种中分离得到。所分得的化合物在10 µg/mL下对上述肿瘤细胞增殖均未显示出明显的细胞毒活性;化合物9对苏云金芽孢杆菌显示出抗菌活性,最小抑菌浓度为25 µg/mL。该研究提示海绵共附生链霉菌是活性天然产物发现的一个新来源,具有重要的研究价值和广阔的开发前景。
利益冲突 所有作者均声明不存在利益冲突
[1] Vu H N T, Nguyen D T, Nguyen H Q,. Antimicrobial and cytotoxic properties of bioactive metabolites produced byYBQ59 isolated fromprels in yen Bai Province of Vietnam [J]., 2018, 75(10): 1247-1255.
[2] Wu C S, Zacchetti B, Ram A F J,. Expanding the chemical space for natural products by-co-cultivation and biotransformation [J]., 2015, 5: 10868.
[3] Zhen X, Gong T, Liu F,. A new analogue of echinomycin and a new cyclic dipeptide from a marine-derivedsp. LS298 [J]., 2015, 13(11): 6947-6961.
[4] Genilloud O. Actinomycetes: Still a source of novel antibiotics [J]., 2017, 34(10): 1203-1232.
[5] Zhang S Y. Morindolestatin, naturally occurring dehydromorpholinocarbazole alkaloid from soil-derived bacterium of the genus[J]., 2020, 22(3): 1113-1116.
[6] Sun J D, Zhao G X, O'Connor R D,. Vertirhodins A-F, C-linked pyrrolidine-iminosugar-containing pyranonaphthoquinones fromsp. B15-008 [J]., 2021, 23(3): 682-686.
[7] Marchbank D H, Ptycia-Lamky V C, Decken A,. Guanahanolide A, a meroterpenoid with a sesterterpene skeleton from coral-derivedsp [J]., 2020, 22(16): 6399-6403.
[8] An J S, Shin B, Kim T H,. Dumulmycin, an antitubercular bicyclic macrolide from a riverine sediment-derivedsp [J]., 2021, 23(9): 3359-3363.
[9] Jiao W H, Yuan, W L, Li Z Y,. Anti-MRSA actinomycins D1-D4from the marine sponge-associatedsp. LHW52447 [J]., 2018, 74(40): 5914-5919.
[10] Wang N, Cui C B, Li C W. A new cyclic dipeptide penicimutide: The activated production of cyclic dipeptides by introduction of neomycin-resistance in the marine-derived fungus[J]., 2016, 39(6): 762-770.
[11] Xiang W X, Liu Q, Li X M,. Four pairs of proline-containing cyclic dipeptides fromsp. HT88, an endophytic bacterium ofL [J]., 2020, 34(15): 2219-2224.
[12] 吕海宁, 陈辉, 屈晶, 等. 内生真菌次生代谢产物研究 [J]. 中国现代中药, 2015, 17(5)427-430.
[13] Cronan J M Jr, Davidson T R, Singleton F L,. Plant growth promoters isolated from a marine bacterium associated withsp [J]., 1998, 11(4): 271-278.
[14] 彭坤, 苏瑞强, 张改云, 等. 深海放线菌sp. R21的次生代谢产物研究 [J]. 中国中药杂志, 2015, 40(12): 2367-2371.
[15] Yang B, Dong J D, Zhou X F,. Proline-containing dipeptides from a marine sponge of aspecies [J]., 2009, 92(6): 1112-1117.
[16] Hwang J T, Jang H J, Kim J H,.KR-050L inhibit IL-6/STAT3 activation [J]., 2017, 122(5): 1412-1422.
[17] 龙聪, 刘小宇, 卢小玲, 等. 海洋亚硫酸杆菌M44的代谢产物研究 [J]. 中国抗生素杂志, 2012, 37(4): 51.
[18] Hong L L, Yu H B, Wang J,. Unusual anti-allergic diterpenoids from the marine sponge[J]., 2017, 7: 43138.
[19] Song T F, Chen M X, Ge Z WBioactive penicipyrrodiether A, an aadduct of GKK1032 analogue and phenol A derivative, from a marine-sourced fungussp. ZZ380 [J]., 2018, 83: 13395-13401.
Secondary metabolites of a marine sponge associated162432
CHEN Rui-qiang1, LUO Xiang-chao2, LIN Hou-wen1, 2, JIAO Wei-hua2
1. College of Food, Shanghai Ocean University, Shanghai 201306, China 2. Research Center for Marine Drugs, State Key Laboratory of Oncogenes and Related Genes, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China
To reveal the secondary metabolites of a marine sponge associated162432.The organic extract and fractions were separated and purified by octadecylsilyl silica (ODS) medium-pressure column chromatography (MPLC) and semi-preparative high-performance liquid chromatography (HPLC). The obtained purified compounds were identified by high-resolution-electrospray-mass spectrometry (HR-ESI-MS), nuclear magnetic resonance spectroscopy (NMR) and literature data comparison. The absolute configuration of new compound was determined by NMR and electrostatic circular dichroism (ECD) calculations.Nine compounds were isolated from162432, including one new compound streptomyces dipeptide A (1) and eight known compounds: cyclo-(--Hyp--Phe) (2), cyclo-(-Pro--Phe) (3), cyclo-(-Hyp--Leu) (4), cyclo-(-Hyp--Leu) (5), cyclo-(-Pro--Leu) (6), cyclo-(-Pro--Leu) (7), cyclo-(-Pro--Ile) (8), cyclo-(-Leu--Val) (9). The cytotoxicity on tumor cell proliferation and antibacterial activities of the isolated compounds 1—9 were evaluated. None of compounds 1—9 showed significant cytotoxic activity on tumor cell proliferation at the concentration of 10g/mL; compound 9 showed antibacterial activity againstwith the minimal inhibitory concentration (MIC) value of 25 µg/mL.Compound 1 is a new compound, compound 2 and 4—9 are isolated fromfor the first time. Compound 9 showed antibacterial activity against.
marine sponge;162432; streptomyces dipeptide A; cyclo-(-Leu--Val); marine natural product; antibacterial activity
R284.1
A
0253 - 2670(2023)13 - 4104 - 07
10.7501/j.issn.0253-2670.2023.13.003
2023-03-21
国家重点研发计划项目(2022YFC2804100);国家自然科学基金项目(22137006);国家自然科学基金项目(82022068)
陈瑞强,硕士研究生,从事海洋天然产物研究。E-mail: 2823468021@qq.com
通信作者:林厚文,教授,博士生导师,研究方向为海洋药物。E-mail: Franklin67@126.com Tel: (021)68383346
焦伟华,研究员,博士生导师,研究方向为海洋药源分子的结构与功能。E-mail: weihuajiao@hotmail.com Tel: (021)68383339
[责任编辑 王文倩]
