三黄散和百优酸对杂交鲟海豚链球菌病的治疗效果
2023-07-05宋建宇
王 静,熊 燕,梁 祥,宋建宇
(云南省渔业科学研究院,昆明 650051)
【研究意义】杂交鲟生长速度快,适应性广,抗病能力强,经济价值高,适宜规模化养殖[1]。但近年来随着鲟鱼养殖规模及产量的不断扩大提升,各种疾病的暴发也愈加频繁,严重制约了中国鲟鱼养殖业的发展[2]。海豚链球菌病是杂交鲟养殖的主要疾病之一,发病率高,流行范围广且周期长,危害严重,感染发病死亡率高达50%以上,对杂交鲟养殖业造成的经济损失巨大[2-4]。目前用于防治杂交鲟海豚链球菌病的药物主要是抗生素及消毒剂等化学药物,但长期使用此类药物会产生水体生态失衡、病原菌耐药性和药物残留等一系列问题[4-6],因此开发新的疗效好且无药物残留的防治方法来防控水产养殖中的杂交鲟海豚链球菌病具有重要意义。【前人研究进展】随着水产养殖业的迅速发展,水产养殖病害问题日益严重,疾病暴发频繁,抗生素及消毒剂等化学药物的过量或不当使用引起一系列生态环境问题,造成经济损失,不利于绿色健康高效养殖业的发展[7-9]。中药成本低、绿色环保,用其防治鱼类疾病无药物残留且有利于水产养殖病害群体防治[10],是无公害养殖的首选药物,目前已有学者开展了中草药制剂防治海豚链球菌病的研究[11]。三黄散主要成分为黄苓、黄柏、大黄、大青叶,均具有广谱抗菌效果。百优酸主要由精选的有机酸、植物提取物、独特透化剂和缓释载体组成。【本研究切入点】现有的杂交鲟海豚链球菌病的防治药物主要是抗生素及消毒剂等化学药物,中草药防治药物相对较少。已有报道三黄散与百优酸在一些细菌性疾病的预防治疗中起重要作用,但对于杂交鲟海豚链球菌病的防治作用鲜有研究。【拟解决的关键问题】本研究将海豚链球菌人工感染健康杂交鲟致使其发病,再用三黄散与百优酸的不同组合对发病杂交鲟进行治疗,最后对治疗结果进行综合分析,为中药治疗杂交鲟海豚链球菌病提供依据。
1 材料与方法
1.1 试验材料
试验用海豚链球菌取自于云南省渔业科学研究院实验室分离鉴定并保存的海豚链球菌菌株。健康杂交鲟[西伯利亚鲟(Acipenserbaerii)(♀)×施氏鲟(Acipenserschrenckii)(♂)]来自云南省会泽县鲟鱼养殖场,规格为25 ~ 30 cm,(60+2) g,暂养2周后用于试验。
主要试剂:脑心浸出液培养基购于北京威泰科生物技术有限公司;三黄散购于广东华源生物科技有限公司;百优酸购于百奥明饲料添加剂(中国)有限公司;Biosharp 4%多聚甲醛组织固定液购于云南恩驰科技有限公司;MS-222购于江苏渔医生水产科技有限公司;碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等检测试剂盒由南京建成生物工程研究所提供。
1.2 试验方法
1.2.1 病原菌液制备 将菌株接种于脑心浸出液培养基,28 ℃震荡培养过夜,用0.85%无菌生理盐水将其制备成菌悬液,再用麦氏比浊法调整细菌浓度。
1.2.2 人工感染及防治试验 根据预试验,细菌攻毒试验选取浓度为1.2×105cfu/mL的海豚链球菌液(预试验攻毒感染发病率为50%左右),注射剂量为0.2 mL/尾。
将健康杂交鲟分为5组,空白对照组、阳性对照组、三黄散组、百优酸组、三黄散+百优酸组,每组100尾。空白对照组经胸鳍基部注射0.85%无菌生理盐水,0.2 mL/尾。其余4组分别经胸鳍基部注射浓度为1.2×105cfu/mL的海豚链球菌液,注射剂量为0.2 mL/尾。试验期间各组水池中连续充氧,水温(19±1)℃,空白对照组与阳性对照组饲喂正常饲料,三黄散组饲喂0.5%三黄散饵料,百优酸组饲喂0.1%百优酸饵料,三黄散+百优酸组饲喂0.5%三黄散+0.1%百优酸饵料。每天需观察各组杂交鲟的发病死亡情况,根据各组杂交鲟的死亡情况判断治疗效果,采组织样的杂交鲟不计入死亡总数。
1.2.3 采样及处理 攻毒后于第7、14、21、28和35天每个试验组分别随机取3尾鱼,空白对照组同步取样。用100 mg/L MS-222快速麻醉后,进行尾静脉采血,血样于4 ℃冰箱中静置2 h后于4 ℃下3500 r/min离心10 min制备血清,上清液于-80 ℃冰箱中保存备用。攻毒组于发病高峰期每组各随机取3尾鱼用于采集肝、肠组织,组织样品保存于4%多聚甲醛中用作制备病理切片。
1.2.4 血液生化指标测定 用南京建成生物工程研究所提供的试剂盒测定杂交鲟血清碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)、过氧化物酶(POD)的活力。其中AKP采用酶标法测定,其余指标皆采用比色法测定。
1.2.5 组织形态学分析 人工感染后10~20 d为发病高峰期,于第14天采集各攻毒组杂交鲟的肝、肠组织,用4%多聚甲醛组织固定液固定,制做石蜡组织切片,HE常规染色,并用光学显微镜观察、拍照保存。
1.3 数据统计与分析
数据用软件Excel 2016 初步处理,再用SPSS 18.0 统计软件中单因素方差分析和 Duncan’s多重比较法对试验结果的差异显著性进行分析处理,P<0.05 表示差异显著。
2 结果与分析
2.1 攻毒后各处理组杂交鲟死亡率
人工感染后的第3天各攻毒组杂交鲟均开始出现无方向性窜游或离群沿池边游动,第5天杂交鲟开始出现死亡,第35天各攻毒组杂交鲟均出现不同程度的死亡情况,其中阳性对照组死亡数最多,死亡率为54.6%;三黄散+百优酸组死亡数最少,死亡率为19.6%;三黄散组和百优酸组的死亡数均少于阳性对照组,死亡率分别为35.1%和32.0%(表1)。

表1 农业科技成果转化的参与主体及主要职能
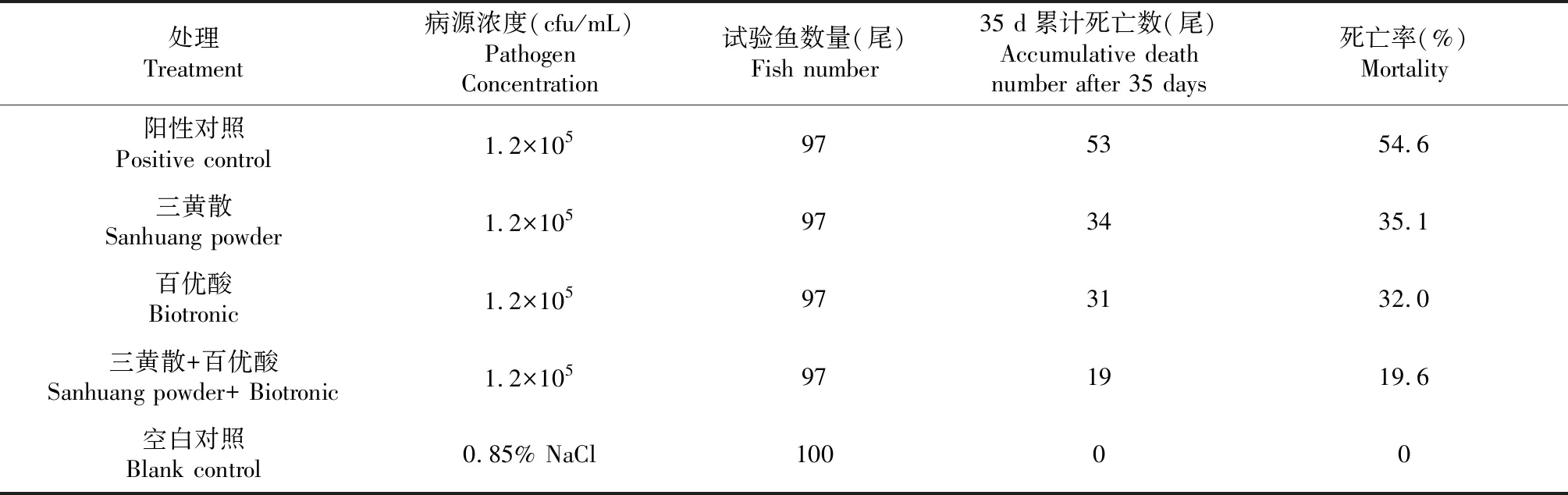
表1 各处理组杂交鲟的死亡率

表2 农业科技成果转化主体基本统计特征
2.2 血液生化指标测定结果
2.2.1 酸性磷酸酶(ACP)活力 在整个试验期,人工感染海豚链球菌后各攻毒组杂交鲟血清ACP活力均先升高后降低,且各攻毒组的ACP活力都始终显著(P<0.05)高于空白对照组。ACP活力各攻毒组均于第21天达到峰值,且阳性对照组显著高于其余处理组,三黄散组与百优酸组差异不显著,但二者均显著高于三黄散+百优酸组(图1)。
图1 农业科技成果转化利益分配机制的影响因素评价指标体系
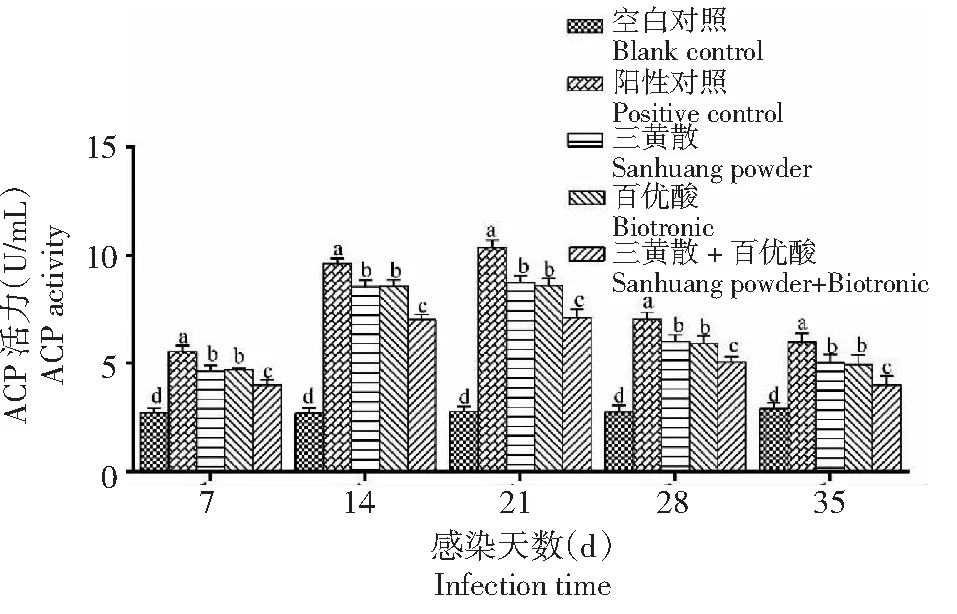
不同小写字母表示不同处理组在同一时间点差异显著(P<0.05),下同。
2.2.2 碱性磷酸酶(AKP)活力 在整个试验期,人工感染海豚链球菌后各攻毒组杂交鲟血清AKP活力均先升高后缓慢降低,各攻毒组的AKP活力都始终显著高于空白对照组。AKP活力各攻毒组均于第14天达到峰值,且在整个试验期,阳性对照组均显著高于其他处理组,三黄散组和百优酸组均显著高于三黄散+百优酸组;百优酸组在第0~21天显著高于三黄散组,试验后期二者的AKP水平差异不显著(图2)。

图2 不同处理组杂交鲟血清AKP活力变化
2.2.3 溶菌酶(LZM)活力 在整个试验期,人工感染海豚链球菌后各处理组杂交鲟血清溶菌酶(LZM)活力变化趋势与AKP相似,呈先升高再缓慢降低的变化趋势,且各攻毒组的LZM活力都始终显著高于空白对照组的。LZM活力各攻毒组均于第14天达到峰值,且在整个试验期,阳性对照组都显著高于其他处理组,三黄散组和百优酸组均显著高于三黄散+百优酸组,三黄散组与百优酸组差异不显著(图3)。
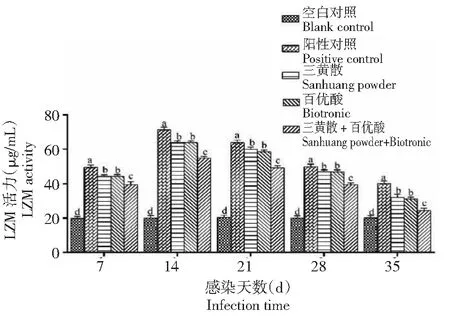
图3 不同处理组杂交鲟血清LZM活力变化
2.2.4 过氧化物酶(POD)活力 在整个试验期,人工感染海豚链球菌后各攻毒组杂交鲟血清过氧化物酶(POD)活力均先降低后升高再缓慢降低,且都显著高于空白对照组,其中POD活力阳性对照组均显著高于其他组处理,三黄散组显著高于百优酸组,百优酸组显著高于三黄散+百优酸组(图4)。在第7天时,空白对照组的POD活力显著高于各攻毒组,阳性对照组的POD活力显著低于其他处理组,三黄散组和百优酸组的POD活力显著低于三黄散+百优酸组,三黄散组与百优酸组的POD活力差异不显著。
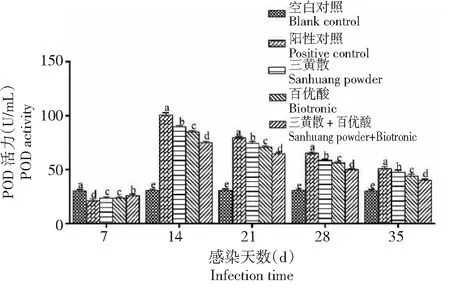
图4 不同处理组杂交鲟血清POD活力变化
2.2.5 超氧化物歧化酶(SOD)活力 在整个试验期,人工感染海豚链球菌后各攻毒组杂交鲟血清超氧化物歧化酶(SOD)活力均先升高再缓慢降低,且各攻毒组的SOD活力都始终显著高于空白对照组。其中,各攻毒组的SOD活力均于第14天达到峰值,且SOD活力阳性对照组都显著高于其他处理组,三黄散组和百优酸组均显著高于三黄散+百优酸组(图5)。

图5 不同处理组杂交鲟血清SOD活力变化
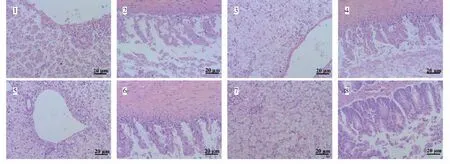
1:阳性对照组肝脏(20×10);2:阳性对照组肠(20×10);3:三黄散组肝脏(20×10);4:三黄散组肠(20×10);5:百优酸组肝脏(20×10);6:百优酸组肠(20×10);7:三黄散+百优酸组肝脏(20×10);8:三黄散+百优酸组肠(20×10)。
2.3 组织病理切片结果
杂交鲟感染海豚链球菌发病后内脏的病理变化主要表现为肝细胞严重变性坏死,崩解,伴有大量炎症细胞浸润(图6-1);肠粘膜受损严重,肠绒毛坏死脱落严重,伴有炎症细胞浸润(图6-2)。三黄散组肝细胞广泛空泡变性,伴有炎症细胞浸润(图6-3);肠粘膜受损较严重,肠绒毛有坏死脱落,伴有炎症细胞浸润(图6-4)。百优酸组肝细胞广泛空泡变性,伴有炎症细胞浸润(图6-5);肠粘膜受损较严重,肠绒毛有坏死脱落,伴有炎症细胞浸润(图6-6)。三黄散+百优酸组肝细胞空泡变性,呈蜂窝状(图6-7);肠粘膜轻微损伤,肠绒毛受损,部分柱状细胞和杯状细胞出现坏死脱落,伴有炎症细胞浸润(图6-8)。三黄散和百优酸都能明显地减轻患病鱼的内脏损伤,且二者联用效果更好。
3 讨 论
3.1 三黄散与百优酸对患海豚链球菌病杂交鲟的治疗效果
近年来,海豚链球菌已发展成为水产养殖的一大杀手,给中国红拟石首鱼(Sciaenopsocellatus)[12]、斑点叉尾鮰(Ictaluruspunctatus)[13-14]、罗非鱼(Oreochromisspp.)[15]和鲟鱼(Sturgeon)[2-6]等水产动物的养殖带来了严重的损失。本研究使用海豚链球菌人工感染杂交鲟鱼,导致其出现嘴部、肛门周围充血出血,解剖后发现肝有出血点、肠道充血等症状,甚至高死亡率,与国内外报道的患海豚链球菌病杂交鲟的主要症状相吻合[2-6,16]。在用三黄散与百优酸对患海豚链球菌病的杂交鲟进行治疗后发现,各治疗组的死亡率明显低于阳性对照组的54.6%,其中三黄散组死亡率35.1%,百优酸组死亡率32%,三黄散+百优酸组死亡率最低为19.6%,说明三黄散和百优酸都对杂交鲟海豚链球菌病具有一定的治疗效果,且二者呈协同作用,联合使用能更好地治疗杂交鲟海豚链球菌病,大幅度降低其死亡率。
3.2 三黄散与百优酸对患海豚链球菌病的杂交鲟血液生化指标的影响
3.2.1 海豚链球菌对杂交鲟血液生化指标的影响 酸性磷酸酶(ACP)是溶酶体的标志酶,其活力代表巨噬细胞吞噬消化能力的强弱[17]。碱性磷酸酶(AKP)是机体代谢的重要调控酶,能增强病体对病原体的识别及吞噬能力,有助于提高杂交鲟的抗病力[18]。本研究发现,人工感染海豚链球菌后杂交鲟血清ACP和AKP活力均先升高再降低,且各攻毒组的酶活力都始终显著高于空白对照组,这与柒壮林等[19]报道海豚链球菌感染罗非鱼的结果一致。据此推断,海豚链球菌感染入侵杂交鲟机体后,血清ACP与AKP活性增高以提高杂交鲟吞噬能力,促使小颗粒细胞解体,达到快速清除病源的效果,后期随着病原体的减少与机体免疫系统的调节,ACP与AKP活性缓慢降低。
溶菌酶(LZM)是一种存在于血液和粘液中能水解致病菌的碱性酶,由巨噬细胞和嗜中性粒细胞产生并分泌,主要作用于革兰氏阳性菌,能增强鱼体的抗病能力[20]。机体溶菌酶活性的提高能加强其溶菌作用,提高机体免疫力[21]。本研究中人工感染海豚链球菌后杂交鲟血清LZM活力先升高再降低,且各攻毒组的酶活力均始终显著高于空白对照组,有报道发现,鲫感染嗜水气单胞菌后血清LZM活力也先升高后下降[22]。据此推测,杂交鲟感染海豚链球菌后鱼体产生了急性应激反应,其通过增加溶菌酶水平来增强机体的免疫力[20],抵抗病原菌的侵袭,随着病原体的减少,后期LZM活性缓慢降低。
机体抗氧化系统的重要成员超氧化物歧化酶(SOD)能抑制和清除超氧阴离子自由基,避免机体防御过氧化,保护机体免受氧化损伤[23]。SOD能通过增强巨噬细胞的吞噬活性提高机体的免疫机能和抗病能力[24-25]。本研究中杂交鲟感染海豚链球菌后血清SOD活力先升高再缓慢降低,这可能是海豚链球菌感染入侵杂交鲟机体后产生的应激反应导致体内的活性氧积聚, 激活了该诱导酶活性,使得鲟鱼血清SOD酶活性应激性升高,协助体内活性氧的清除, 从而避免病原菌入侵造成的机体损伤[24]。
过氧化物酶(POD)是广泛存在于各种动物、植物和微生物体内的一类氧化酶,与吞噬功能和免疫细胞功能相伴,能使毒性物质失活,参与脂的合成、含氮物质的代谢, 能调节氧含量,避免高浓度氧毒害细胞[26]。本研究发现,感染海豚链球菌后杂交鲟血清POD活力先降低后升高再缓慢降低。在第7天时,空白对照组的POD活力显著高于各攻毒组,在7~35 d各攻毒组POD活力都显著高于空白对照组,且均先升高后降低。可能是鱼体内活性氧浓度过高,鲟鱼血清POD酶活性应激性升高,对氧浓度进行调节,使细胞免受高浓度氧的毒性作用。
3.2.2 三黄散与百优酸对患海豚链球菌病的杂交鲟血清酶活的影响 三黄散主要成分为黄苓、黄柏、大黄、大青叶。黄芩主要成分是黄酮类化合物,其特点是能影响细菌体内的代谢途径,抗菌谱广[27]。黄柏药用成分是多种生物碱类物质,能广谱抗菌[28]。大黄富含蒽醌类化合物,通过阻断糖代谢中间产物的氧化及脱氢而抑制细菌蛋白质和核酸合成,已有报道大黄能抑制嗜水气单胞菌活性[29],也能抑制鱼害粘球菌活性[27]。本研究中三黄散组杂交鲟血清的ACP、AKP、LZM、SOD和POD活力变化趋势与阳性攻毒对照组一致,但变化幅度显著低于阳性对照组,说明三黄散能有效减轻海豚链球菌对杂交鲟血液生化指标的影响,对杂交鲟体内的海豚链球菌具有抑制或杀灭的功效。此结果与张彬等[11]所报道的黄连、黄芩、大黄和黄柏4种中草药煎液高度抑制海豚链球菌生长的结论一致。
百优酸主要由精选的有机酸、植物提取物、独特透化剂和缓释载体组成,在抑制和杀灭胃肠道有害菌方面非常高效。已有报道百优酸能提高对虾的生长性能,增强其抗病抗应激能力,抑制部分肠道有害微生物的生长[30]。南京农业大学动物疾病临床诊疗中心证实,百优酸应用于断奶仔猪日粮中能明显降低断奶仔猪的腹泻率和腹泻程度,能抑制肠道有害菌的增殖,还能达到抗生素的效果,可作为理想的替代抗生素产品。本研究中百优酸组杂交鲟血清的ACP、AKP、LZM、SOD和POD活力变化趋势与阳性攻毒对照组一致,但变化幅度显著低于阳性对照组,说明百优酸能有效减轻海豚链球菌对杂交鲟血液生化指标的影响,对鱼体内的海豚链球菌具有抑制或杀灭的效果,与之前的研究基本吻合。
本研究中三黄散+百优酸组杂交鲟血清的ACP、AKP、LZM、SOD和POD活力变化趋势与其他攻毒组一致,但变化幅度显著低于三黄散组和百优酸组,说明三黄散和百优酸共同作用更能减轻海豚链球菌对杂交鲟血液生化指标的影响,对病鱼的治疗效果更好。
3.3 三黄散与百优酸对患海豚链球菌病的杂交鲟组织器官的影响
AKP活性与内脏损伤关系密切,AKP活性增加会导致内脏受损加重[30]。本研究中感染海豚链球菌的杂交鲟阳性对照组AKP 活性极显著增加,三黄散组和百优酸组AKP 活性增加量均低于阳性对照组,各攻毒组中三黄散+百优酸组AKP活性增加量最小。阳性对照组病理学变化主要表现为肝细胞严重变性坏死,崩解,伴有大量炎症细胞浸润,肠粘膜受损严重,肠绒毛严重坏死脱落,伴有炎症细胞浸润。三黄散组和百优酸组肝肠的病理症状较阳性对照组有所减轻,三黄散+百优酸组肝肠病理症状最轻,与已报道的结果相吻合[31-32]。由组织病理结果可知,三黄散和百优酸都能减轻患海豚链球菌病杂交鲟的内脏损伤,且二者联用效果更好。
4 结 论
三黄散和百优酸对杂交鲟海豚链球菌病都有一定的治疗效果,二者联用具有协同作用,能更好地治疗杂交鲟海豚链球菌病,大幅度降低其死亡率。
